2. 中国疾病预防控制中心寄生虫病预防控制所,上海 200025
2. National Institute of Parasitic Diseases Chinese Center For Disease Control And Prevention, Shanghai 200025
冈田绕眼果蝇(Amiota okadai),属于双翅目蝇科(Diptera),虽然在我国呈分散分布,但却与人类生活密切相关。不仅由于它们携带成百上千种病菌,能够传播多种疾病,更因其作为结膜吸吮线虫的中间宿主[1],与近年来结膜吸吮线虫病例的局部流行密切相关[2]。蝇类通常在腐败、肮脏的恶劣环境下生活,但种群却十分强大,重要原因就是由于其具有强大的先天免疫系统,可以有效地抵御异源侵扰[3-4]。昆虫具有识别细菌、真菌、病毒及寄生虫等病原体的有效机制,通过信号转导途径引发一系列的细胞免疫和体液免疫反应,其中体液免疫中关键的抗菌因子-抗菌肽,在先天免疫中占据十分重要的地位[5-6]。
抗菌肽(Antimicrobial peptides,AMPs),是一类低分子量的短肽,大多数是由阳离子和疏水性残基组成的两亲分子[7-8]。由于其对革兰氏阳性菌、革兰氏阴性菌、丝状真菌、原生生物以及包膜病毒在内的微生物都具有快速且有效的杀伤效果,因此被称为“自然抗生素”[9],因其多通过静电和疏水作用吸附于细菌细胞膜,进而破坏膜结构发挥活性,而这种独特的作用机制使细菌很难通过改变细胞膜成分对抗菌肽产生耐药性[10],因此抗菌肽大有成为传统抗生素理想替代品的趋势。此外,由于近年来抗生素的滥用,耐药细菌已成为严重危害人类健康的问题,因此鉴定和开发新的抗菌剂也亟待解决[11]。但由于天然抗菌肽在生物体内含量较低,直接提取步骤繁琐且效率低、成本高,提取物的纯度也难以保证,因此规模化生产短期还难以实现[12]。目前的研究表明基因工程抗菌肽替代天然抗菌肽在理论和实践上都已成为可行。因而通过基因克隆、表达的方式获取目的抗菌肽,越来越受到人们的重视[13]。目前用于表达抗菌肽的基因工程表达系统有原核和真核两种,其中真核表达系统除了具有蛋白表达水平高、生产成本低的特点,还能够对表达产物进行翻译后的加工,从而保证了表达产物活性高[12]。利用杆状病毒表达系统表达抗菌肽是当前抗菌肽基因工程表达研究中应用较广泛的方法[14]。
目前已鉴定的蝇类中的抗菌肽有attacin、cecropin[15]、diptericin[16]、defensin[17]、MDAP-2D[18]及Muscin等。本实验室通过生物信息学方法鉴定了转录组文库中多个和前述抗菌肽同源的unigene,随后通过差异表达谱分析筛选出一个表达量高且有显著差异的基因unigene6686_AO-1,将其命名为aoattacin(未发表数据),通过生物信息学分析发现该基因氨基酸序列具备分子量小、富含脯氨酸、疏水性氨基酸等较多抗菌肽的特征,本研究利用昆虫细胞Sf9真核表达系统对其进行体外表达,并对其生物活性进行鉴定,为相关抗生素替代品的研发和应用提供参考依据。
1 材料与方法 1.1 材料冈田绕眼果蝇:由本实验室保种和饲养,幼虫使用发酵1-2 d的苹果、香蕉、梨果块进行饲养,每2 d换一次水果。饲养温度25-30℃,相对湿度70%-80%,光照8 h/d[1]。抑菌实验菌种:抑菌实验所用菌种由中国疾病预防控制中心曹建平研究员和遵义医科大学基础医学院宋鸿教授馈赠。革兰氏阳性菌:金黄色葡萄球菌(Staphylococcus aureus)、脲芽孢八叠球菌(Sporosarcina ureae)、枯草芽孢杆菌(Bacillus subtilis)、藤黄微球菌(Micrococcus luteus)、氧化微杆菌(Microbacterium oxydans)、蜡样芽孢杆菌(Bacillus cereus)、巨大芽孢杆菌(Bacillus megaterium); 革兰氏阴性菌:伤寒杆菌(Salmonella typhi)、铜假绿单胞菌(Pseudomonas aeruginosa)、痢疾菌属(Shigella sp.)、大肠杆菌(Escherichia coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)、鸡伤寒沙门氏菌(Salmonella gullinarum)、荧光假单胞菌(Pseudomonas fluorescens)、嗜水气单胞菌(Aeromonas hydrophila)、维氏气单胞菌(Aeromonas veronii)、变形菌(Proteus species)、稳定伯克霍尔德菌(Burkholderia stabilis)、黏质沙雷氏菌(Serratia marcescens); aoattacin基因、Sf9细胞、质粒pFast-bac1、E.coli DH10Bac感受态细胞、AB-PCR仪(北京世纪科信科学仪器有限公司); Tanon-1600凝胶成像仪(广州誉维生物科技仪器有限公司); DYY-8C电泳仪(北京六一生物科技有限公司); SW-CJ-ID超净工作台(苏州江东精密仪器有限公司); HH-3D恒温水浴锅(江苏科析仪器有限公司); GHP-9160培养箱(上海一恒科学仪器有限公司); Thermo离心机(赛默飞世尔科技(中国)有限公司); BIC-400人工气候箱(上海博迅公司); HR40-Ⅱ A2生物安全柜(青岛海尔特种电器有限公司)。
1.2 方法 1.2.1 冈田绕眼果蝇总RNA提取和反转录果蝇培养在遵义医科大学-贵州省普通高等学校传染病与生物安全特色重点实验室(BSL-2)的人工气候箱中进行[1],选择3龄果蝇幼虫采用RNA提取试剂盒(北京庄盟)提取总RNA,经1%的琼脂糖凝胶电泳检测其完整性后,利用核酸定量仪测定其浓度和纯度,利用反转录试剂盒(北京庄盟)合成cDNA。
1.2.2 抗菌肽aoattacin基因的筛选、分析、验证及合成利用转录组中unigene的注释文库结合已知的抗菌肽基因序列做序列查询,利用BLASTp从转录组里筛选到5个抗菌肽aoattacin同源基因。为了进一步确定筛选的序列为抗菌肽序列,使用MEGA 5.0软件构建基因家族系统进化树,分析基因的同源性。通过转录组中的表达量及表达谱分析,筛选到一个高表达的aoattacin基因,通过PCR进行验证。随后对候选的aoattacin基因进行密码子优化,送成都擎科生物科技有限公司进行全基因合成,合成时分别在5'端添加BamH Ⅰ酶切位点和信号肽序列,3'端添加EcoR Ⅰ酶切位点和6个His标签,引物为aoatt-F:5'-TTCATACCGTCCCACCATCGGGCGCGGATCCATGGAGTCCCACATGCTGCTGTTCCTGTT-3':aoatt-R:5'-GCTCGTCGACGTAGGCCTTTGAATTCTCAGTGATGGTGGTGGTGGTGGCAGATCCAGGAA-3'。合成序列的测序验证由成都擎科生物科技有限公司完成。
1.2.3 重组质粒pFast-bac1-aoattacin的构建及鉴定BamH Ⅰ和EcoR Ⅰ双酶切aoattacin基因与pFast-bac1载体后,进行连接(基因2 µL、载体100-200 ng、ligase buffer 2 µL、T4 ligase 2 µL、20 µL总体积,16℃过夜),将连接产物转化到大肠杆菌TOP10感受态细胞。PCR验证单克隆菌落,引物序列为:pbattF:5'-AAATGATAACCATCTCGC-3';pbattR:5'-TTCAGGTTCAGGGGGAGGTG-3'。用SnaB Ⅰ和Hind Ⅲ进行双酶切鉴定,测序验证由成都擎科生物科技有限公司完成。
1.2.4 重组Bacmid的构建及鉴定将20 ng的pFast-bac1-aoattacin加入大肠杆菌DH10Bac感受态细胞中,进行蓝白斑及抗生素筛选实验。对得到的8个阳性克隆提取质粒进行PCR验证。引物为M13-F:5'-GTTTTCCCAGTCACGAC-3',M13-R:5'-CAGGAAACAGCTATGAC-3',测序验证由成都擎科生物科技有限公司完成。
1.2.5 aoattacin基因在Sf9细胞中表达及验证细胞转染及P1、P2代病毒扩增:取对数生长期、活力大于95%的Sf9细胞接种(9×105个细胞/2 mL/孔)于六孔板中,制备Bacmid与Cellfectin® Ⅱ Reagent复合物,用SF 900Ⅱ(不含双抗)培养基稀释后,加到每个孔中,27℃孵育5 h,去掉复合物混合液,加入SF 900Ⅱ(含双抗)培养基,27℃湿度孵育至细胞出现病毒感染迹象,收获P1代病毒(106 pfu/mL,1 000 r/min,离心5 min,用0.2 µm的滤膜过滤上清); 继续扩增P1代病毒到P2代(1×107-1×108 pfu/mL)。Aoattacin的表达、纯化:接种活力大于95%的Sf9细胞2×106个至200 mL摇瓶,待细胞生长至对数期,加入P2代病毒(1:100,培养72 h),离心收集细胞和培养基上清提取细胞裂解物粗蛋白(参照昆虫蛋白提取试剂盒说明书操作)。镍柱亲和层析纯化后,对抗菌肽进行SDS-PAGE及Western Blot检测、纯化。MOI优化:在分析Aoattacin表达过程中,发现不同的条件导致不同的表达水平。为了优化Aoattacin的表达,对Sf9细胞(活力大于95%,2×106个)接种至30 mL摇瓶生长至对数期,分别按照1:20、1:100、1:500的比例加入P2代病毒,感染48 h、72 h后离心收集细胞和培养基上清,设定alpha-L-fucosidase作为阳性对照,进行Western Blot检测,检测目的蛋白表达量并纯化。
1.2.6 Aoattacin的抑菌活性检测将抑菌实验菌株在LB培养基中(200 r/min,37℃)培养10 h,按照1%的接种量转接培养(OD600≈0.2),新鲜LB培养基稀释菌液×100备用。将纯化的Aoattacin蛋白用无菌水进行稀释,取90 µL细菌稀释液和10 µL蛋白稀释液加入96孔板中,23℃ 100 r/min培养12 h。分别以10 µL无菌水和10 µL氨苄青霉素(30 µg/mL)作为阴性和阳性平行对照。在利用分光光度计OD600下检测实验组和对照组菌液的浊度,来判断其是否具有抑菌活性,并测定最小抑菌浓度(MIC),把与阴性对照组相比实验组达到85%以上细菌死亡的多肽浓度定义为最小抑菌浓度(MIC,每组3次实验重复),实验及菌种保存均在卫生部寄生虫病原与媒介生物学重点实验室(BSL-2)的生物安全柜中进行。
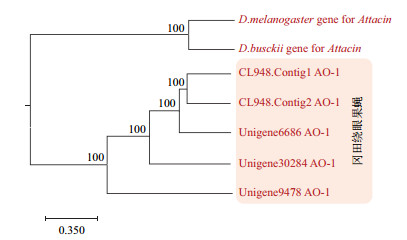
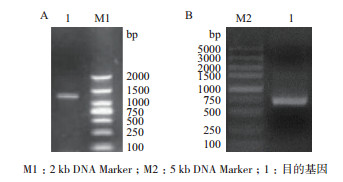
2 结果 2.1 抗菌肽基因的筛选、分析及全基因合成通过同源注释及从转录组数据库中挑选出来的aoattacin基因包含以下5个:CL948.Contig1_AO-1、CL948.Contig2_AO-1、Unigene30284_AO-1、Unigene6686_AO-1、Unigene9478_AO-1,为避免注释的错误,我们从BLASTp比对序列中,选取了2个高同源性、高置信的外源attacin基因作为参考序列(E value = 0)进行系统进化分析,结果证明了BLAST比对和数据库中的注释结果,冈田绕眼果蝇的5个抗菌肽基因聚在一个进化树分支,与2个外源参考序列明显分开(图 1);PCR进行验证候选unigene6686_AO-1(1 200 bp),长度及测序结果与预期一致(图 2-A); 选择其中最长的ORF,经密码优化后添加信号肽、His标签、BamH Ⅰ和EcoR Ⅰ酶切位点后进行全基因合成,合成后的产物通过电泳(图 2-B)及测序验证,结果与预期结果一致,并且未发现碱基突变和缺失。
|
| 图 1 aoattacin基因系统进化树 |
|
| 图 2 候选aoattacin基因的PCR鉴定(A)、全基因合成aoattacin基因的琼脂糖凝胶电泳鉴定(B) |
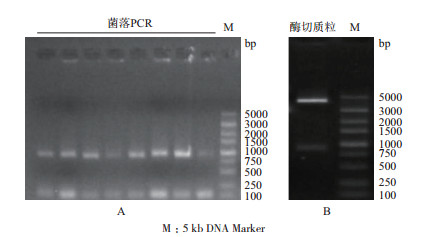
阳性克隆的PCR结果(图 3-A)显示目的条带在约1 000 bp位置,符合预期,序列测序验证结果也表明目的基因序列成功连接至载体上; 将重组质粒用SnaB Ⅰ和Hind Ⅲ双酶切,电泳结果表明目的基因(约750-1 000 bp)和质粒(约3 000-5 000 bp)条带均符合预期(图 3-B),测序验证也显示序列与预期序列一致,说明重组质粒pFast-bac1-aoattacin构建成功。
|
| 图 3 菌落PCR结果(A)、重组质粒双酶切鉴定(B) |
对阳性单克隆菌落的质粒进行PCR并测序验证,电泳结果(图 4)显示在3 000 bp处出现明显条带,符合预期(理论2 936 bp),测序结果也显示与预期序列一致,说明重组Bacmid构建成功。挑选DNA浓度最高的菌落(8号)进行后续实验。
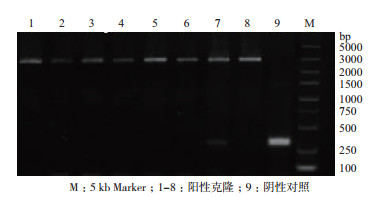
|
| 图 4 重组Bacmid PCR鉴定 |
利用SDS-PAGE对镍柱亲和层析纯化前后的培养上清及细胞进行检测:在培养基及细胞破碎后的上清中无明显目的蛋白条带(图 5-A); Western Blot显示该蛋白在细胞破碎离心后沉淀样中存在(图 5-B),上述结果表明Aoattacin蛋白为跨膜蛋白但表达量不高。分析了Aoattacin的表达过程,发现不同的条件导致不同的表达水平,进一步通过MOI优化表达条件,但产量没有明显提高(图 6)。
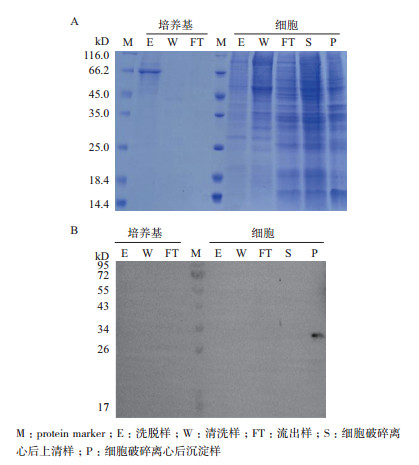
|
| 图 5 SDS-PAGE(A)及Western Blot(B)检测200 mL细胞表达纯化 |

|
| 图 6 MOI优化表达及检测 |
纯化的冈田绕眼果蝇抗菌肽Aoattacin对各种细菌的最小抑菌浓度(MIC)见表 1,实验表明Aoattacin对金黄色葡萄球菌在内的20种受试细菌都具有抑菌作用,其中对革兰氏阳性菌金黄色葡萄球菌抑制作用最强,MIC值为0.68 µmol/L,对革兰氏阴性菌黏质沙雷氏菌的抑制作用最弱,其MIC值为11.25 µmol/L。结果显示冈田绕眼果蝇抗菌肽Aoattacin对革兰氏阳性菌的抑制效果要更好。
冈田绕眼果蝇作为一种重要的医学昆虫,是结膜吸吮线虫主要传播媒介。虽然其分布有着局部分散的特点,但由于结膜吸吮线虫病例的日趋增多,其越来越多引起我们的研究。由于其饲养简单,繁殖能力强,还有通过我们前期组学分析从其中鉴定了多种抗菌肽序列,因此它有望继家蝇之后成研究抗菌肽的蝇类资源之一。抗菌肽作为一类广泛存在于自然界生物体中的小分子多肽类物质,是机体先天性免疫的重要组成部分[19-20]。由于多重耐药病原体的出现和传播,昆虫抗菌肽成了替代抗生素的潜在生物资源库,以解决当前抗生素的局限性[21]。虽然可以通过化学合成方法获得抗菌肽,但由于化学合成结构的差异,往往需要对其结构进行修饰后才具有活性。如化学合成的线性抗菌肽1-Muscin无抑菌活性,而经过环化修饰后的c-Muscin才对多种细菌有抑制作用[22]。而利用原核表达系统,由于其细胞缺少蛋白质的翻译后加工修饰过程,表达真核来源的蛋白可能会影响表达产物的生物活性,另外,由于抗菌肽强烈的抑菌活性,有时也会在其表达过程中将宿主杀死,使得重组表达难以在原核微生物中进行。真核表达系统则具有蛋白质的翻译后加工修饰过程,表达产物在分子结构、理化特性和生物化学功能等方面与天然蛋白分子相近,被广泛使用。昆虫杆状病毒系统使用的昆虫细胞可在无二氧化碳条件27℃进行贴壁或悬浮培养,操作相对简单,工业化生产方面具有天然优势,且昆虫细胞培养及操作较简便,成本低,因此被广泛用于生产基因工程产品。目前,全世界的学者已从100多种昆虫中建立了500多株细胞系。在国内也有20多个昆虫细胞系建立。由于Spodoptera frugiperda细胞株Sf9和Sf21以及Trichoplusia ni细胞株High Five和Tn-368对AcMNPV非常敏感,因而它们是杆状病毒表达系统中常用的昆虫细胞[23]。此外,抗菌肽数据库(APD:http://aps.unmc.edu/AP/main.php)中已经收集了大约2 600种抗菌肽。然而昆虫的AMPS种类不到10%,因此对昆虫AMPS的研究对AMPS的认识和应用具有重要意义[24]。随着抗菌肽的深入研究和基因工程的广泛应用,昆虫抗菌肽的功能、工作机制将更加明确,其应用也将更加多样、广泛。
本课题组前期利用化学合成方法获得的抗菌肽Aoattacin蛋白对表 1中的待选细菌,如:枯草芽孢杆菌(Bacillus subtilis)、稳定伯克霍尔德菌(Burkholderia stabilis)、鸡伤寒沙门氏菌(Salmonella gullinarum)、栖冷克吕沃尔菌(Kluyvera cryocrescens)等的最低抑菌浓度均大于100 µmol/L(未发表数据),可以认为对这些细菌没有起到抑制作用。而本研究中通过昆虫细胞表达Aoattacin对上述细菌都具有很强的抑制效果,这表明与合成抗菌肽相比,真核细胞表达的Aoattacin抑菌谱更广。此外,通过真核表达系统表达家蝇Aoattacin的研究目前报道也较少,较为成功的有中国仓鼠卵巢细胞(CHO)中稳定表达家蝇抗菌肽Attacin的报道[25],而本实验成功将包含冈田绕眼果蝇抗菌肽aoattacin基因的杆状病毒表达载体转染到Sf9细胞,通过Western Blot对目的蛋白表达情况检测时发现目的条带的位置与预测分子量(34 kD)有所偏差,我们推测由于真核表达蛋白存在一定后期修饰造成的分子量变化,后续我们也正在利用质谱法对该蛋白进行鉴定以证实其修饰方式。表达的Aoattacin蛋白的分子量与预测的大小基本一致,表明Bacmid重组质粒在昆虫Sf9细胞中成功表达。虽然经过前期密码子及MOI的优化,但结果仍然显示aoattacin基因在Sf9细胞中表达量较小,距离后期进行规模化生产仍有一定难度,但本实验也为后续规模化生产提供了基础实验数据的参考。
4 结论本研究构建了冈田绕眼果蝇抗菌肽Aoattacin成熟肽在昆虫细胞Sf9中的表达载体,诱导表达后进行蛋白检测,Tricine-SDS-PAGE及Western Blot分析结果表明aoattacin基因在昆虫细胞Sf9中成功表达,抑菌实验显示Aoattacin对受试革兰氏阳性和革兰氏阴性菌都具有抑制作用,是一种新型广谱抗菌肽。
| [1] |
黄学贵, 张露菲, 王灵军, 等. 贵州省遵义市冈田绕眼果蝇的诱捕、鉴定及人工饲养[J]. 医学动物防制, 2017(7): 765-766. |
| [2] |
郑明辉, 叶昌林, 江楠, 等. 贵州省遵义地区人体结膜吸吮线虫线粒体DNA分析[J]. 中国血吸虫病防治杂志, 2017, 29(5): 598-601, 614. |
| [3] |
Hoffmann JA. The immune response of Drosophila[J]. Nature, 2003, 426(6962): 33-38. DOI:10.1038/nature02021 |
| [4] |
Tanaka H, Ishibashi J, Fujita K, et al. A genome-wide analysis of genes and gene families involved in innate immunity of Bombyx mori[J]. Insect Biochemistry and Molecular Biology, 2008, 38(12): 1087-1110. DOI:10.1016/j.ibmb.2008.09.001 |
| [5] |
Graveley BR, Kaur A, Gunning D, et al. The organization and evolution of the Dipteran and Hymenopteran Down syndrome cell adhesion molecule(Dscam)genes[J]. Rna-a Publication of the Rna Society, 2004, 10(10): 1499-1506. DOI:10.1261/rna.7105504 |
| [6] |
Kocks C, Cho JH, Nehme N, et al. Eater, a transmembrane protein mediating phagocytosis of bacterial pathogens in Drosophila[J]. Cell, 2005, 123(2): 335-346. DOI:10.1016/j.cell.2005.08.034 |
| [7] |
Brogden KA. Antimicrobial peptides:pore formers or metabolic inhibitors in bacteria?[J]. Nature Reviews Microbiology, 2005, 3(3): 238-250. DOI:10.1038/nrmicro1098 |
| [8] |
Boman HG. Peptide antibiotics and their role in innate immunity[J]. Annual Review of Immunology, 1995, 13(1): 61-92. DOI:10.1146/annurev.iy.13.040195.000425 |
| [9] |
English BK, Gaur AH. The use and abuse of antibiotics and the development of antibiotic resistance[J]. Hot Topics in Infection and Immunity in Children VI, 2010, 659: 73-82. |
| [10] |
Ju JW, Joo HN, Lee MR, et al. Identification of a serodiagnostic antigen, legumain, by immunoproteomic analysis of excretory-secretory products of Clonorchis sinensis adult worms[J]. Proteomics, 2009, 9(11): 3066-3078. DOI:10.1002/pmic.200700613 |
| [11] |
Feng Q, Huang Y, Chen M, et al. Functional synergy of α-helical antimicrobial peptides and traditional antibiotics against Gram-negative and Gram-positive bacteria in vitro and in vivo[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2015, 34(1): 197-204. |
| [12] |
王青, 徐彦召, 刘保国, 等. 抗菌肽的特点及其基因工程研究进展[J]. 黑龙江畜牧兽医, 2017(17): 5-8. |
| [13] |
Hermosilla C, Pantchev N, Dyachenko V, et al. First autochthonous case of canine ocular Dirofilaria repens infection in Germany[J]. Veterinary Record, 2006, 158(4): 134-135. DOI:10.1136/vr.158.4.134 |
| [14] |
李忠强, 郑伟, 闫春梅, 等. 抗菌肽基因工程化研究进展[J]. 科学家, 2017, 5(11): 27-28. DOI:10.3969/j.issn.1673-9671.2017.11.050 |
| [15] |
Lu X, Shen J, Jin X, et al. Bactericidal activity of Musca domestica cecropin(Mdc)on multidrug-resistant clinical isolate of Escherichia coli[J]. Applied Microbiology and Biotechnology, 2012, 95(4): 939-945. DOI:10.1007/s00253-011-3793-2 |
| [16] |
柳峰松, 王丽娜, 唐婷, 等. 家蝇抗菌肽Diptericin基因的克隆与分析[J]. 昆虫学报, 2009, 52(10): 1078-1082. DOI:10.3321/j.issn:0454-6296.2009.10.003 |
| [17] |
Wang JX, Zhao XF, Liang YL, et al. Molecular characterization and expression of the antimicrobial peptide defensin from the housefly(Musca domestica).[J]. Cellular & Molecular Life Sciences Cmls, 2006, 63(24): 3072-3082. |
| [18] |
Pei Z, Sun X, Tang Y, et al. Cloning, expression, and purification of a new antimicrobial peptide gene from Musca domestica larva[J]. Gene, 2014, 549(1): 41-45. |
| [19] |
Fox JL. Antimicrobial peptides stage a comeback[J]. Nature Biotechnology, 2013, 31(5): 379-382. DOI:10.1038/nbt.2572 |
| [20] |
Badinloo M, Nguyen E, Suh W, et al. Overexpression of antimicrobial peptides contributes to aging through cytotoxic effects in Drosophila tissues[J]. Archives of Insect Biochemistry and Physiology, 2018(12): e21464. |
| [21] |
Mylonakis E, Podsiadlowski L, Muhammed M, et al. Diversity, evolution and medical applications of insect antimicrobial peptides[J]. Philosophical Transactions of the Royal Society of London, 2016, 371(1695): pii:20150290. DOI:10.1098/rstb.2015.0290 |
| [22] |
杨雪, 唐婷, 王一丽, 等. 家蝇新型抗菌肽Muscin的基因克隆、表达模式及抑菌活性[J]. 昆虫学报, 2015, 58(6): 617-624. |
| [23] |
朱帮福, 卢兹凡, 陈南春, 等. 昆虫杆状病毒表达系统的研究进展[J]. 细胞与分子免疫学杂志, 2002, 18(6): 681-684. DOI:10.3321/j.issn:1007-8738.2002.06.058 |
| [24] |
Liu SH, Wei D, Yuan GR, et al. Antimicrobial peptide gene cecropin-2 and defensin respond to peptidoglycan infection in the female adult of oriental fruit fly, Bactrocera dorsalis(Hendel)[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2017, 206: 1-7. DOI:10.1016/j.cbpb.2017.01.004 |
| [25] |
徐建华, 朱家勇, 金小宝, 等. 多聚组氨酸标签的Attacin抗菌肽基因克隆及其在CHO细胞中稳定表达[J]. 广东医学, 2007, 28(12): 1910-1913. DOI:10.3969/j.issn.1001-9448.2007.12.008 |