多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类稠环化合物,主要来源是化石燃料的不完全燃烧,具有较强的致癌、致畸和致突变能力,对于生物毒害较大[1]。由于难以被生物降解,是美国环境保护署“优先控制”的持久性有机污染物[2]。我国土壤PAHs污染情况较为严重。Liu等[3]研究显示北京市周边土壤中,总PAHs含量可能达到887 μg/kg; Zheng等[4]研究显示,以成都为代表的西部地区土壤中PAHs最高含量约75 431 ng/g,平均值为3 106 ng/g。因此PAHs污染治理受到人们的日益关注。蒽是多环芳烃中一类重要的污染物质,三环线性分子,水溶性极低,微生物降解难度大。
漆酶(EC 1.10.3.2)最早由日本Yoshida于1883年在东南亚的漆树中发现。进一步的研究发现其广泛存在于植物、高等真菌以及少数细菌和昆虫中[5]。1996年,Collins等[6]首次报道了漆酶对PAHs的降解作用。漆酶对于PAHs的降解具有高效性。Janikowski等[7]的研究显示鞘氨醇单胞菌属(Sphingomonas)分泌的漆酶对萘、菲和蒽的最高降解效率可达98 mg/(L·h); Majcherczyk等[8]的研究显示,在介体HBT的作用下,云芝菌所产漆酶对于常见14种PAHs降解效率高,可降解50%芘、苯并芘[a]和蒽,完全降解苊、苊烯、芴等。在真菌之中,以灵芝为代表的白腐真菌属受到格外关注,其胞外漆酶活性高,易于纯化[9],且广泛降解木质素[10]。由于漆酶具有稳定,无副产物等优点,在造纸、环境保护、生物合成、食品加工和能源开发等行业中被大规模应用[11-12]。
灵芝是一种名贵的药食两用真菌,属于担子菌亚门,最早记录于《本草纲目》中。其富含甾醇、萜类等生物活性物质,具有免疫调节、抗肿瘤、抗氧化等多种功效[13],在中国传统中医中具有重要作用,且近年来其商业价值被大规模开发,日益受到重视[14]。常用的抗氧化剂对人体有潜在的危害,故开发新型无害抗氧化剂有重要的意义。灵芝是受到长期关注的潜在资源。孟歌等[15]的研究结果表明灵芝具有较强的抗氧化能力,可以作为天然抗氧化剂进一步开发利用。灵芝是真菌中主要产漆酶的种属,不同灵芝产菌株产漆酶能力有较大的差异[16]。刘禹等[17]的研究结果显示,有柄树舌灵芝漆酶活性(均值1195.4 U/g)显著高于其他菌种,灵芝S3、26A和甜灵芝的最大漆酶活性仅有其37%、27%和10%左右。而王书超等[18]对树舌灵芝的进一步研究显示,其产漆酶能力与碳源、氮源、温度和pH等条件相关,且影响程度依次减小,表明不同的环境因素对微生物产漆酶能力影响较大。
活性与耐受力不足是现阶段限制漆酶大规模工业化应用的关键因素,因此提高胞外漆酶活性具有重要意义[19]。此前已有大量研究证实化合物种类及浓度[20-22]、复合培养基及诱导物粒子大小对于产漆酶能力及胞外漆酶活性的影响[23-24]。但蒽作为一种外源物质,对灵芝漆酶是否存在影响目前还鲜有研究。本研究以3株不同的灵芝菌株为实验材料,分析在蒽的作用下,漆酶活性和漆酶基因转录表达水平的响应特征。
1 材料与方法 1.1 材料 1.1.1 菌种3株灵芝菌株荣保1号、川芝和美芝,由四川农业大学微生物系提供。
1.1.2 主要试剂马铃薯葡萄糖琼脂培养基(PDA,北京奥博星生物技术有限责任公司); 丙酮(成都市科隆化学品有限公司); 蔥(纯度99%,罗恩化学试剂公司); 2,2'-连氮-双(3-乙基苯并噻唑-6-磺酸)[2,2'-azinobis(3-ethylbenzthiazoline-6-sulphonic acid),ABTS](solarbio公司); M-MuLv第一链cDNA合成试剂盒(生工生物工程股份有限公司); SYBR Green Master Mix(Vazyme公司)。
1.1.3 主要仪器iQ5荧光定量PCR仪(美国Bio-Rad公司); V-1100D型分光光度计(美谱达)。
1.2 方法 1.2.1 菌种活化与培养菌株保存与活化使用PDA固体培养基,菌株培养使用PDB培养基(土豆200 g,葡萄糖20 g,pH自然,定容至1 000 mL)。250 mL锥形瓶中加入50 mL PDB培养基,115℃灭菌30 min。每个锥形瓶接种3块活化的菌丝体(直径1 cm),30℃避光恒温静置培养。培养5 d后加入蔥(由丙酮配制成2.0 g/L母液,0.22 μm滤膜过滤除菌),使其终浓度为1.0 mg/L。同时设置两组对照,一组加入等量丙酮,另外一组为空白对照。30℃避光恒温静置培养,分别于1 h、3 h、6 h、9 h和24 h取样,用于酶活和转录表达水平分析。每个处理3个重复。
1.2.2 漆酶酶活性的测定取1.0 mL发酵液,12 000 r/min离心5 min,上清液即为粗酶液,测定方法参照秦澎等[25]。测定反应体系为2.7 mL 0.1 mol/L醋酸-醋酸钠缓冲溶液(pH 4.5)、0.2 mL 0.5 mol/L ABTS和0.1 mL粗酶液。于波长420 nm处、30℃测定吸光度变化,计算漆酶活性。定义1 min氧化l μmol ABTS所需的酶量为一个酶活力单位(U/mL)。每个菌株3个重复,以煮沸灭活粗酶液为对照。
1.2.3 总RNA提取、cDNA合成和qRT-PCR取少量液氮保存的菌丝体,研磨成粉末状,利用TRIzol法提取总RNA[26],通过1%琼脂糖凝胶电泳检测RNA的完整性。检测合格的RNA使用M-MuLv第一链cDNA合成试剂盒合成第一链cDNA。
以合成的cDNA为模板,对相关灵芝漆酶基因进行转录表达水平分析。qRT-PCR在iQ5(Bio-Rad)仪器上进行。荧光定量PCR反应体系共计10.0 μL:Green Master Mix 5.0 μL,Rox Reference Dye 0.2 μL,cDNA 1.0 μL,引物0.4 μL,加入ddH2O补足至10.0 μL。qRT-PCR分析具体程序依据Mix说明书进行:95℃ 5 min; 95℃ 10 s; 60℃ 30 s; 重复40个循环,60℃退火。以灵芝RPL4基因为内参基因,所用引物序列参照文献[27],通过熔解曲线判定引物的特异性,利用双δ法计算基因的相对转录表达水平。
1.2.4 数据分析利用Excel进行数据整理计算制表,利用SPSS进行相关性分析,利用Origin作图。
2 结果 2.1 不同处理条件下灵芝漆酶活性不同处理时间及条件下,3株灵芝菌株漆酶活性存在差异,总的趋势为抑制,促进多发生在处理时间较长的条件下(图 1)。美芝在蒽(En+BT)短时间处理下,漆酶活性小幅下调,但随处理时间延长,漆酶活性不断上升,当处理24 h时,漆酶活性达到22.93 U/mL,是对照(CK)和丙酮(BT)处理的1.29倍和1.43倍。荣保1号在3种处理条件下,漆酶活性均随处理时间延长而上升。蒽(En+BT)处理3 h,漆酶活显著上升,达到8.22 U/mL,是对照(CK)和丙酮(BT)的1.71和1.75倍; 处理24 h时,丙酮(BT)和蒽(En+BT)处理下,漆酶活性达到最高,分别是对照(CK)的1.47和1.29倍。川芝在丙酮(BT)和蒽(En+BT)处理下,漆酶活性大幅降低至对照的一半左右。处理1 h后,分别为18.29 U/mL和17.31 U/mL,且随着培养时间延长,漆酶活性无明显变化。
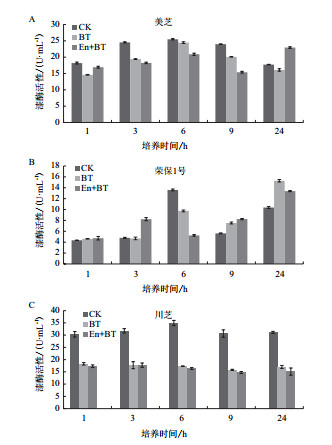
|
| 图 1 美芝(A)、荣保1号(B)和川芝(C) |
利用qRT-PCR分析蒽处理下3株灵芝菌株漆酶基因在转录表达水平上的差异。同时分析丙酮作用下漆酶基因的转录表达规律。结果显示(表 1-3),除在川芝中,未检测到2个漆酶基因(Glac6和Glac12)的转录本,其余漆酶基因转录表达水平存在差异性和特异性。
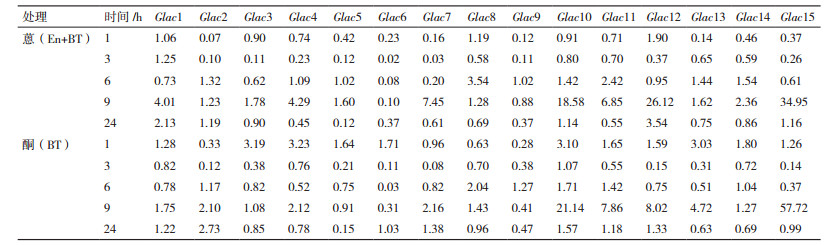
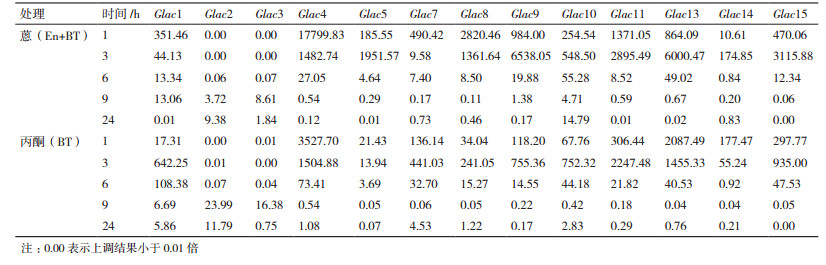
美芝漆酶基因在蒽(En+BT)处理前期(1 h),所有漆酶基因均转录表达均被抑制,随着培养时间的延长,部分漆酶基因的转录表达水平开始上升(表 1)。3 h时,Glac15是对照的4.58倍; 9 h时,Glac11是对照的8.80倍; 在处理6 h后,Glac12转录表达水平一直上升,最高达到对照的33.92倍(24 h)。丙酮(BT)处理下,有5个漆酶基因(Glac1、3、5、12和15)的表达在不同处理发生了上调,其余10个漆酶基因的表达被不同程度地抑制。丙酮(BT)与蒽(En+BT)处理下漆酶的表达规律相比较,有4个漆酶基因(Glac6、9、11和14)在蒽(En+BT)处理下发生了上调。
荣保1号在蒽(En+BT)处理下,大多数漆酶基因(Glac1、Glac3-5、Glac7、Glac10-15)的转录表达高峰出现在处理9 h。Glac15、Glac12和Glac10在蒽(En+BT)处理下转录表达水平上调最大,分别为对照的34.9、26.12和18.58倍。其余基因转录表达峰值出现在处理6 h,上调幅度最大为Glac8,仅为对照的3.54倍。处理全过程中,Glac6和Glac9显示被抑制,Glac6被抑制幅度最大,最低表达仅为对照的0.02倍。丙酮(BT)处理下,7个漆酶基因(Glac1、Glac7、Glac10-13和Glac15)转录表达峰值出现在9 h,Glac15和Glac10转录表达上调幅度最大,分别为对照的57.72和21.14倍。丙酮(BT)处理下,未见被明显抑制的基因(表 2)。整体而言,相关基因转录表达水平均围绕对照小幅波动,均有一个转录表达水平的峰值。Glac10受到促进效果最明显,Glac15转录表达水平波动最大。
川芝在蒽(En+BT)处理下,除Glac2和Glac3外,其余基因转录表达水平均快速下降至被抑制。处理1 h,转录表达水平上调幅度大于1 000倍的有Glac4(17799.83倍)、Glac8(2820.46倍)和Glac11(1371.05倍)。处理24 h,仅有Glac10转录表达水平表现为促进(14.79倍),Glac15转录表达水平已经低于对照的0.01倍。Glac2和Glac3转录表达水平则随处理时间延长而缓慢上升。处理24 h,Glac2转录表达水平已为对照的9.38倍。丙酮(BT)处理下,表达水平变化规律与蒽(En+BT)处理下基本一致(表 3)。总体而言,两种处理条件对于川芝漆酶基因转录表达水平的影响一致,均为先促进后抑制。
3 讨论已有研究报道发现,灵芝属中不同菌株、冬菇不同菌株的产漆酶能力和规律存在较大的差异,与生长速度、培养条件等存在一定关联[17, 28]。本研究中,3株灵芝菌株的产漆酶能力存在差异,且在丙酮(BT)或蒽(En+BT)的胁迫下,漆酶活性的变化规律也存在差异,其中川芝漆酶活性一直被强烈抑制。3株菌株中,美芝在丙酮(BT)或蒽(En+BT)处理下,漆酶活性变化的幅度最小,暗示其耐受性较强,可作为蒽原位降解的候选微生物资源。
漆酶大多以同工酶的形式存在于生物体,如白腐真菌中含有11个漆酶同工酶基因[29],灵芝中含有15个漆酶同工酶基因。在进化过程中,针对不同的环境胁迫,这些基因做出相应的特征响应。金属Pb2+、Cd2+、Cu2+和Fe2+胁迫下,灵芝5个漆酶基因(Glac4、Glac6、Glac10、Glac11和Glac12)的转录表达水平发生上调[9]。丙酮或蒽作为一种外源物质,对灵芝漆酶的转录表达水平存在不同的作用,且在不同的菌株中,漆酶同工酶基因转录表达的响应特征存在差异。菌株美芝相关基因表达差异较小; 菌株荣保1号在丙酮(BT)处理下,漆酶基因Glac10的响应较大,在蒽(En+BT)处理下,漆酶基因Glac10和Glac15的响应较大; 菌株川芝在丙酮(BT)处理下,漆酶基因Glac4和Glac10的响应较大,在蒽(En+BT)处理下,漆酶基因Glac4、Glac9和Glac13的响应较大。说明这些基因在灵芝菌株适应丙酮(BT)和蒽(En+BT)的胁迫过程中可能发挥重要的作用。
通过分析丙酮(BT)或蒽(En+BT)处理下,3株菌漆酶活性与15个漆酶同工酶基因转录表达水平变化的相关性发现,川芝中漆酶活性与较多的同工酶基因转录表达水平显著相关。两种处理条件下,5个漆酶基因的转录表达水平与漆酶活性显著相关,其中Glac2[BT:-0.93;(En+BT):-0.75]和Glac3[BT:-0.87;(En+BT):-0.76]表达水平与活性负相关,暗示这两个漆酶在活性降低中可能起着主要作用。
4 结论在1.0 mg/L蒽的处理下,3株灵芝菌株在漆酶活性和漆酶同工酶基因转录表达水平上表现出不同的响应特征。川芝漆酶活性最高,在丙酮(BT)或蒽(En+BT)作用下,漆酶活性被抑制程度最强,相关基因转录表达水平波动幅度也最大,表明川芝可能对丙酮(BT)或蒽(En+BT)胁迫较敏感。美芝漆酶活性和基因转录表达水平在丙酮(BT)或蒽(En+BT)存在情况下均受到抑制,但波动较小,暗示该菌株对这两种物质的耐受力较强,可作为原位降解蒽的一个微生物资源。荣保1号漆酶活性随着丙酮(BT)或蒽(En+BT)胁迫时间的增加而不断上升,但漆酶基因的转录表达水平未发生较大变化,显示该菌株对丙酮或蒽(En+BT)有较强的适应能力。
| [1] |
吴宇澄, 林先贵. 多环芳烃污染土壤真菌修复进展[J]. 土壤学报, 2013, 50(6): 1191-1199. |
| [2] |
Gong Z, Wang X, Tu Y, et al. Polycyclic aromatic hydrocarbon removal from contaminated soils using fatty acid methyl esters[J]. Chemosphere, 2010, 79(2): 138-143. DOI:10.1016/j.chemosphere.2010.01.037 |
| [3] |
Liu H, Yu X, Liu Z, et al. Occurrence, characteristics and sources of polycyclic aromatic hydrocarbons in arable soils of Beijing, China[J]. Ecotoxicol Environ Saf, 2018, 159: 120-126. DOI:10.1016/j.ecoenv.2018.04.069 |
| [4] |
Zheng H, Xing X, Hu T, et al. Biomass burning contributed most to the human cancer risk exposed to the soil-bound PAHs from Chengdu Economic Region, western China[J]. Ecotoxicol Environ Saf, 2018, 159: 63-70. DOI:10.1016/j.ecoenv.2018.04.065 |
| [5] |
Unuofin JO, Okoh AI, Nwodo UU. Utilization of agro industrial wastes for the production of laccase by Achromobacter xylosoxidans HWN16 and Bordetella bronchiseptica HSO16[J]. Journal of Environmental Management, 2019, 231: 222-231. DOI:10.1016/j.jenvman.2018.10.016 |
| [6] |
Collins PJ, Kotterman M, Field JA, et al. Oxidation of anthracene and benzo[J]. Appl Environ Microbiol, 1996, 62(12): 4563-4567. |
| [7] |
Janikowski TB, Velicogna D, Punt M, et al. Use of a two-phase partitioning bioreactor for degrading polycyclic aromatic hydrocarbons by a Sphingomonas sp[J]. Applied Microbiology and Biotechnology, 2002, 59(2-3): 368-376. DOI:10.1007/s00253-002-1011-y |
| [8] |
Majcherczyk A, Johannes C. Oxidation of polycyclic aromatic hydrocarbons(PAH)by laccase of Trametes versicolor[J]. Enzyme and Microbial Technology, 1998, 22(5): 335-341. DOI:10.1016/S0141-0229(97)00199-3 |
| [9] |
Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungus Trametes orientalis:Purification, characterization, and application[J]. International Journal of Biological Macromolecules, 2017, 102: 758-770. DOI:10.1016/j.ijbiomac.2017.04.089 |
| [10] |
An Q, Wu XJ, Han ML, et al. Sequential solid-state and submerged cultivation of the white rot fungus Pleurotus ostreatus on biomass and the activity of lignocellulolytic enzymes[J]. BioResources, 2016, 11(4): 8791-8805. |
| [11] |
沈柯宇, 张西蓓, 秦澎, 等. 4种重金属对灵芝漆酶活性及转录表达的影响[J]. 应用与环境生物学报, 2017, 3: 448-453. |
| [12] |
郑飞, 等. 白腐真菌东方栓孔菌在两种液体培养基中产漆酶过程的生理学研究[J]. 菌物学报, 2017, 36(5): 582-597. |
| [13] |
何茂兰, 沈柯宇, 等. 金属胁迫下灵芝寡肽转运蛋白基因家族的转录表达[J]. 微生物学通报, 2017, 44(9): 2120-2127. |
| [14] |
Si J, Meng G, Wu Y, et al. Medium composition optimization, structural characterization, and antioxidant activity of exopolysaccharides from the medicinal mushroom Ganoderma lingzhi[J]. International Journal of Biological Macromolecules, 2019, 124: 1186-1196. DOI:10.1016/j.ijbiomac.2018.11.274 |
| [15] |
孟歌, 崔宝凯, 李春道, 等. 药用真菌灵芝液体培养过程中的抗氧化活性研究[J]. 菌物学报, 2018, 37(4): 486-501. |
| [16] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011, 2: 48-55. |
| [17] |
刘禹, 兰进, 徐新然, 等. 灵芝属不同菌种漆酶活性的比较[J]. 中药材, 2016, 8: 1692-1695. |
| [18] |
王书超, 张宇, 何爽, 等. 树舌灵芝产漆酶发酵条件的优化[J]. 现代农业研究, 2018, 27(3): 11-13. |
| [19] |
Zheng F, et al. Immobilization of laccase onto chitosan beads to enhance its capability to degrade synthetic dyes[J]. International Biodeterioration & Biodegradation, 2016, 110: 69-78. |
| [20] |
司静, 崔宝凯. 绒毛栓孔菌液体培养过程中胞外酶活性的研究[J]. 基因组学与应用生物学, 2012, 31(1): 70-77. DOI:10.3969/gab.031.000070 |
| [21] |
司静, 崔宝凯, 等. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405-416. |
| [22] |
司静, 崔宝凯, 贺帅, 等. 微酸多年卧孔菌产漆酶条件优化及其在染料脱色中的应用[J]. 应用与环境生物学报, 2011, 17(5): 736-741. |
| [23] |
Ma HF, Meng G, Cui BK, et al. Chitosan crosslinked with genipin as supporting matrix for biodegradation of synthetic dyes:Laccase immobilization and characterization[J]. Chemical Engineering Research and Design, 2018, 132: 664-676. DOI:10.1016/j.cherd.2018.02.008 |
| [24] |
韩美玲, 等. 不同木质纤维素诱导对糙皮侧耳液体发酵产漆酶活性的影响[J]. 菌物学报, 2017, 36(3): 349-357. |
| [25] |
秦澎, 辜运富, 曾先富, 等. 香菇漆酶高产菌株筛选及漆酶基因的表达研究[J]. 菌物学报, 36(9): 1243-1250. |
| [26] |
Ling M, Feldman L. A rapid TRIzol-based two-step method for DNA-free RNA extraction from Arabidopsis, siliques and dry seeds[J]. Biotechnology Journal, 2010, 5(2): 183-186. DOI:10.1002/biot.200900211 |
| [27] |
Xiang QJ, Li J, Qin P, et al. Identification and evaluation of reference genes for qRT-PCR studies in Lentinu laedodes[J]. PLoS One, 2018, 13(1): e0190226. DOI:10.1371/journal.pone.0190226 |
| [28] |
安琪.冬菇不同菌株酶活性的研究[D].北京: 北京林业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10022-1016139792.htm
|
| [29] |
卓睿.白腐真菌漆酶及同工酶基因家族的克隆表达调控研究[D].武汉: 华中科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10487-1015596640.htm
|