2. 中南林业科技大学森林资源生物技术湖南省国际科技创新合作基地,长沙 410004;
3. 甘肃农业职业技术学院,兰州 730020
2. Hunan Provincial International Cooperation Base of Scientific and Technological Innovation, Central South University of Forestry and Technology, Changsha 410004;
3. Gansu Agriculture Technology College, Lanzhou 730020
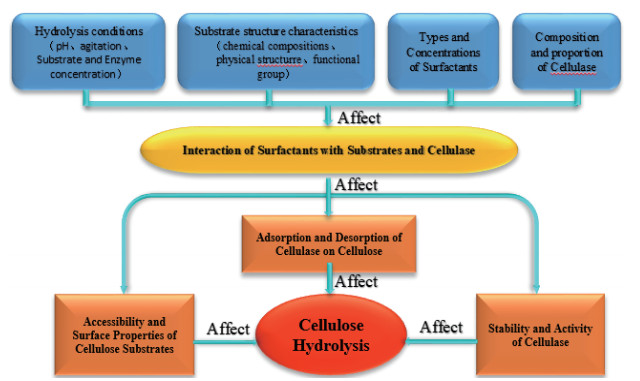
木质纤维素生物质是一种丰富的可再生资源,然而由于植物细胞壁对微生物和分解酶的天然抗性使其难以被有效利用[1]。与物理、化学等方法相比,利用纤维素酶进行酶解糖化具有条件温和、利于环保,且不产生后续发酵抑制物等优点[2]。但目前纤维素酶普遍存在酶解效率低、酶负荷大等问题,导致实际使用成本过高,不利于生产[3-4]。为解决这一问题,各国学者采取了多种策略,包括添加酶助剂[5]、筛选微生物以寻求性能更好的新型纤维素分解酶[6-7]、酶的定向进化和蛋白质工程[8]以及提高预处理技术和酶的再利用等[9]。表面活性剂(Surfactant,SF)是一种两亲性分子,含有一个憎水基团和一个亲水基团,具有两性分子的结构特征使其表现出乳化、浸润、分散和增溶等多种特性,是一种理想的酶助剂。研究发现,添加SF可以显著提高纤维素的酶水解率。根据极性基团的解离性质,SF可分为离子型和非离子型,离子型SF根据解离后的电荷,又可分为阳离子型、阴离子型和两性离子型。大量研究表明,对纤维素酶解的促进效果最好的是非离子型SF,如典型的吐温和聚乙二醇,因其具有稳定性高、相容性好和溶解性强等优点,可以显著提高纤维素水解率[10-11]。也有研究把阴阳离子表面活性剂进行复配,寻找新型表面活性剂[12-13],进一步改善SF对纤维素酶解的促进作用。根据来源的不同,SF又可分为化学表面活性剂(Chemical surfactants,CSF)和生物表面活性剂(Biosurfactant,BSF)。BSF是一类由微生物、植物或动物产生的具有一定表面活性的两性物质[14],相对CSF具有无毒、可降解等优点,且具有更高的表面活性和较低的临界胶束浓度,以及更强的pH稳定性、乳化能力和抗黏附活性。
虽然添加SF可以显著提高纤维素酶解效率,增加还原糖产量,但不同类型的SF对纤维素的酶解具有不同的影响,且SF的作用效果受到底物结构、水解条件和酶的组成等多方面的影响。SF对纤维素酶解的影响机理也尚不完全清楚,普遍认为其能减少纤维素酶在木质纤维素表面的无效吸附、提高纤维素酶的稳定性和活性及改变底物结构特性等。因此,本文从上述几个方面对表面活性剂对纤维素酶解的影响及机理的研究进展进行综述,旨在为木质纤维素生物质的酶解转化研究提供理论借鉴。
1 影响表面活性剂作用效果的因素大量研究表明添加SF可显著提升纤维素的转化率,提高酶的稳定性,增加还原糖产率[15-16]。Parnthong等[17]在棕榈果串(Palm fruit bunch,PFB)中添加浓度为0.25%(W/V)的Tween-80,还原糖产量增加约50.5%,并发现Tween-80能吸附在木质素的疏水表面上,从而促进纤维素酶在纤维素上的吸附,进而提高纤维素的酶解率。类似的,Kim等[18]研究发现,SF对不含木质素的底物酶解也有较大的提高。在α-纤维素和滤纸的酶解过程中加入0.5%的Tween-80,72 h后可以将转化率从59.4%和69.2%分别提高到81.3%和91.2%。Li等[19]发现随着SF用量从0增加0.06 g/g DS(干物质质量比),葡萄糖产率迅速增加,而当SF用量超过0.06 g/g DS时,葡萄糖产率略有降低。这可能是由于过量的SF达到了临界胶束浓度发生自凝聚,形成的胶束抑制了酶与底物接触,从而降低了葡萄糖的产率[20]。Cai等[21]发现PVP-8000比PEG、Tween等传统SF的效果更好。其研究表明,PVP-8000在木质素上的吸附量较大,吸附层更稳定、更亲水,降低了纤维素酶在木质素上无效吸附的73.1%。因此,大大提高了木质纤维素的酶解率。但SF性能的优劣既取决于其分子结构的特点(即极性基团和非极性基团的组成),又受到底物结构、酶的组成及各种水解条件,如pH、转速、底物浓度等的影响。
1.1 底物对表面活性剂作用效果的影响底物不同,其纤维素、半纤维素及木质素的含量也不同,SF与底物的相互作用亦不同,因此对酶活的影响也不尽相同。Sipos等[22]在6种木质纤维素酶解中添加了PEG-4000,研究发现仅对云杉、柳树、大麻有促进作用,而对玉米、小麦的秸秆和高粱渣的酶解没有明显的改善。同样的,Rocha-Martin等[3]采用高固含量和低酶用量等工艺条件,对预处理玉米秸秆、甘蔗秸秆和微晶纤维素进行水解。结果表明,加入PEG-4000可使3种材料的葡萄糖产率分别提高10%、7.5%和32%。这可能是不同类型的木质素通过不同的机制抑制酶水解。Li等[23]研究发现,纤维素酶在有机溶胶木质素上无效吸附,减少了降解纤维素的有效酶,从而降低了水解速率和最终还原糖产量。硫酸盐木质素沉积在纤维素表面,抑制其与纤维素酶接触,而分子量影响木质素的抑制作用。小分子木质素溶解性较好,与酶结合后形成的复合物仍处于水相,只导致少部分(10%)的酶失活,纤维素酶仍能进入底物内部与纤维素结合并水解纤维素,但大分子木质素与酶结合后,复合物可能无法有效地进入纤维素内部,形成一定的空间排斥现象,阻止纤维素酶进一步水解纤维素,当大分子木质素较多沉淀在纤维素表面时,这种空间排斥作用将更加明显。另外,核磁共振分析表明,木质素的结构特征,如官能团等决定了木质素在酶解过程中的吸附能力,高含量的脂肪族羟基或低含量的羧基导致高的表面疏水性,增加木质素和酶之间的无效吸附。因此,不同底物的木质素结构特征及含量均不相同,影响纤维素酶与纤维素有效结合的方式亦不同,表面活性剂因能与底物结合,改变其结构特性,如疏水性、电负性及空间位阻等,因而改善了纤维素酶在底物上的吸附性能,提高了纤维素的水解率。
对于纯纤维素来说,纤维素对纤维素酶的可及度是限制酶解的主要原因,也是影响SF作用效果的重要因素。Mizutani等[24]研究发现,Tween-20对Avicel、Tencel等结晶度较高的纤维物质的酶解有促进作用,而对结晶度较低的铜氨人造纤维没有促进作用,认为可能是SF抑制了内切酶在纤维素表面的无效吸附,从而使得外切酶更容易进入纤维素链的末端。而有研究者有不同的发现,Gupta等[25]研究发现聚合度影响外切酶的活性,外切酶不能水解较低聚合度的纤维素,因而聚合度高的纤维素底物反而水解率更高,并认为提高底物的表面积和反应位点的数目有利于酶的吸附,从而提高水解的初始速率。因此,纤维素的结构特点,如结晶度、聚合度等均会影响纤维素的可及度,进而影响纤维素酶(外切酶和内切酶)的吸附性能,因而SF的作用效果亦不相同。
1.2 水解条件对表面活性剂作用效果的影响木质纤维素的酶解是一个固液两相反应过程,除了木质纤维素的结构特性,水解条件、固液两相传质效率等同样会影响SF的作用效果。Lou等[26]发现,pH值升高能显著增强木质素的表面电荷(负电荷),导致木质素变得更加亲水,并降低其与纤维素酶结合的亲和力,从而减少纤维素酶的无效吸附,进而提高纤维素的转化率。Wang等[27]也有相似的发现,将缓冲液的pH由5.0提高到5.5时,阴离子型SF木质素磺酸钠能将木质纤维素的72 h转化率提高10%。因此,pH值影响底物、酶的表面性质,也影响SF对酶解的作用效果。而有研究者表示,在最佳水解条件下,SF对纤维素酶水解的促进作用并不明显,但在苛刻条件下(高转速、高固液比等)可以提高纤维素的转化。Yang等[28]发现在转速为0 r/min、100 r/min时,Tween-80对纯纤维素转化率的影响很小,然而,当转数增加到180 r/min时,Tween-80使得纤维素转化率从35%提高到45%。类似的,Okino等[29]比较了搅拌和静置条件下Tween-80的添加对滤纸水解反应速率的影响,发现在搅拌条件下水解速率明显增加,然而在静态条件下并没有增加,认为Tween-80能防止纤维素酶在搅拌条件下失活。另外,含水量(固液比)影响物质的传质效率,高固液比能够提高酶解糖浓度以及后续发酵的产物浓度,减少废水产生,但会降低纤维素酶的转化率、增加能耗等[30],添加SF有助于这一问题的解决。Ma等[31]研究了SF与底物浓度的关系发现,Tween-80在低固液(10%)比条件下,对纤维素酶的促进作用并不显著,而在高固液比(25%)条件下能显著提高纤维素酶的转化率(提高90%)。这可能是苛刻条件下纤维素酶更易受到液体剪切力作用而失活,SF因能通过相互作用力保护纤维素酶不受剪切力影响,从而提高了纤维素酶的转化率[28, 32]。
1.3 SF的种类和浓度对其作用效果的影响SF的种类和浓度对纤维素酶解的促进效果也有显著影响。Ouyang等[33]发现,在Avicel的水解体系中添加0.03 g/g和0.05 g/g的PEG-4000其转化率分别提高了69.8%和78.9%,然而继续增加浓度(0.08、0.11和0.14 g/g)并没有进一步提高转化率。研究发现,聚乙二醇(Polyethylene glycol,PEG)的疏水基团和亲水基团可分别与木质素的苯基和甲基相互作用,从而在木质素上形成水合层,抑制了木质素与纤维素酶的无效吸附,因而提高了纤维素的酶水解率[34]。类似的,Cai等[35]发现随着阳离子型SF十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB)浓度的增加,微晶纤维素的72 h水解率呈现先升高后降低的趋势。当CTAB浓度超过0.1 mmol/L时,微晶纤维素的72 h水解率出现显著下降,加入1 mmol/L的CTAB后,微晶纤维素的72 h水解率仅为8.3%。同样的,Alhammad等[36]研究了4种非离子型SF(PEG-4000、PEG-8000、TitronX-80和Tween-100)对纤维素酶解杨木的影响,发现添加1%(W/W)SF时,在PEG-4000存在下酶解有58.5%的最大葡萄糖产率,而在TritonX-100存在下只产生40.3%的最低葡萄糖产率。然而,除了TritonX-100,SF浓度增加到5%和8%时,均没有使葡萄糖产量进一步提高,表明SF的种类和浓度均对纤维素酶的水解产生显著的影响。
1.4 纤维素酶对表面活性剂作用效果的影响纤维素酶的来源与组成也是影响SF作用效果的重要因素。来源与组成不同的纤维素酶,其分子量、疏水性及所带电荷亦不同,均会影响SF与酶的相互作用,进而影响酶与纤维素之间的吸附性能以及不同酶组分间的协同作用,从而对酶水解的效率和还原糖产率产生影响。Zhou等[37]对来源不同的纤维素酶,在加入同一种SF的情况下比较了其CMCase和FPase酶活的活性大小。研究发现,当添加量为0.5 g/L时,TritonX-114和Tween-80能大大提高纤维素酶Ⅱ(EbSL OH,德国)对滤纸的120 h转化率,而对羧甲基纤维素没有或甚至轻微的负面影响;相反,SF能促进纤维素酶Ⅲ(山东大学,中国)对羧甲基纤维素的水解,但对滤纸水解没有影响;而用纤维素酶Ⅰ(Novo.s,丹麦)水解时,SF对羧甲基纤维素和滤纸都没有显示出积极的效果。
综上所述,SF对纤维素酶的促进作用受到诸多因素的影响,在利用SF提高酶解效率时应选着合适的种类及浓度范围,并注意各种水解条件,以达到最佳的处理效果。
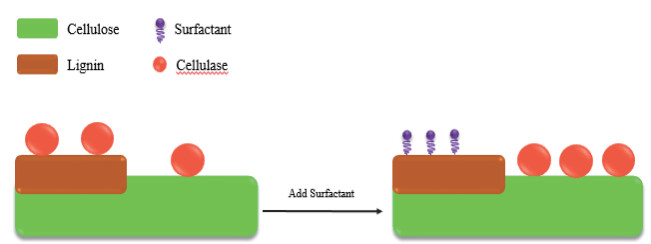
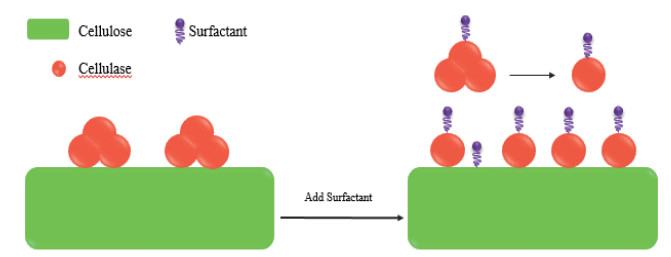
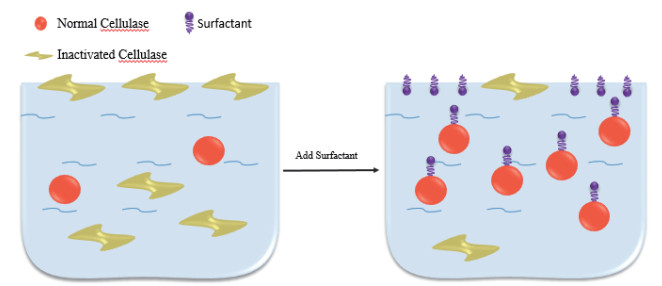
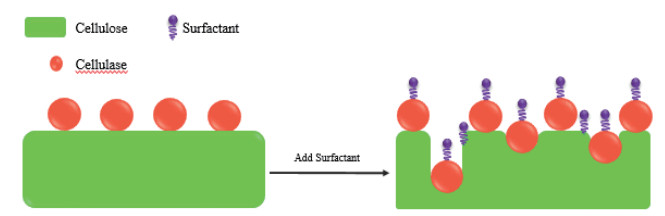
2 表面活性剂对纤维素酶解影响的作用机制SF对纤维素酶解影响的作用机制较为复杂,尚未形成系统理论,总的来说是由SF、底物与酶三者之间通过各种分子间作用力,包括疏水相互作用、离子键、氢键等引起的酶吸附性能和酶活性的改变,可以从以下3个方面解释:(1)SF吸附在木质素上降低纤维素酶在木质素上的无效吸附(图 1);另外,可通过与纤维素酶和底物相互作用,分散纤维素酶聚集体并抑制纤维素酶在底物上的过量吸附,来降低纤维素酶在纤维素上的无效吸附(图 2),从而使溶液中的游离酶含量提高,并能促进纤维素酶与纤维素结合,提高纤维素酶的水解效率。(2)通过与纤维素酶竞争气液界面和降低液体剪切力抑制纤维素失活,提高纤维素酶的活性与稳定性,进而提高了纤维素的酶水解率(图 3);(3)改变底物结构特性,增加底物的可及度和酶的结合位点(图 4)。
|
| 图 1 表面活性剂抑制木质素对纤维素酶无效吸附的机理 |
|
| 图 2 表面活性剂抑制纤维素对纤维素酶无效吸附的机理 |
|
| 图 3 表面活性剂在防止纤维素酶失活中的作用机理 |
|
| 图 4 表面活性剂增强纤维素酶对纤维素的可及度 |
纤维素的酶解过程包括酶在纤维素上的吸附、水解和脱吸附3个步骤,而木质素是一类具有强疏水性的物质,木质素的存在会影响木质纤维素的疏水性质,即影响纤维素酶的吸附与脱吸附性能。纤维素酶的吸附分为两种:特异性吸附和非特异性吸附。特异性吸附是由纤维素酶中的结合域(Cellulose binding domain,CBD)完成的,并能将纤维素链送到纤维素酶催化域(Catalyse domain,CD)中进行催化酶解;而非特异性吸附是酶与底物之间的相互作用造成的,如氢键、静电作用和疏水相互作用等,不参与酶解反应,即为无效吸附[38-39]。有研究表明木质纤维素对酶的无效吸附是导致水解率不高的重要原因之一。Jiang等[40]研究了非离型SF Tween-80对纤维素酶在模型木质素底物上吸附的影响,用石英晶体微天平和耗散监测分析了Tween-80和纤维素酶在木质素底物上的吸附发现,Tween-80主要通过分散作用(≥85%)快速吸附在木质素底物上并促进木质素分子的增溶。Tween-80吸附在木质素上能增强木质素的极性表面能,使木质素表面更加亲水,从而降低了纤维素酶在木质素上的吸附。同样的,Cai等[41]使用木质磺酸盐和(3-氯-2-羟丙基)三甲基氯化铵合成了一种新型表面活性剂(Quaternization of sulfonated lignin,SLQA),并研究了其对桉木酶解的影响发现,SLQA比木质素磺酸盐有更显著的促进作用,SLQA吸附在木质素表面可以提高木质素的亲水性,形成更有效的空间位阻和水化层,减少对纤维素酶的无效吸附,从而促进纤维素的酶解。Lin等[42-43]将SF进行复配,把木质素磺酸盐基聚氧乙烯醚(Lignosulfonate-based polyoxyethylene ether,LS-PEG)与阳离子表面活性剂十六烷基三甲基溴化铵结合发现,LS-PEG的磺酸基能通过静电吸引优先与CTAB的季铵基相互作用,形成具有非离子表面活性的配合物CTAB-LS-PEG。CTAB-LS-PEG表现出电中性和疏水性,从而加强了对纤维素酶在木质素上无效吸附的抑制作用,使得新型SF配合物对木质纤维素酶解效率的提高更为显著。
也有研究者有不同的发现,Li等[44]认为,内切葡聚糖酶和外切葡聚糖酶首先以结合结构域吸附在纤维素底物上,大部分催化结构域与纤维素反应,当大量纤维素酶吸附在纤维素上时,由于过于拥挤,纤维素酶的催化结构域发生重叠,不能被充分利用。聚乙二醇是一种在水溶液中具有不稳定性和无规则卷曲构象的线性聚合物,由于它吸附在纤维素上抑制了纤维素酶的过量吸附,因而使得吸附在纤维素上的纤维素酶得以充分反应,从而提高了对不含木质素的微晶纤维素(Avicel)的酶水解率。因此,证实了PEG-4000不仅可以减少纤维素酶在木质素的无效吸附,而且对纤维素也同样有效。类似的,Lin等[45]发现木质素磺酸盐(Lignosulfonate,LS)与十六烷基三甲基溴化铵(Cetyltrimethylammonium bromide,CTAB)的配合物LS-CTAB可以显著提高木质纤维素的水解率。首先,LS通过静电作用或疏水作用吸附在纤维素酶聚集体上,分散纤维素酶聚集体形成更小和更亲水的LS-纤维素酶聚集体,减少纤维素酶聚集体在纤维素上的无效吸附。然后,CTAB吸附在LS-纤维素酶聚集体上将其强负电荷调节为弱负电荷,弱负电荷有利于纤维素酶与带负电荷的纤维素相互作用,进一步提高纤维素的转化率。
2.2 提高纤维素酶的稳定性与活性纤维素酶的失活是影响木质纤维素生物质发展的重要原因之一。在搅拌的液体环境里,纤维素酶由于液体剪切力作用容易失活,而底物的存在与否对酶活也有很大影响,一般而言,在无底物存在的条件下,纤维素酶的机械稳定性较好。另外,当酶处于气液界面时,失活也将加剧。研究发现,SF可以提高纤维素酶的稳定性,通过抑制酶失活来促进纤维素的酶解。Xin等[46]通过研究玉米秸秆和云杉的酶解动力学特征发现,纤维二糖水解酶(外切葡聚糖酶)的失活是纤维素酶总活力损失的主要原因,而Tween-80是纤维二糖水解酶特异性的激活剂。在含0.5 mg/mL木质素、0.5 mg/mL半纤维素和0.5 mol/L半纤维素低聚物的混合物中加入纤维二糖酶,发现原纤维二糖酶活损失了60%,而Tween-80的加入使损失的活性恢复了约40%。这表明Tween-80能在消除木质素、半纤维素及其衍生物对纤维二糖水解酶的抑制作用方面表现出特异性的积极作用,从而在酶解过程中维持酶的高活性。
Lou等[47]进一步研究发现,在高搅拌速率的情况下SF对纤维素酶解的促进作用反而更显著。研究纤维素酶溶液的表面张力,发现缓冲液、PEG-4600溶液及纤维素酶溶液的表面张力分别为70.1 mN/m、63.3 mN/m和55.5 mN/m,这表明纤维素酶和SF均会在气液界面上聚集。由于纤维素酶暴露于气液界面时,纤维素酶分子的疏水部分会伸展到空气中,而亲水部分则浸没在水中,这种不平衡的作用力会导致纤维素酶的折叠,从而失去活性。虽然SF在气液界面聚集的能力没有纤维素酶强,但能和纤维素酶竞争气液界面,从而阻止部分纤维素酶在气液表面聚集,进而减少气液界面上的纤维素酶分子的数量,抑制酶的失活[48]。另外,研究纤维素酶溶液的流变特性,结果显示加入PEG-4600的纤维素酶溶液剪切力低于没有PEG-4600的纤维素酶溶液(由8.4 Pa降低到7.6 Pa),这表明PEG-4600可以在高搅拌速率下降低纤维素酶溶液的剪切力,进而减少了由剪切力作用导致的酶的失活。纤维素酶分子在高搅拌速率下受到强烈的剪切力和冲击力,在纤维素酶分子上的瞬时力可能是不平衡的,这将导致纤维素酶结构的变化而失活。非离子表面活性剂在纤维素酶分子表面的吸附可能与氢键和疏水相互作用有关[49],而具有极性的亲水性基团(如PEG分子中的醚基)可以通过与水的氢键形成致密的水化壳[50]。该水化壳具有润滑作用,能够降低剪切力和冲击力对纤维素酶分子的影响,从而提高了纤维素酶的稳定性。同样的,Kaar等[51]研究发现,SF的存在降低了溶液表面张力,通过减少“多余的表面”阻止纤维素酶在气液表面与空气接触,使纤维素酶更加稳定。另外,SF还可通过与纤维素酶竞争自由表面区域阻止纤维素酶在气液交界面上的变性。在高搅拌速率(200 r/min)和低固载条件下,纤维素酶浓度相对较低,更容易因剪切力和气液界面而失活,因此非离子表面活性剂对酶解的促进作用更加显著。
2.3 改变底物结构特性,增加底物的可及度和酶的结合位点如前所述底物的结构特点对纤维素的酶解有着显著的影响。研究发现,SF可以通过改变底物结构的性质来促进纤维素的水解。Seo等[52]研究发现,除木质素含量高、结晶度高外的大多数样品的细胞壁,在添加Tween-20后会塌陷,造成10-50 nm孔洞的形成,不仅使纤维素酶的单层饱和吸附量增加3-3.6倍,而且使纤维素酶的吸附速率增加160-880倍,纤维素72 h转化率也提高了8.7%-21.5%,并认为为了获得Tween-20的结构效应,需要对样品进行某种程度的预处理(如木质素去除),以加强Tween-20向样品中的扩散。而Kim等[53]使用扫描电镜观察发现,Tween-80能使纤维素滤纸膨胀,表面出现裂纹,变得无序易剥落,因此增加了其与纤维素酶的接触面积,从而提高纤维素酶的吸附性能。相似的,Helle等[54]认为SF可以改变纤维素的超微结构以增加纤维素酶对其攻击的脆弱性。Lin等[55]使用耗散监测石英晶体微天平(Quartz crystal microbalance with dissipation monitoring,QCM-D)和原子力显微镜(Atomic force microscopy,AFM)研究了SF配合物EHL-PEG对纤维素膜酶解动力学的影响发现,EHL-PEG能在纤维素膜表面开凿出大量空腔,使膜更加疏松、暴露,达到最大酶解速率后,纤维素膜被逐层剥落,直至平衡,因而增加了纤维素酶的接触位点,提高了纤维素酶的酶解效率。
另外,拉伸强度的损失被认为是决定纤维素织物物理性能的主要因素之一。Hemmatinejad等[56]测定了纤维素织物的拉伸强度和折皱回复角等物理性能发现,5种SF在同一浓度下,分别使纤维素织物的拉伸强度降低了5%、7%、8%、8%和17%,而对应纤维素织物水解释放的还原糖含量也呈逐渐增加的趋势。表明表面活性剂,尤其是非离子表面活性剂,能通过降低底物结构的拉伸强度来提高纤维素的酶水解率。
SF可以改变底物一定的结构性质,使其更易与纤维素酶发生反应,但相互作用的分子机理尚不清楚,且纤维素底物的结构包括聚合度、结晶度、可及度以及纤维素与半纤维素、木质素的交联互相影响,较为复杂,不能孤立考察,今后需更进一步地深入探究。
3 总结与展望木质纤维素生物质的利用具有极大的应用前景,提高纤维素酶的水解效率与还原糖产量,对木质纤维素生物质的有效利用有重大意义。SF对纤维素的酶解有显著的促进作用,然而SF、纤维素酶与底物三者之间相互作用较为复杂,诸多因素均会对其作用效果产生影响(图 5)。目前,SF对纤维素酶解的影响机制多停留在宏观方面,为发挥SF的最大作用,需进一步从以下几个方面深入探究SF对木质纤维素酶解的影响规律及微观作用机制:(1)SF是通过何种作用力与底物结合的,对底物的表面电荷及亲水性有什么影响,是如何影响纤维素酶与底物结合的;(2)SF与纤维素酶之间的分子作用力有哪些,是如何影响酶的活性和稳定性的,如何减少酶因与底物相互作用而导致的失活的;(3)SF是如何影响液体表面张力和剪切力,进而提高酶的稳定性的;(4)探究SF与底物间的分子作用力,是如何改变底物微观结构的,综合考察SF对底物结构,包括聚合度、结晶度、可及度及拉伸强度的影响。
|
| 图 5 表面活性剂促进纤维素酶解的关系图 |
| [1] |
Himmel ME, Ding SY, Johnson DK, et al. Biomass recalcitrance:engineering plants and enzymes for biofuels production[J]. Science, 2007, 315(5813): 804-807. DOI:10.1126/science.1137016 |
| [2] |
Sindhu R, Binod P, Panden A, et al. Biological pretreatment of lignocellulosic biomass-an overview[J]. Bioresource Technology, 2016, 199: 76-82. DOI:10.1016/j.biortech.2015.08.030 |
| [3] |
Rocha-Martin J, Martinez-Bernal C, Perez-Cobas Y, et al. Additives enhancing enzymatic hydrolysis of lignocellulosic biomass[J]. Bioresource Technology, 2017, 244(Pt 1): 48-56. |
| [4] |
Chakraborty R, Chatterjee S, Mukhopadhyay P, et al. Progresses in waste biomass derived catalyst for production of biodiesel and bioethanol:a review[J]. Procedia Environmental Sciences, 2016, 35: 46-554. |
| [5] |
Xing Y, Bu L, Sun D, et al. Enhancement of high-solids enzymatic hydrolysis and fermentation of furfural residues by addition of Gleditsia saponin[J]. Fuel, 2016, 177: 142-147. DOI:10.1016/j.fuel.2016.03.024 |
| [6] |
Pennacchio A, Ventorino V, Cimini D. Isolation of new cellulase and xylanase producing strains and application to lignocellulosic biomasses hydrolysis and succinic acid production[J]. Bioresource Technology, 2018, 259: 325-333. DOI:10.1016/j.biortech.2018.03.027 |
| [7] |
Makhuvele R, Ncube I, Rensburg ELJ, et al. Isolation of fungi from dung of wild herbivores for application in bioethanol production[J]. Brazilian Journal of Microbiology, 2017, 48(4): 648-655. DOI:10.1016/j.bjm.2016.11.013 |
| [8] |
Kuhad RC, Deswal D, Sharma S, et al. Revisiting cellulase production and redefining current strategies based on major challenges[J]. Renewable and Sustainable Energy Reviews, 2016, 55: 249-272. DOI:10.1016/j.rser.2015.10.132 |
| [9] |
Karimi K, Taherzadeh MJ. A critical review on analysis in pretreatment of lignocelluloses:Degree of polymerization, adsorption/desorption, and accessibility[J]. Bioresource Technology, 2016, 203: 348-356. DOI:10.1016/j.biortech.2015.12.035 |
| [10] |
Kristensen JB, Borjesson J, Bruun MH, et al. Use of surface active additives in enzymatic hydrolysis of wheat straw lignocellulose[J]. Enzyme and Microbial Technology, 2007, 40(4): 888-895. DOI:10.1016/j.enzmictec.2006.07.014 |
| [11] |
Eriksson T, Borjesson J, Tjerneld F. Mechanism of surfactant effect in enzymatic hydrolysis of lignocellulose[J]. Enzyme and Microbial Technology, 2002, 31(3): 353-364. DOI:10.1016/S0141-0229(02)00134-5 |
| [12] |
Cai C, Qiu X, Lin X, et al. Improving enzymatic hydrolysis of lignocellulosic substrates with pre-hydrolysates by adding cetyltrimethylammonium bromide to neutralize lignosulfonate[J]. Bioresource Technology, 2016, 216: 968-975. DOI:10.1016/j.biortech.2016.06.043 |
| [13] |
Lin XL, Zhou MS, Wang SY, et al. Synthesis, structure, and dispersion property of a novel lignin-based polyoxyethylene ether from kraft lignin and poly (ethylene glycol)[J]. Acs Sustainable Chemistry and Engineering, 2014, 2(7): 1902-1909. DOI:10.1021/sc500241g |
| [14] |
Zajjc JE, Panchal CJ. Bio-emulsifiers[J]. Crc Critical Reviews in Microbiology, 1976, 5(1): 39-66. DOI:10.3109/10408417609102309 |
| [15] |
Talukder MMR, Hai YG, Puah SM. Interaction of silica with cellulase and minimization of its inhibitory effect on cellulose hydrolysis[J]. Biochemical Engineering Journal, 2017, 18: 91-96. |
| [16] |
Kamsani N, Salleh MM, Basriet SA, et al. Effects of surfactant on the enzymatic degradation of oil palm empty fruit bunch (OPEFB)[J]. Waste and Biomass Valorization, 2017(3): 1-8. |
| [17] |
Parnthong J, Kungsanant S, Chavadej S. Enhancement of enzymatic hydrolysis of lignocellulosic materials by nonionic surfactant[J]. Key Engineering Materials, 2017, 757: 151-155. DOI:10.4028/www.scientific.net/KEM.757.151 |
| [18] |
Kim HJ, Kim SB, Kim CJ. The effects of nonionic surfactants on the pretreatment and enzymatic hydrolysis of recycled newspaper[J]. Biotechnology and Bioprocess Engineering, 2007, 12(2): 147-151. DOI:10.1007/BF03028641 |
| [19] |
Li C, Zhong L, Lan FH, et al. Effect of cellobiase and surfactant supplementation on the enzymatic hydrolysis of pretreated wheat straw[J]. Bioresources, 2011, 6(4): 3850-3858. |
| [20] |
Parnthong J, Kungsanant S, Chavadej S. The Influence of nonionic surfactant adsorption on enzymatic hydrolysis of oil palm fruit bunch[J]. Applied Biochemistry and Biotechnology, 2018(1): 1-14. |
| [21] |
Cai C, Qiu XQ, Zeng MJ, et al. Using polyvinylpyrrolidone to enhance the enzymatic hydrolysis of lignocelluloses by reducing the cellulase non-productive adsorption on lignin[J]. Bioresource Technology, 2016, 227: 74-81. |
| [22] |
Sipos B, Szilagyi M, Sebestyen Z, et al. Mechanism of the positive effect of poly (ethylene glycol) addition in enzymatic hydrolysis of steam pretreated lignocelluloses[J]. Comptes Rendus Biologies, 2011, 334(11): 812-823. DOI:10.1016/j.crvi.2011.06.005 |
| [23] |
Li XL, Li M, Pu YQ, et al. Inhibitory effects of lignin on enzymatic hydrolysis:The role of lignin chemistry and molecular weight[J]. Renewable Energy, 2018, 123: 664-674. DOI:10.1016/j.renene.2018.02.079 |
| [24] |
Mizutani C, Sethumadhavan K, Howley P, et al. Effect of a nonionic surfactant on trichoderma cellulase treatments of regenerated cellulose and cotton yarns[J]. Cellulose, 2002, 9(1): 83-89. DOI:10.1023/A:1015821815568 |
| [25] |
Gupta R, Lee YY. Mechanism of cellulase reaction on pure cellulosic substrates[J]. Biotechnology and Bioengineering, 2010, 102(6): 1570-1581. |
| [26] |
Lou HM, Zhu JY, Lan TQ, et al. pH-Induced lignin surface modification to reduce nonspecific cellulase binding and enhance enzymatic saccharification of lignocelluloses[J]. Chemsuschem, 2013, 6(5): 919-927. DOI:10.1002/cssc.201200859 |
| [27] |
Wang ZJ, Lan TQ, Zhu JY. Lignosulfonate and elevated pH can enhance enzymatic saccharification of lignocelluloses[J]. Biotechnology for Biofuels, 2013, 6(1): 9. DOI:10.1186/1754-6834-6-9 |
| [28] |
Yang MH, Zhang AM, Liu BB, et al. Improvement of cellulose conversion caused by the protection of Tween-80 on the adsorbed cellulase[J]. Biochemical Engineering Journal, 2011, 56(3): 125-129. DOI:10.1016/j.bej.2011.04.009 |
| [29] |
Okino S, Ikeo M, Makoto U, et al. Effects of Tween 80 on cellulase stability under agitated conditions[J]. Bioresource Technology, 2013, 142(8): 35-539. |
| [30] |
Jorgenson H, Vibr-Pedersen J, Larsen J, et al. Liquefaction of lignocellulose at high-solids concentrations[J]. Biotechnology and Bioengineering, 2010, 96(5): 862-870. |
| [31] |
Ma XX, Yue GJ, Yu JL, et al. Enzymatic hydrolysis of cassava bagasse with high solid loading[J]. Journal of Biobased Materials and Bioenergy, 2011, 5(2): 275-281. DOI:10.1166/jbmb.2011.1138 |
| [32] |
Reese ET. Inactivation of cellulase by shaking and its prevention by surfactants[J]. J Appl Biochem, 1980, 2(1): 36-39. |
| [33] |
Ouyang J, Dong ZW, Song XY, et al. Improved enzymatic hydrolysis of microcrystalline cellulose (Avicel PH101) by polyethylene glycol addition[J]. Bioresource Technology, 2010, 101(17): 6685-6691. DOI:10.1016/j.biortech.2010.03.085 |
| [34] |
Borjesson J, Engqvist M, Sipos B, et al. Effect of poly (ethylene glycol) on enzymatic hydrolysis and adsorption of cellulase enzymes to pretreated lignocellulose[J]. Enzyme and Microbial Technology, 2007, 41(1): 186-195. |
| [35] |
Cai C, Pang YX, Zhan XJ, et al. Using temperature-responsive zwitterionic surfactant to enhance the enzymatic hydrolysis of lignocelluloses and recover cellulase by cooling[J]. Bioresource Technology, 2017, 243: 1141-1148. DOI:10.1016/j.biortech.2017.07.058 |
| [36] |
Alhammad A, Adewale P, Kuttiraja M, et al. Enhancing enzyme-aided production of fermentable sugars from poplar pulp in the presence of non-ionic surfactants[J]. Bioprocess and Biosystems Engineering, 2018, 41(8): 1-10. |
| [37] |
Zhou Y, Chen HM, Feng Q, et al. Non-ionic surfactants do not consistently improve the enzymatic hydrolysis of pure cellulose[J]. Bioresource Technology, 2015, 182: 136-143. DOI:10.1016/j.biortech.2015.01.137 |
| [38] |
Liu J, Shi JG, Jian L, et al. Characterization of the interaction between surfactants and enzymes by fluorescence probe[J]. Enzyme and Microbial Technology, 2011, 49(4): 360-365. DOI:10.1016/j.enzmictec.2011.06.014 |
| [39] |
Chandel AK, Silva SSD. Sustainable degradation of lignocellulosic biomass-techniques, applications and commercialization[J]. Bioresource Engineering, 2013, 275: 61-64. |
| [40] |
Jiang F, Qian C, Esker AR, et al. Effect of non-ionic surfactants on dispersion and polar interactions in the adsorption of cellulases onto lignin[J]. Journal of Physical Chemistry B, 2017, 121(41): 9607-9620. DOI:10.1021/acs.jpcb.7b07716 |
| [41] |
Cai C, Zhan XJ, Zeng MJ, et al. Using recyclable pH-responsive lignin amphoteric surfactant to enhance the enzymatic hydrolysis of lignocelluloses[J]. Green Chemistry, 2017, 19(22): 5479-5487. DOI:10.1039/C7GC02571H |
| [42] |
Lin XL, Qiu XQ, Yuan L, et al. Lignin-based polyoxyethylene ether enhanced enzymatic hydrolysis of lignocelluloses by dispersing cellulase aggregates[J]. Bioresource Technology, 2015, 185: 165-170. DOI:10.1016/j.biortech.2015.02.067 |
| [43] |
Lin XL, Qiu XQ, Lou HM, et al. Enhancement of lignosulfonate-based polyoxyethylene ether on enzymatic hydrolysis of lignocelluloses[J]. Industrial Crops & Products, 2016, 80: 86-92. |
| [44] |
Li JH, Li SZ, Fan CY, et al. The mechanism of poly (ethylene glycol)4000 effect on enzymatic hydrolysis of lignocellulose[J]. Colloids and Surfaces Biointerfaces, 2012, 89(1): 203-210. |
| [45] |
Lin XL, Cai C, Huang JH, et al. Understanding the effect of the complex of lignosulfonate and cetyltrimethylammonium bromide on the enzymatic digestibility of cellulose[J]. Energy and Fuels, 2017, 31(1): 672-678. DOI:10.1021/acs.energyfuels.6b02681 |
| [46] |
Xin DL, Yang M, Chen X, et al. Improving the hydrolytic action of cellulases by Tween 80:Offsetting the lost activity of cellobiohydrolase Cel7A[J]. Acs Sustainable Chemistry and Engineering, 2017, 5(12): 11339-11345. DOI:10.1021/acssuschemeng.7b02361 |
| [47] |
Lou HM, Zeng MJ, Hu QY, et al. Nonionic surfactants enhanced enzymatic hydrolysis of cellulose by reducing cellulase deactivation caused by shear force and air-liquid interface[J]. Bioresource Technology, 2017, 249: 1-8. |
| [48] |
Bhagia S, Dhir R, Kumar R, et al. Deactivation of cellulase at the air-liquid interface is the main cause of incomplete cellulose conversion at low enzyme loadings[J]. Scientific Reports, 2018, 8(1): 1350. DOI:10.1038/s41598-018-19848-3 |
| [49] |
Zhang M, Ouyang J, Liu BT, et al. Comparison of hydrolysis efficiency and enzyme adsorption of three; Different cellulosic materials in the presence of poly (ethylene Glycol)[J]. Bioenergy Research, 2013, 6(4): 1252-1259. DOI:10.1007/s12155-013-9334-3 |
| [50] |
Zheng J, Li LY, Chen SF, et al. Molecular simulation study of water interactions with oligo (ethylene glycol)-terminated alkanethiol self-assembled monolayers[J]. Langmuir the Acs Journal of Surfaces and Colloids, 2004, 20(20): 8931-8938. DOI:10.1021/la036345n |
| [51] |
Kaar WE, Holtzapple MT. Benefits from Tween during enzymic hydrolysis of corn stover[J]. Biotechnology and Bioengineering, 2015, 59(4): 419-427. |
| [52] |
Seo DJ, Fujita H, Sakoda A. Structural changes of lignocelluloses by a nonionic surfactant, Tween 20, and their effects on cellulase adsorption and saccharification[J]. Bioresource Technology, 2011, 102(20): 9605-9612. DOI:10.1016/j.biortech.2011.07.034 |
| [53] |
Kim W, Gamo Y, Sani YM, et al. Effect of Tween 80 on hydrolytic activity and substrate accessibility of carbohydrolase I (CBH I) from Trichoderma viride[J]. Asian Australasian Journal of Animal Sciences, 2006, 19(5): 684-689. DOI:10.5713/ajas.2006.684 |
| [54] |
Helle SS, Duff S JB, Cooper DG. Effect of surfactants on cellulose hydrolysis[J]. Biotechnology and Bioengineering, 2010, 42(5): 611-617. |
| [55] |
Lin XL, Qiu XQ, Zhu DM, et al. Effect of the molecular structure of lignin-based polyoxyethylene ether on enzymatic hydrolysis efficiency and kinetics of lignocelluloses[J]. Bioresource Technology, 2015, 193: 266-273. DOI:10.1016/j.biortech.2015.06.089 |
| [56] |
Hemmatinejad N, Vahabzadeh F, Kordestani SS. Effect of surfactants on enzymatic hydrolysis of cellulosic fabric[J]. Iranian Polymer Journal, 2002, 11(5): 333-338. |




