黄芪(Astragalus membranaceus),多年生草本植物,具有滋补等药用功效。近年来,因栽培、连作面积增多,致使黄芪病害加重,其中根腐病是影响黄芪产量与品质的主要病害之一。黄芪根腐病发生在整个生育时期,发病过程是由根茎向下,由主根向侧根蔓延,根表面出现病斑且表皮粗糙,对病株的根部进行装片制作观察病根结构,发现病株维管束组织变褐色,有明显被溶解的现象。黄芪根腐病病原菌包括茄腐镰刀菌(Fusarium solaniun)和尖孢镰刀菌(Fusarium oxysporum)、立枯丝核菌(Rh-izoctonia solani)等[1]。目前对黄芪根腐病的防治主要是化学农药防治,但随着现代生态农业的发展,生物防治体现出其优势。因此,探索有效的生物防治方法正逐渐引起人们的重视。本研究以实验室保存的从敦煌地区盐碱土壤中分离筛选出的21株芽孢杆菌为实验材料,研究该类菌对黄芪根腐病病原菌的抑制作用,并筛选出对黄芪根腐病病原菌具有较好防治效果的拮抗芽孢杆菌菌株,以期为黄芪根腐病的防治提供依据。
1 材料与方法 1.1 材料 1.1.1 培养基马铃薯葡萄糖琼脂培养基(PDA):去皮马铃薯20 g,葡萄糖2.0 g,琼脂1.5-2.0 g,水100 mL,pH自然; 牛肉膏蛋白胨琼脂培养基(NA):牛肉膏0.5 g,蛋白胨1.0 g,NaCl 0.5 g,琼脂1.5-2 g,水100 mL,pH 7.0;牛肉膏蛋白胨培养基(NB):牛肉膏0.5 g,蛋白胨1.0 g,NaCl 0.5 g,水100 mL,pH 7.0。
1.1.2 供试菌株芽孢杆菌:敦煌地区盐碱土壤中分离筛选得到21株芽孢杆菌,由本实验室保存。指示病原菌:分离自甘肃陇西黄芪1号栽培基地的黄芪根腐病病原菌G2茄腐镰刀菌(F. solaniun),由本实验室保存。
1.2 方法 1.2.1 生防芽孢杆菌的初筛将保存的21株芽孢杆菌接于NA平板,在37℃恒温培养箱中活化24 h后备用,黄芪根腐病病原菌G2在PDA平板,在28℃恒温培养箱中活化6 d后备用。采用平板对峙法[2]测定21株芽孢杆菌对黄芪根腐病原菌G2抑菌率,各处理3次重复,在28℃恒温培养5 d。计算公式:抑菌率=(对照组直径-试验组直径)/对照菌落直径×100%[2]。
1.2.2 生防芽孢杆菌的复筛选择初筛中抑菌率大于70%的菌株进行复筛,将活化后待筛选的拮抗芽孢杆菌分别接入等量的NB液体培养基中,在37℃,160 r/min的条件下振荡培养48 h后,将培养好的菌液在4℃,10 000 r/min离心10 min,弃去沉淀,上清液用0.22 μm的微孔滤器过滤,得到无菌上清液,备用[3]。
采用琼脂扩散法,将PDA培养基在灭菌后冷却至50℃左右,以200:1的比例加入病原真菌菌悬液,混合均匀后倒入已用水琼脂作为底层的培养皿中,制备带菌平板,待平板凝固后,用已灭菌的打孔器在平板上打孔,向孔内加入200 μL发酵上清液,以加入等量无菌水作为对照组,各处理3次重复。在28℃恒温培养3 d后,利用上述计算公式测定抑菌率,筛选出对黄芪根腐病病原菌G2拮抗作用最强的菌株。
1.2.3 菌体形态观察将优势生防芽孢杆菌接种于NA培养基平板,37℃恒温培养24 h,再对菌株进行革兰氏染色、镜检,观察优势生防芽孢杆菌的菌落、菌体形态特征。
1.2.4 生理生化特征测定根据《伯杰氏细菌鉴定手册》[4]与《常见细菌系统鉴定手册》[5]对筛选出来的优势生防芽孢杆菌株进行明胶液化、淀粉水解等生理生化鉴定。
1.2.5 16S rDNA基因序列分析采用土壤DNA小量提取试剂盒提取细菌DNA,采用16S rDNA细菌通用引物27F/1492R进行PCR扩增。PCR反应体系(30 μL):模板DNA 4 μL,引物各1 μL,Taq酶15 μL,ddH2O 9 μL; 反应参数:95℃ 5 min; 95℃ 1 min,57℃ 1 min,72℃ 2 min,共25个循环; 72℃总延伸10 min。PCR扩增后,采用1%琼脂糖凝胶电泳检测PCR产物,将扩增产物送至甘肃中鼎森生物科技有限公司测序,经过NCBI数据库进行BLAST比对分析,利用MEGA7.0软件,设置Bootstrap values为1 000,使用邻近法方法构建系统发育树[2]。
1.2.6 拮抗芽孢杆菌的盆栽防效试验通过黄芪苗盆栽试验测定拮抗芽孢杆菌对该病原菌的防治作用。(1)病原菌孢子悬液的制备:分别刮取PDA平板上28℃,培养10 d的病原菌,将其分散到6 g/L CMC(羧甲基纤维素钠)溶液中制成孢子悬液,孢子浓度调至2.0×107 CFU/mL[6]。(2)盆栽试验设计:从甘肃陇西黄芪1号栽培基地选取长势一致的健康蒙古黄芪苗分成3组,即空白组(不接菌种)、对照组(接种病原菌)、试验组(接种病原菌和拮抗芽孢杆菌),每处理12盆,每盆3株,幼苗移栽至装有混合营养土(营养土:蛭石:珍珠岩=3:1:1)的塑料小花盆中,14 d后采取伤根灌注法[7]向对照组和试验组接种上述病原菌孢子悬液,每盆接种量均为5 mL,以接等量无菌水为对照。接种病原菌14 d后,分别向每盆试验组接种5 mL拮抗芽孢杆菌发酵滤液,以接等量无菌水为空白对照。(3)防效测定:培养28 d后观察统计发病情况,按照植物病害分级标准计算防治效果。黄芪根腐病分级标准为0级,无病斑; 1级,有病斑1%-5%;2级,有病斑6%-10%;3级,有病斑11%-20%;4级,有病斑21%-40%;5级,有病斑41%-60%;6级,病斑61%-80%;7级,81%以上。计算公式:发病率=发病植株数/调查总株数×100%;病情指数=∑(病级总株数×发病级别)/(调查总株数×最高级别)×100%;防治效果=(对照病情指数-试验病情指数)/对照病情指数×100%[8]。
1.2.7 数据处理数据采用SPSS 17.0软件进行方差分析,处理间差异的多重比较采用Duncan氏新复极差法。
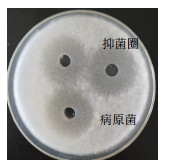
2 结果 2.1 优势生防芽孢杆菌筛选结果通过对21株供试芽孢杆菌的初步筛选,获得了10株对黄芪根腐病病原真菌茄腐镰刀菌G2抑菌效果较好的芽孢杆菌,其抑菌率大于90%(表 1);为了进一步研究初筛菌株对该病原菌的拮抗能力与分泌产抗物质能力的大小,通过琼脂扩散法进行复筛,发现菌株7-2-1-6的发酵上清液对茄腐镰刀菌拮抗活性较高,抑菌圈直径大且清晰,能很大程度的抑制茄腐镰刀菌的生长,其发酵上清液抑菌率达85.40%(图 1)。
|
| 图 1 菌株7-2-1-6的发酵液抑菌效果 |
菌株7-2-1-6在NA培养基上菌落为乳白色,不透明,边缘不规则,表面光滑,质地黏稠。进行革兰氏染色后,在光学显微镜下观察发现(图 2),菌体短杆状、呈紫红色,因此,菌株7-2-1-6是革兰氏阳性细菌。

|
| 图 2 菌株7-2-1-6菌落(A)菌体(B)形态 |
菌株7-2-1-6生理生化特征结果如表 2所示。
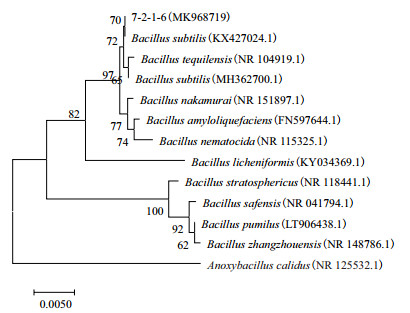
经过对菌株7-2-1-6的16S rDNA基因序列测定及分析,并构建系统发育树(图 3)。菌株7-2-1-6与Bacillus subtilis(KX427024.1)属同一个分支,结合形态特征与生理生化,可以鉴定菌株7-2-1-6为枯草芽孢杆菌(B. subtilis)。
|
| 图 3 菌株7-2-1-6的系统发育树 |
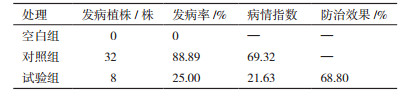
通过对盆栽黄芪植株生长发病情况的观察记录,在第28天的生长发病情况如表 3所示。
通过盆栽试验测定了菌株7-2-1-6对黄芪根腐病的防治效果。结果显示对照组黄芪幼苗的株高和主根长明显小于空白组和试验组的株高和主根长,对照组和试验组的显著差异表明(图 4),菌株7-2-1-6能显著降低黄芪根腐病的发病程度,防治效果达到68.80%(表 3),说明菌株7-2-1-6对黄芪根腐病具有较好的防治作用。

|
| 图 4 黄芪根腐病拮抗菌盆栽防效试验 |
芽孢杆菌是一类重要的具有生物研究价值的微生物资源,大部分生防芽孢杆菌对环境适应性强,繁殖速度快、具有抗逆性,同时可以产生多种抗菌物质[9],在植物病害防治中有很高的应用价值,陈倩倩等[10]发现暹罗芽孢杆菌(B. siamensis)分泌的活性物质能抑制尖孢镰刀菌; 陈志杰等[3]发现芽孢杆菌4-z-3发酵液中的抗菌物质对多种植物病原真菌都有明显的抑菌作用; 李玉聪等[11]研究发现甲基营养型芽孢杆菌(B. methylotrophicus)对马铃薯疮痂病具有较好的防治作用; 雷白时等[12]研究发现解淀粉芽孢杆菌HD-5对草莓根腐病病原菌尖孢镰刀菌有抑制作用,盆栽防治效果达77.78%。
本研究筛选鉴定出枯草芽孢杆菌7-2-1-6分离自敦煌地区盐碱土壤中,是典型的极端环境,相比于自然条件下微生物而言,在盐碱土壤等极端环境条件下生长的微生物具有特殊的生理功能、遗传特性及代谢方式等,因为它们为了适应恶劣极端的外界环境,经过长期的生长和变化,产生了特殊的生理机能和代谢体系,所以极端环境中的微生物能够将产生大量的活性物质,对于生物防治的应用具有更大的潜能[13]。张飞鹏等[14]从大庆地区盐碱土壤中分离出一株芽孢杆菌B. brevi优势种; 董艳萍等[15]在塔克拉玛干沙漠南麓及罗布泊地区分离出很多可能产生新的活性物质的放线菌; 贾丽[16]从我国西部极端环境盐湖区分离筛选出一定数量的耐高糖芽孢杆菌。
目前,对黄芪根腐病的防治主要采用化学农药防治,而化学防治不仅会造成农药残留污染环境,还会使病原菌产生抗药性,甚至会降低品质[17]。鉴于此,通过拮抗微生物进行生物防治已成为研究的热门课题,高芬等[18]研究发现PGPR菌G10对黄芪根腐病病原菌有拮抗作用; 牛世全等[19]研究发现蓝紫链霉菌(Streptomyces tuirus)对黄芪根腐病的2种致病菌均有较好的抑制作用; 郑豆豆等[20]通过盆栽试验验证的放线菌菌株DA4-3-12、DA8-4-10和221对黄芪根腐病的防效分别为60.1%、46%和69.99%。本研究以黄芪根腐病病原真菌茄腐镰刀菌G2为防治对象,通过平板对峙法和琼脂扩散法筛选得到一株生防芽孢杆菌7-2-1-6,该生防菌株发酵上清液对黄芪根腐病病原真菌茄腐镰刀菌G2的抑制率为85.40%,通过对该生防菌株的相关研究鉴定为枯草芽孢杆菌(B.subtilis),同时,经盆栽防效测定对黄芪根腐病防治效果约68.80%,具有良好的应用前景,为黄芪根腐病的生物防治提供菌种资源。虽然菌株7-2-1-6盆栽试验中表现出较好的防治效果,但在实际生物防治过程中的施用浓度、方法、土壤类型及对生态环境的影响等还需要进一步验证与探究。
4 结论以分离自敦煌地区盐碱土壤中21株芽孢杆菌为研究对象,黄芪根腐病病原菌Fusarium solaniun KR997532为靶标菌,筛选得到较强拮抗作用的生防芽孢杆菌7-2-1-6,将其鉴定为枯草芽孢杆菌(B.subtilis),盆栽防效测定试验结果显示,菌株7-2-1-6对黄芪根腐病具有良好的防治作用。
| [1] |
陈垣, 朱蕾, 郭凤霞, 等. 甘肃渭源蒙古黄芪根腐病病原菌的分离与鉴定[J]. 植物病理学报, 2011, 41(4): 428-429. |
| [2] |
豆雅楠, 牛世全, 豆建涛, 等. 芽孢杆菌拮抗苹果树腐烂病菌的筛选、鉴定及抑菌活性初探[J]. 微生物学通报, 2018, 45(12): 2684-2694. |
| [3] |
陈志杰, 谢江辉, 陈宇丰, 等. 一株植物病原拮抗细菌的分离筛选及拮抗物质[J]. 生态学杂志, 2018, 37(5): 1595-1604. |
| [4] |
布坎南, 伯杰. 细菌鉴定手册[M]. 北京: 科学出版社, 1984.
|
| [5] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [6] |
申光辉, 薛泉宏, 张晶, 等. 草莓根腐病拮抗真菌筛选鉴定及其防病促生作用[J]. 中国农业科学, 2012, 45(22): 4612-4626. DOI:10.3864/j.issn.0578-1752.2012.22.007 |
| [7] |
孙广宇, 宗兆峰. 植物病理学实验技术[M]. 北京: 中国农业出版社, 2002.
|
| [8] |
辛中尧, 徐红霞, 陈秀蓉. 枯草芽孢杆菌(Bacillus subtilis)B1、B2菌株对当归、黄芪的防病促进生长效果[J]. 植物保护, 2008, 34(6): 142-144. DOI:10.3969/j.issn.0529-1542.2008.06.038 |
| [9] |
严婉荣, 肖敏, 陈圆, 等. 芽孢杆菌基本特征、16S rRNA对比分析及特异性基因挖[J]. 基因组学与应用生物学, 2017, 36(11): 4686-4692. |
| [10] |
陈倩倩, 刘波, 王阶平, 等. 芽孢杆菌FJAT-28592抗真菌脂肽的研究[J]. 农业生物技术学报, 2016, 24(2): 261-269. |
| [11] |
李玉聪, 李滨影, 油心怡, 等. 马铃薯疮痂病拮抗菌的筛选鉴定及防治效果初探[J]. 生物技术通报, 2018, 34(10): 116-121. |
| [12] |
雷白时, 王笑颖, 姜军坡, 等. 草莓根腐病生防芽孢杆菌的筛选鉴定与盆栽防效试验[J]. 河北农业大学学报, 2016, 39(3): 19-22. |
| [13] |
李海云, 胡磊, 牛世全, 等. 河西走廊酒泉地区盐碱土壤中可培养放线菌多样性[J]. 生态学杂志, 2015, 34(2): 367-372. |
| [14] |
张飞鹏, 林志伟, 张振南, 等. 大庆盐碱土中微生物的分离及芽孢杆菌的鉴定[J]. 黑龙江八一农垦大学学报, 2011, 23(5): 6-8. DOI:10.3969/j.issn.1002-2090.2011.05.003 |
| [15] |
董艳萍, 郭琳, 旭格拉·哈布丁, 等. 塔克拉玛干沙漠南麓土壤放线菌资源勘探及抗菌活性筛选[J]. 中国抗生素杂志, 2013, 38(4): 241-247. DOI:10.3969/j.issn.1001-8689.2013.04.001 |
| [16] |
贾丽.我国西部极端环境中高糖菌株的分离筛选及新种微生物分类学研究[D].北京: 北京化工大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10010-1016323344.htm
|
| [17] |
Chen S, Zhang M, Wang J, et al. Biocontrol effects of Brevibacillus laterosporus AMCC100017 on potato common scab and its impact on rhizosphere bacterial communities[J]. Biological Control, 2017, 106: 89-98. DOI:10.1016/j.biocontrol.2017.01.005 |
| [18] |
高芬, 任小霞, 王梦亮, 等. 中草药根腐病及其微生物防治研究进展[J]. 中国中药杂志, 2015, 40(21): 4122-4126. |
| [19] |
牛世全, 耿晖, 阎薇如, 等. 黄芪根腐病生防放线菌筛选鉴定及其优化培养[J]. 植物保护学报, 2016, 43(6): 943-950. |
| [20] |
郑豆豆, 牛世全, 周璇, 等. 黄芪根腐病复合生防放线菌筛选鉴定及其防治作用[J]. 生态学杂志, 2019, 03(6): 753-761. |