近年来,酶在工业应用中占据了极其重要的位置,漆酶就是其中之一。漆酶(Laccase,EC1.10.3.2)是多酚氧化酶中一种含铜的糖蛋白氧化酶,与植物抗坏血酸氧化酶和哺乳动物血浆铜蓝蛋白同属蓝色多铜氧化酶家族,是研究最早最多的酶系统之一[1]。1883年,日本学者吉田首次在日本紫胶漆树(Rhus verniciflua)漆液中发现了一种可以使汁液氧化变硬、催化漆固化过程的蛋白质[2],1894年Bertrand等[3]将这种蛋白质命名为漆酶。
漆酶按其来源可分为植物漆酶、动物漆酶和微生物漆酶3类。目前,已发现漆树、木蜡树、罗汉松、巴勒斯坦黄连木、七叶树及连翘等树种中均有漆酶存在,在水稻、棉花、茶、烟草等农作物,芒果、香蕉、葡萄等水果中也发现了漆酶[4]。不同来源的漆酶,其性质存在显著差异。即使同属漆树漆酶,产于中国、日本的漆树(Rhus vernicifera)酶和产于越南的漆树(Rhus succedanea)酶在生物学性质上也有很大差别。一直以来,关于动物漆酶的研究都相对较少,仅在麻蝇、烟草天蛾、绿头苍蝇、蚊子和蝗虫等昆虫中发现有微量的漆酶活性[5-6]。有学者猜测,动物中的漆酶可能并不是准确意义上的漆酶,而是某些具有类似催化性能的多酚氧化酶,因此还需进一步研究确定[7]。
微生物漆酶在自然界中分布最为广泛,在大量落叶覆盖的林区土壤中、造纸厂的木质纤维废水及水稻等作物的根部均有发现,按其来源可分为真菌漆酶和细菌漆酶[8-16]。其中真菌漆酶是自然界中漆酶的主要来源,具有单电子氧化还原电位高、催化活性强等特性,同时,真菌漆酶不仅能催化底物的氧化聚合反应还能对木质素进行氧化转化,具有十分广阔的应用前景和非常重要的研究价值。目前,该类漆酶的研究涉及到60多种真菌,主要以担子菌和子囊菌为主,其中担子菌中的白腐真菌是唯一能够利用自身氧化酶系统将木质纤维素转化为二氧化碳的一类真菌[17],被认为是主要的真菌漆酶生产者和研究对象。
漆酶能够利用分子氧为电子受体催化氧化6大类250余种底物,包括酚及其衍生物、羧酸及其衍生物、芳胺及其衍生物、金属化合物和其他非酚类底物等[18-19]。在过去的几十年中,由于其良好的催化氧化能力及对复杂环境污染物的降解能力而受到了研究者的极大关注,使得漆酶被广泛应用于纸浆漂白、环境治理、生物检测、食品加工、有机合成以及生物能源等多个领域[20-24]。本文对近年来真菌漆酶的生物学性质、生产、纯化及固定化等方面的最新研究进展进行概述,以期为该领域的研究提供参考。
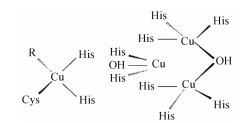
1 真菌漆酶的生物学性质 1.1 结构特征漆酶结构中最重要的部分就是铜原子,其参与漆酶活性中心的架构和组成,结合底物并直接参与键的断裂与形成,决定漆酶的活力和特异性,使漆酶具有氧化还原功能。典型的漆酶有4个铜原子及3个铜原子结合位点,根据磁学和光谱学性质不同可将4个铜原子分为3类[25]。T1铜原子相对独立,与两个组氨酸(His)的N和一个半胱氨酸(Cys)的S配位,形成扭曲的四面体结构。其中共价键Cu-S(Cys)的配位是还原态底物的结合位点,漆酶在此附近接受来自底物的电子转移,进而将底物彻底氧化,使得T1铜原子在614 nm(ε = 5 300 M-1cm-1)处产生强烈的蓝色特征吸收带[26],因此也称漆酶为铜蓝蛋白。T2铜原子无特殊吸收峰,具有电子顺磁共振效应(Electron paramagnetic resonance,EPR)性质,其与T3铜原子紧密相连形成一个三核中心,是漆酶的催化活性中心。该三核中心与8个His配位结合,其中T2铜原子结合2个His,T3铜原子结合6个His。T3铜原子由两个铜原子组成,由于其偶联作用导致T3铜原子的EPR性质消失,但在330 nm处有宽的吸收峰[27]。同时,由于一些反应中间体如过氧中间体的吸收,导致T3铜原子在400/420-460 nm之间也存在一些小的吸收带[28]。图 1显示了漆酶具体的活性中心结构。
1.2 催化作用漆酶作为一种氧化酶,其作用底物十分广泛,能催化氧化木质素、酚类化合物、非酚类化合物等多种物质。简单而言,漆酶的催化氧化作用机理主要表现在底物自由基中间体的产生和分子氧还原成水两个方面[29]。首先,反应底物与处于酶活性中心的T1铜原子位点相结合,T1铜原子接受来自还原态底物的电子转移,同时该底物被氧化形成自由基;其次,T1铜原子将单个电子通过Cys-His途径传递到由T2和T3铜原子构成的三核中心上,分子氧在此处接受电子,被还原成水。
由于漆酶的分子量较大,很难进入细胞间隙,且氧化还原电势大多在0.5-0.8 V之间,而非酚型芳香族化合物的氧化还原电势在1.5 V左右,这使得漆酶不能够直接氧化非酚型芳香族化合物[30]。介体是能够被漆酶高效氧化的低分子量有机化合物,它能够进入细胞间隙,通过氧化作用形成的中间产物而高效氧化该介体介导的底物,且氧化态产物不对漆酶起抑制作用,还可以被二级底物还原,实现反复利用。漆酶对非酚型芳香族化合物的催化氧化大多是依靠介体完成的,因此,寻找天然、有效、廉价的介体是目前漆酶应用的一个研究热点。
1.3 理化性质 1.3.1 温度真菌漆酶是一种适宜在温和环境条件下发挥作用的氧化酶。其反应的最适温度范围较窄,通常在25-50℃之间。过高或过低的温度都会抑制漆酶活性,尤其是高温,对漆酶活力的破坏比较严重。但不同来源的漆酶反应最适温度也存在显著差异。据报道,从广州地区分离的木霉(Trichoderma)中得到的漆酶具有耐高温特性,这可能是由于其所处的地理环境所致,其最适反应温度为65℃,在70℃保温60 min后残余酶活保留60%以上[31]。漆酶的重组也可能使其最适温度发生变化,葛飞等[32]通过响应面法测得刺芹侧耳(Pleurotus eryngii)所产漆酶的最适温度为27.6℃,而夏文静等[33]对P. eryngii漆酶进行了重组,发现该重组酶在20-60℃范围内随温度增加漆酶的活性不断升高,最适温度为60℃。
1.3.2 pH真菌漆酶的最适反应pH通常为3.5-6.0[34],如云芝栓孔菌(Trametes versicolor)所产漆酶的最适pH为3.8[35],多孔菌(Polyporus)为4.2[36],硬毛粗盖孔菌(Funalia trogii)为6.0[37]。在漆酶的生产过程中,最适pH的确定不仅要保证漆酶的高活性,还要考虑漆酶的稳定性,如白腐真菌糙皮侧耳(Pleurotus ostreatus)所产漆酶在pH为3.0的高酸性环境下活性较强,但漆酶稳定性保持效果较差,而pH呈中性至碱性时,漆酶稳定性较强但活性非常低,综合考虑,该漆酶最佳反应pH为5.0[38]。此外,研究发现通过改变漆酶的pH可以使其作用发生变化,张楠等[39]发现漆酶对玉米秸秆木质素同时兼具解聚和聚合作用,pH较高时综合表现为解聚作用,pH较低时则表现为聚合作用。
1.3.3 金属离子多种金属离子如K+、Ag+、Cu2+、Mg2+、Ca2+、Zn2+、Pb2+、Pd2+、Hg2+、Co2+、Ba2+、Fe2+和Fe3+等对漆酶活性也可产生重要的影响。一般而言,一定浓度的Cu2+会促进漆酶活性的增加。Zhuo等[40]研究了几种金属离子对P. ostreatus HAUCC 162漆酶活性的影响,10 d后发现Cu2+、Fe2+、Mn2+、Cd2+均使胞外漆酶活性有所增加,其中Cu2+效果最为显著。也有一些金属离子对漆酶活性产生抑制作用。研究发现,Co2+、Ni2+、Cd2+、Fe3+、Ag+等对漆酶活性的抑制作用很强,其原因可能是反应过程中,这些金属离子占据了漆酶的活性中心,改变了漆酶的结构,使底物不能与漆酶相结合,从而抑制了酶活[41]。也有报道称,Co2+、Mn2+、Ca2+、Fe2+和Hg2+会使双孢蘑菇(Agaricus bisporus)漆酶活性下降,其中Hg2+对其酶活显示出了较强的抑制作用[42]。此外,部分金属离子对漆酶降解染料的能力会产生促进作用,Cu2+和Cr6+使从白腐真菌欧洲灵芝(Ganoderma lucidum)中获得的漆酶对浓度为50.0 mg/L的两种染料雷玛唑黑5(Remazol Black 5,RB5)和雷玛唑亮蓝R(Remazol brilliant blue R,RBBR)的脱色效果显著增强,其中1.0 mmol/L Cu2+的添加使漆酶在1 h内对RB5和RBBR的脱色率分别达到94%和35.5%[43]。
2 真菌漆酶的生产 2.1 漆酶高产菌株的筛选真菌漆酶在纸浆漂白、环境治理、生物检测、食品加工、有机合成以及生物能源等多个工业领域具有较高的应用价值及潜力[44-51],但不同真菌产漆酶的能力不同,因此,筛选高产漆酶的真菌菌株就显得尤其重要,这将为漆酶高产菌株的选育和工业等领域的进一步应用奠定基础[52]。目前,高产漆酶的真菌菌株主要集中于小薄孔菌属(Antrodiella)、黑木耳(Auricularia heimuer)、毛木耳(Auricularia polytricha)、黑管孔菌属(Bjerkandera)、蜡孔菌属(Ceriporia)、拟蜡孔菌属(Ceriporiopsis)、齿毛菌属(Cerrena)、金针菇(Flammulina velutipes)、木蹄层孔菌(Fomes fomentarius)、粗盖孔菌属(Funalia)、灵芝属(Ganoderma)、深褐褶菌(Gloeophyllum sepiarium)、灰树花孔菌(Grifola frondosa)、猴头菌属(Hericium)、纤孔菌属(Inonotus)、囊耙齿菌属(Irpex)、荣氏孔菌属(Junghuhnia)、香菇(Lentinus edodes)、巨孔菌属(Megasporia)、锐孔菌属(Oxyporus)、多年卧孔菌属(Perenniporia)、木层孔菌属(Phellinus)、侧耳属(Pleurotus)、Polyporus、鲜红密孔菌(Pycnoporus cinnabarinus)、血红密孔菌(Pycnoporus sanguineus)、硬孔菌属(Rigidoporus)、桑黄属(Sanghuangporus)、裂褶菌(Schizophyllum commune)和栓孔菌属(Trametes)等[34, 53-54]。真菌漆酶的筛选主要是通过愈创木酚平板法初筛和液体发酵复筛。其中,愈创木酚能够被漆酶氧化产生茶褐色物质,进而利用氧化变色圈与菌丝直径的比值初步判断是否有漆酶产生[55]。刘家扬等[56]在干枯的木头中通过愈创木酚PDA平板法初筛得到6株产漆酶活力较高的菌株。除愈创木酚法外,陈琼华等[57]还通过α-萘酚的PDA平板法对43株大型真菌进行筛选,通过12 d对菌株生长状况的观察及菌丝圈与紫色氧化圈直径的测量,筛选出21株氧化圈直径与菌丝圈直径比值较大的菌株,具有较高的漆酶活性。
液体发酵复筛法通常是对菌株进行液体摇瓶培养后,用紫外分光光度计检测420 nm波长处吸光度的变化。王玉俊等[58]用液体发酵复筛的方法对P. cinnabarinus、F. fomentarius、一色齿毛菌(Cerrena unicolor)、轮纹韧革菌(Stereum ostrea)和宽鳞多孔菌(Polyporus squamosus)5种白腐真菌的产漆酶能力进行筛选,发现P. cinnabarinus所产漆酶活性最高。
2.2 培养条件培养条件的选择是真菌发酵生产漆酶的关键一环,可以通过单因子和正交实验或响应面设计的方法确定真菌产漆酶的最佳培养基及条件,主要涉及到碳源、氮源、温度、pH、转速等因素[59]。一般来说,真菌生产漆酶的最适温度为25-35℃,转速为140-200 r/min,偏酸性条件会促进真菌的发酵,在氮源相对较少时形成的“氮饥饿”状态会使漆酶的产量增加。王书超等[60]以树舌灵芝(Ganoderma applanatum)为实验材料,通过单因素实验和Plackett-Burman设计对漆酶的生产条件进行了优化,发现由20 g/L玉米粉和5 g/L豆粕组成、pH为5.5的培养基中,28℃摇瓶培养7 d时漆酶活性最高。郑飞等[61]将白腐真菌东方栓孔菌(Trametes orientalis)接种在两种营养条件不同的液体培养基中,发现该菌在缺营养条件下对部分次级代谢产物的分泌能力较强,且具有较好的适应能力,而在复杂的培养基中生产漆酶水平较高。
此外,发酵罐法通过旋转搅拌增加了氧气含量,使培养基得到充足的养分,通气效果较好,解决了摇瓶培养中菌液不均匀等问题,受到了研究者的极大关注[62]。近年来,对发酵罐生产漆酶的研究越来越多,其中包括黄孢原毛平革菌(Phanerochaete chrysosporium)、韦伯灵芝(Ganoderma weberianum)、疣孢漆斑菌(Myrothecium verrucaria)等。陈琼华等[63]将G. weberianum漆酶置于50 L发酵罐中进行发酵,实验结果显示,漆酶活性达到27 667.7 U/L,是摇瓶发酵水平的2.5倍。然而,发酵罐法使用成本较高,对于实验是否需要发酵罐及对发酵罐大小的选择要综合考虑,对于发酵罐未来是否会达到普遍使用的状态还有待观察。
2.3 漆酶的诱导生产在真菌培养过程中适当添加诱导剂可以大大提高漆酶的产量和活性。诱导剂的种类多样,可以分为化学诱导剂、生物诱导剂和物理诱导剂等。化学诱导剂主要是愈创木酚、金属离子、芳香族化合物、酚类化合物等,其中铜和阿魏酸是G. lucidum产漆酶最好的诱导剂[64],金属离子(Fe2+、Cu2+)与芳香族化合物(香草酸、肉桂酸和阿魏酸)的协同刺激使P. ostreatus产漆酶的能力进一步提升[40]。同一类诱导剂的复合诱导作用通常比使用单一诱导剂效果要好,不同类诱导剂间的协同作用也会是提高漆酶产量和活性的有效诱导方法[65]。目前研究的生物诱导剂主要包括木屑、玉米芯、棉籽壳、麦麸、麦秆等。安琪等[66]在富含简单碳/氮源的培养基中添加碱性木质素作为生物诱导剂,使P. ostreatus的菌丝生物量和漆酶活性均有显著提高。Couto等[67]在对半固态条件下T. versicolor产漆酶能力的研究中发现,二甲苯胺是最好的诱导剂,可以使漆酶活性达到1 700 U/L,但是在以大麦麸为基质的情况下,能够使T. versicolor所产的漆酶活性进一步提高,达到2 000 U/L。与生物和化学诱导方法相比,物理诱导并不常见,主要是通过紫外处理、超高压处理、辐射处理等方式。研究发现,使用紫外诱导的方法处理G. lucidum,所产漆酶活力是未处理菌株的2.83倍,发酵时间也缩短了1 d[68]。
3 真菌漆酶的纯化漆酶是一种酶蛋白,常常与其它物质复杂地混合在一起,在实际的工业流程中,对漆酶适应极端环境的要求极高,因此开发和研究具有特殊性质的酶蛋白,对于工业化发展尤为重要[69]。而工业生产过程中往往需要更加耐高温和耐酸碱性的抗性酶,为评估漆酶在工业应用中的适合度,需要对其理化性质、作用机理和生物学功能进行深入地研究和测定,因此,漆酶的分离纯化和性质分析已经成为漆酶研究的重点[70]。据报道,胞外酶是真菌漆酶的主要种类,与胞内酶相比,其提取分离纯化的过程更加简单容易,且稳定性也较好,可适于多种工业应用[34]。截至目前,全世界被纯化和分析性质的真菌漆酶已经有上百种[71]。
漆酶的分离纯化方法有透析、超滤、电泳、等电点沉淀、盐析、离子交换柱层析、亲和层析和疏水层析等,通常需要采用几种方法相结合才能将漆酶从复杂的体系中分离出来。Ramírez-Cavazos等[70]对P. sanguineus CS43的两种热稳定性漆酶通过超滤、离子交换柱层析和疏水作用层析进行纯化,得到其比活力近285 U/mg。他们还发现这两种漆酶在50℃和60℃都显示出很高的氨基酸序列相似性(91%)和热稳定性。性质分析主要是研究其催化系数、最适pH、热稳定性、光谱性质、分子量、底物特异性等,并探索金属离子、螯合剂和无机化合物等对漆酶活性和稳定性的影响。菌株来源不同的漆酶,其稳定性、最适pH、最适温度、分子量、作用底物及动力学特征等都不尽相同[72],使用不同的纯化方法,漆酶的比活力和回收率也不尽相同。Manavalan等[73]用交联葡聚糖G-100和DEAE-纤维素柱层析纯化G. lucidum漆酶,获得的漆酶分子量为38.3 kD,活性回收率为32%,以2,2′-连氮-双(3-乙基苯并噻唑-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)为底物、pH 5.0、温度为55℃时,漆酶活性最高。而Wang等[74]以白腐真菌C. unicolor GSM-01中获得的具有较强染料脱色能力的漆酶为材料,通过3个离子交换柱层析和一个凝胶过滤层析进行纯化,得到的漆酶是一种单体蛋白,分子量为63.2 kD,活性回收率为33.9%,最适pH和温度分别为2.6和45℃。此外,还发现Fe3+和Fe2+是C. unicolor GSM-01漆酶最有效的抑制剂,Mn2+可低幅度提高3.8%-10.5%漆酶活性。Zheng等[75]从T. orientalis中发现了一种新型漆酶,并对其通过硫酸铵分级沉淀、DEAE-cellulose DE52阴离子交换柱层析和Sephrose CL-6B琼脂糖凝胶柱层析进行纯化,发现得到的漆酶是一种单体蛋白质,分子量为44.0 kD,回收率为47.33%,最佳pH和温度分别为4.0和80℃,Mn2+对提高漆酶活性有较好的效果。
近年来,漆酶的纯化方法更新变化不大,在今后的研究中,应当注重探索和开发纯化效率更高、操作更加简单易行的新型纯化方法,为漆酶性质的研究及进一步工业化应用提供技术支持。
4 真菌漆酶的固定化漆酶是一类具有生物催化功能的蛋白质,其能够在温和条件下高效地催化生物反应,对作用底物的选择具有专一性,且反应后酶自身的数量和性质不发生改变,具有无污染、环境友好等特点,符合当今工业化生产的环保要求[76]。但游离的漆酶稳定性差,在环境中易受温度、pH、酸碱性等因素的影响,且不易分离提纯进行重复性使用,这在一定程度上限制了漆酶的工业化应用。
1966年,Tosa等[77]通过固定化处理使氨基酰化酶在工业上实现了连续化生产,提高了酶的利用率,从此,酶的固定化研究激发了学者们的广泛兴趣。固定化酶是指利用物理或化学手段将酶固定在载体上或者束缚在一定范围内、同时保持了催化活性、并能连续反应和反复使用的酶制剂[78]。将固定化技术应用于漆酶,使其易从反应体系中分离出来,实现了重复利用,同时可以简化产物的提纯工艺,增强游离漆酶的化学稳定性及对周围环境的适应能力,且保持了最初的催化特性和催化效率,大大提升了对酶反应过程的操控范围,为漆酶的产业化发展和进一步应用开拓了更广阔的前景[79-88]。
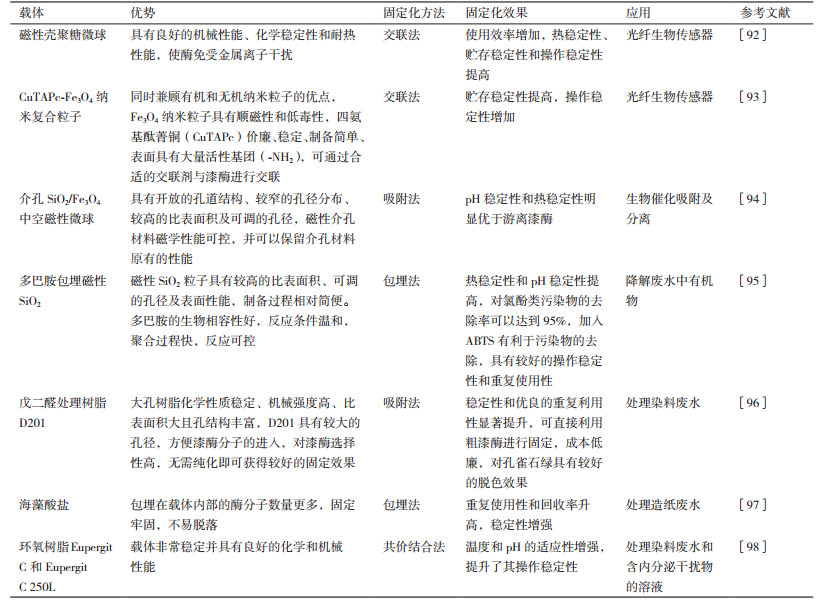
目前,漆酶固定化的方法已经相对成熟,常用的固定化方法可分为物理法和化学法,物理法包括吸附法和包埋法等,化学法包括共价法和交联法等。固定化载体的选择范围相对较广,研究人员也在不断探索和发现新的固定化载体并将其应用到漆酶的固定化中[89-91],载体的选择是漆酶能否实现固定化及固定化效果好坏的关键,表 1总结了几种载体的优势、固定化方法、固定化效果及应用。
近年来,有关磁性载体的研究越来越多,其能够显著提升漆酶的热稳定性、pH稳定性和贮存稳定性,同时也增加了酶的回收率和可操作性[99],但使用磁性载体固定的漆酶活性并不十分稳定。因此,开发优良、稳定的漆酶固定化载体将成为今后研究的热点方向。除载体的选择外,合适的固定化方法也是决定漆酶固定化效果的关键,适合的固定化方法结合高效、稳定的载体将会使漆酶的使用效率显著提升。然而,很多关于固定化漆酶的研究目前仍处于实验室阶段,投入到工业大规模生产的案例少之又少,还需进一步研究。
5 小结漆酶是一种含铜的多酚氧化酶,广泛存在于各种真菌、植物和细菌中,真菌漆酶的研究最多也最深入。为提高真菌漆酶活性,进行了大量生物学特性及优化生产条件的相关研究,并取得了一些进展。漆酶的生产是工业化应用的基础,发掘性质优良的漆酶并提高其活性,将是今后不断研究的重点。
漆酶本质上是一种环保型酵素,具有独特的降解机理,对性质优良的漆酶进行纯化和固定化,提高其稳定性和使用效率,实现多次重复利用,是目前研究的热点方向。寻找适合的纯化及固定化方法、稳定及机械性能优异的酶固定化载体将是漆酶今后实现大规模工业化应用的关键。
| [1] |
刘辉, 韩振亚, 苏焕斌, 等. 漆酶及其产生菌应用研究进展[J]. 广东化工, 2016, 43(7): 100-101. DOI:10.3969/j.issn.1007-1865.2016.07.047 |
| [2] |
Yoshida H. LXIII. -Chemistry of lacquer (Urushi). Part Ⅰ. Communication from the Chemical Society of Tokio[J]. Journal of the Chemical Society, Transactions, 1883, 43: 472-486. DOI:10.1039/CT8834300472 |
| [3] |
Bertrand G. Sur le latex de l'arbre à laque[J]. Comptes Rendus Hebdomadaires des Séances de I'Académie des Sciences (Paris), 1894, 118: 1215-1218. |
| [4] |
万云洋, 杜予民. 漆酶来源与绿色化学应用[J]. 林产化学与工业, 2008, 28(6): 100-108. DOI:10.3321/j.issn:0253-2417.2008.06.022 |
| [5] |
甘主镐. 生漆的化学[M]. 北京: 科学出版社, 1984.
|
| [6] |
Liu ZG, Wang HH, Xue CB. Molecular identification and enzymatic properties of laccase2 from the diamondback moth Plutella xylostella (Lepidoptera:Plutellidae)[J]. Journal of Integrative Agriculture, 2018, 17(10): 2310-2319. DOI:10.1016/S2095-3119(17)61764-7 |
| [7] |
邓寒梅, 邵可, 梁家豪, 等. 漆酶的来源及固定化漆酶载体研究进展[J]. 生物技术通报, 2017, 33(6): 10-15. |
| [8] |
Wang SN, Chen QJ, Zhu MJ, et al. An extracellular yellow laccase from white rot fungus Trametes sp. F1635 and its mediator systems for dye decolorization[J]. Biochimie, 2018, 148: 46-54. DOI:10.1016/j.biochi.2018.02.015 |
| [9] |
Shanmugam S, Ulaganathan P, Swaminathan K, et al. Enhanced biodegradation and detoxification of malachite green by Trichoderma asperellum laccase:Degradation pathway and product analysis[J]. International Biodeterioration & Biodegradation, 2017, 125: 258-268. |
| [10] |
Kolomytseva MP, Myasoedova NM, Chernykh AM, et al. Laccase isoform diversity in basidiomycete Lentinus strigosus 1566:Potential for phenylpropanoid polymerization[J]. International Journal of Biological Macromolecules, 2019, 137: 1199-1210. DOI:10.1016/j.ijbiomac.2019.07.056 |
| [11] |
Zhuo R, Zhang JW, Yu HB, et al. The roles of Pleurotus ostreatus HAUCC 162 laccase isoenzymes in decolorization of synthetic dyes and the transformation pathways[J]. Chemosphere, 2019, 234: 733-745. DOI:10.1016/j.chemosphere.2019.06.113 |
| [12] |
Zerva A, Koutroufini E, Kostopoulou I, et al. A novel thermophilic laccase-like multicopper oxidase from Thermothelomyces thermophila and its application in the oxidative cyclization of 2', 3, 4-trihydroxychalcone[J]. New Biotechnology, 2019, 49: 10-18. DOI:10.1016/j.nbt.2018.12.001 |
| [13] |
Blánquez A, Rodríguez J, Brissos V, et al. Decolorization and detoxification of textile dyes using a versatile Streptomyces laccase-natural mediator system[J]. Saudi Journal of Biological Sciences, 2019, 26: 913-920. DOI:10.1016/j.sjbs.2018.05.020 |
| [14] |
Olajuyigbe FM, Fatokun CO. Biochemical characterization of an extremely stable pH-versatile laccase from Sporothrix carnis CPF-05[J]. International Journal of Biological Macromolecules, 2017, 94: 535-543. DOI:10.1016/j.ijbiomac.2016.10.037 |
| [15] |
Khodaverdian S, Dabirmanesh B, Heydari A, et al. Activity, stability and structure of laccase in betaine based natural deep eutectic solvents[J]. International Journal of Biological Macromolecules, 2018, 107: 2574-2579. DOI:10.1016/j.ijbiomac.2017.10.144 |
| [16] |
Britos CN, Gianolini JE, Portillo H, et al. Biodegradation of industrial dyes by a solvent, metal and surfactant-stable extracellular bacterial laccase[J]. Biocatalysis and Agricultural Biotechnology, 2018, 14: 221-227. DOI:10.1016/j.bcab.2018.03.015 |
| [17] |
李晨歌. 漆酶及其应用研究进展[J]. 陇东学院学报, 2017, 28(1): 62-66. DOI:10.3969/j.issn.1674-1730.2017.01.014 |
| [18] |
龚睿, 孙凯, 谢道月. 真菌漆酶在绿色化学中的研究进展[J]. 生物技术通报, 2018, 34(4): 24-34. |
| [19] |
Zhu Y, Ouyang XP, Zhao Y, et al. Oxidative depolymerization of lignin improved by enzymolysis pretreatment with laccase[J]. Journal of Energy Chemistry, 2018, 27: 801-805. DOI:10.1016/j.jechem.2017.04.018 |
| [20] |
Paramjeet S, Manasa P, Korrapati N. Biofuels:production of fungal-mediated ligninolytic enzymes and the modes of bioprocesses utilizing agro-based residues[J]. Biocatalysis and Agricultural Biotechnology, 2018, 14: 57-71. DOI:10.1016/j.bcab.2018.02.007 |
| [21] |
Naghdi M, Taheran M, Brar SK, et al. Removal of pharmaceutical compounds in water and wastewater using fungal oxidoreductase enzymes[J]. Environmental Pollution, 2018, 234: 190-213. DOI:10.1016/j.envpol.2017.11.060 |
| [22] |
Isaschar-Ovdat S, Fishman A. Crosslinking of food proteins mediated by oxidative enzymes-a review[J]. Trends in Food Science & Technology, 2018, 72: 134-143. |
| [23] |
Barrios-Estrada C, Rostro-Alanis MJ, Muñoz-Gutiérrez BD, et al. Emergent contaminants:endocrine disruptors and their laccase-assisted degradation-a review[J]. Science of the Total Environment, 2018, 612: 1516-1531. DOI:10.1016/j.scitotenv.2017.09.013 |
| [24] |
Brémond U, de Buyer R, Steyer JP, et al. Biological pretreatments of biomass for improving biogas production:an overview from lab scale to full-scale[J]. Renewable and Sustainable Energy Reviews, 2018, 90: 583-604. DOI:10.1016/j.rser.2018.03.103 |
| [25] |
Quintanar L, Yoon J, Aznar CP, et al. Spectroscopic and electronic structure studies of the trinuclear Cu cluster active site of the multicopper oxidase laccase:nature of its coordination unsaturation[J]. Journal of the American Chemical Society, 2005, 127(40): 13832-13845. DOI:10.1021/ja0421405 |
| [26] |
Solomon EI, Sundaram UM, Machonkin TE. Multicopper oxidases and oxygenases[J]. Chemical Reviews, 1996, 96: 2563-2605. DOI:10.1021/cr950046o |
| [27] |
Garavaglia S, Cambria MT, Miglio M, et al. The structure of Rigidoporus lignosus laccase containing a full complement of copper ions, reveals an asymmetrical arrangement for the T3 copper pair[J]. Journal of Molecular Biology, 2004, 342(5): 1519-1531. DOI:10.1016/j.jmb.2004.07.100 |
| [28] |
Morpurgo L, Agostinelli E, Senepa M, et al. A room temperature electron paramagnetic resonance study of native and fluoride-reacted Vietnamese and Japanese lacquer-tree laccases:differences from liquid-nitrogen spectra[J]. Journal of Inorganic Biochemistry, 1985, 24(1): 1-8. |
| [29] |
李平, 易弋, 邓春, 等. 漆酶的结构及其应用研究进展[J]. 中国酿造, 2016, 35(5): 10-15. |
| [30] |
曹明乐, 张海波, 黄峰, 等. 漆酶的研究进展[J]. 山东林业科技, 2012, 42(3): 106-115. DOI:10.3969/j.issn.1002-2724.2012.03.035 |
| [31] |
吴振强, 秦鹏, 王菊芳, 等. 产耐温漆酶菌的筛选及培养基优化[J]. 陕西科技大学学报, 2009, 27(1): 68-73. DOI:10.3969/j.issn.1000-5811.2009.01.015 |
| [32] |
葛飞, 张慧敏, 龚倩, 等. 杏鲍菇产漆酶培养条件优化及其对菲的降解特性研究[J]. 食品工业科技, 2014, 35(14): 221-225. |
| [33] |
夏文静, 周学, 周燕, 等. 杏鲍菇重组漆酶对不同酚类污染物的降解研究[J]. 食品工业科技, 2017, 38(24): 99-103. |
| [34] |
Baldrian P. Fungal laccases-occurrence and properties[J]. FEMS Microbiology Reviews, 2006, 30(2): 215-242. DOI:10.1111/j.1574-4976.2005.00010.x |
| [35] |
范文霞, 蔡友华, 刘学铭, 等. 毛云芝菌漆酶的分离纯化和性质研究[J]. 食品科学, 2008, 29(12): 422-425. DOI:10.3321/j.issn:1002-6630.2008.12.095 |
| [36] |
王宜磊, 周长路. 多孔菌Polyporus W38漆酶的纯化及性质研究[J]. 微生物学杂志, 2002, 22(6): 28-29. DOI:10.3969/j.issn.1005-7021.2002.06.010 |
| [37] |
宋丽丽, 张志平, 王光路, 等. 硬毛粗盖孔菌产漆酶条件优化及其对日落黄的降解作用[J]. 食品工业科技, 2019, 40(10): 133-138. |
| [38] |
王辉, 陈广胜, 韩松. 添加天然物质对白腐菌糙皮侧耳菌产漆酶的影响[J]. 东北林业大学学报, 2013, 41(10): 112-115. DOI:10.3969/j.issn.1000-5382.2013.10.024 |
| [39] |
张楠, 邸明伟. pH值对漆酶活化玉米秸秆木质素的影响[J]. 粘接, 2015, 6: 42-46. |
| [40] |
Zhuo R, Yuan P, Yang Y, et al. Induction of laccase by metal ions and aromatic compounds in Pleurotus ostreatus HAUCC 162 and decolorization of different synthetic dyes by the extracellular laccase[J]. Biochemical Engineering Journal, 2017, 117: 62-72. DOI:10.1016/j.bej.2016.09.016 |
| [41] |
Niladevi KN, Jacob N, Prema P. Evidence for a halotolerant-alkaline laccase in Streptomyces psammoticus:purification and characterization[J]. Process Biochemistry, 2008, 43(6): 654-660. DOI:10.1016/j.procbio.2008.02.002 |
| [42] |
Othman AM, Elsayed MA, Elshafei AM, et al. Purification and biochemical characterization of two isolated laccase isoforms from Agaricus bisporus CU13 and their potency in dye decolorization[J]. International Journal of Biological Macromolecules, 2018, 113: 1142-1148. DOI:10.1016/j.ijbiomac.2018.03.043 |
| [43] |
Murugesan K, Kim YM, Jeon JR, et al. Effect of metal ions on reactive dye decolorization by laccase from Ganoderma lucidum[J]. Journal of Hazardous Materials, 2009, 168(1): 523-529. DOI:10.1016/j.jhazmat.2009.02.075 |
| [44] |
Agrawal K, Chaturvedi V, Verma P. Fungal laccase discovered but yet undiscovered[J]. Bioresources and Bioprocessing, 2018, 5: 4. DOI:10.1186/s40643-018-0190-z |
| [45] |
Lin XJ, Wu ZM, Zhang CY, et al. Enzymatic pulping of lignocellulosic biomass[J]. Industrial Crops & Products, 2018, 120: 16-24. |
| [46] |
Guebitz GM, Nyanhongo GS. Enzymes as green catalysts and interactive biomolecules in wound dressing hydrogels[J]. Trends in Biotechnology, 2018, 36(10): 1040-1053. DOI:10.1016/j.tibtech.2018.05.006 |
| [47] |
Tonin F, Melis R, Cordes A, et al. Comparison of different microbial laccases as tools for industrial uses[J]. New Biotechnology, 2016, 33(3): 387-398. DOI:10.1016/j.nbt.2016.01.007 |
| [48] |
de Lima DP, dos Santos EA, Marques MR, et al. Fungal bioremediation of pollutant aromatic amines[J]. Current Opinion in Green and Sustainable Chemistry, 2018, 11: 34-44. DOI:10.1016/j.cogsc.2018.03.012 |
| [49] |
Pellis A, Cantone S, Ebert C, et al. Evolving biocatalysis to meet bioeconomy challenges and opportunities[J]. New Biotechnology, 2018, 40: 154-169. DOI:10.1016/j.nbt.2017.07.005 |
| [50] |
Bilal M, Rasheed T, Nabeel F, et al. Hazardous contaminants in the environment and their laccase-assisted degradation-A review[J]. Journal of Environmental Management, 2019, 234: 253-264. |
| [51] |
司静, 李伟, 崔宝凯, 等. 真菌漆酶性质、分子生物学及其应用研究进展[J]. 生物技术通报, 2011, 2: 48-55. |
| [52] |
甄静, 李冠杰, 李伟, 等. 毛栓孔菌XYG422菌株产漆酶发酵条件优化及对玉米秸秆生物降解的研究[J]. 菌物学报, 2017, 36(6): 718-729. |
| [53] |
Rivera-Hoyos CM, Morales-Álvarez ED, Poutou-Piñales RA, et al. Fungal laccases[J]. Fungal Biology Reviews, 2013, 27: 67-82. DOI:10.1016/j.fbr.2013.07.001 |
| [54] |
Fernández-Fernández M, Sanromán MÁ, Moldes D. Recent developments and applications of immobilized laccase[J]. Biotechnology Advances, 2013, 31: 1808-1825. DOI:10.1016/j.biotechadv.2012.02.013 |
| [55] |
司静, 崔宝凯, 戴玉成. 栓孔菌属漆酶高产菌株的初步筛选及其产酶条件的优化[J]. 微生物学通报, 2011, 38(3): 405-416. |
| [56] |
刘家扬, 蔡宇杰, 廖祥儒, 等. 漆酶高产菌的筛选及产酶优化[J]. 食品与机械, 2010, 26(4): 10-14. |
| [57] |
陈琼华, 周玉萍, 毕凡星, 等. 真菌漆酶高产菌株的筛选[J]. 广州大学学报:自然科学版, 2009, 8(5): 53-57. |
| [58] |
王玉俊, 樊忠慧, 王长宝, 等. 高产漆酶白腐真菌的筛选[J]. 湖北农业科学, 2017, 56(21): 4043-4045. |
| [59] |
梁倩倩, 魏生龙, 席亚丽, 等. 响应面法优化荷叶离褶伞菌丝体产漆酶条件[J]. 菌物学报, 2016, 35(3): 335-342. |
| [60] |
王书超, 张宇, 何爽, 等. 树舌灵芝产漆酶发酵条件的优化[J]. 现代农业研究, 2018, 3: 9-11. |
| [61] |
郑飞, 孟歌, 安琪, 等. 白腐真菌东方栓孔菌在两种液体培养基中产漆酶过程的生理学研究[J]. 菌物学报, 2017, 36(5): 582-297. |
| [62] |
刘海霞, 张力, 乔梁. 白腐真菌发酵罐产漆酶条件的优化[J]. 江苏农业科学, 2017, 45(21): 305-307. |
| [63] |
陈琼华, 周玉萍, 桂林, 等. 韦伯灵芝漆酶生产中试研究[J]. 食品与发酵工业, 2016, 42(5): 44-49. |
| [64] |
Kuhar F, Papinutti L. Optimization of laccase production by two strains of Ganoderma lucidum using phenolic and metallic inducers[J]. Revista Argentina de Microbiología, 2014, 46(2): 144-149. DOI:10.1016/S0325-7541(14)70063-X |
| [65] |
Tavares APM, Coelho MAZ, Coutinho JAP, et al. Laccase improvement in submerged cultivation:induced production and kinetic modelling[J]. Journal of Chemical Technology and Biotechnology, 2005, 80: 669-676. DOI:10.1002/jctb.1246 |
| [66] |
安琪, 司静, 戴玉成. 不同诱导培养基对糙皮侧耳液体发酵产漆酶活性的影响[J]. 菌物学报, 2018, 37(3): 361-370. |
| [67] |
Couto SR, Gundín M, Lorenzo M, et al. Screening of supports and inducers for laccase production by Trametes versicolor in semi-solid-state conditions[J]. Process Biochemistry, 2002, 38(2): 249-255. DOI:10.1016/S0032-9592(02)00087-0 |
| [68] |
王岁楼, 李国富, 王琼波, 等. 紫外和超高压诱导漆酶产生菌变异的对比研究[J]. 郑州轻工业学院学报:自然科学版, 2005, 20(3): 39-42. |
| [69] |
Fang ZM, Li TL, Chang F, et al. A new marine bacterial laccase with chloride-enhancing, alkaline-dependent activity and dye decolorization ability[J]. Bioresource Technology, 2012, 111: 36-41. DOI:10.1016/j.biortech.2012.01.172 |
| [70] |
Ramírez-Cavazos LI, Junghanns C, Ornelas-Soto N, et al. Purification and characterization of two thermostable laccases from Pycnoporus sanguineus and potential role in degradation of endocrine disrupting chemicals[J]. Journal of Molecular Catalysis B:Enzymatic, 2014, 108: 32-42. DOI:10.1016/j.molcatb.2014.06.006 |
| [71] |
Si J, Peng F, Cui BK. Purification, biochemical characterization and dye decolorization capacity of an alkali-resistant and metal-tolerant laccase from Trametes pubescens[J]. Bioresource Technology, 2013, 128: 49-57. DOI:10.1016/j.biortech.2012.10.085 |
| [72] |
Kim H, Lee S, Ryu S, et al. Decolorization of Remazol Brilliant Blue R by a purified laccase of Polyporus brumalis[J]. Applied Biochemistry & Biotechnology, 2012, 166(1): 159-164. |
| [73] |
Manavalan T, Manavalan A, Thangavelu KP, et al. Characterization of optimized production, purification and application of laccase from Ganoderma lucidum[J]. Biochemical Engineering Journal, 2013, 70(2): 106-114. |
| [74] |
Wang SS, Ning YJ, Wang SN, et al. Purification, characterization, and cloning of an extracellular laccase with potent dye decolorizing ability from white rot fungus Cerrena unicolor GSM-01[J]. International Journal of Biological Macromolecules, 2017, 95: 920-927. DOI:10.1016/j.ijbiomac.2016.10.079 |
| [75] |
Zheng F, An Q, Meng G, et al. A novel laccase from white rot fungus Trametes orientalis:Purification, characterization, and application[J]. International Journal of Biological Macromolecules, 2017, 102: 758-770. DOI:10.1016/j.ijbiomac.2017.04.089 |
| [76] |
Zheng MM, Chi YJ, Yi HW, et al. Decolorization of Alizarin Red and other synthetic dyes by a recombinant laccase from Pichia pastoris[J]. Biotechnology Letters, 2014, 36(1): 39-45. DOI:10.1007/s10529-013-1323-2 |
| [77] |
Tosa T, Mori T, Fuse N, et al. Studies on continuous enzyme reactions. I. Screening of carriers for preparation of water-insoluble aminoacylase[J]. Enzymologia, 1966, 31(4): 214-224. |
| [78] |
Bilal M, Asgher M, Parra-Saldivar R, et al. Immobilized ligninolytic enzymes:An innovative and environmental responsive technology to tackle dye-based industrial pollutants-A review[J]. Science of the Total Environment, 2017, 576: 646-659. DOI:10.1016/j.scitotenv.2016.10.137 |
| [79] |
Zheng F, Cui BK, Wu XJ, et al. Immobilization of laccase onto chitosan beads to enhance its capability to degrade synthetic dyes[J]. International Biodeterioration & Biodegradation, 2016, 110: 69-78. |
| [80] |
Lassouane F, Aït-Amar H, Amrani S, et al. A promising laccase immobilization approach for Bisphenol A removal from aqueous solutions[J]. Bioresource Technology, 2019, 271: 360-367. DOI:10.1016/j.biortech.2018.09.129 |
| [81] |
Saoudi O, Ghaouar N. Biocatalytic characterization of free and immobilized laccase from Trametes versicolor in its activation zone[J]. International Journal of Biological Macromolecules, 2019, 128: 681-691. DOI:10.1016/j.ijbiomac.2019.01.199 |
| [82] |
Nadaroglu H, Mosber G, Gungor AA, et al. Biodegradation of some azo dyes from wastewater with laccase from Weissella viridescens LB37 immobilized on magnetic chitosan nanoparticles[J]. Journal of Water Process Engineering, 2019, 31: 100866. DOI:10.1016/j.jwpe.2019.100866 |
| [83] |
Rani M, Shanker U, Chaurasia AK. Catalytic potential of laccase immobilized on transition metal oxides nanomaterials:Degradation of alizarin red S dye[J]. Journal of Environmental Chemical Engineering, 2017, 5: 2730-2739. DOI:10.1016/j.jece.2017.05.026 |
| [84] |
Jahangiri E, Thomas I, Schulze A, et al. Characterisation of electron beam irradiation-immobilised laccase for application in wastewater treatment[J]. Science of the Total Environment, 2018, 624: 309-322. DOI:10.1016/j.scitotenv.2017.12.127 |
| [85] |
Rouhani S, Rostami A, Salimi A, et al. Graphene oxide/CuFe2O4 nanocomposite as a novel scaffold for the immobilization of laccase and its application as a recyclable nanobiocatalyst for the green synthesis of arylsulfonyl benzenediols[J]. Biochemical Engineering Journal, 2018, 133: 1-11. DOI:10.1016/j.bej.2018.01.004 |
| [86] |
Mohammadi M, As'habi MA, Salehi P, et al. Immobilization of laccase on epoxy-functionalized silica and its application in biodegradation of phenolic compounds[J]. International Journal of Biological Macromolecules, 2018, 109: 443-447. DOI:10.1016/j.ijbiomac.2017.12.102 |
| [87] |
Naghdi M, Taheran M, Brar SK, et al. Pinewood nanobiochar:A unique carrier for the immobilization of crude laccase by covalent bonding[J]. International Journal of Biological Macromolecules, 2018, 115: 563-571. DOI:10.1016/j.ijbiomac.2018.04.105 |
| [88] |
Chen XC, Zhou QZ, Liu FM, et al. Removal of nine pesticide residues from water and soil by biosorption coupled with degradation on biosorbent immobilized laccase[J]. Chemosphere, 2019, 233: 49-56. DOI:10.1016/j.chemosphere.2019.05.144 |
| [89] |
Zdarta J, Meyer AS, Jesionowski T, et al. Developments in support materials for immobilization of oxidoreductases:a comprehensive review[J]. Advances in Colloid and Interface Science, 2018, 258: 1-20. DOI:10.1016/j.cis.2018.07.004 |
| [90] |
Ma HF, Meng G, Cui BK, et al. Chitosan crosslinked with genipin as supporting matrix for biodegradation of synthetic dyes:laccase immobilization and characterization[J]. Chemical Engineering Research and Design, 2018, 132: 664-676. DOI:10.1016/j.cherd.2018.02.008 |
| [91] |
Cui JD, Ren SZ, Sun BT, et al. Optimization protocols and improved strategies for metal-organic frameworks for immobilizing enzymes:current development and future challenges[J]. Coordination Chemistry Reviews, 2018, 370: 22-41. DOI:10.1016/j.ccr.2018.05.004 |
| [92] |
姜德生, 龙胜亚, 肖海燕, 等. 磁性壳聚糖微球的制备及其用作漆酶固定化载体[J]. 应用化学, 2005, 22(10): 1122-1126. DOI:10.3969/j.issn.1000-0518.2005.10.018 |
| [93] |
黄俊, 周菊英, 肖海燕, 等. CuTAPc-Fe3O4纳米复合粒子及其漆酶固定化研究[J]. 化学学报, 2005, 63(14): 1343-1347. DOI:10.3321/j.issn:0567-7351.2005.14.017 |
| [94] |
王苗苗, 李群艳, 韦奇, 等. 介孔SiO2/Fe3O4中空磁性微球的漆酶固定化[J]. 高等学校化学学报, 2013, 34(2): 299-305. |
| [95] |
张笛, 邓满凤, 赵赫, 等. 多巴胺包埋磁性SiO2固定化漆酶催化去除4-氯酚[J]. 化工学报, 2015, 66(9): 3705-3711. |
| [96] |
戚绪亮, 刘翔, 刘波, 等. 树脂D201上粗漆酶的固定化及对孔雀石绿的脱色[J]. 环境科学, 2012, 33(8): 2747-2751. |
| [97] |
Olajuyigbe FM, Adetuyi OY, Fatokun CO. Characterization of free and immobilized laccase from Cyberlindnera fabianii and application in degradation of bisphenol A[J]. International Journal of Biological Macromolecules, 2019, 125: 856-864. DOI:10.1016/j.ijbiomac.2018.12.106 |
| [98] |
Lloret L, Hollmann F, Eibes G, et al. Immobilisation of laccase on Eupergit supports and its application for the removal of endocrine disrupting chemicals in a packed-bed reactor[J]. Biodegradation, 2012, 23(3): 373-386. DOI:10.1007/s10532-011-9516-7 |
| [99] |
王珏玉, 范丽莉, 王炎, 等. 漆酶固定化磁性载体的研究进展[J]. 化学与生物工程, 2017, 34(1): 15-22. DOI:10.3969/j.issn.1672-5425.2017.01.003 |