2. 无锡市城市环境科技有限公司,无锡 214026;
3. 中粮贸易内蒙古有限公司农业产业化部,呼和浩特 010000
2. Wuxi City Environmental Sanitation Co. Ltd., Wuxi 214026;
3. COFCO Trade Inner Mongolia Co. Ltd., Ministry of Agriculture and Industrialization, Hohhot 010000
随着全球工业化发展,金属需求量居高不下,全球高品位、易处理矿产储量不断下降,利用生物浸出对低品位矿产资源进行提炼受到重视[1-2]。传统高温冶炼主要针对高品位精矿且成本高、耗能高,而生物浸出具备成本低廉、绿色无污染、操作简便等特点,可有效提炼贫尾矿及废弃物中的金属离子[1-4]。
贫黄铜矿是一类含硫低品位矿石,约占世界铜矿产总储量的70%,在生物浸出中的应用受到越来越多的重视,但由于其面心四面体结构浸出难度大,在酸浸或细菌浸出中效果均不理想。在贫黄铜矿浸出体系中,质子作用矿物促使其溶解释放出金属离子和还原性硫化物等[1]。硫杆菌利用矿物表面硫化物获取能量,同时生成质子进一步作用于矿石促进铜离子溶出[5]。在浸出前期铜离子浓度低,对微生物生长影响较小,随着矿物不断溶出,高浓度铜离子对浸出微生物产生毒害,影响其生物活性进而影响浸出效果[6-8]。因此该类浸矿微生物的铜耐受性能在浸出体系中非常关键。
喜温硫杆菌(Acidithiobacillus caldus)是一类革兰氏阴性化能自养菌,能适应浸出过程中的高温环境,并利用矿物中还原性硫化物作为能量来源[9-10]。王玉光等[11]发现A. caldus在浸出初期通过对硫化物的氧化促进矿物中Fe2+的释放,帮助其他能够利用Fe2+作为能源物质的浸出菌株进行生长,是硫化铜矿浸出中的优势菌株之一。Watkin等[12]在废硫化铜堆中选择性富集分离出A. caldus DSM 8584T菌株。
本研究对实验室保藏的A. caldus进行适应性铜耐受定向驯化,获得具备铜抗性菌株,比较驯化菌株与出发菌株在铜胁迫下的生长参数差异性,并在铜胁迫体系中初步应用驯化菌株浸出,研究出发菌株与驯化菌株浸出差异及浸出体系中参数变化,旨在为未来类似的生物浸出工业应用提供参考。
1 材料与方法 1.1 材料实验菌株为A. caldus,驯化后菌株保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2018727。改良Starkey液体培养基(g/L):(NH4)2SO4 0.3、KH2PO4 3.0、K2HPO4 0.3、MgSO4 0.24、KCl 0.1、Ca(NO3)2 0.01、升化硫5.0,1 mL微量元素(g/L,Na2SO4 25,FeCl3 3.3,H3BO3 1,MnSO4 1,ZnSO4 0.4,Na2MoO4 0.34,CoCl2 0.21,CuSO4 0.25),调节pH至1.8。硫粉经过常压间歇式灭菌,微量元素经过滤灭菌,两者于接种前加入培养基。
浸出矿样为安徽铜陵冬瓜山铜矿采集的贫黄铜矿,由黄铜矿、磁黄铁矿、黄铁矿和磁铁矿组成,矿石粉碎后过300目筛,控制矿物颗粒直径小于48 μm。超纯水轻柔洗涤矿样表面灰尘,置于玻璃干燥器自然干燥备用。
pH计,梅特勒-托利多仪器有限公司; 离子色谱仪,美国赛默飞世尔科技公司; Quanta-200型扫描电镜,荷兰FEI公司; 傅里叶变换红外光谱仪,美国尼高力仪器公司; X射线衍射仪D8型,德国布鲁克AXS公司; 原子吸收光谱仪Z-8000,日本日立公司。
1.2 方法 1.2.1 菌株铜耐受性定向驯化将生长至对数中期出发菌株转接到含0.5 g/L Cu2+改良Starkey培养基中培养,将适应性菌株不断转接至含更高铜浓度的Starkey复合培养基进行驯化,每次转接Cu2+浓度提高0.5 g/L。直至菌株不能在更高铜浓度下生长,选取当前菌株为驯化菌株。将经过6个多月驯化获得的适应性铜耐受驯化菌株与出发菌株在0、1及3 g/L Cu2+条件下培养,每天测定其菌体量变化。
1.2.2 适应性菌株铜胁迫下浸出贫黄铜矿将生长至对数生长中期的出发菌株及驯化菌株以10%的接种量转接至200 mL改良Starkey培养基中,添加20 g/L贫黄铜矿,添加Cu2+浓度分别为0、1及3 g/L,在40℃、转速170 r/min条件下进行浸出实验。浸出过程中每2 d调节pH为2.0,保持酸浸环境。定期检测体系中pH及硫酸根浓度。
1.2.3 分析方法 1.2.3.1 菌体浓度及生长曲线测定核酸法测定菌体浓度,培养液离心(367×g,2 min)除去单质硫成分,取0.5 mL稀释至合适浓度的菌液于1.5 mL离心管中,加入1.5 mL的5%三氯乙酸,于80℃水浴25 min,冰水冷却后以5%三氯乙酸为对照,在260 nm下测定吸光度。根据吸光度与显微镜计数建立的标准曲线计算菌体浓度,每隔1 d测定菌体浓度绘制生长曲线。
1.2.3.2 浸出体系中游离菌体浓度及矿渣吸附菌体浓度测定取浸出液离心(367×g,2 min)除去矿渣颗粒,核酸法测定游离菌体浓度。收集1 mL浸出混合液于离心管中,离心收集矿渣,加1 mL无菌水后在旋涡振荡器上振荡2 min,3次,将附着于矿渣表面的菌振荡到体系中,离心去除矿渣后测定上清液中菌体浓度来推算矿渣吸附菌体浓度。
1.2.3.3 浸出过程中pH测定通过pH计测浸出液中的pH值变化。浸出过程中每2 d测定1次pH变化。
1.2.3.4 浸出过程中硫酸根浓度测定将浸出液稀释至合适浓度,经过0.45 μm滤膜过滤后通过离子色谱法测定硫酸根浓度。色谱条件:色谱柱为Dionex Inopac AS11-HC阴离子分析柱(250 mm×4 mm),检测器为电导检测器,淋洗液为20 mmol/L KOH溶液,淋洗液流量1 mL/min,进样体积10 μL,出峰时间在4.87 min。
1.2.3.5 矿渣SEM观察离心(365×g,2 min)收集浸出结束后矿渣,烘干后取少量制样于电镀膜并在铜板上固定,在扫描电子显微镜下观察矿渣形貌。
1.2.3.6 矿渣FITR分析将矿渣样品与KBr按1:100的比例在玛瑙研钵反复研磨混匀,保持环境干燥,通过油压器压片后,用傅里叶变换红外光谱仪测定红外吸附光谱。
1.2.3.7 矿渣XRD分析取适量矿渣研磨后填平于检测盘中心凹陷处,将检测盘放置于检测夹上,用X射线衍射仪在2-Theta(°)下进行扫描。检测图谱通过软件MDI Jade 5.0结合PDF卡片库进行分析。
1.2.3.8 矿渣硝化处理及铜离子含量测定取0.1 g矿渣置于250 mL烧杯中,用少量超纯水润湿,加入15 mL浓HCL加热3 min。随后加入5 mL浓HNO3,加热至大部分水分蒸干,冷却后用超纯水吹洗杯壁,再次加热至蒸干。最后加入4 mL 6 mol/L HCL和25 mL超纯水,加热溶解可溶性盐类后过滤定容到100 mL容量瓶中。将硝化液稀释至合适浓度,在原子吸收光谱仪上测定铜离子浓度并换算矿渣中含铜量。
2 结果 2.1 菌株铜耐受性定向驯化及驯化菌株生长性能分析以A. caldus为出发菌株,经过6个多月的适应性铜耐受定向驯化,初步获得了具有较强耐受铜胁迫压力的驯化菌株A. caldus CCTCC M 2018727。在0、1及3 g/L Cu2+下出发菌株与驯化菌株生长情况,如图 1所示,在1 g/L Cu2+胁迫下,出发菌株最高菌体量由对照体系1.68×108 cells/mL急剧下降到0.79×108 cells/mL,比对照组推迟4 d在第10天达到μmax。在3 g/L Cu2+胁迫下出发菌株菌体量进一步下降,生长更加缓慢。而驯化后菌株在1 g/L Cu2+胁迫下生长受到轻微抑制,菌体量保持在1.85×108 cells/mL水平,在第6天达到μmax。在3 g/L Cu2+胁迫下驯化菌株生长受到较大抑制,菌体量降低到1.34×108 cells/mL并在第10天达到μmax。
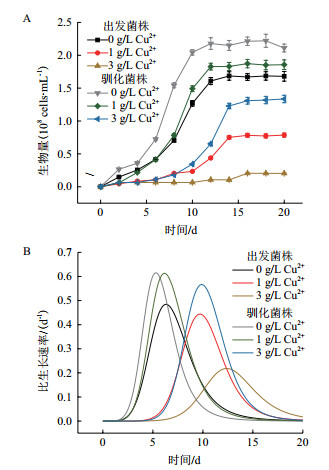
|
| A:出发与驯化菌株生物量变化;B:出发与驯化菌种比生长速率变化 图 1 不同铜胁迫培养下主要生化参数 |
贫黄铜矿生物浸出体系中pH及SO42-浓度变化如图 2所示。浸出前2 d各体系pH水平急剧上升,在3 g/L Cu2+浸出体系下驯化菌株pH值由2.0提高到2.96,出发菌株pH值由2.0上升到2.42。随着浸出进行,在浸出中后期各体系pH均下降到2.0左右。浸出过程中SO42-浓度变化如图 2-B所示,在相同胁迫条件下,驯化菌株体系中SO42-浓度均高于出发菌株。由于不同胁迫条件下加入CuSO4含量不同,SO42-初始浓度存在差异。随浸出进行,体系中SO42-浓度不断上升,表明矿物内还原性硫化物不断被利用。在相同胁迫条件下浸出过程中,驯化菌株浸出体系SO42-浓度高于出发菌株。在3 g/L Cu2+浸出体系中,驯化菌株浸出体系中SO42-浓度比浸出开始时提高了4.88 g/L,而出发菌株仅提高了3.21 g/L,说明驯化菌株在浸出环境中对还原性硫化物利用能力更强。

|
| A:浸出体系中pH变化;B:浸出体系中硫酸根浓度变化 图 2 不同浸出体系中主要参数变化 |
分析浸出体系中游离在体系中菌体浓度及吸附在矿物表面菌体浓度变化,如图 3所示。各体系中菌体量变化趋势基本相同,驯化菌株游离菌体浓度高于出发菌株。在0、1及3 g/L Cu2+胁迫体系中,驯化菌株最终游离菌体浓度分别比出发菌株提高18.56%、23.91%及100.01%。随着浸出体系胁迫浓度增高,驯化菌株与出发菌株浸出差异增大,高胁迫浓度下驯化菌株生长更具优势。在3 g/L Cu2+胁迫体系中驯化菌株最高吸附菌体浓度达到2.11×107 cells/mL,比出发菌株提高94.66%。
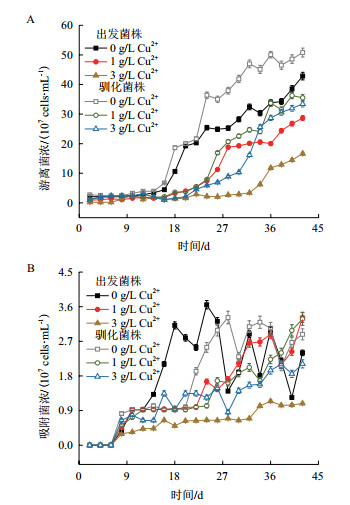
|
| A:浸出体系中游离菌浓变化;B:浸出体系中吸附菌浓变化 图 3 不同浸出体系中生物量变化 |
SEM观察矿渣表面形貌如图 4所示,对照组中矿渣表面腐蚀痕迹明显,较多细微沟壑出现,同时大量硫颗粒及衍生物暴露在表面。驯化菌株作用下矿渣腐蚀程度更高,有更多的硫颗粒暴露。在1-2 g/L Cu2+胁迫体系中菌体生长受到胁迫抑制,矿物表面腐蚀痕迹相对减少,生成黄钾铁矾较多。相比之下,驯化菌株作用痕迹比出发菌株更加明显。在3 g/L Cu2+胁迫体系中,出发菌株体系中矿物表面较为光滑,驯化菌株腐蚀痕迹强于出发菌株,但与此同时矿物表面也有较多黄钾铁矾生成。

|
| A:0 g/L Cu2+出发菌株浸出矿渣;B:0 g/L Cu2+驯化菌株浸出矿渣;C:1 g/L Cu2+出发菌株浸出矿渣;D:1 g/L Cu2+驯化菌株浸出矿渣;E:3 g/L Cu2+出发菌株浸出矿渣;F:3 g/L Cu2+驯化菌株浸出矿渣 图 4 不同浸出体系中矿渣SEM分析 |
FTIR分析矿渣表面官能团如图 5所示。矿渣表面吸收峰主要在750 cm-1、1 000 cm-1、1 100 cm-1、1 650 cm-1、3 400 cm-1处出现。其中在1 650 cm-1和3 400 cm-1处的吸收峰与N-H伸缩振动和弯曲振动相关,在1 100 cm-1处的吸收峰与S=O的伸缩振动相关,在750 cm-1、1 000 cm-1处的吸收峰与SO42-相关。对照组浸出体系中,驯化菌株作用下矿渣表面特征吸收峰比出发菌株体系变得更加尖锐,随着胁迫作用增强,吸收峰强度变弱。在3 g/L Cu2+胁迫条件下,出发菌株体系中1 100 cm-1处的吸收峰消失,而驯化菌株体系中该峰仍保留。
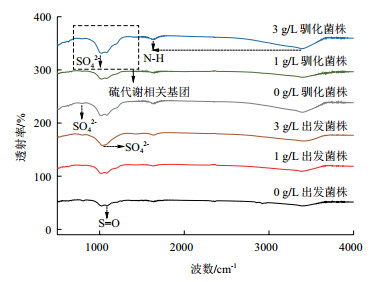
|
| 图 5 不同浸出体系矿渣FTIR分析 |
利用XRD技术分析不同体系矿渣成分差异性。如图 6所示,矿渣表面主要成分包括:FeS2、KFe(SO4)2(OH)6、CuFeS2、Fe3O4、CuO、FeS、CaSO4、Cu2O、FeCO3、(NH4)3Fe(SO4)3、Cu8S5和CaCO3。矿物成分主要为硫、铁和铜化合物,随胁迫浓度增强矿渣中FeS2和CuFeS2两种物质吸收峰增多。各浸出体系矿渣中均含有黄钾铁矾成分,且随胁迫作用增强该物质吸收峰增多。驯化菌株浸出体系中随胁迫浓度提高有(NH4)3Fe(SO4)3生成,该物质也会在矿物表面造成钝化效果不利于浸出。在各体系中还形成了一些中间产物,如Fe3O4、FeS、Cu8S5、CuO和Cu2O等。
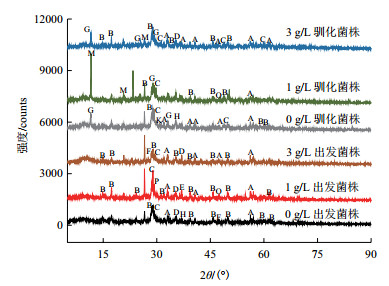
|
| A:FeS2; B:KFe(SO4)2(OH)6; C:CuFeS2; D:Fe3O4; E:CuO; F:FeS; G:CaSO4; H:Cu2O; K:FeCO3; M:(NH4)3Fe(SO4)3; O:Cu8S5; P:CaCO3 图 6 不同浸出体系矿渣XRD分析 |
各体系铜离子浸出率如图 7所示。在0、1及3 g/L Cu2+浸出体系中驯化菌株最终浸出率分别达到43.03%、27.28%及17.99%。在对照体系中,菌体生长未受到胁迫,浸出效果较好,出发菌株浸出率达到37.63%,驯化菌株浸出率达到43.03%,提升幅度不大。在1 g/L Cu2+胁迫体系中,出发菌株浸出率急剧下降到15.96%;驯化菌株浸出率为27.28%,下降幅度较小。在3 g/L Cu2+胁迫体系中,高铜浓度下菌体生长受到抑制,出发菌株铜耐受力弱,因此浸出率极低。而驯化菌株对铜耐受力增强,在3 g/L Cu2+胁迫体系中仍可保留较强生物活性,菌体作用于矿物从中获取能源物质同时促进矿物溶解,浸出率仍可达到17.99%。随胁迫作用增强,驯化菌株浸出率较出发菌株提升更加明显,说明了驯化菌株在恶劣环境中浸出优势更强。
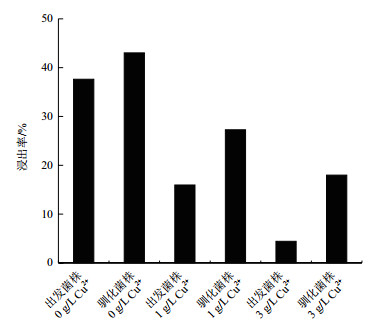
|
| 图 7 不同浸出体系铜浸出率 |
微量铜可作为体内各种酶的辅助因子,对于生物体必不可少,但过量的铜离子会使得细胞中产生大量活性氧自由基与细胞内大分子相互作用,导致细胞损伤从而影响细胞活力[6, 13]。铜离子对于浸出菌株影响较大,浸出菌株的铜抗性性能尤为重要[14]。对A. caldus进行6个多月的适应性铜耐受定向驯化,获得驯化菌株A. caldus CCTCC M 2018727。在0、1及3 g/L Cu2+纯培养体系中比较出发与驯化菌株生长差异,随胁迫浓度提高两菌株生物量均下降,出发菌株下降急剧而驯化菌株下降幅度较小体现了更稳定的生长性能。驯化菌株μmax提高且出现时间提前,暗示延滞期缩短,展示了良好的铜耐受性能因此被选用于后续的生物浸出实验。
贫黄铜矿生物浸出体系中涉及的主要反应如下所示:
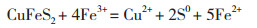 (1)
(1)
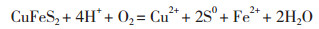 (2)
(2)
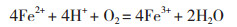 (3)
(3)
 (4)
(4)
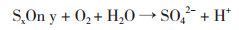 (5)
(5)
反应(1)与(2)表明,体系中的H+与Fe3+可攻击矿石促使矿石溶解释放出铜离子,同时将单质硫释放出来。A. caldus利用矿物中的单质硫获取能量进行生长,同时产生的H+可氧化攻击铜矿使Cu2+释放出来[5, 15-16]。浸出初期菌体浓度低,菌体对矿物中硫化物利用不充分且产酸较少,同时矿物中的较多碱性成分在浸出初期释放出来,因此pH水平急剧上升。高胁迫体系中出发菌株代谢活性低,离子作用不活跃,驯化菌株pH上升水平相对较高。在浸出中后期,各体系pH均下降到2.0左右,此时菌体与离子、矿物之间的作用趋于平衡,矿物中的硫化物渐渐大量释放出来,被菌体利用并产生H+导致pH维持在低水平。
反应(4)与(5)表明菌体利用硫化物获取自身代谢能量并生成H+及硫酸根离子,根据硫酸根浓度的变化可以推测菌体对硫化物的利用效率[17]。在同一胁迫条件下,驯化菌株体系中硫酸根生成浓度均高于出发菌株。在0、1及3 g/L Cu2+浸出体系中,驯化菌株浸出过程中硫酸根生成量比出发菌株分别提高22.02%、37.73%及52.25%。随胁迫增强菌体硫氧化水平变弱,驯化菌株具备更强环境适应力,能更好地利用硫化物促进矿物溶解。
浸出体系中游离菌体与吸附菌体共同发挥作用,吸附菌体在矿物表面进行硫代谢通过质子作用加速矿物溶解,促进矿物中硫化物释放到环境中,为游离菌体提供能源物质,帮助介导体系中直接浸出机制,游离菌体利用硫化物更好的维持酸浸环境。吸附菌体浓度在浸出前期很低,是由于初期暴露在矿渣表面单质硫颗粒较少,随着浸出进行贫黄铜矿不断溶出,吸附菌体越来越多。在各体系中,驯化菌株最终游离菌体浓度分别提高18.56%、23.91%及100.01%。在3 g/L Cu2+体系中驯化菌株最高吸附菌体浓度比出发菌株提高94.66%。驯化菌株在胁迫体系适应性增强,同时与矿物作用更活跃,生物量水平相应提高。
SEM观察矿渣表面形貌,在对照体系中菌株生长未受到胁迫对矿物作用活跃,矿渣表面出现较多细微沟壑,同时大量硫颗粒及衍生物暴露,暗示较强的生物吸附作用[18]。在1 g/L Cu2+胁迫体系中,矿物表面腐蚀痕迹相对减少,生成黄钾铁矾较多,该物质在矿物表面会形成钝化膜不利于菌体吸附作用[19]。相比之下,驯化菌株作用痕迹比出发菌株更加明显。在3 g/L Cu2+胁迫体系中,出发菌株体系中矿物表面较为光滑,说明受到菌体作用少,难以引发有效的“接触”浸出机制[19],驯化菌株作用痕迹强于出发菌株,但矿物表面也有较多黄钾铁矾生成。
研究表明,浸出过程中细胞分泌胞外聚合物(Extracellular polymeric substances,EPS)包裹在矿物表面,促进矿物与菌体间的结合,EPS中主要含有多糖、脂类、蛋白质等[20]。矿渣表面N-H吸收峰的出现与矿物表面附着的EPS相关,暗示菌体在矿物表面聚集吸附,同时分泌EPS帮助更好地吸收环境中营养物质。A. caldus可利用矿物中还原态硫进行代谢获取能量,S=O、SO42-吸收峰的出现与矿物表面硫代谢相关[17-18]。驯化菌株浸出体系中矿物表面更多菌体附着且作用活跃,各吸收峰变得尖锐,随胁迫作用增强吸收峰强度变弱。在3 g/L Cu2+胁迫下,出发菌株体系中S=O吸收峰消失,暗示菌株硫氧化性能受到抑制,不能形成活跃的生化反应。
硫杆菌利用贫黄铜矿中硫化物进行自身代谢,浸出体系中质子相互作用会在矿渣表面形成多种衍生物,利用XRD技术分析矿渣成分差异性。矿物成分主要为硫、铁、铜化合物,其中FeS2、CuFeS2分别是黄铁矿及黄铜矿的主要成分,随胁迫浓度增强吸收峰增多。各浸出体系矿渣成分中均有黄钾铁矾成分,该物质会在矿物表面形成钝化膜难以除去,不利于菌体吸附作用于矿物从而影响浸出效率[19]。铜胁迫下菌体代谢活性降低,还原性硫化物利用率低从而难以在矿物表面进行有效的离子循环。驯化菌株在浸出体系中适应性增强、硫代谢更加活跃,有效促进了离子循环使得矿物中有更多衍生物生成,但随胁迫浓度提高有(NH4)3Fe(SO4)3生成,该物质也会在矿物表面造成钝化效果不利于浸出。在各体系中一些中间产物如Fe3O4、FeS、Cu8S5、CuO和Cu2O的形成,暗示菌体在矿物表面进行复杂的铁硫代谢促进铜浸出。
在对照体系中,驯化菌株浸出率提升幅度不大。在1 g/L Cu2+胁迫体系中,驯化菌株浸出率比出发菌株提高70.93%,出发菌株受到胁迫影响浸出率下降明显。在3 g/L Cu2+胁迫体系中,出发菌株生长受到严重抑制,严重影响到浸出效果因此浸出率极低,驯化菌株在该条件下浸出率提高306.09%,体现出较强浸出优势。
综上,通过适应性铜抗性定向驯化使得A. caldus铜抗性增强,在高铜胁迫环境中体现出更强适应力,浸出优势显著,有望为类似的工业浸出研究提供参考。在后续研究中,可对菌株铜耐受机制进行分析,帮助提高菌株铜抗性从而提高浸出效率。
4 结论经6个月Cu2+适应性驯化,获得了具有较强抵御铜胁迫抗性的A. caldus CCTCC M 2018727。从μmax、浸出矿渣形貌差异、关键官能团变化及矿渣组成成分等方面系统揭示其提升浸出效能的机制。相对于出发菌株在3 g/L Cu2+下μmax仅为0.21 d-1,驯化菌株可维持在0.54 d-1水平,μmax出现时间由10 d提前至13 d。SEM观察浸出结束后矿渣表面形貌,驯化菌株体系中更多单质硫暴露在矿物表面,腐蚀痕迹更明显,表面菌体对矿物表面更强的作用。FTIR分析表明驯化菌株体系中N-H、S=O及SO42-吸收峰更加尖锐,说明矿物表面存在更多A. caldus附着细胞发挥其“直接接触”浸出机制,利用矿物表面的颗粒硫。XRD结果显示伴随胁迫增强时更多黄钾铁矾生成,附着在矿石表面,阻碍浸出,而驯化菌株体系中黄钾铁矾量明显较少。驯化后A. caldus在0、1及3 g/L Cu2+胁迫水平下的浸出率分别为43.03%、27.28%及17.99%,比出发菌株分别提高了14.35%、70.93%及306.09%,体现了显著的铜耐受能力和浸出效能优势。
| [1] |
Panda S, Akcil A, Pradhan N, et al. Current scenario of chalcopyrite bioleaching:a review on the recent advances to its heap-leach technology[J]. Bioresource Technology, 2015, 196: 694-706. DOI:10.1016/j.biortech.2015.08.064 |
| [2] |
Johnson DB. Biomining goes underground[J]. Nature Geoscience, 2015, 8(3): 165-166. DOI:10.1038/ngeo2384 |
| [3] |
Shiers DW, Collinson DM, Watling HR. Life in heaps:a review of microbial responses to variable acidity in sulfide mineral bioleaching heaps for metal extraction[J]. Research in Microbiology, 2016, 167(7): 576-586. DOI:10.1016/j.resmic.2016.05.007 |
| [4] |
聂毅磊, 陈宏, 罗立津, 等. 一种浸矿混合菌种的筛选、鉴定及浸矿的研究[J]. 生物技术通报, 2016, 32(8): 177-183. |
| [5] |
Feng S, Yang H, Yu X, et al. A novel and highly efficient system for chalcopyrite bioleaching by mixed strains of Acidithiobacillus[J]. Bioresource Technology, 2013, 129: 456-462. DOI:10.1016/j.biortech.2012.11.110 |
| [6] |
Martínez-Bussenius C, Navarro CA, Jerez CA. Microbial copper resistance:importance in biohydrometallurgy[J]. Microbial Biotechnology, 2017, 10(2): 279-295. DOI:10.1111/1751-7915.12450 |
| [7] |
Xia LX, Yin C, Cai LY, et al. Metabolic changes of Acidithiobacillus caldus under Cu2+ stress[J]. Journal of Basic Microbiology, 2011, 50(6): 591-598. |
| [8] |
赵雪淞, 王冬旭, 刘鑫, 等. 金属离子对中等嗜热混合菌活性的影响[J]. 生物技术通报, 2017, 33(12): 151-155. |
| [9] |
Mangold S, Vald SJ, Holmes DS, et al. Sulfur metabolism in the extreme acidophile Acidithiobacillus caldus[J]. Frontiers in Microbiology, 2011, 2(1): 17. |
| [10] |
Zhang X, Liu XD, He Q, et al. Gene turnover contributes to the evolutionary adaptation of Acidithiobacillus caldus:Insights from comparative genomics[J]. Frontiers in Microbiology, 2016, 7: 1960. |
| [11] |
Wang YG, Zeng WM, Qiu GZ, et al. A moderately thermophilic mixed microbial culture for bioleaching of chalcopyrite concentrate at high pulp density[J]. Applied & Environmental Microbiology, 2014, 80(2): 741-750. |
| [12] |
Watkin ELJ, Keeling SE, Perrot FA, et al. Metals tolerance in moderately thermophilic isolates from a spent copper sulfide heap, closely related to Acidithiobacillus caldus, Acidimicrobium ferrooxidans and Sulfobacillus thermosulfidooxidans[J]. Journal of Industrial Microbiology & Biotechnology, 2009, 36(3): 461-465. |
| [13] |
Qi H, Wu XL, Jiang Y, et al. Differential gene expression and bioinformatics analysis of copper resistance gene afe-1073 in Acidithiobacillus ferrooxidans[J]. Biological Trace Element Research, 2013, 152(1): 91-97. DOI:10.1007/s12011-012-9589-0 |
| [14] |
Oetiker N, Norambuena R, Martínez-Bussenius C, et al. Possible role of envelope components in the extreme copper resistance of the biomining Acidithiobacillus ferrooxidans[J]. Genes, 2018, 9(7): 347. DOI:10.3390/genes9070347 |
| [15] |
Yang HY, Liu W, Chen GB, et al. Function of microorganism and reaction pathway for carrollite dissolution during bioleaching[J]. Transactions of Nonferrous Metals Society of China, 2015, 25(8): 2718-2724. DOI:10.1016/S1003-6326(15)63896-1 |
| [16] |
Johnson DB. Biomining-biotechnologies for extracting and recovering metals from ores and waste materials[J]. Current Opinion in Biotechnology, 2014, 30: 24-31. DOI:10.1016/j.copbio.2014.04.008 |
| [17] |
张宪.嗜酸氧化硫硫杆菌的全基因组测序及硫氧化途径研究[D].长沙: 中南大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10533-1014408541.htm
|
| [18] |
Ye M, Yan P, Sun S, et al. Bioleaching combined brine leaching of heavy metals from lead-zinc mine tailings:Transformations during the leaching process[J]. Chemosphere, 2016, 168: 1115-1125. |
| [19] |
Zeng WM, Zhou HB, Liu XD, et al. Preservation of moderately thermophilic culture by freeze drying and frozen preservation way and effect on subsequent bioleaching of chalcopyrite[J]. Transactions of Nonferrous Metals Society of China, 2010, 20(5): 882-887. DOI:10.1016/S1003-6326(09)60230-2 |
| [20] |
Zeng W, Qiu G, Zhou H, et al. Characterization of extracellular polymeric substances extracted during the bioleaching of chalcopyrite concentrate[J]. Hydrometallurgy, 2010, 96(3): 177-180. |




