目前我国马铃薯的种植面积和总产量位居世界首位[1],随着种植面积的不断增加,马铃薯连作现象越来越普遍,导致土传病害呈逐年加重趋势[2-3]。马铃薯黑痣病是典型的土传病害,由立枯丝核菌(Rhizoctonia solani Kühn)引起,主要为害马铃薯的根茎部和薯块,对马铃薯产量和外观品质具有重要影响,已成为影响马铃薯生产的主要病害之一。目前,化学农药可以在一定程度上对黑痣病进行预防,但是在实际生产中存在用药量大,效果不佳等问题[4]。因此,马铃薯黑痣病的安全有效的防治是目前生产上急需解决的问题。
芽胞杆菌Bacillus spp.是植物和土壤环境微生态区系的优势种群,其可以产生脂肽类[5]、抗菌蛋白[6]等多种抗菌物质,并且能够产生抗逆性很强的内生芽胞,可作为防治多种病害的生防菌[7],是未来土传病害防治的重要研究方向。鉴定生防菌的种类和对生防芽胞杆菌的生防相关因子进行多方面研究对生防菌的应用有重要的指导作用,其中与芽胞杆菌抑菌作用相关的物质主要是抗菌脂肽、抗生素和水解酶类等[8]。李全胜等[9]报道莫哈韦芽胞杆菌B. mojavensis能够合成蛋白酶并含有srfAA、fenD、bacA脂肽类抗生素合成基因,具有良好的抑菌防病能力;王俊丽等[10]研究发现解淀粉芽胞杆菌B. amyloliquefaciens等够产生嗜铁素、蛋白酶、纤维素酶和吲哚乙酸(IAA),发酵原液在离体情况下对番茄灰霉病的防效为100%;刘洋等[11]发现内生芽胞杆菌1A可以通过分泌蛋白酶和纤维素酶降解真菌细胞壁,使菌丝扭曲、断裂,分支增多并缠绕,菌丝颜色加深等,对孢子萌发抑制率达74.89%。但是生防芽胞杆菌的研究中与马铃薯黑痣病相关的报道较少,增加关于马铃薯黑痣病的生防芽胞杆菌的筛选和生防机理的研究是必要的。
为筛选对马铃薯黑痣病菌有抑制作用的生防菌,本研究从张北地区多年连作的马铃薯黑痣病田中采集土样,从中筛选对马铃薯黑痣病菌有抑制作用的生防菌株,并对效果较好的生防菌株进一步进行鉴定并测定其抑菌谱和分泌的生防相关物质,以期丰富马铃薯黑痣病生防资源,为马铃薯黑痣病的生物防治提供理论指导。
1 材料与方法 1.1 材料 1.1.1 供试土壤采自河北省张北县马铃薯黑痣病发生地块的健康马铃薯植株根际土壤,取得土壤放入无菌袋中编号。
1.1.2 供试病原菌立枯丝核菌(Rhizoctonia solani)ZB4;干腐病菌(Fusarium sambucinum)B-6;早疫病菌(Alternaria solani)NHL17-207;疮痂病菌(Streptomyces scabies)13;枯萎病菌(Fusarium oxysporum)腰站1-1;黑胫病菌(Erwinia carotovora)E8。供试病原菌均由河北农业大学植物保护学院马铃薯晚疫病实验室保存。
1.1.3 培养基LB培养基:酵母膏5 g/L,蛋白胨10 g/L,NaCl 10 g/L,琼脂20 g/L。
PDA培养基:马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L。
燕麦培养基:燕麦30 g/L,琼脂20 g/L。
生理生化鉴定所需培养基:参照《常见细菌系统鉴定手册》[12]。
解磷培养基:葡萄糖10.0 g/L,NaCl 0.3 g/L,KCl 0.3 g/L,硫酸铵0.5 g/L,硫酸镁0.3 g/L,琼脂20 g/L,MnSO4 0.03 g/L,硫酸亚铁0.03 g/L,磷酸三钙5.0 g/L,pH 7.0。
解钾培养基:蔗糖5 g/L,葡萄糖5 g/L,硫酸铵0.5 g/L,酵母膏0.5 g/L,MgSO4·7H2O 0.3 g/L,Na2HPO4 2 g/L,七水硫酸亚铁0.03 g/L,MnSO4 0.03 g/L,钾长石2 g/L,琼脂18 g/L,pH 7.0。
酪蛋白培养基:葡萄糖10.0 g/L,酵母膏4 g/L,酪蛋白10.0 g/L,KH2PO4 1.0 g/L,MgSO4·7H2O 0.2 g/L,琼脂20 g/L,pH 7.0。
纤维素培养基:K2HPO4 1.0 g/L,硫酸铵2 g/L,MgSO4·7H2O 0.5 g/L,NaCl 0.5 g/L,微晶纤维素2 g/L,琼脂20 g/L。
果胶培养基:蛋白胨20 g/L,酵母膏5 g/L,牛肉膏5 g/L,NaCl 5 g/L,果胶5 g/L,琼脂20 g/L,pH 7.0加饱和乙酸铜溶液染色15 min。
1.2 方法 1.2.1 拮抗细菌的分离与筛选取10 g土样加入装有90 mL无菌水的灭菌锥形瓶中,充分震荡、摇匀,80℃水浴20 min,取1 mL土壤悬浮液用无菌水梯度稀释10-1、10-2、10-3、10-4、10-5倍,分别吸取200 µL梯度稀释液均匀涂布于LB固体培养基上,每个梯度重复3皿,放入37℃恒温培养箱中培养24 h。待平板长出单菌落后,挑取单菌落进行纯化、培养,4℃保存备用。
初筛:以立枯丝核菌ZB4为指示菌,在PDA培养基中央接种直径5 mm的ZB4菌饼,上下左右各2.5 cm处放置5 mm的滤纸片,点接5 µL分离得到的候选拮抗菌菌悬液,以接无菌水为对照,待对照长满平板后,测量抑菌带宽度,挑选抑菌效果较好的进行复筛。
复筛:在PDA培养基中央接种直径5 mm的滤纸片,点接5 µL分离得到的候选拮抗菌菌悬液,上下左右各2.5 cm处放置5 mm的ZB4菌饼,以接无菌水为对照,待对照长满平板后,测量抑菌圈直径。
1.2.2 菌株的鉴定 1.2.2.1 生理生化鉴定菌落形态观察:将Z17-2菌液稀释涂布于LB平板上37℃培养24 h,观察菌落形状、颜色、边缘、表面、隆起形状、透明度。
生理生化鉴定参照《伯杰氏系统分类手册》[13]和《常见细菌系统分类手册》[12]进行。
1.2.2.2 分子生物学鉴定使用全式金细菌基因组提取试剂盒提取Z17-2基因组DNA。采用通用引物27F、1492R扩增16S rDNA,采用简并引物gyrB-F、gyrB-R[14]扩增gyrB基因(引物序列见表 1)。PCR产物经1%凝胶电泳检测,并送上海生工生物工程有限公司测序。应用BLAST软件将所得序列与GeneBank数据库中核酸序列进行比对分析,下载同源性高的序列用MEGA6.06软件邻接法(Neighbour-Joining)构建系统发育树。
用接种环挑取一环保存的生防菌Z17-2菌液在LB平板上划线活化,挑取一环单菌落到装LB培养基(100/250 mL)的三角瓶中,37℃,200 r/min培养24 h备用。
抑制病原真菌测定:采用抑菌圈法对Z17-1的抑菌能力进行测定。在培养基平皿中央放置直径6 mm的滤纸片,四周2.5 cm处放直径6 mm的病原菌菌饼。取发酵液5 μL点在滤纸片中央,以无菌水为对照,适宜温度培养至对照长满全皿,十字交叉法测定抑菌圈大小。
抑制病原细菌测定:将病原细菌制成菌悬液进行涂板,在培养皿中央放置一滤纸片,取发酵结束发酵液5 μL点在滤纸片中央,适宜温度培养至对照长满全皿,十字交叉法测定抑菌圈大小。
1.2.4 生防菌Z17-2生防因子分析 1.2.4.1 菌株Z17-2发酵液表面活性物质的检测应用改进排油圈方法[15]检测生防菌Z17-2发酵液是否有表面活性功能的脂肽类产物生成。
1.2.4.2 产脂肽基因的检测参考邓建良[16]、王超男[17]的文献合成sfp、ituA、fenB、bacD、mycB等5个目的基因的引物(引物序列见表 1),生防菌Z17-2的基因组DNA为模板进行PCR扩增。25 μL PCR反应体系为:2×Taq Master Mix 12.5 μL、10 μmol/L引物各1 μL、模板DNA 1 μL、ddH2O 9.5 μL。扩增sfp、ituA基因的PCR程序为:94℃预变性4 min;94℃变性1 min、43℃退火1 min、72℃延伸1 min,共30个循环;72℃延伸10 min。扩增fenB基因的PCR程序为:94℃预变性4 min;94℃变性1 min、50℃退火1 min、72℃延伸1 min,共30个循环;72℃延伸10 min。扩增bacD基因的PCR程序为:94℃预变性4 min;94℃变性1 min、54℃退火1 min、72℃延伸1 min,共30个循环;72℃延伸10 min。扩增mycB基因的PCR程序为:94℃预变性4 min;94℃变性1 min、53℃退火1 min、72℃延伸1.5min,共30个循环;72℃延伸10 min。PCR产物经过1%琼脂糖凝胶电泳检测。
1.2.4.3 脂肽粗提物抑菌活性测定采用大孔树脂法[18]进行生防菌Z17-2发酵液中脂肽物质的提取,以立枯丝核菌为指示菌,采用带毒培养基法检测脂肽类物质的抑菌作用,具体方法为:将脂肽粗提物按照1%的体积分数加入到融化的PDA培养基中,制成带毒培养基,以空白PDA为对照,在培养皿中央接种直径为6 mm的立枯丝核菌菌饼,25℃恒温培养3 d后计算抑菌率,重复3次。抑菌率计算公式如下:
抑菌率(%)=[对照菌落直径(mm)-处理菌落直径(mm)]/对照菌落扩展直径(mm)×100%
1.2.4.4 体外产酶及解磷解钾能力测定将生防菌Z17-2分别点接到酪蛋白培养基、纤维素培养基、果胶培养基、磷培养基、钾培养基上,37℃培养48 h,观察是否有透明圈产生,若有则证明具有相应的分解酶产生。
1.2.4.5 产铁载体能力测定取菌株Z17-2发酵上清液0.5 mL加入0.5 mLCAS显色液,室温静置2 h,以空白培养基做对照,实验设置3个重复。若颜色变化为黄色,则证明生防菌Z17-2具有产铁载体的能力。
2 结果 2.1 拮抗细菌分离筛选从11份健康马铃薯植株根际土中共筛选得到对黑痣病菌有抑制作用的拮抗菌109株,经初筛和复筛得到抑菌效果稳定的拮抗菌株共9株,命名为Z17-1-Z17-9,其中菌株Z17-2对马铃薯立枯丝核菌抑制效果稳定,抑菌圈直径大于29 mm。
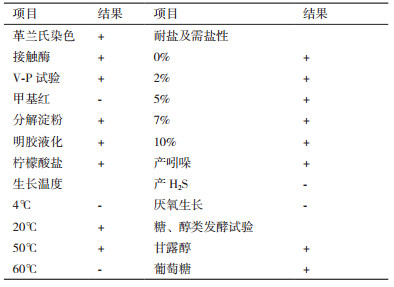
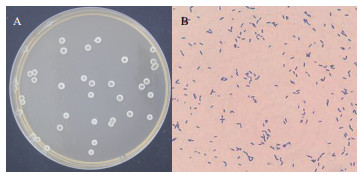
2.2 菌株鉴定 2.2.1 形态及生理生化特征菌株Z17-2在LB平板上培养24 h时,形成近圆形具有乳白色菌膜的菌落,菌落表面有褶皱,四周有凸起中间略凹陷(图 1),革兰氏染色为阳性。
|
| A:LB上的菌落图片;B:革兰氏染色图片(10×100倍) 图 1 Z17-2菌落形态和革兰氏染色 |
菌株Z17-2生理生化测定结果(表 2),接触酶实验、V-P实验阳性,甲基红实验阴性,可以分解淀粉、使明胶液化,可以发酵糖、醇类产酸,能利用柠檬酸盐,可以产生吲哚,不能产生H2S,在20℃-50℃均可生长,低于4℃不能生长,可以在含盐10%的培养基上生长,生理生化特征符合《伯杰氏细菌鉴定手册》和《常见细菌系统鉴定手册》中对于芽胞杆菌属的描述。
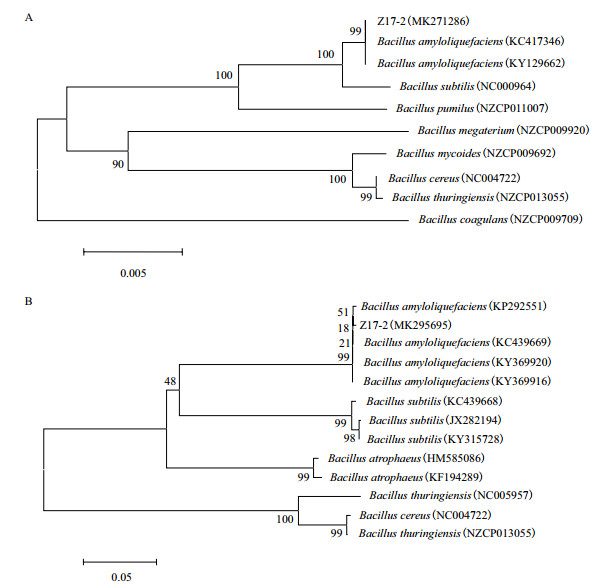
经NCBI Blast分析Z17-2拮抗菌的16S rDNA序列(Gen-bank登录号为MK271286)与解淀粉芽胞杆菌KC417346相似度为100%,gyrB(Gen-bank登录号为MK295695)序列与解淀粉芽胞杆菌KP292551的相似度为99%。利用邻接法(Neighbour-Joining)构建系统发育树结果表明,Z17-2的16S rDNA和gyrB序列均与解淀粉芽胞杆菌聚为一支(图 2)。结合生理生化特征,鉴定菌株Z17-2为解淀粉芽胞杆菌。
|
| A:基于16S rDNA序列构建的系统发育树;B:基于gyrB序列构建的系统发育树 图 2 菌株Z17-2系统发育树 |
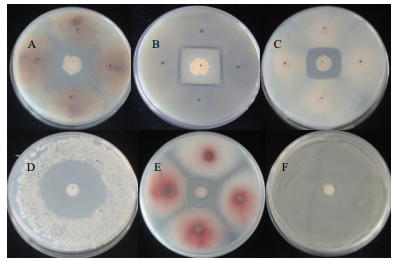
菌株Z17-2对马铃薯上常见病原菌的抑菌结果(表 3,图 3)表明,它不仅对立枯丝核菌有抑制作用,而且对枯萎病菌、干腐病菌、早疫病菌等真菌和疮痂放线菌也具有抑菌作用,对黑胫病菌没有抑制作用。
|
| A-F:R. solani ZB4;F. sambucinum B-6;A. solani NHL17-207;S. scabies 13;F. oxysporum腰站1-1;E. carotovora E8 图 3 生防菌Z17-2抑菌谱 |
通过向油膜中央滴加Z17-2发酵液可以形成明显的排油圈,而滴加LB培养基则不能形成排油圈,结果表明,发酵液具有表面活性剂的作用,说明Z17-2能够产生具有表面活性的脂肽类物质。对5个脂肽类合成基因进行PCR扩增,结果有4对引物分别扩增出相应的目的条带,分别是基因sfp(675 bp)、fenB(1 400 bp)、bacD(540 bp)、mycB(2 024 bp)(图 4),对应的脂肽类物质分别是sufactins、fengycins、Bacillomycin D、mycosubtilin,未扩增到ituA的目的条带。应用大孔树脂法提取的脂肽类物质对马铃薯黑痣病菌进行抑菌试验结果(图 5)表明,其对马铃薯黑痣病菌有很好的抑菌效果,抑菌率达到70.38%。
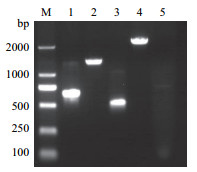
|
| M:DM2000 maker;1:sfp;2:fenB;3:bacD;4:mycB;5:ituA 图 4 生防菌Z17-2脂肽合成基因的PCR产物电泳 |
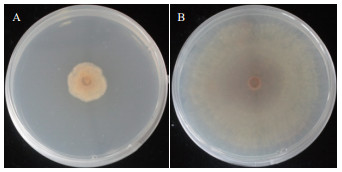
|
| A:脂肽提取物;B:对照 图 5 生防菌Z17-2发酵液脂肽提取物对立枯丝核菌的抑制作用 |
通过底物降解法测定生防菌Z17-2具有分泌蛋白酶、纤维素酶,不具有分泌果胶酶的能力,不具有解磷解钾能力。通过CAS显色法证明生防菌Z17-2具有产生铁载体的能力。
3 讨论菌株鉴定是了解与应用生防菌株的基础,目前常用的鉴定方法是生理生化特征鉴定和基于16S rDNA序列的系统发育分析,崔月贞[19]结合形态学特征和16S rDNA基因序列同源性分析将3株马铃薯晚疫病的拮抗菌262AY11、262AY6和264AY2鉴定为韦氏芽胞杆菌B. weihenstephanensis、解淀粉芽胞杆菌B. amyloliquefaciens和枯草芽胞杆菌B. subtilis。有研究表明16S rDNA序列在枯草芽胞杆菌近缘种相似度太高,除短小芽孢杆菌和索诺拉沙漠芽孢杆菌以外,其余8个种的16S rDNA基因序列相似性均在99.5%以上[20]。所以近几年开发出了很多16S rDNA的替代靶基因,如gyrB、gyrA、rpoB、recA、rctB等[10, 21]。Wang[22]研究发现gyrB基因在枯草群各种、亚种之间相似性在75%-95%之间,相比于16S rDNA基因能更准确地将枯草芽胞杆菌近缘种区分开。
生物活性物质在生防微生物表现生防作用方面有至关重要的作用[6],Cawoy[23]发现sufactin可以刺激植物的免疫反应,提高植物抗病性;Soo-Jin[24]发现枯草芽胞杆菌KS03抑制Gloeosporium gloeosporioides的主要抑菌物质是iturin A2;李丹等[25]研究发现解淀粉芽胞杆菌TR2和CE解磷解钾能力可以促进西瓜幼苗根和茎的生长。解淀粉芽胞杆菌是极具潜力的生防菌,能够产生多种抑菌物质,其中脂肽类是其产生的一种重要的抑菌活性物质,主要包括sufactins、fengycins、iturin三个家族[5]。近年来,对脂肽合成基因有比较深入的研究,可以利用PCR扩增的方法快速检测生防菌中是否具有脂肽类合成的基因,如卢彩鸽等[26]通过PCR扩增检测到解淀粉芽胞杆菌MH71中含有fenB、mycB、ituA、sfp等脂肽类抗生素合成酶基因;王亚杰等[27]研究发现解淀粉芽胞杆菌fqhm-13含有脂肽抗生素合成基因ituC、ituD、fenD和srfAB,本研究筛选到的生防解淀粉芽胞杆菌Z17-2中检测到了sfp、fenB、bacD、mycB等脂肽合成基因,这说明生防菌Z17-2可能通过多种抗生素的共同作用发挥其生防效果。
本研究采用便捷、高效的指示菌法筛选到一株高效生防菌Z17-2,结合形态及生理生化特征、16S rDNA和gyrB序列分析,将菌株Z17-2鉴定为解淀粉芽胞杆菌B. amyloliquefaciens,其对马铃薯黑痣病的抑菌圈直径大于2.9 cm,抑菌效果优于关小敏等[28]筛选的类芽胞杆菌G1和朱明明等[29]筛选的贝莱斯芽胞杆菌HN-Q-8,且对5种常见马铃薯病原菌具有抑制作用。通过关键基因扩增和底物降解法测定产生防因子能力,结果表明解淀粉芽孢杆菌Z17-2能够合成表面活性素、丰原素和伊枯草素,能够分泌嗜铁素、蛋白酶和纤维素酶表明解淀粉芽胞杆菌Z17-2通过多种作用方式表现其生防功能,是1株很有应用潜力的生防菌株。本研究结果为该生防菌株的开发应用提供了很好的理论基础。
4 结论本试验共筛选出对立枯丝核菌有抑制效果的拮抗菌109株,其中菌株Z17-2对早疫病菌、枯萎病菌、干腐病菌、疮痂病菌菌也有明显抑制作用。综合形态学、生理生化特征及16S rDNA和gyrB序列分析,将其鉴定为解淀粉芽胞杆菌,经过测定发现其可以产生脂肽类、蛋白酶、纤维素酶、铁载体等生防相关物质。
| [1] |
杨帅, 闵凡祥, 高云飞, 等. 新世纪中国马铃薯产业发展现状及存在问题[J]. 中国马铃薯, 2014, 28(5): 311-316. DOI:10.3969/j.issn.1672-3635.2014.05.012 |
| [2] |
黄冲, 刘万才. 近年我国马铃薯病虫害发生特点与监控对策[J]. 中国植保导刊, 2016, 36(6): 48-52. DOI:10.3969/j.issn.1672-6820.2016.06.011 |
| [3] |
谢奎忠, 陆立银, 罗爱花, 等. 长期连作对马铃薯土传病害和产量的影响[J]. 中国种业, 2018(2): 65-67. DOI:10.3969/j.issn.1671-895X.2018.02.021 |
| [4] |
王晓娇, 曹春梅, 逯春杏, 等. 内蒙古自治区马铃薯黑痣病病原菌(菌核)存活力及地下侵染研究[J]. 中国马铃薯, 2018, 32(2): 101-107. DOI:10.3969/j.issn.1672-3635.2018.02.008 |
| [5] |
Ongena M, Jacques P. Bacillus lipopeptides:versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125. DOI:10.1016/j.tim.2007.12.009 |
| [6] |
马佳, 李颖, 胡栋, 等. 芽胞杆菌生物防治作用机理与应用研究进展[J]. 中国生物防治学报, 2018, 34(4): 639-648. |
| [7] |
陈志谊. 芽孢杆菌类生物杀菌剂的研发与应用[J]. 中国生物防治学报, 2015, 31(5): 723-732. |
| [8] |
李红晓, 张殿朋, 卢彩鸽, 等. 生防解淀粉芽胞杆菌(Bacillus amyloliquefaciens)最新研究进展[J]. 微生物学杂志, 2016, 36(2): 87-92. DOI:10.3969/j.issn.1005-7021.2016.02.015 |
| [9] |
李全胜, 谢宗铭, 刘政, 等. 棉花黄萎病拮抗细菌H14的筛选鉴定及其拮抗机理分析[J]. 植物保护学报, 2018, 45(6): 1204-1211. |
| [10] |
王俊丽, 卢彩鸽, 刘伟成, 等. 一株芽胞杆菌QD-10的鉴定及生防特性分析[J]. 中国生物防治学报, 2014, 30(4): 564-572. |
| [11] |
刘洋, 朱天辉, 郑磊, 等. 一株内生拮抗细菌的分离鉴定及其抗菌机理研究[J]. 植物保护, 2016, 42(1): 33-39. DOI:10.3969/j.issn.0529-1542.2016.01.006 |
| [12] |
蔡妙英, 东秀珠. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [13] |
布坎南.伯杰. 细菌鉴定手册[M]. 北京: 科学出版社, 1984.
|
| [14] |
王爱军, 柴兆祥, 李金花, 等. 马铃薯干腐病菌和黑痣病菌拮抗芽胞杆菌的筛选及鉴定[J]. 中国生物防治学报, 2013, 29(4): 586-594. |
| [15] |
魏新燕, 黄媛媛, 黄亚丽, 等. 拮抗灰霉菌的海洋细菌甲基营养型芽胞杆菌的筛选、鉴定及其抑菌活性物质的研究[J]. 中国生物防治学报, 2017, 33(5): 667-674. |
| [16] |
邓建良.解淀粉芽孢杆菌YN-1抑制植物病原真菌活性物质研究[D].武汉: 华中农业大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10504-2010010103.htm
|
| [17] |
王超男.拮抗细菌的筛选鉴定及其环脂肽合成相关基因检测[D].北京: 北京农学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10020-1016141288.htm
|
| [18] |
冯大兴. 抗菌脂肽分离纯化的研究[J]. 现代畜牧兽医, 2015(11): 9-16. DOI:10.3969/j.issn.1672-9692.2015.11.003 |
| [19] |
崔月贞, 杨小利, 杨成德, 等. 拮抗马铃薯晚疫病菌的高寒草地牧草内生细菌的鉴定及其生物功能测定[J]. 植物保护学报, 2016, 43(5): 789-795. |
| [20] |
曹凤明, 杨小红, 马鸣超, 等. 枯草芽孢杆菌近缘种群鉴定方法研究进展[J]. 微生物学通报, 2014, 41(5): 968-974. |
| [21] |
Javier P, M Carmen M, Arahal DR, et al. Multilocus sequence analysis of the central clade of the genus Vibrio by using the 16S rRNA, recA, pyrH, rpoD, gyrB, rctB and toxR genes[J]. International Journal of Systematic & Evolutionary Microbiology, 2010, 60(Pt 1): 154. |
| [22] |
Wang LT, Lee FL, Tai CJ, et al. Reclassification of Bacillus axarquiensis Ruiz-Garcia et al. 2005 and Bacillus malacitensis Ruiz-Garcia et al. 2005 as later heterotypic synonyms of Bacillus mojavensis Roberts et al. 1994[J]. International Journal of Systematic & Evolutionary Microbiology, 2007, 57(7): 1663-1667. |
| [23] |
Cawoy H, Mariutto M, Henry G, et al. Plant defense stimulation by natural isolates of bacillus depends on efficient surfactin production[J]. Molecular plant-microbe interactions, 2014, 27(2): 87-100. DOI:10.1094/MPMI-09-13-0262-R |
| [24] |
Soo-Jin C, Sam Keun L, Byeong Jin C, et al. Detection and characterization of the Gloeosporium gloeosporioides growth inhibitory compound iturin A from Bacillus subtilis strain KS03[J]. FEMS Microbiology Letters, 2010, 223(1): 47-51. |
| [25] |
李丹, 李茸梅, 秦伟英, 等. 两株解淀粉芽胞杆菌对西瓜枯萎病的防治作用及其相关生防因子检测[J]. 中国生物防治学报, 2018, 34(5): 729-737. |
| [26] |
卢彩鸽, 张殿朋, 刘霆, 等. 解淀粉芽胞杆菌MH71的生防活性及脂肽类抗生素基因检测[J]. 植物保护, 2015, 41(3): 12-18. DOI:10.3969/j.issn.0529-1542.2015.03.003 |
| [27] |
王亚杰, 高宇, 陈晓萌, 等. 解淀粉芽胞杆菌防治番茄果实灰霉病及其抑菌物质分析[J]. 园艺学报, 2018, 45(7): 1296-1304. |
| [28] |
关小敏, 孟品品, 刘星, 等. 马铃薯黑痣病生防菌的筛选和鉴定及其生长条件的研究[J]. 干旱地区农业研究, 2015, 33(3): 90-95. |
| [29] |
朱明明, 张岱, 赵冬梅, 等. 马铃薯黑痣病生防芽孢杆菌的筛选与鉴定[J]. 江苏农业科学, 2018, 46(14): 97-101. |