植物性纤维素和半纤维素是地球上最丰富的可再生资源,其年产量分别可达720和600亿t[1],我国每年的纤维素废弃物亦达20亿t[2]。如何实现纤维素的高效生物转化是最充分利用纤维素资源的关键[3]。在低温环境中,中高温菌株的纤维素降解活性会大大降低,而低温菌株的纤维素酶具有特殊的分子适应机制,在连续运转系统中具有高生长速率、高酶活力及高催化效率,而且反应过程在低温下进行,无需加热和冷却,具有比中高温纤维素酶的处理时间短、生产成本低、更加节约能源的优点,使其在低温环境生物质降解上有极大的应用潜力[4-6],因此寻找和开发产高活性低温纤维素酶菌种成为当前研究的热点[7]。
以单一的碳源为底物分离获得的菌株普遍存在菌种较单一且纤维素降解率较低等特点,而且多数不能产生全组分的纤维素酶,往往需要多种微生物共同协作完成,因此,复合菌系的作用日显突出[8-9]。针对地区气候、基于多种碳源为底物进行分离培养,可得到产不同组分的纤维素酶,并且以酶活较高的菌株构建复合系,有望获得适应地区气候的、纤维素降解效率较高的菌株或复合系。但现有研究主要针对中高温纤维素降解菌群,而对低温纤维素降解菌系的研究相对较少,已分离到的产低温纤维素酶的微生物种类也有限[10-12]。
由于内蒙古地区秋冬季气温低,周期长,中高温菌及其酶的应用受到了较大限制,因此,加强低温纤维素降解菌及其酶的研究对于低温地区纤维素等生物质资源的降解应用具有重要意义[13-14]。本文分别以微晶纤维素、羧甲基纤维素和D-水杨苷3种碳源筛选具有外切葡聚糖酶酶活性、内切葡聚糖酶酶活性和β-葡萄糖苷酶酶活性的菌株并构建高效低温纤维素降解复合系,分析研究低温地区土壤纤维素降解菌的群落结构,认识和挖掘该地区低温纤维素降解菌资源,筛选高效的低温纤维素降解菌群,将为开发低温降解纤维素复合菌剂奠定基础。
1 材料与方法 1.1 材料 1.1.1 试验样品样品为采集自内蒙古自治区呼伦贝尔森林的带腐烂落叶的表层土壤,放冰盒运回实验室,4℃冰箱保存备用。
1.1.2 培养基及试剂配方(1)富集培养基:纤维素(秸秆末、滤纸浆)5 g,蛋白胨5 g,碳酸钙2 g,氯化钠5 g,磷酸氢二钾0.5 g,硫酸镁0.5 g,蒸馏水1 000 mL,pH自然。
(2)筛选培养基:羧甲基纤维素钠/微晶纤维素/D-水杨苷5 g,酵母粉2 g,磷酸二氢钾0.5 g,硫酸镁0.5 g,琼脂20 g,蒸馏水1 000 mL,pH自然。
(3)鉴别培养基:硫酸铵2 g,硫酸镁0.5 g,磷酸氢二钾1 g,氯化钠0.5 g,羧甲基纤维素钠/微晶纤维素/D-水杨苷2 g,刚果红0.4 g,琼脂22 g,蒸馏水1 000 mL。
(4)滤纸培养基:滤纸条(每条:1 cm×3.6 cm,约0.03 g)5 g,酵母粉2 g,磷酸二氢钾0.5 g,硫酸镁0.5 g,蒸馏水1 000 mL,pH自然。
(5)1% CMC-Na/微晶纤维素/D-水杨苷溶液:10 g CMC-Na/微晶纤维素/D-水杨苷溶解于柠檬酸缓冲液(pH 4.8,0.2 mol/L)并定容至1 000 mL。
(6)10×TE缓冲液:100 mmol/L Tris-HCl,10 mmol/L EDTA,pH 8。高温灭菌,室温保存,用时稀释为1×TE。
1.2 方法 1.2.1 土样富集培养将采回的土样充分混合均匀,取适当样品于烧杯中,加入富集培养基,充分混匀,置于4℃培养箱中进行富集,15 d后,转接新鲜培养基富集培养,转接3次后,用于分离和筛选纤维素降解菌。
1.2.2 菌株筛选取10 mL富集好的样品溶液加入含90 mL无菌水的三角瓶中,置于120 r/min摇床中4℃振荡1 h,充分混匀,然后将菌悬液稀释成10-2、10-3、10-4 3个浓度梯度,每个梯度3个重复,涂布到3种含不同碳源的固体培养基上,4℃培养1-2周。挑取不同形态、颜色的菌落进行划线纯化,获得纯培养物。挑取可降解不同纤维素的菌株,接种到对应的碳源-刚果红鉴别培养基上,4℃培养,进一步筛选,观察菌株生长状况。根据水解圈的大小筛选纤维素酶活性高的菌株。
1.2.3 菌株的鉴定及其系统发育分析参考胡晓红等[15]的方法进行细菌DNA的提取。选用细菌通用引物对27F和1492R进行PCR扩增。用琼脂糖凝胶DNA回收试剂盒(上海捷锐生物工程有限公司)将PCR扩增产物进行纯化。采用北京全式金生物技术有限公司的pEASY-T1 Cloning Kit将目的片段与载体连接,并将其连接产物转入到大肠杆菌感受态细胞中。用M13引物对阳性克隆子进行菌落PCR扩增检测,由上海生物工程有限公司进行测序。将测序结果中的载体序列删除,然后选取峰图整齐的序列利用EzTaxon数据库对各个核酸序列进行比对及相似性分析。
1.2.4 酶活性测定以150 μL 1%(W/V)的微晶纤维素/CMC-Na /D-水杨苷缓冲液、醋酸缓冲液(含0.0015 g滤纸)分别作为反应底物,加入50 μL粗酶液,于50℃恒温水浴锅中反应30 min,然后加入200 μL DNS终止反应,并将混合物在沸水浴中煮5 min,待反应混合物冷却,加入650 μL蒸馏水,混匀,取出200 μL加至96孔酶标板上,用酶标仪测定540 nm下的吸光值(OD540)。分别测定外切葡聚糖酶酶活、内切葡聚糖纤维二糖水解酶酶活、β-葡萄糖苷酶酶活和总酶活(滤纸酶活)。
酶活力定义:在50℃的反应条件下,1 min内催化底物生成1 μmol葡萄糖所需的酶量为1 U/mL。
1.2.5 低温细菌降解复合系构建从分离纯化得到的经拮抗实验验证的互不拮抗菌株中,对应每种纤维素碳源分别筛选出3株酶活性较高的菌株,共9株,进行复合系构建。
1.2.5.1 单菌株的滤纸酶活性测定把互不拮抗的菌株单独接种到滤纸培养基中,4℃振荡培养,每隔24 h检测一次发酵液的OD540值,测定滤纸酶活。
1.2.5.2 降解复合系的构建及其酶活性测定把互不拮抗的菌株接种到对应碳源的液体培养基中,4℃恒温振荡培养,当OD600均接近时,在3种不同碳源培养基中培养的菌株当中任意选择一株菌组合成复合系。各取1 mL复合系培养液分别接种到50 mL已灭菌的滤纸培养基中,4℃低温培养,每隔24 h测定一次发酵液的滤纸酶活及培养液的pH值。
1.2.5.3 降解复合系的滤纸降解率将烘干至恒重的滤纸加入到降解复合系培养基中,4℃低温培养,培养结束后将培养液于5 400 r/min离心6 min,去除上清液后水洗,于6 000 r/min离心6 min,再用盐酸和硝酸的混合溶液洗除菌体后,用清水洗涤,105℃烘干至恒重,称重,计算失重率,每组3个平行[16]。
2 结果 2.1 低温纤维素降解细菌的分离筛选用3种含不同碳源的鉴别培养基分离筛选土样中低温纤维素降解菌,共得到172株细菌。细菌菌落主要以浅黄色、白色、浅红色、黄色、橘红色为主,多为圆形或近圆形的凸起的菌落,且多数边缘光滑,光泽不透明; 无规则的菌落很少,且只有少数菌落边缘粗糙,扁平的菌落较少。
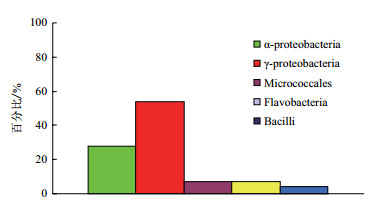
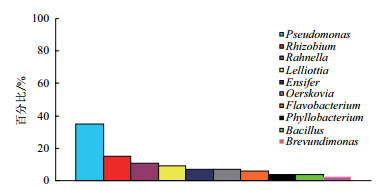
2.2 不同碳源筛选的低温纤维素菌群结构分析将筛选菌株的16S rDNA序列在EzTaxon数据库中进行同源性分析,对低温纤维素降解菌群进行分类。在172株低温纤维素降解细菌中,可以利用微晶纤维素(Avicel)的细菌有46株(图 1-2),在纲分类水平上,25株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占全部菌株的54%,为最优势类群,其次为α-变形菌纲(α-Proteobacteria),占28%;在属分类水平上,有16株属于假单胞菌属(Pseudomonas),占35%,为降解微晶纤维素的最优势菌属,7株属于根瘤菌属(Rhizobium),占15%,为第二优势菌属。
|
| 图 1 以微晶纤维素为碳源筛选的低温细菌群落组成(纲水平) |
|
| 图 2 以微晶纤维素为碳源筛选的低温细菌群落组成(属水平) |
能利用羧甲基纤维素(CMC)的细菌有65株(图 3-4)。在纲分类水平上,17株属于变形菌门中的α-变形菌纲(α-Proteobacteria),占全部菌株的26%;31株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占全部菌株的48%,为最优势类群,其次为α-变形菌纲(α-Proteobacteria),占26%;在属分类水平上,有17株属于假单胞菌属(Pseudomonas),占26%,为降解CMC的最优势菌属,8株属于根瘤菌属(Rhizobium),8株属于厄氏菌属(Oerskovia),分别占12%,为第二优势菌属。

|
| 图 3 以羧甲基纤维素为碳源筛选的低温细菌群落组成(纲水平) |

|
| 图 4 以羧甲基纤维素为碳源筛选的低温细菌群落组成(属水平) |
可以利用D-水杨苷的细菌有61株(图 5-6),在纲分类水平上,33株属于变形菌门中的γ-变形菌纲(γ-Proteobacteria),占54%,为最优势类群,其次为α-变形菌纲(α-Proteobacteria),占34%;在属分类水平上,有16株属于假单胞菌属(Pseudomonas),占26%,为降解D-水杨苷的最优势菌属,有10株属于根瘤菌属(Rhizobium),占16%,为第二优势菌属。

|
| 图 5 以D-水杨苷为碳源筛选的低温细菌群落组成(纲水平) |

|
| 图 6 以D-水杨苷为碳源筛选的低温细菌群落组成(属水平) |
γ-变形菌纲为第一优势菌群,α-变形菌纲为第二优势菌群,可以低温降解纤维素的数量最少的菌群为厚壁菌门(Firmicutes)。
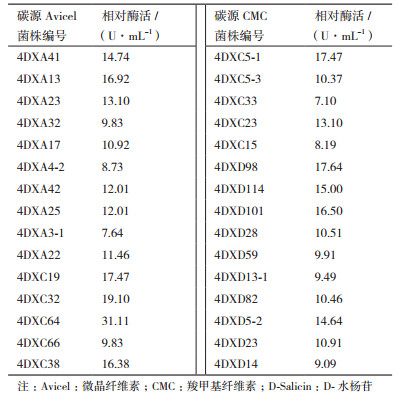
2.3 低温纤维素降解菌的酶活测定对筛选得到的172株低温纤维素降解菌在4℃下进行其相对酶活的测定,将其中酶活性相对较高的前10株菌列于表 1。其中,以微晶纤维素为碳源筛得的菌株的酶活性均在7 U/mL-17 U/mL; 菌株4DXC66、4DXC33和4DXC15的CMC酶活性均低于10 U/mL,菌株4DXC64的CMC酶活性为31.11 U/mL,最高,其余菌株的CMC酶活性均在10 U/mL-20 U/mL; 菌株4DXD98和4DXD101的β-葡萄糖苷酶活性相对较高,分别为17.64 U/mL和16.5 U/mL,其余菌株的酶活性均在9 U/mL-15 U/mL。
从对应每种纤维素碳源分别筛选出3株酶活性较高的菌株,然后组合成27个复合系。降解微晶纤维素能力较强的菌株为4DXA13、4DXA23和4DXA41,分别编号为1、2、3;降解CMC能力较强的菌株为4DXC19、4DXC32和4DXC64,分别编号为1'、2'、3';降解D-水杨苷能力较强的菌株为4DXD98、4DXD101和4DXD114,分别编号为1''、2''、3''。9株菌经测序得到其16S rDNA序列,经过EzTaxon数据库比对,与最近缘模式种的同源性均大于99%(表 2)。其中,菌株4DXA41、4DXC19、4DXC64、4DXD101和4DXD114均属于假单胞菌属(Pseudomonas),4DXA13属于Ancylobacter,4DXA23属于叶杆菌属(Phyllobacterium),4DXC32属于寡养单胞菌属(Stenotrophomonas),4DXD98属于Lelliottia。
将构建低温降解复合系所用的单菌株分别接种到滤纸液体培养基中4℃恒温培养,每隔24 h测定一次酶活性,结果如图 7所示。降解微晶纤维素的菌株4DXA13、4DXA23、4DXA41和降解D-水杨苷的菌株4DXD98、4DXD101、4DXD114的滤纸酶活性都在第4天达到最大,分别为17.46 U/mL、13.62 U/mL、13.79 U/mL、15.87 U/mL、15.68 U/mL、17.26 U/mL; 而降解CMC的菌株4DXC19、4DXC32、4DXC64的滤纸酶活性在第5天达到最大,分别为26.05 U/mL、25.86 U/mL、32.74 U/mL。

|
| 图 7 4℃下构建低温降解复合系的单菌株的滤纸酶活性 |
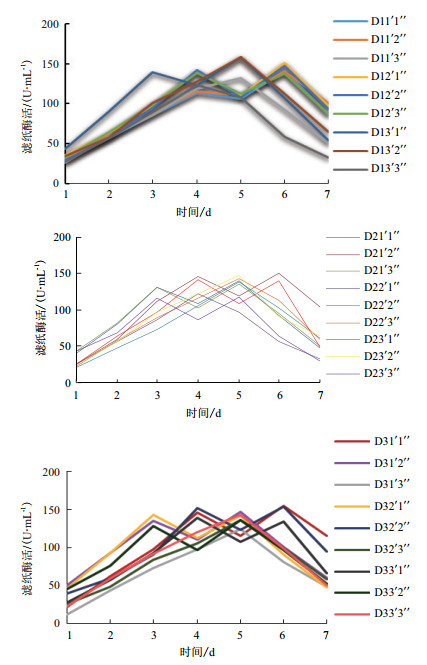
把27个降解复合系组合分别接种到滤纸液体培养基中4℃恒温培养,每隔24 h对各个组合的滤纸酶活性进行测定,结果如图 8所示。低温降解复合系在发酵的过程中,约17个组合的滤纸酶活性出现了两个峰值,剩余组合的酶活性只出现一个峰值。其中,组合D11'1''、D11'2''、D12'1''、D12'2''、D12'3''、D21'2''、D23'1''、D31'1''、D32'2''、D33'1''在第4天和在第6天出现二个峰值; 组合D13'1''、D21'1''、D21'3''、D23'3''、D31'2''、D32'1''、D33'2''在第3天和第5天出现二个峰值; 而组合D11'3''、D13'2''、D13'3''、D22'2''、D22'3''、D23'2''、D31'3''、D32'3''、D33'3''只在第5天出现一个峰值; D22'1''只在第4天出现一个峰值。
|
| 图 8 4℃下低温降解复合系的滤纸酶活性 |
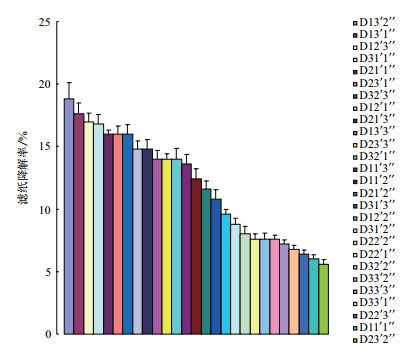
降解复合系中酶活性比较高的组合是D12'1''、D12'2''、D13'1''、D13'2''、D21'2''、D23'2''、D31'1''、D31'2''和D32'2'',酶活性都在147-160 U/mL之间,其中组合D13'1''和D13'2''的酶活性最高,为158.02 U/mL,是复合系中单菌株的5-10倍,4℃下滤纸降解率分别为17.6%和18.8%(图 9),为低温降解滤纸的最优菌群组合。
|
| 图 9 4℃低温降解复合系7天内的滤纸降解率 |
未调pH的培养液灭菌后的pH为8.11和8.23,接种复合系D13'1''和D13'2培养1 d后两者的pH值分别下降到6.32和6.43,并在随后5 d里都维持在6.2-6.6之间,变化幅度较小,比较稳定(图 10)。

|
| 图 10 4℃下低温降解复合系7天内的pH值变动 |
本文分别以微晶纤维素、羧甲基纤维素和D-水杨苷为唯一碳源共筛选得到172株低温纤维素降解菌。其中,γ-变形菌纲(γ-Proteobacteria)为第一优势菌群,α-变形菌纲(α-Proteobacteria)为第二优势菌群,在所有低温降解纤维素细菌中占绝对数量优势,为主要菌群,其次为Actinobacteria纲。在低温降解D-水杨苷中出现拟杆菌门(Bacteroidetes)中的Sphingobacteriia纲的细菌,说明相对微晶纤维素和羧甲基纤维素而言,其更容易降解D-水杨苷,产生β-葡糖苷酶。有研究表明,Sphingobacteriia纲中细菌可以降解BTEX(苯、乙苯、甲苯、二甲苯的统称)[17]; 拟杆菌门(Bacteroidetes)中Flavobacteria纲的细菌可以产生视紫素[18]。
通过16S rDNA序列分析,分离到的低温纤维素降解菌分属15个属。其中,假单胞菌属(Pseudomonas)、根瘤菌属(Rhizobium)、芽孢杆菌属(Bacillus)和黄杆菌属(Flavobacterium)为主要菌属。本文样品采集地属于温带较寒冷地区,与温带地区的菌种有一些类似,如Maki等[19]从加拿大(温带地区)造纸厂的污泥中筛选到的纤维素降解细菌主要以芽孢杆菌属(Bacillus)为主,杜颖[20]从来自内蒙古不同地区的样品中筛选到的纤维素降解细菌也主要以假单胞菌属(Pseudomonas)和芽孢杆菌属(Bacillus)为主。本文中分离得到的苍白杆菌属(Ochrobactrum)、Lelliottia、厄氏菌属(Oerskovia)、剑菌属(Ensifer)、叶杆菌属(Phyllobacterium)、Ancylobacter、地杆菌属(Pedobacter)、拉恩氏菌属(Rahnella)、短波单胞菌属(Brevundimonas)等属的细菌在降解纤维素方面报道较少。
王玢等[21]在15℃下从黄海海底筛选到一株嗜冷纤维素降解细菌,其内切葡聚糖酶酶活121.9 μg/mL、外切葡聚糖纤维二糖水解酶酶活102.2 μg/mL,李春艳等[22]在10℃下从生活垃圾土壤中筛选到一株低温纤维素降解细菌FLX-1,内切葡聚糖酶酶活为14.12 U/mL,Akila等[23]在15℃下从牛粪沼气池中筛选出一株嗜冷梭菌PXYL1,其内切葡聚糖酶酶活为35.75 U/mg,β-葡萄糖苷酶活为0.89 U/mg,滤纸酶活为23.68 U/mg,崔秀秀等[14]对1株耐冷纤维素降解细菌HQ产酶条件进行优化后,内切葡聚糖酶酶活达到32.5 U/mL; 本文用于构建低温降解复合系组合中的菌株的外切葡聚糖纤维二糖水解酶酶活在13 U/mL-17 U/mL之间,内切葡聚糖酶酶活在17 U/mL-33 U/mL之间,β-葡萄糖苷酶酶活在15 U/mL-18 U/mL之间,滤纸酶活在13 U/mL-33 U/mL之间。和以上几种菌株的酶活性相比,本文在4℃下获得的菌株的各类酶活并不太高,属于中等水平,这可能与培养温度有关,目前对于4℃低温条件下获得的产高纤维素酶活的菌株的研究报道较少。
自然环境中纤维素的降解多是由多种微生物协同完成的,微生物混合作用降解纤维素的效率及活性均比单独菌株作用高。潘虎等[24]构建了一个高效纤维素降解菌群SYF,培养10 d后,滤纸酶活性达126.3 U/mL,滤纸降解率为71.5%,酶活性低于本文的低温降解复合系的最高滤纸酶活性,但其滤纸降解率很高; 赵听[25]构建了小麦秸秆降解复合菌群FWD1,其滤纸酶活性为75.74 U/mL,其在7 d内的滤纸降解率为10%,王岩[26]把5株菌进行组合产生了13个纤维素降解复合系,对其滤纸酶活力及其降解率进行了研究,其中组合F1F8F25的滤纸酶活性最高,为0.326 IU/g,其在8℃,48 h的滤纸降解率为28.08%,付秋玥[27]从农村自然堆肥中筛出低温纤维素降解菌组成的复合菌系X11F74滤纸酶活力可达0.327 IU/g。本文低温降解复合系组合中,D13'1''和D13'2''的滤纸酶活性最高,为158.02 U/mL,是单菌株酶活的5-10倍,在目前所报道的纤维素降解复合菌系中处于较高水平,4℃下的滤纸降解率分别为17.6%和18.8%,说明复合系中的不同菌株之间存在明显的协同作用,具有较高的研究价值和应用价值,值得进一步的研究。混合菌培养体系中pH值的明显变化会降低纤维素酶活性,导致复合菌群生长恶化,因此,在复合系的发酵中pH值的不稳定是降低或抑制纤维素分解活性的主要原因之一[28]。通过监测复合系D13'1''和D13'2''在降解滤纸过程中的酸碱度,复合系发酵液的pH值会稳定在6.2-6.6范围内,说明复合系的纤维素降解稳定性较好。由于低温纤维素酶的最适作用温度普遍较低,一般最适作用温度为20-25℃[29],本文是在50℃测定的纤维素酶活性,由于温度较高会导致酶的活性受抑制[3],还需进一步研究其最佳反应条件。
4 结论在4℃下以微晶纤维素、CMC和D-水杨苷3种不同的底物从呼伦贝尔森林土壤中分离到172株低温纤维素降解细菌,第一优势菌纲为γ-Proteobacteria,第二优势菌纲为α-Proteobacteria; 第一优势菌属为假单胞菌属(Pseudomonas),第二优势菌属为根瘤菌属(Rhizobium)。将酶活性高的菌株分别混合构建了27个低温降解复合系,其中有9个复合系的滤纸酶活都在140 U/mL以上,D13'1''和D13'2''的酶活性最高,为158.02 U/mL,滤纸降解率分别为17.6%和18.8%,是低温降解复合系最优菌群组合。
| [1] |
Gilbert HJ. The biochemistry and structural biology of plant cell wall deconstruction[J]. Plant Physiology, 2010, 153(2): 444-455. DOI:10.1104/pp.110.156646 |
| [2] |
张俙何, 洪春来, 朱凤香, 等. 农业废弃物资源化利用现状与前景展望[J]. 现代农业科技, 2013(20): 209, 218. |
| [3] |
罗立津, 等. 耐低温木质纤维素降解菌群的富集培养及其种群结构分析[J]. 农业生物技术学报, 2015, 23(6): 727-737. |
| [4] |
王世杰, 王翔, 卢桂兰, 等. 低温微生物修复石油烃类污染土壤研究进展[J]. 应用生态学报, 2011, 22(4): 1082-1088. |
| [5] |
董硕, 迟乃玉, 王鑫, 等. 低温纤维素酶的研究进展[J]. 生物技术通报, 2011(2): 37-41. |
| [6] |
张丽珉, 等. 南极罗斯海区域可培养微生物分离鉴定及产低温酶能力初步筛选[J]. 海洋学报, 2018, 40(8): 152-164. DOI:10.3969/j.issn.0253-4193.2018.08.015 |
| [7] |
亢宗静, 袁楠, 等. 若尔盖高原湿地的真菌群落结构及低温纤维素降解真菌特征[J]. 土壤通报, 2017, 48(4): 830-836. |
| [8] |
Haruta S, Cui ZJ, Huang Z, et al. Construction of a stable microbial community with high cellulose-degradation ability[J]. Appl Microbiol Biotechnol, 2002, 59(4/5): 529-534. |
| [9] |
Kato S, Haruta S, Cui ZJ, et al. Stable coexistence of five bacteria l strains as a cellulose-degrading community[J]. Applied and Environmental Microbiology, 2005, 71(11): 7099-7106. DOI:10.1128/AEM.71.11.7099-7106.2005 |
| [10] |
盛铭浩, 徐凤花, 等. 低温纤维素降解复合菌系的选育及性能分析[J]. 湖北农业科学, 2013, 52(8): 1814-1816, 1828. DOI:10.3969/j.issn.0439-8114.2013.08.021 |
| [11] |
萨如拉, 高聚林, 于晓芳, 等. 玉米秸秆低温降解复合菌系的筛选[J]. 中国农业科学, 2013, 46(19): 4082-4090. DOI:10.3864/j.issn.0578-1752.2013.19.014 |
| [12] |
赵旭, 王文丽, 李娟, 等. 低温秸秆降解微生物菌剂的研究进展[J]. 生物技术通报, 2014(11): 55-61. |
| [13] |
勾长龙.低温纤维素降解菌的筛选及其复合菌系在牛粪堆肥中的应用研究[D].长春: 吉林农业大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10193-1014053265.htm
|
| [14] |
崔秀秀, 韩梅, 李丽娜, 等. 利用响应面法优化耐冷纤维素降解菌产内切纤维素酶的发酵条件[J]. 华中农业大学学报, 2016, 35(4): 62-69. |
| [15] |
胡晓红, 彭惠民, 等. PCR及Real-time PCR评价细菌DNA提取方法[J]. 重庆医科大学学报, 2008, 33(2): 155-158. |
| [16] |
王伟东, 等. 快速木质纤维素分解菌复合系MC1对秸秆的分解能力及稳定性[J]. 环境科学, 2005, 26(5): 156-160. DOI:10.3321/j.issn:0250-3301.2005.05.031 |
| [17] |
张倩.高盐条件BTEX降解菌群多样性、降解基因型及相容性溶质分析[D].上海: 华东理工大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10251-1012516360.htm
|
| [18] |
Gómezconsarnau L, González JM, M Colllladó, et al. Light stimulates growth of proteorhodopsin-containing marine Flavobacteria[J]. Nature, 2007, 445(7124): 210-213. DOI:10.1038/nature05381 |
| [19] |
Maki ML, Broere M, Leung KT, et al. Characterization of some efficient cellulase producing bacteria isolated from paper mill sludges and organic fertilizers[J]. International Journal of Biochemistry & Molecular Biology, 2011, 2(2): 146-154. |
| [20] |
杜颖.纤维素降解微生物筛选及纤维素酶的特征分析、基因克隆和表达[D].呼和浩特: 内蒙古农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10129-1015427632.htm
|
| [21] |
王玢, 汪天虹, 张刚. 产低温纤维素酶海洋嗜冷菌的筛选及研究[J]. 海洋科学, 2003, 27(5): 42-45. DOI:10.3969/j.issn.1000-3096.2003.05.011 |
| [22] |
李春艳, 于琦, 冯露. 低温纤维素降解菌分离鉴定及产酶条件优化[J]. 东北农业大学学报, 2015, 46(10): 74-81. DOI:10.3969/j.issn.1005-9369.2015.10.011 |
| [23] |
Akila G, Chandra TS. A novel cold-tolerant Clostridium strain PXYL1 isolated from a psychrophilic cattle manure digester that secretes thermolabile xylanase and cellulase[J]. FEMS Microbiology Letters, 2003, 219(1): 63-67. DOI:10.1016/S0378-1097(02)01196-5 |
| [24] |
潘虎, 董俊德, 卢向阳. 高效纤维素降解菌群的构建及其生物多样性分析[J]. 湖南农业大学学报:自然科学版, 2012, 38(2): 139-145. |
| [25] |
赵听.小麦秸秆降解复合菌群FWD1的构建、降解特性及其微生物群落组成研究[D].杨凌: 西北农林科技大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10712-1015332731.htm
|
| [26] |
王岩.低温发酵菌群筛选及其特效研究[D].哈尔滨: 东北农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10224-1014341352.htm
|
| [27] |
付秋玥.低温纤维素降解菌的筛选及其混合发酵效果研究[D].哈尔滨: 东北农业大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10224-1013207110.htm
|
| [28] |
单谷, 罗廉, 余世袁. pH值对纤维素酶制备的影响[J]. 南京林业大学学报, 1999, 23(3): 60-62. DOI:10.3969/j.issn.1000-2006.1999.03.014 |
| [29] |
林艳梅, 生吉萍, 申琳, 等. 适冷纤维素降解微生物研究进展[J]. 生物技术, 2010, 20(2): 95-97. |