厌氧消化技术因其高效的生物降解性和高能量回收率,现已成为治理有机固体废弃物和废水的核心生物技术。大分子有机物(纤维素、淀粉和蛋白质等)在水解菌和发酵菌的作用下分解为小分子有机物(丁酸、丙酸和乙醇等)及H2和CO2,而后在互营有机酸氧化菌的作用下分解为乙酸、H2和CO2,最后严格厌氧的产甲烷古菌利用H2和乙酸,通过多种途径产生甲烷[1-2]。挥发性脂肪酸(Volatile fatty acid,VFA)作为厌氧消化过程中重要的中间产物,其氧化降解是厌氧消化限速步骤。目前关于乙酸和丙酸互营氧化的研究较多,而丁酸作为其中一类VFA,在厌氧消化研究中也具有重要意义。有研究表明,在奶制品及肉制品加工厂废水的厌氧处理过程中,丁酸约占31%[3]。此外,丙酸氧化菌Smithella通过歧化途径将丙酸转化为丁酸后再进行氧化分解[4-5],丁酸作为中间产物可影响丙酸降解过程。丁酸氧化过程中(C4H8O2 + 2H2O → 2CH3COOH + 2H2)ΔG大于0,所以丁酸氧化菌需与产甲烷古菌形成互营,降低反应产物H2的分压,才能完成代谢[6]。
实际环境中,厌氧消化过程极易受各类抑制剂的影响[7-9]。当抑制物浓度达到临界水平时,会影响甲烷产生,造成甲烷产量下降[10-12],其根本原因是对功能微生物类群的抑制,从而破坏有机物转化为甲烷过程中多种营养微生物间的互作关系[13]。猪粪、牛粪和鸡粪等动物粪便中通常含有高浓度的兽药抗生素作为饲料添加剂,用于提高产量或控制疾病[14],高浓度抗生素可能导致厌氧消化过程的抑制或失败。目前我国最常用的人畜用抗生素是氟喹诺酮类、磺胺类和四环素类抗生素[15]。其中,氯四环素(Chlortetracycline,CTC)在实际畜禽粪便中浓度高达100 mg/L[16],可抑制部分革兰氏阴性菌(如产甲烷古菌)的活性,从而抑制整个厌氧消化过程[17]。因此,研究抗生素对互营丁酸氧化群落的结构和活性的影响,对于制定削减抑制和保持反应器稳定运行的对策至关重要。然而目前对相关微生物群落的结构及其对抑制物的响应仍缺乏系统的认识。
互营氧化产甲烷过程中,有机酸氧化菌与产甲烷古菌间的电子传递方式有氢气转移、甲酸转移和直接电子转移[18]。种间直接电子传递(Direct interspecies electron transfer,DIET)是最新的一种互营方式,其电子传递不需要氢气或甲酸载体,节省了能量的同时,传递也不受扩散速度的影响,因此具有极高的电子传递效率。目前报道的产甲烷体系中,能进行DIET的微生物主要包括Geobacter sulfurreducens、Geobacter metallireducens、Methanosaeta harundinacea和Methanosarcina barkeri[19-20],其直接电子传递过程主要是通过Geobacter细菌的导电性菌毛实现[21]。Zhao等[22]通过在沼气池中添加Fe3O4富集得到Syntrophomonas和Methanosaeta证实Syntrophomonas和Methanosaeta也可能存在DIET过程。近年来,研究发现导电颗粒物质(如活性炭、生物炭和铁氧化物等)也可作为电子传递体参与直接电子传递过程[23-26]。其中,颗粒活性炭比表面积大,具备良好的导电性和抗腐蚀性[27],在研究导电物质介导DIET过程中广泛应用[28-29]。
本研究构建了以丁酸为唯一碳源的厌氧消化反应器,在稳定运行条件下,通过16S rRNA的高通量测序研究互营丁酸氧化群落对抑制物的响应。此外,在抑制物存在条件下,添加颗粒活性炭(Granular active carbon,GAC),研究互营有机酸氧化菌和产甲烷古菌间是否可通过GAC进行直接电子传递,以及在CTC和GAC协同作用下,微生物群落结构和关键微生物活性的动态变化。
1 材料与方法 1.1 以丁酸为唯一碳源的反应器构建及运行本研究采用工作体积为1.8 L的全混流连续厌氧消化反应器(Continuous stirred tank reactors,CSTR)。反应器原始接种污泥为四川省某猪场常温厌氧消化污泥。反应器在37℃,0.05 d-1稀释率条件下运行,供给以丁酸为唯一碳源的合成废水(TOC浓度为8 000 mg/L)。反应器构建及合成废水成分同此前研究[30]。反应器稳定运行500 d后,收集其微生物群落进行后续实验。
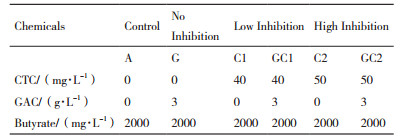
1.2 批次抑制及添加活性炭实验从反应器中取出18 mL混合液,倒入充满氮气的50 mL培养瓶中。培养瓶顶空用纯氮气置换3 min后,用丁基橡胶塞和铝密封。为消除混合液中残余的有机酸,将培养瓶置于37℃的摇床中预培养1 h。预培养后,在培养瓶中加入不同浓度的CTC作为抑制剂,并加入终浓度为2 000 mg/L丁酸钠作为碳源。CTC浓度范围为20-60 mg/L。
根据对不同浓度CTC的耐受情况,分别选择低浓度和高浓度的CTC,并根据预实验结果添加终浓度为3 mg/L的GAC,以考察抑制剂及GAC对互营丁酸降解微生物群落的影响。GAC来源于石家庄宏森活性炭有限公司,电子交换能力(Electron exchange capacity,EEC)为0.78 mmol e-/g,过40-60目筛后备用。实验设置如表 1所示。培养瓶中分别添加40 mg/L和50 mg/L的CTC且无GAC的处理命名为C1和C2,培养瓶中分别添加上述两种浓度的CTC且添加GAC的处理命名为GC1和GC2。数字“1”表示“低抑制”,数字“2”表示“高抑制”。此外,培养瓶中加入丁酸盐作为微生物生长的碳源,初始浓度均为2000 mg/L。所有实验组设置3个平行样品。将培养瓶置于37℃摇床中培养,培养18 h后,检测产气量及培养液中VFAs的浓度,每个处理选取2个平行样品进行微生物群落分析。
培养18 h后,收集全部污泥培养液提取微生物群落总RNA[31]。采用PrimeScript RT reagent Kit试剂盒及随机引物对RNA进行反转录。引物338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACHVGGGTWTCTAAT-3')扩增细菌16S rRNA基因V3-V4高变区。采用古菌通用引物524F10extF(5'-TGYCAGCCGCCGCGGTAA-3')和Arch958RmodR(5'-YCCGGCGTTGAVTCCAATT-3')扩增古菌16S rRNA基因V4-V6高变区。双向引物加入样品特异的12 bp条形码序列(barcode)。PCR反应体系如下:总体积25 μL,包括0.4 μL Fast Pfu聚合酶,4 μL 5×Fast Pfu聚合酶缓冲液,2 μL 2.5 mmol/L dNTPs,正反向引物各1.6 μL和10 ng cDNA模板。PCR反应条件如下:95℃ 3 min,95℃ 30 s,55℃ 30 s,72℃ 45 s(27个循环),72℃最终延伸10 min。所有样品PCR产物等摩尔混合并用AxyPrep DNA Gel Extraction Kit试剂盒及QuantiFluorTM-ST进行纯化和定量,合格后用于Illumina HiSeq2000系统完成测序。
1.4 生物信息学及统计学分析利用最小显著差数(The least significant difference,LSD)对各处理组进行显著性检验,差异显著水平设为P<0.05。通过Illumina测序获得原始配对数据后,首先利用Trimmomatic软件(版本0.36)[32]去除质量评分低于30的序列并利用FLASH软件(版本1.2.11)进行序列拼接[33],以获得16S rRNA基因中整个V4-V6高变区的序列。对序列进行降噪、降低测序错误和去除嵌合体处理后,根据上述特有的12 bp的barcode,将上述高质量序列分配到各个样品中,再按照97%的相似性划分OTU(Operational taxonomic unit,OTU)。最后,将OTU代表序列与Silva(SSU123)16S rRNA基因数据库中的序列进行比对,按照0.7的置信度对OTU进行物种分类。利用Spearman等级相关系数分析环境因素对微生物群落结构的影响。利用R软件(https://www.r-project.org/)计算Spearman等级相关系数及相应P值(P<0.05则为统计学上显著性相关)。利用HemI(Heatmap Illustrator,版本1.0,http://hemi.biocuckoo.org/)创建热图。利用开源平台Cytoscape_v.3.6.1生成共现网络,用以可视化微生物类群间相互作用。选择相对丰度排名前30的微生物属来构建网络。两个节点之间的连接表示强(| r | > 0.5)和显著(P<0.05)Spearman相关性。每个节点的大小与显著的正/负相关(即度)的数量成比例; 两个节点之间的每个连接的厚度与Spearman的相关系数(r)成比例,范围从| 0.5 |到| 1 |。
1.5 反应器理化参数测试反应器中悬浮固体(Suspended solids,SS)、挥发性悬浮固体(Volatile suspended solids,VSS)、总有机碳(Total organic carbon,TOC)和VFAs等参数的测试方法同此前研究[34]。
1.6 核苷酸序列登记号原始测序数据已上传至NCBI(Accession num-ber:PRJNA544829)。
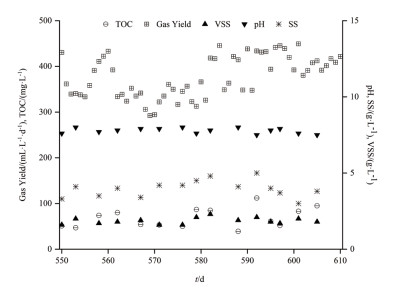
2 结果 2.1 反应器运行情况实验期间,以丁酸为唯一碳源的反应器已在0.05 d-1稀释率下稳定运行500余天(图 1)。反应器pH保持在7.5,产气量稳定在400 mL/d(图 1)。丁酸及乙酸浓度均低于100 mg/L,表明反应器中的丁酸被微生物群落完全矿化。VSS平均浓度为1.86 g/L。在运行550 d和610 d间采集反应器中混合液样品进行微生物群落分析和批量抑制及添加GAC实验。
|
| 图 1 以丁酸为唯一碳源的反应器运行情况(37℃,0.05 d-1) |
为研究反应器中的活性微生物群落,从反应器污泥中提取两个平行RNA样品并进行16S rRNA高通量测序。基于16S rRNA序列中97%的相似性,共获得247个OTU。在门水平,细菌主要类群(相对丰度> 3%)为Firmicutes(16.0%),Proteobacteria(13.2%),Bacteroidetes(9.6%)和Synergistetes(3.3%)(图 2)。在属水平,优势细菌属(相对丰度> 2%)分别是Syntrophomonas(11.6%),unclassified Sphingobacteriales(8.9%),unclassified Hydrogenophilaceae(7.0%),Tepidanaerobacter(2.74%)和unclassified Synergistaceae(2.08%)(图 2)。古菌群落中,主要古菌属为Methanosaeta(48.5%),Methanoculleus(3.4%)和Methanobacterium(2.7%)(图 2)。

|
| O:反应器原始微生物群落;A:空白对照;G:3 g/L GAC;C1:40 mg/L CTC;GC1:40 mg/L CTC和3 g/L GAC;C2:50 mg/L CTC;GC2:50 mg/L CTC和3 g/L GAC,下同 图 2 不同处理下微生物优势属的相对丰度 |
为研究不同浓度CTC对产甲烷的影响,选择20-60 mg/L浓度的CTC进行产甲烷抑制测试。结果显示,20 mg/L浓度的CTC对产甲烷无明显抑制,30-50 mg/L条件下产气量分别降低17.3%,36.5%和80.8%,60 mg/L时几乎无产气。根据对CTC的耐受情况,最终选择低浓度(40 mg/L)和高浓度(50 mg/L)的CTC进行抑制实验,并添加GAC研究其对产甲烷过程的影响。
批次抑制及添加GAC实验中,丁酸初始浓度为2000 mg/L。培养18 h后,产气量、丁酸和乙酸浓度结果如图 3所示。培养18 h后,在低(C1,40 mg/L)和高(C2,50 mg/L)浓度CTC条件下,产气量分别降低40.4%和49.3%(图 3-a),丁酸降解速率分别降低44.2%和51.3%(图 3-b),乙酸浓度分别降低31.2%和45.4%(图 3-c),表明CTC对丁酸降解有明显抑制作用。

|
| 不同小写字母的组相互之间差异显著(P<0.05,LSD) 图 3 不同处理下产气量(a)、丁酸浓度(b)和乙酸浓度(c) |
在添加GAC的处理中(图 3),无CTC条件下,加入GAC导致产气量降低2.9%,丁酸降解速率无明显变化,乙酸浓度增加7.0%。当GAC和CTC同时存在时(GC1和GC2),产气量分别降低48.5%和64.7%(图 3-a),丁酸降解率降低48.8%和72.6%(图 3-b),乙酸浓度降低34.7%和58.3%(图 3-c)。
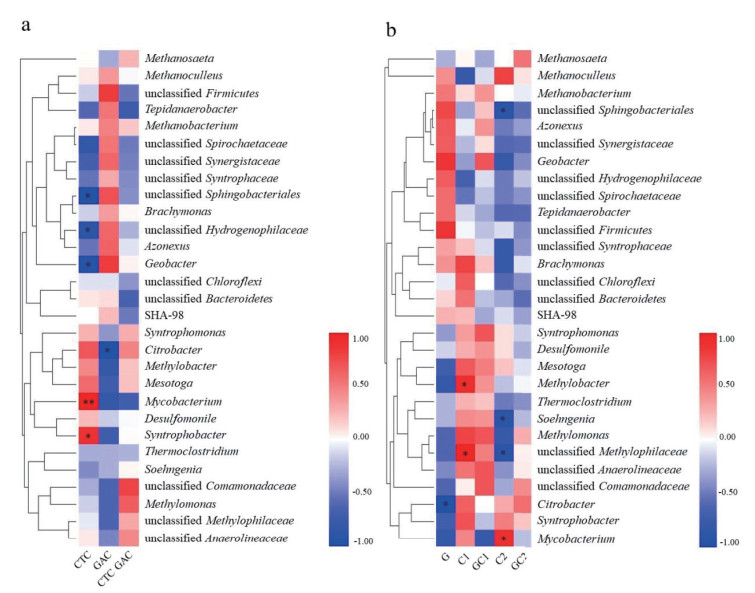
2.4 抗生素及添加活性炭对丁酸氧化群落活性的影响为研究CTC及添加GAC对微生物类群活性的影响,通过计算Spearman相关系数以表明微生物群落结构与环境因子之间的相关性(图 4)。在CTC抑制条件下,有7种OTU(Syntrophomonas、Citrobacter、Methylobacter、Mesotoga、Mycobacterium、Desulfomonile和Syntrophobacter)的相对活性与CTC浓度呈正相关,表现出对CTC的耐受性; 其中Mycobacterium和Syntrophobacter呈显著正相关(P<0.05),表明相对其他细菌,该微生物对CTC有较强的耐受性和适应能力。相反地,有8种OTU(Tepidanaerobacter、unclassified Spirochaetaceae、unclassified Synergistaceae、unclassified Syntrophaceae、unclassified Sphingobacteriales、unclassified Hydrogenophilaceae、Azonexus和Geobacter)与CTC浓度呈负相关,表明其可能不耐受CTC; 其中unclassified Sphingobacteriales、unclassified Hydrogenophilaceae和Geobacter受到显著抑制(P<0.05)(图 4-a)。此外,不同浓度抑制剂影响不同微生物类群(图 4-b)。低浓度CTC处理时,仅有3种OTU的活性(Methanoculleus、unclassified Hydrogenophilaceae和unclassified Spirochaetaceae)受到较明显的抑制,大部分OTU表现出耐受性,其中Methylobacter和unclassified Methylophilaceae的相对活性与CTC浓度呈显著正相关; 高浓度CTC抑制了大部分细菌的活性并显著抑制了unclassified Sphingobacteriales、Soehngenia和unclassified Methylophilaceae的活性,只有3种OTU(Citrobacter、Syntrophobacter和Mycobacterium)表现出耐受性,其中Mycobacterium的相对活性与CTC浓度呈显著正相关(P<0.05)(图 4-b)。
|
| CTC:C1和C2;GAC:G;CTC GAC:GC1和GC2;红色表示正相关,蓝色表示负相关;显著相关(P值<0.05)用*标记,极显著相关(P值<0.01)用**标记 图 4 不同添加物(a)和不同处理下(b)环境因子和主要菌属间Spearman相关性热图 |
添加GAC条件下,有6种OTU(unclassified Firmicutes、unclassified Synergistaceae、unclassified Sphingobacteriales、unclassified Hydrogenophilaceae、Azonexus和Geobacter)相对活性与GAC呈明显正相关; 有5种OTU(Citrobacter、Methylobacter、Mesotoga、Mycobacterium和Syntrophobacter)相对活性与GAC呈负相关,其中Citrobacter的活性呈显著负相关(P<0.05)(图 4-a)。低浓度CTC添加GAC处理条件下有五种OTU(Geobacter、Syntrophomonas、Methylomonas、unclassified Anaerolineaceae和unclassified Comamonadaceae)的相对活性与GAC呈明显正相关,其中Geobacter在低浓度CTC处理时被抑制,添加GAC后表现出耐受性; 而Mycobacterium对单独存在的CTC表现出耐受性,添加GAC其相对活性明显降低; 高浓度CTC添加GAC处理时,大部分OTU的相对活性呈负相关,只有3个OTU(Methanosaeta、unclassified Comamonadaceae和Citrobacter)呈正相关趋势。相比于高浓度CTC处理,添加GAC后Methanosaeta和unclassified Comamonadaceae的活性明显增强(图 4-b); 而Mycobacterium的活性明显降低,与低浓度CTC条件下对GAC的响应相同。
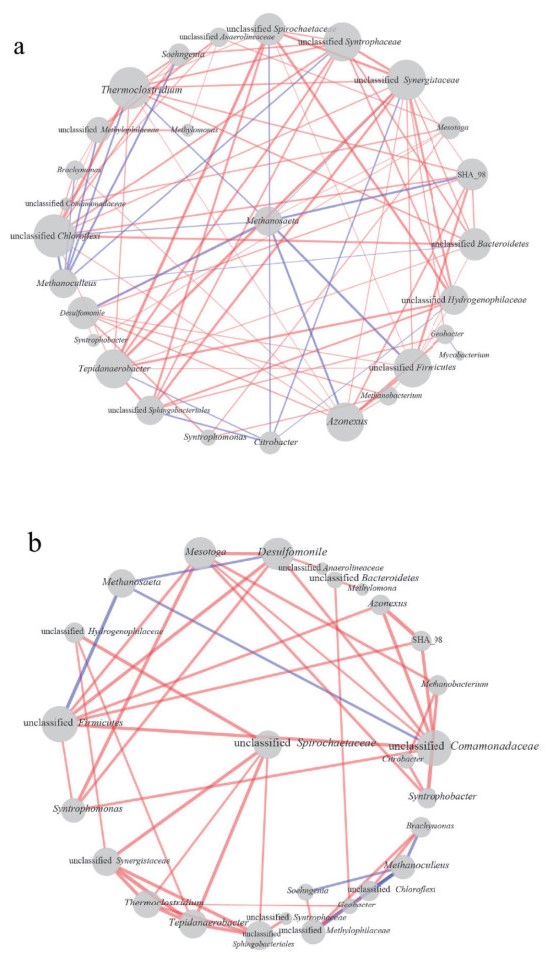
2.5 基于群落和抗生素及添加活性炭的网络分析共现网络分析用于研究群落中优势属之间的直接或间接相互作用(图 5)。为了从整体水平探讨综合条件对微生物群落的影响,选取所有处理组数据进行分析。在所有处理条件下相关性网络图中(图 5-a),与Methanosaeta、Methanoculleus相联系的OTU均呈负相关性,如Thermoclostridium、unclassified Firmicutes、Azonexus等。Syntrophomonas和Mesotoga呈正相关联系,因为Mesotoga可以利用Syntrophomonas的代谢产物乙酸。与Geobacter相关的OTU较少,其中仅有Azonexus、unclassified Sphingobacteriales和unclassified Synergistaceae与其呈正相关,且这3种OTU的生物活性都与GAC呈正相关。
|
| 连接表示显著的相关性(| r |> 0.5),蓝色表示负相关,红色表示正相关;每个节点的大小与连接数成比例,每条线的粗细与Spearman相关性系数成比例;a:所有处理组;b:CTC单独处理 图 5 基于Spearman相关性分析的共现微生物属网络 |
在仅有CTC处理的相关性网络图中,群落中的“中枢”是unclassified Firmicutes、unclassified Comamonadaceae、Tepidanaerobacter和Methanoculleus(图 5-b)。其中,unclassified Firmicutes和unclassified Comamonadaceae两个簇内大部分OTU(如Mesotoga、Syntrophomonas和Azonexus等)间呈正相关联系,仅有Methanosaeta与这两个“中枢”呈负相关联系。此外,unclassified Firmicutes、unclassified Comamonadaceae和Methanobacterium与Mesotoga呈正相关性。Tepidanaerobacter为“中枢”的簇中,unclassified Hydrogenophilaceae和unclassified Sphingobacteriales与“中枢”有很强的相关性。“中枢”为Methanoculleus的簇中大部分OTU聚集为负相关趋势,如Soehngenia、unclassified Methylophilaceae和Brachymonas。
3 讨论原始反应器细菌类群中,Firmicutes,Proteobacteria,和Bacteroidetes常见于厌氧消化系统[35-36]。属于Clostridia的Syntrophomonas(OTU133)是已知的丁酸氧化菌,该菌株可通过β-氧化途径将丁酸降解为乙酸和H2[37]。属于Sphingobacteriia的unclassified Sphingobacteriales(OTU233)与Sphingobacteriales(HQ692029)具有97%的序列相似性,该菌在甜菜硅藻的中温厌氧消化反应器中被检测出,可降解包括蛋白质和碳水化合物在内的复杂大分子有机物[38]。属于Betaproteobacteria的unclassified Hydrogenophilaceae(OTU234)与Planifilum(NR_040940)具有88.5%的序列相似性,Planifilum是堆肥产生的生物气溶胶中的优势嗜热细菌[39]。属于Firmicutes的Tepidanaerobacter(OTU210)与Tepidanaerobacter acetatoxydans Re1(EU386163)具有99%的序列相似性,该菌分离自含有高浓度铵的中温污泥反应器,为一类互营乙酸氧化细菌[40]。属于Thermotogae的Mesotoga(OTU59)是已知的乙酸氧化细菌,在对苯二甲酸甲酯(Terephthalate,TA)产甲烷反应器中被发现,可降解TA分解代谢副产物乙酸[41]。属于Synergistia的unclassified Synergistaceae(OTU217)与Saccharofermentans M3/6T(NR_115340)具有94.7%的序列相似性,该菌株是从沼气反应器中分离出的新菌种,可利用蛋白底物和糖类产乙酸、丙酸和异戊酸,有助于厌氧消化的水解产酸过程[42]。这些OTU与已知微生物序列的低相似性表明厌氧消化体系中也存在较多未知微生物物种。古菌群落中,优势古菌属Methanosaeta是已知的乙酸营养型产甲烷古菌,能利用乙酸产生CH4和CO2[43]。近年来,有研究发现Methanosaeta可通过直接种间电子转移(DIET)接受电子以消耗乙酸,表明厌氧消化中有机物转化为CH4不仅仅是通过电子载体(如H2和甲酸)的扩散进行的[44]。目前已知Geobacter可通过导电菌毛参与DIET向产甲烷菌提供电子[45]。Zhao等[46]发现互营丁酸氧化菌Syntrophomonas也可能通过DIET与Methanosaeta互营生长[22]。另外两个古菌属Methanoculleus和Methanobacterium为氢营养型产甲烷古菌,常见于反应器、填埋场、废水和热泉中。相较于高温,中温条件下氢营养型产甲烷古菌的生物活性相对偏弱[47],因此本研究反应器中Methanoculleus和Methanobacterium的相对丰度较低。
CTC对丁酸降解有明显抑制作用,在厌氧消化过程中,由于底物、接种物、环境条件(温度、pH)和驯化期的不同,抑制剂的抑制浓度范围较大,CTC的抑制浓度通常在2-100 mg/L范围内波动[10-12, 48]。与抑制物单独作用相比,添加GAC增强了抑制性,这可能是GAC吸附使抑制物和有机酸积累导致的结果。有研究表明GAC的导电性能加强微生物群落种间直接电子传递,有效促进互营产甲烷过程[49],与本次实验结果有所差异,可能是由与反应器和实际物料体系不同造成的。
环境因子和主要菌属间Spearman相关性热图表明,相对其他细菌,丁酸氧化菌Syntrophomonas对CTC有一定的耐受性,其氧化丁酸产乙酸过程可能不会受到明显抑制。作为丁酸氧化的产物,乙酸不仅可被Methanosaeta利用产甲烷,还可被乙酸氧化菌Tepidanaerobacter和Mesotoga氧化为CO2和H2,产生的CO2和H2将参与氢营养型产甲烷过程[40]。本研究中Tepidanaerobacter的相对活性受到CTC的抑制,可能导致乙酸积累,从而抑制整个丁酸氧化过程。有研究表明,挥发性有机酸积累对厌氧消化过程中微生物有着致命的毒害作用[50]。Geobacter已被证实可以直接向产甲烷古菌传递电子并促进甲烷的生产[45],本研究中,CTC显著抑制了Geobacter的相对活性,可能阻断其与古菌的电子传递过程。此外,群落中一些未知细菌(如unclassified Sphingobacteriales和unclassified Hydrogenophilaceae)受到CTC的明显抑制,这些细菌可能为参与丁酸氧化的微生物提供必需的营养物质,从而影响关键菌的生长,因此有必要进一步研究这些未知细菌。Geobacter是目前唯一已知通过DIET传递电子的细菌,该细菌活性与GAC呈明显正相关,表明添加GAC可能促进其参与直接电子传递过程,与此前研究结果一致[51]。在本研究中,添加GAC,最终甲烷产量降低2.9%-30.4%,可能是其他未知细菌(如unclassified Firmicutes和unclassified Sphingobacteriales)与产甲烷古菌形成互营,导致Geobacter无法与古菌形成种间直接电子传递。此外,添加GAC处理中,Methanosaeta、Syntrophomonas和Mesotoga的相对活性降低,Mesotoga可将乙酸氧化为CO2和H2以供给氢营养型产甲烷古菌[52],H2和CO2来源减少也可能导致甲烷产量的降低。低浓度CTC和GAC的共同处理增强了Syntrophomonas的相对活性,而乙酸营养型产甲烷古菌Methanosaeta的相对活性降低,可能由于丁酸氧化产生的乙酸未被及时消耗,导致乙酸积累并影响甲烷产生。高浓度CTC和GAC处理时,包括Geobacter在内的大部分微生物活性被抑制,直接电子传递过程的阻断导致GAC的添加无明显作用效果。
共现网络分析提供了生态信息的可视化,可以阐明生物间相互作用,共享生理学或栖息地亲缘关系[53]。密集连接的节点由较大的圆圈表示,表明该菌属与其他类群具有更显著的正相关或负相关,因此可能是群落中的重要微生物。最密集连接的节点被定义为“中枢”,是群落中其他成员的潜在代谢指标[54]。所有处理网络分析结果表明,Geobacter可能与Azonexus、unclassified Sphingobacteriales和unclassified Synergistaceae协同生长,GAC促进了Geobacter生长代谢,同时增强了它们的相对活性。属于Betaproteobacteria的主要属Azonexus与Azonexus caeni菌株Slu-05(NR_041017)具有99%的序列相似性,该菌是从废水处理厂的污泥中分离出的反硝化细菌[55]。Azonexus能够在微氧条件下生长,但通常在产甲烷体系中检测到[56-57]。属于Synergistia的unclassified Synergistaceae可能通过氧化乙酸产生电子,并被产甲烷菌用于产生甲烷[45]。
在仅有CTC处理的相关性网络图中,Methanosaeta与两个“中枢”(unclassified Firmicutes和unclassified Comamonadaceae)呈负相关联系,表明它们与乙酸营养型产甲烷古菌存在一定的竞争关系。此外,unclassified Firmicutes和unclassified Comamonadaceae可能是Mesotoga生长代谢的伴生菌,增强了Mesotoga与Methanosaeta竞争乙酸时的优势。乙酸氧化细菌Mesotoga和丁酸氧化细菌Syntrophomonas与这两个“中枢”都呈正相关趋势,表明它们与有机酸氧化细菌具有密切的关系。Mesotoga和Methanobacterium呈正相关联系,Mesotoga氧化乙酸产生的CO2可被氢营养型产甲烷古菌Methanobacterium利用,与此前研究结果相同[52]。Tepidanaerobacter为“中枢”的簇中,一些易受CTC影响的OTU(如unclassified Hydrogenophilaceae和unclassified Sphingobacteriales)与“中枢”都有很强的相关性,它们被抑制的同时会影响Tepidanaerobacter的生物活性。
综上所述,丁酸氧化菌(Syntrophomonas)和乙酸氧化菌(Mesotoga和Tepidanaerobacter)与群落中大部分细菌(如unclassified Comamonadaceae、unclassified Firmicutes、unclassified Sphingobacteriales等)呈正相关,它们的活性易受到CTC的抑制,从而影响乙酸和H2的产出,导致甲烷产量降低。产甲烷古菌(Methanosaeta和Methanoculleus)与其相联系的细菌(Azonexus、Thermoclostridium和unclassified Chloroflexi等)均呈负相关性,而添加GAC增强了Geobacter以及与其呈正相关的细菌(Azonexus、unclassified Synergistaceae和unclassified Sphingobacteriales等)的活性,间接影响了产甲烷古菌生长代谢,致使产甲烷量降低。虽然添加GAC可以增强Geobacter等菌的活性,但是CTC对它们的抑制作用占主导地位。
4 结论本研究利用以丁酸为唯一碳源的厌氧反应器,揭示了互营丁酸氧化群落结构和相互作用,研究互营丁酸氧化群落对CTC的响应,以及在CTC和GAC协同作用下,微生物群落结构和关键微生物活性的动态变化。结果表明,反应器群落中优势菌属互营丁酸氧化菌Syntrophomonas和乙酸营养型产甲烷古菌Methanosaeta存在互营生长关系。CTC明显抑制产甲烷量,尽管Syntrophomonas相对耐受CTC,但与其呈正相关的微生物(如unclassified Firmicutes和unclassified Comamonadaceae)活性受CTC抑制。乙酸氧化菌Tepidanaerobacter受CTC抑制,可能导致代谢产物乙酸的积累从而降低丁酸氧化率。此外,添加GAC增强了Geobacter和Azonexus等细菌的活性,而产甲烷古菌(Methanosaeta和Methanoculleus)与其相联系的细菌(Azonexus、Thermoclostridium和unclassified Chloroflexi等)均呈负相关性,间接影响了产甲烷古菌生长代谢,从而导致产甲烷量降低。与处理实际物料的厌氧消化反应器相比,以丁酸为唯一碳源的厌氧反应器中,微生物群落结构较简单,长期供给含丁酸的合成废水可驯化出稳定的微生物群落且各微生物类群间相互作用较紧密。因此,添加GAC虽可能促进Geobacter潜在的直接电子传递能力,但对关键有机酸氧化菌及产甲烷古菌并无明显促进作用。后续可就实际物料厌氧消化体系中,微生物群落对抑制物的响应及导电介质介导直接电子传递过程进行深入研究。
| [1] |
蒲贵兵, 王胜军, 孙可伟. 接种量对泔脚发酵产氢余物甲烷化的强化研究[J]. 中山大学学报:自然科学版, 2009, 48(1): 87-92. |
| [2] |
Tang YQ, Shigematsu T, Morimura S, et al. Dynamics of the microbial community during continuous methane fermentation in continuously stirred tank reactors[J]. Journal of Bioscience and Bioengineering, 2015, 119(4): 375-383. DOI:10.1016/j.jbiosc.2014.09.014 |
| [3] |
Ramsay IR, Pullammanappallil PC. Protein degradationduring anaerobic wastewater treatment: derivation of stoichiometry[J]. Biodegradation, 2001, 12(4): 247-57. DOI:10.1023/A:1013116728817 |
| [4] |
De Bok FAM, Stams AJM, Dijkema C, et al. Pathway of propionate oxidation by a syntrophic culture of Smithella propionica and Methanospirillum hungatei[J]. Applied and Environmental Microbiology, 2001, 67(4): 1800-1804. DOI:10.1128/AEM.67.4.1800-1804.2001 |
| [5] |
Dolfing J. Syntrophic propionate oxidation via butyrate: a novel window of opportunity under methanogenic conditions[J]. Applied Environmental Microbiology, 2013, 79(14): 4515-4516. DOI:10.1128/AEM.00111-13 |
| [6] |
易悦, 王慧中, 郑丹, 等. 丁酸和戊酸互营氧化产甲烷微生物学研究进展[J]. 中国沼气, 2017, 35(3): 3-10. DOI:10.3969/j.issn.1000-1166.2017.03.001 |
| [7] |
Hansen KH, Angelidaki I, Ahring BK. Anaerobic digestion of swine manure: inhibition by ammonia[J]. Water Research, 1998, 32(1): 5-12. DOI:10.1016/S0043-1354(97)00201-7 |
| [8] |
Nanninga HJ, Gottschal JC. Anaerobic purification of waste water from a potato-starch producing factory[J]. Water Research, 1986, 20(1): 97-103. DOI:10.1016/0043-1354(86)90220-4 |
| [9] |
Genschow E, Hegemann W, Maschke C. Biological sulfate removal from tannery wastewater in a two-stage anaerobic treatment[J]. Water Research, 1996, 30(9): 2072-2078. DOI:10.1016/0043-1354(96)00332-6 |
| [10] |
Fedler CB, Day DL. Anaerobic digestion of swine manure containing an antibiotic inhibitor[J]. Agricultural waste utilization and management Proceedings of the 5th International Symposium on Agricultural Wastes, 1985, 523-530. |
| [11] |
Bauer A, Lizasoain J, Nettmann E, et al. Effects of the antibiotics chlortetracycline and enrofloxacin on the anaerobic digestion in continuous experiments[J]. BioEnergy Research, 2014, 7(4): 1244-1252. DOI:10.1007/s12155-014-9458-0 |
| [12] |
Sanz JL, Rodríguez N, Amils R. The action of antibiotics on the anaerobic digestion process[J]. Applied Microbiology and Biotechnology, 1996, 46(5-6): 587-592. DOI:10.1007/s002530050865 |
| [13] |
Briones A, Raskin L. Diversity and dynamics of microbial communities in engineered environments and their implications for process stability[J]. Current Opinion in Biotechnology, 2003, 14(3): 270-276. DOI:10.1016/S0958-1669(03)00065-X |
| [14] |
Zhao L, Dong YH, Wang H. Residues of veterinary antibiotics in manures from feedlot livestock in eight provinces of China[J]. Science of the Total Environment, 2010, 408(5): 1069-1075. DOI:10.1016/j.scitotenv.2009.11.014 |
| [15] |
Xu W, Zhang G, Li X, et al. Occurrence and elimination of antibiotics at four sewage treatment plants in the Pearl River Delta(PRD), South China[J]. Water Research, 2007, 41(19): 4526-4534. DOI:10.1016/j.watres.2007.06.023 |
| [16] |
尹福斌, 季超, 董红敏, 等. 畜禽粪便中残留抗生素对厌氧消化影响的研究进展[J]. 中国农业科技导报, 2016, 18(5): 171-177. |
| [17] |
孙建平, 郑平, 胡宝兰. 金霉素对猪场废水厌氧消化抑制作用[J]. 哈尔滨工业大学学报, 2010, 42(4): 652-655. |
| [18] |
张小元, 李香真, 李家宝. 微生物互营产甲烷研究进展[J]. 应用与环境生物学报, 2016, 22(1): 156-166. |
| [19] |
Lovley DR. Happy together: microbial communities that hook up to swap electrons[J]. Isme Journal, 2017a, 11(2): 327-336. DOI:10.1038/ismej.2016.136 |
| [20] |
Lovley DR. Syntrophy goes electric: direct interspecies electron transfer[J]. Annual Review of Microbiology, 2017, 71(1): 643-664. DOI:10.1146/annurev-micro-030117-020420 |
| [21] |
Morita M, Malvankar NS, Franks AE, et al. Potential for direct interspecies electron transfer in methanogenic wastewater digester aggregates[J]. MBio, 2011, 2(4): 00159-00111. |
| [22] |
Zhao Z, Li Y, Yu Q, et al. Ferroferric oxide triggered possible direct interspecies electron transfer between, Syntrophomonas, and, Methanosaeta, to enhance waste activated sludge anaerobic digestion[J]. Bioresource Technology, 2017, 250: 79-85. |
| [23] |
Tang J, Zhuang L, Ma J, et al. Secondary mineralization of ferrihydrite affects microbial methanogenesis in GeobacterMethanosarcina cocultures[J]. Applied & Environmental Microbiology, 2016, 82(19): 5869-5877. |
| [24] |
Chen S, Rotaru AE, Liu F, et al. Carbon cloth stimulates direct interspecies electron transfer in syntrophic cocultures[J]. Bioresour Techol, 2014, 173: 82-86. DOI:10.1016/j.biortech.2014.09.009 |
| [25] |
Chen S, Rotaru AE, Shrestha PM, et al. Promoting interspecies electron transfer with biochar[J]. Scientific Reports, 2014, 4: 5019-5019. |
| [26] |
Liu F, Rotaru AE, Shrestha PM, et al. Magnetite compensates for the lack of a pilin-assoicated c-type cytochrome in extracellular electron exchange[J]. Environmental Microbiology, 2015, 17(3): 648-655. DOI:10.1111/1462-2920.12485 |
| [27] |
Pham TH, Aelterman P, Verstraete W, et al. Bioanode performance in bioelectrochemical systems: recent improvements and prospects[J]. Trends Biotechnol. 27, 2009, 27(3): 168-178. DOI:10.1016/j.tibtech.2008.11.005 |
| [28] |
Liu F, Rotaru AE, Shrestha PM, et al. Promoting direct interspecies electron transfer with activated carbon[J]. Energy & Environmental Science, 2012, 5(10): 8982-8989. |
| [29] |
Lee JY, Lee SH, Park HD. Enrichment of specific electro-active microorganisms and enhancement of methane production by adding granular activated carbon in anaerobic reactors[J]. Bioresource Technology, 2016, 205(54): 205-212. |
| [30] |
Shigematsu T, Tang Y, Kawaguchi H, et al. Effect of dilution rate on structure of a mesophilic acetate-degrading methanogenic community during continuous cultivation[J]. Journal of Bioscience and Bioengineering, 2003, 96(6): 547-558. DOI:10.1016/S1389-1723(04)70148-6 |
| [31] |
Griffiths RI, Whiteley AS, O'donnell AG, et al. Rapid method for coextraction of DNA and RNA from natural environments for analysis of ribosomal DNA-and rRNA-based microbial community composition[J]. Applied and Environmental Microbiology, 2000, 66(12): 5488-5491. DOI:10.1128/AEM.66.12.5488-5491.2000 |
| [32] |
Bolger A, Scossa F, Bolger ME, et al. The genome of the stress-tolerant wild tomato species Solanum pennellii[J]. Nature Genetics, 2014, 46(9): 1034. DOI:10.1038/ng.3046 |
| [33] |
Fouhy F, Deane J, Rea MC, et al. The effects of freezing on faecal microbiota as determined using MiSeq sequencing and culture-based investigations[J]. PLoS One, 2015, 10(3): 119-355. |
| [34] |
Jiang X, Hayashi J, Sun ZY, et al. Improving biogas production from protein-rich distillery wastewater by decreasing ammonia inhibition[J]. Process Biochem, 2013, 48(11): 1778-1784. DOI:10.1016/j.procbio.2013.08.014 |
| [35] |
Fontana A, Patrone V, Puglisi E, et al. Effects of geographic area, feedstock, temperature, and operating time on microbial communities of six full-scale biogas plants[J]. Bioresource Technology, 2016, 218: 980-990. DOI:10.1016/j.biortech.2016.07.058 |
| [36] |
Campanaro S, Treu L, Kougias PG, et al. Metagenomic binning reveals the functional roles of core abundant microorganisms in twelve full-scale biogas plants[J]. Water Research, 2018, 140(1): 123-134. |
| [37] |
Brenner, Don J, Krieg, et al. Bergey's Manual? of Systematic Bacteriology[M]. US: Springer, 2005.
|
| [38] |
Niclas K, Stefan S, Paul S. Potential impact of process parameters upon the bacterial diversity in the mesophilic anaerobic digestion of beet silage[J]. Bioresource Technology, 2011, 102(10): 5692-5701. DOI:10.1016/j.biortech.2011.02.108 |
| [39] |
Goff OL, Bru-Adan V, Bacheley H, et al. The microbial signature of aerosols produced during the thermophilic phase of composting[J]. Journal of Applied Microbiology, 2010, 108(1): 325-340. DOI:10.1111/j.1365-2672.2009.04427.x |
| [40] |
Westerholm M, Roos S, Anna S. Tepidanaerobacter acetatoxydans sp. nov. an anaerobic, syntrophic acetate-oxidizing bacterium isolated from two ammonium-enriched mesophilic methanogenic processes[J]. Systematic & Applied Microbiology, 2011, 34(4): 260-266. |
| [41] |
Nobu MK, Narihiro T, Rinke C, et al. Microbial dark matter ecogenomics reveals complex synergistic networks in a methanogenic bioreactor[J]. The ISME Journal, 2015, 9(8): 1710-1722. DOI:10.1038/ismej.2014.256 |
| [42] |
Geizecler T, Sarah H, Daniel W, et al. Proteiniphilum saccharofermentans, strr. M3/6 T, isolated from a laboratory biogas reactor is versatile in polysaccharide and oligopeptide utilization as deduced from genome-based metabolic reconstructions[J]. Biotechnology Reports, 2018, 18: e00254. DOI:10.1016/j.btre.2018.e00254 |
| [43] |
Ma K, Liu X, Dong X. Methanosaeta harundinacea sp. nov. a novel acetate-scavenging methanogen isolated from a UASB reactor[J]. International Journal of Systematic & Evolutionary Microbiology, 2006, 56(1): 127-131. |
| [44] |
Zhang S, Chang J, Lin C, et al. Enhancement of methanogenesis via direct interspecies electron transfer between, Geobacteraceae, and, Methanosaetaceae, conducted by granular activated carbon[J]. Bioresource Technology, 2017, 245: 132-137. DOI:10.1016/j.biortech.2017.08.111 |
| [45] |
Rotaru AE, Shrestha PM, Liu F, et al. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane[J]. Energy & Environmental Science, 2014, 7: 408-415. |
| [46] |
Wasserfallen A, Nolling J, Pfister P, et al. Phylogenetic analysis of 18 thermophilic Methanobacterium isolates supports the proposals to create a new genus, Methanothermobacter genn. nov. and to reclassify several isolates in three species, Methanothermobacter thermautotrophicus comb. nov. Methanothermobacter wolfeii comb. nov. and Methanothermobacter marburgensis sp. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 2000, 50(1): 43-53. DOI:10.1099/00207713-50-1-43 |
| [47] |
Ahring BK, Ibrahim AA, Mladenovska Z. Effect of temperature increase from 55 to 65℃ on performance and microbial population dynamics of an anaerobic reactor treating cattle manure[J]. Water Research, 2001, 35(10): 2446-2452. DOI:10.1016/S0043-1354(00)00526-1 |
| [48] |
Álvarez JA, Otero L, Lema JM, 等. The effect and fate of antibiotics during the anaerobic digestion of pig manure[J]. Bioresource Technology, 2010, 101(22): 8581-8586. |
| [49] |
李坚, 汤佳, 庄莉, 等. 导电性生物炭促进geobacter和methanosarcina共培养体系互营产甲烷过程[J]. 生态环境学报, 2018, 27(7): 1260-1268. |
| [50] |
Mccarthy PL, Mckinney RE. Volatile acid toxicity in anaerobic digestion[J]. Journal, 1961, 33(3): 223-232. |
| [51] |
Xing L, Shiyan Z, Christopher R, et al. Syntrophic growth with direct interspecies electron transfer between pili-free Geobacter species[J]. The ISME Journal, 2018, 12(6): 2142-2151. |
| [52] |
Ben HW, Postec A, Aüllo T, et al. Mesotogainfera sp. nov., a mesophilic member of the order Thermotogales, isolated from an underground gas storage aquifer[J]. International Journal of Systematic and Evolutionary Microbiology, 2013, 63(8): 3003-3008. |
| [53] |
Barberán A, Bates ST, Casamayor EO, et al. Using network analysis to explore co-occurrence patterns in soil microbial communities[J]. The ISME Journal, 2011, 6(2): 343. |
| [54] |
Li B, Yang Y, Ma L, et al. Metagenomic and network analysis reveal wide distribution and co-occurrence of environmental antibiotic resistance genes[J]. The ISME Journal, 2015, 9: 2490. DOI:10.1038/ismej.2015.59 |
| [55] |
Quan ZX, Im WT, Lee ST. Azonexus caeni sp. nov., a denitrifying bacterium isolated from sludge of a wastewater treatment plant[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(5): 1043-1046. DOI:10.1099/ijs.0.64019-0 |
| [56] |
Guo HG, Liu RY, Yu ZS, et al. Pyrosequencing reveals the dominance of methylotrophic methanogenesis in a coal bed methane reservoir associated with Eastern Ordos Basin in China[J]. International Journal of Coal Geology, 2012, 93: 56-61. DOI:10.1016/j.coal.2012.01.014 |
| [57] |
Yin Q, Hu Z, Sun Y, et al. Effect of the dosage of ferroferric oxide on batch anaerobic treatment of high strength synthetic wastewater[J]. Desalination & Water Treatment, 2017, 92: 152-158. |