曲霉属(Aspergillus spp.)真菌广泛存在于土壤、植物性食品和饲料原料中,尤其是粮谷类作物在种植、储藏和运输过程中极易被污染[1],其代谢产生的真菌毒素对人畜健康具有较大威胁。其中最重要的真菌毒素有黄曲霉毒素(Aflatoxin,AFs)、赭曲霉毒素(Ochratoxin,OTs)、呕吐毒素(Deoxynivalenol,DON)、玉米赤霉烯酮(Zearalenone,ZEN)、伏马毒素(Fumonisins,FB)等[2]。据联合国粮农组织(Food and agriculture organization of the united nations,FAO)估计,世界上约有25%的谷物受到真菌毒素的污染[3]。受真菌污染的饲料不仅营养成分被破坏,同时真菌及其产生的毒素会影响动物健康及生产效率,且能通过食物链间接影响人类的健康和安全[4]。
赭曲霉(Aspergillus ochraceus)是赭曲霉毒素A(Ochratoxin A,OTA)的主要产生菌,广泛污染谷物、豆类、葡萄、咖啡等农副产品,可以引起人类和动物的肝脏、肾脏损伤,并有致畸、致突变、致癌和免疫抑制作用[5]。黄曲霉(Aspergillus flavus)可以产生AFs,其中的黄曲霉毒素B1(Aflatoxin B1,AFB1)具致癌性和致畸性,被国际癌症研究机构(International agency for research on cancer,IARC)列为1类致癌物[6]。世界主要国家或地区的食品监管机构已经制定了一系列针对不同食品中OTA和AFB1的最大允许限值(Maximum permissible limit,MPL)[5, 7],用于保障人类的健康安全,我国规定谷物及其制品类别中OTA和AFB1的最高限量标准为5 μg/kg和20 μg/kg[8]。
目前,防治真菌毒素污染的方法主要有化学防治法、生物防治法、加强采后贮藏管理等。化学试剂的使用会使得菌株产生抗性,若使用不当,还会增加毒素的产生[9]。生物防治技术是减少或完全清除真菌及其毒素污染的最有前途和最有效的方法[10],其中利用拮抗微生物来抑制原料生产和储藏过程中真菌的污染,从源头控制产毒微生物的增殖,是最大程度的减少真菌及毒素危害的有效途径。目前,已经报道的能够拮抗赭曲霉或黄曲霉的细菌包括亚麻短杆菌(Brevibacterium linens)、表皮短杆菌(Brev. epidermidis)[11]、嗜酸乳杆菌(Lactobacillus acidophilus)[12]、枯草芽孢杆菌(Bacillus subtilis)[13-14]、荧光假单胞菌(Pseudomonas fluorescens)[15]等。本研究旨在从土壤和粮食原料中筛选同时拮抗黄曲霉和赭曲霉的细菌,鉴定并确认其抑菌活性,进而利用微生物及其代谢物来抑制产毒曲霉的生长,从而减少毒素的产生,为进一步研究抑菌机制、探索高效抑菌制剂研发提供材料准备和基础数据。
1 材料与方法 1.1 材料样品:采自北京市怀柔区长哨营乡板栗种植园根部土壤;市售赤豆。
供试真菌:赭曲霉AS 3.4412(A. ochraceus AS 3.4412)、黄曲霉AS 3.870(A. flavus AS 3.870),由本实验室保存。
培养基:营养肉汤(NA)、马铃薯葡萄糖(PDA)琼脂培养基、马铃薯葡萄糖肉汤(PDB)液体培养基、牛肉膏蛋白胨(LB)液体培养基均参照参考文献[16]进行配制。
引物27F/1492R和Bam-man-1F/Bam-man-1R以及PCR反应体系的各种试剂均购自睿博兴科生物技术有限公司;细菌DNA提取试剂盒,天根生化科技(北京)有限公司。
1.2 方法 1.2.1 拮抗细菌的分离、纯化细菌分离采用稀释涂布法[17]。采集5个地点的10份土壤样品,分别称取2.0 g样品于20 mL灭菌生理盐水中充分震荡。混合液180 r/min离心20 min取上清液,梯度稀释为原浓度的10-2、10-3倍,用于筛选环境细菌。市售赤豆用去离子水冲洗,用75%乙醇浸泡30 s,用无菌双蒸水清洗1 min。无菌滤纸吸干赤豆表面水分,取5粒加10 mL无菌生理盐水充分研磨,全部转移至离心管中,再加10 mL无菌生理盐水,于3 500 r/min离心10 min取上清液,梯度稀释为原浓度的10-2倍,用于筛选内生细菌。
取100 μL稀释液涂布于NA固体培养基,37℃倒置培养。观察16 h、24 h、32 h和48 h后的生长状况(菌落大小、形态、色泽、边缘、数量)。从中挑取表型差异的单菌落,转接至新的NA平板上进行扩大培养。将纯化后的菌种转入斜面试管保存。
1.2.2 拮抗细菌的初筛初筛采用平板对峙法[18],用打孔器取直径约为5 mm的赭曲霉、黄曲霉(以新生菌丝为主的菌块)单独接种在PDA平板中央。将PDA平板分为4个区域,接种分离纯化培养的细菌于PDA平板距曲霉菌块2 cm处的3点,另一点不接种细菌作为对照,28℃培养3 d。初步筛选出具有拮抗作用的细菌后,将PDA平板分为两部分,平板中央点种曲霉菌块,一部分中央处接种细菌,另一边作为空白对照,28℃培养3 d,测定曲霉菌菌丝直径,计算抑制率。每个菌株重复2次。
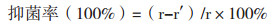
r为对照一侧菌落中心到菌落边缘的距离,r′为处理一侧菌落中心到菌落边缘的距离。
1.2.3 拮抗细菌的复筛 1.2.3.1 曲霉孢子悬液的制备将产毒菌株赭曲霉AS 3.4412和黄曲霉AS 3.870接种到PDA平皿,28℃培养72 h。待孢子形成后,每个平板中加入10 mL含0.05%(V/V)吐温80的无菌生理盐水,用多层纱布过滤除去菌丝残体,充分震荡后制成孢子悬浮液。用血球计数板计数,调整孢子浓度为1×107 CFU/mL。
1.2.3.2 无菌发酵上清液制备挑取在NA培养基上生长的菌株,接种于50 mL LB培养基中,37℃、200 r/min条件下,振荡培养48 h。在4℃、10 000 r/min条件下,将发酵液离心10 min取上清液,上清液于4 500 r/min、4℃下离心40 min,用0.22 μm微孔滤膜过滤作为上清液实验材料。
1.2.3.3 牛津杯法复筛取100 μL曲霉菌孢子悬液涂布于PDA平板上。将PDA平皿分为4个区域,每个板上放置4个牛津杯,向其中3个加入100 μL无菌上清液,另一个加入100 μL LB培养基作为对照[19],28℃恒温培养2 d,连续观察。观察牛津杯周围是否有抑菌圈,并用十字测量法测定抑菌圈直径。每组2个平行。
1.2.4 拮抗细菌的鉴定 1.2.4.1 形态特征鉴定将获得的拮抗菌于LA固体培养基37℃恒温培养24 h,观察菌落形态,经简单染色和革兰氏染色,在1 000倍显微镜下观察菌体形态。
1.2.4.2 生理生化特征鉴定接触酶试验、淀粉水解、葡萄糖氧化发酵试验、M.R试验、糖醇发酵试验,均参照东秀珠等《常见细菌系统鉴定手册》[20]进行。各处理均进行2次重复。
1.2.4.3 16S rDNA鉴定使用细菌DNA提取试剂盒提取菌株基因组DNA。以拮抗菌株基因组作为扩增的模板,用引物正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)、反向引物1492R(5′-CGGTTACCTTGTTACGACTT-3′),终浓度1 μL/25 μL反应体系(ddH2O 17.3 μL、10×Buffer 2.5 μL、dNTP 2 μL、上游引物1 μL、下游引物1 μL、DNA模板1 μL、Taq酶0.2 μL)。反应条件:94℃预变性5 min,94℃变性45 s,56℃退火45 s,72℃延伸90 s,循环30次。
取10 μL扩增产物进行2%琼脂糖凝胶电泳,凝胶成像系统中观察PCR产物片段大小。PCR产物由北京睿博兴科生物技术有限公司测序。测序序列,登录NCBI数据库进行BLAST同源性分析,利用MEGA 7.0进行序列比对,构建系统发育树。
1.2.4.4 枯草芽孢杆菌近缘种群特异PCR鉴定采用细菌基因组提取试剂盒提取细菌DNA。采用枯草芽孢杆菌群解淀粉芽孢杆菌特异性引物[21]:正向引物Bam-man-1F(5′-TCGGTTTCACATCCTTCATC-3′),反向引物Bam-man-1R(5′-TTTGTCAGCGTGTCTTCTG-3′),对该菌的β-甘露聚糖酶基因进行PCR反应。以拮抗菌株基因组作为扩增的模板,终浓度1 μL/25 μL反应体系(ddH2O 17.3 μL、10×Buffer 2.5 μL、dNTP 2 μL、上游引物1 μL、下游引物1 μL、DNA模板1 μL、Taq酶0.2 μL)。反应条件:94℃预变性5 min,94℃变性45 s,50℃退火45 s,72℃延伸90 s,循环30次。取10 μL扩增产物进行2%琼脂糖凝胶电泳,凝胶成像系统中观察PCR产物片段大小。
1.2.5 SC-B15抑菌活性物质的性质研究经温度、pH、蛋白酶的不同处理后,以抑菌圈直径反映上清液的抑菌活性,抑菌圈直径越大,抑菌效果越好。牛津杯的外径为8 mm,抑菌圈直径超过8 mm说明有抑菌活性。
1.2.5.1 温度稳定性实验分别取上清液1.5 mL于5支2 mL离心管中,在20、40、60、80和100℃温度条件下水浴处理30 min[19],恢复至室温后,0.22 μm细菌过滤器去除菌体,用牛津杯法检测抑菌活性,培养2 d后,用十字交叉法测量抑菌圈直径。
1.2.5.2 pH稳定性实验取上清液2 mL于6支10 mL离心管中,分别将pH值调至2.0、4.0、6.0、8.0、10.0、12.0,于室温下放置2 h,0.22 μm细菌过滤器去除菌体,用牛津杯法检测抑菌活性,培养2 d后,用十字交叉法测量抑菌圈直径。
1.2.5.3 蛋白酶稳定性实验分别取上清液2 mL于3支10 mL离心管中,测定其初始pH值。调节至对应所用蛋白酶的最适pH值后,分别向其中添加木瓜蛋白酶(pH=7.0)、胰蛋白酶(pH=8.0)、胃蛋白酶(pH=2.0),37℃水浴2 h后,再调pH值至与上清液初始相同。0.22 μm细菌过滤器去除菌体,以同等浓度的酶为对照,用牛津杯法检测抑菌活性,培养2 d后,用十字交叉法测量抑菌圈直径。
1.2.6 拮抗菌株生防机理的探究 1.2.6.1 利用显微观测拮抗细菌对曲霉菌体生长的影响参考1.2.2步骤,从曲霉受到抑制的一侧的菌丝取样,以另一侧正常生长的菌丝作为空白对照,使用棉蓝试剂染色并在400倍光学显微镜下观察菌丝形态。
1.2.6.2 上清液对曲霉孢子萌发的影响将赭曲霉AS 3.4412和黄曲霉AS 3.870的孢子浓度调整为1×107 CFU/mL,按1%的接种量,分别与等体积的无菌上清液混合培养于PDB液体培养基中[13](以加入LB培养基为对照),置28℃摇床培养,18 h后观察曲霉孢子萌发情况。
1.2.7 SC-B15菌株鉴定方法将测序获得的16S rDNA序列提交至NCBI中,在GenBank中通过BLAST进行序列比对。根据同源性相似度差异,选取同源性较高的聚类菌株,使用MEGA 7.0软件通过Neighbor-Joining法构建系统发育树,与数据库中登录的近源菌株系统发育关系进行分析,比较遗传进化距离。
1.2.8 数据处理方法实验重复3次,数据用平均值±标准偏差表示,用软件SPSS 19.0中的配对样本t检验分析比较处理组间的差异,在α=0.05水平下检验其差异显著性。
2 结果 2.1 细菌分离纯化经涂布培养,共从5个采集地点的10份种植园土壤和赤豆样品中,筛选出58株能在NA培养基上生长良好且外表性状不同的细菌菌株,其中有43株源于种植园土壤,15株源于赤豆样品,属于赤豆内生菌。
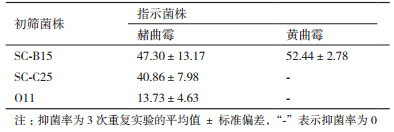
2.2 拮抗细菌初筛结果经平板对峙法筛选,源于土壤的2株环境细菌(SC-B15、SC-C25)和源于赤豆的1株内生细菌(O11)对赭曲霉AS 3.4412均有抑制作用,其中菌株SC-B15同时对黄曲霉AS 3.870有抑制作用。SC-B15对赭曲霉和黄曲霉的抑菌率分别为(47.30±13.17)%、(52.44±2.78)%(表 1)。
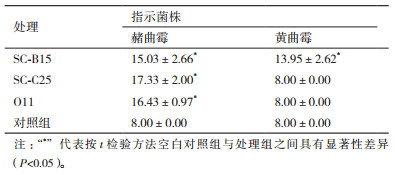
细菌发酵液经离心、超滤,去除菌体后,进行牛津杯法抑菌实验分析。结果如表 2所示:SC-B15发酵上清液对赭曲霉AS 3.4412和黄曲霉AS 3.870的抑菌圈直径分别为15.03±2.66 mm和13.95±2.62 mm,表明细菌SC-B15的代谢产物能显著抑制赭曲霉和黄曲霉的生长。
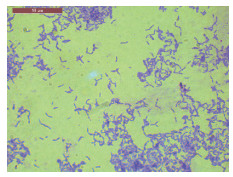
SC-B15菌株在NA固体培养基上37℃培养24 h后,如图 1所示,菌落呈圆形,凸起,表面褶皱,边缘不规则,表面无光泽,灰白色,不透明,直径3-4 mm,黏稠。光学显微镜下观察,菌体呈短杆状,革兰染色均匀且为阳性,大小均匀,芽孢中生,不膨大(图 2)。

|
| 图 1 SC-B15在NA固体培养基培养24 h后的菌落形态 |
|
| 图 2 SC-B15的显微形态观察结果(×1000) |
结果显示,菌株SC-B15接触酶反应、淀粉水解、葡萄糖、纤维二糖、D-山梨醇、乳糖、麦芽糖、甘露醇、肌醇发酵均为阳性,甲基红试验为阴性,该菌株符合芽孢杆菌(Bacillus sp.)的基本理化特性,与解淀粉芽孢杆菌有极高的相似性。
2.4.3 16S rDNA序列同源性鉴定采用细菌通用引物27F/1492R对SC-B15进行基因PCR扩增,得到大小1 430 bp片段。在NCBI数据库中与已知序列进行BLAST比对,结果如图 3显示,SC-B15与解淀粉芽孢杆菌(B. amyloliquefaciens)(登录号:KC887505.1)的16S rDNA同源性达到99%以上。使用MEGA7.0软件构建系统发育树,进一步证明拮抗菌SC-B15属于解淀粉芽孢杆菌。
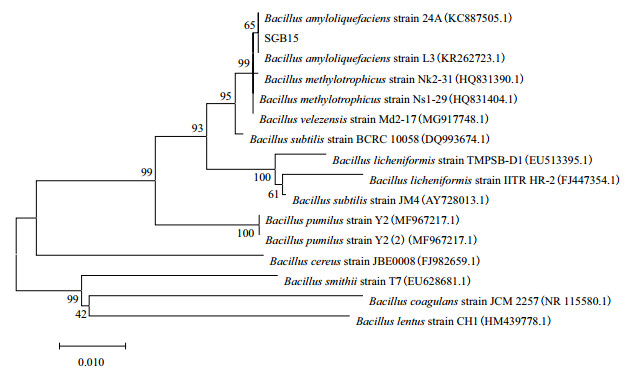
|
| 图 3 SC-B15的系统进化树 |
采用枯草芽孢杆菌群特异性引物Bam-man-1F/Bam-man-1R对SC-B15的β-甘露聚糖酶基因进行PCR反应[21],PCR扩增产物用2%琼脂糖凝胶电泳检测,得到大小约1 300 bp片段(图 4),对应解淀粉芽孢杆菌PCR引物大小为1 275 bp。出现的单一条带与预期产物分子量一致,再一次证实SC-B15为解淀粉芽孢杆菌。
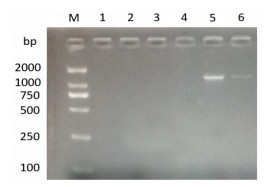
|
| M:Marker;1-2:SC-C25;3-4:O11;5-6:SC-B15 图 4 枯草芽孢杆菌群特异PCR产物电泳分析 |
上清液经不同温度处理后,对赭曲霉的抑菌活性变化很小,抑菌圈直径均在19.4-21.2 mm之间,仍保持着较强的抑菌活性;对黄曲霉抑菌活性在20-40℃范围内较强,抑菌圈直径均在18.9-21.0 mm之间,60、80、100℃处理后抑菌活性减小,抑菌圈直径均在8.5-9.3 mm(图 5)。
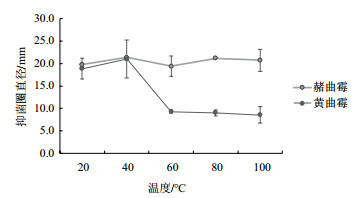
|
| 图 5 解淀粉芽孢杆菌SC-B15对曲霉菌的温度抑菌稳定性 |
上清液经不同pH值处理后,对赭曲霉的抑菌活性在pH为2、4和12的条件下减弱许多,抑菌圈直径平均为8.3-8.9 mm,在pH 6-10的范围内抑菌活性较强,抑菌圈直径平均为17.4-19.5 mm,pH=10时对赭曲霉抑菌活性最高;对黄曲霉的抑菌活性在pH为2、4和12的条件下同样减弱许多,抑菌圈直径平均为8.0 mm,在pH 6-10的范围内抑菌活性较强,抑菌圈直径平均为16.0-24.5 mm,pH=8时对黄曲霉抑菌活性最高(图 6)。
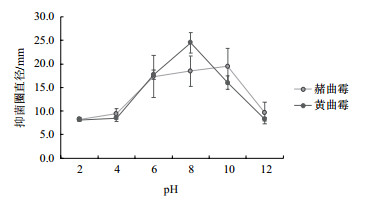
|
| 图 6 解淀粉芽孢杆菌SC-B15对曲霉菌的pH抑菌稳定性 |
上清液分别用胃蛋白酶、胰蛋白酶或木瓜蛋白酶处理后发现(图 7),胃蛋白酶处理使得对赭曲霉的抑菌活性下降,抑菌圈平均直径为8.5 mm,与未处理组对照相比,胰蛋白酶和木瓜蛋白酶处理对赭曲霉抑菌效果无影响,抑菌圈直径平均为19.8 mm和19.5 mm;胃蛋白酶处理同样使得对黄曲霉的抑菌活性下降,抑菌圈平均直径为8.0 mm,与未处理组对照相比,胰蛋白酶和木瓜蛋白酶处理对黄曲霉抑菌效果有一定影响,但仍有较强的抑菌活性,抑菌圈直径平均为18.5 mm和12.0 mm。
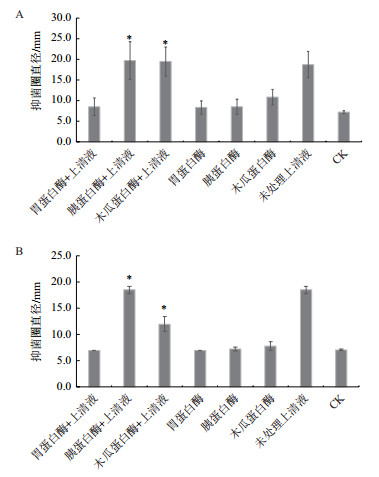
|
| A:赭曲霉;B:黄曲霉。“*”代表处理组与对照组之间具有显著性差异(P < 0.05);CK:空白对照组 图 7 解淀粉芽孢杆菌SC-B15对曲霉菌的蛋白酶抑菌稳定性 |
如图 8所示,与对照组对比,光学显微镜下受到解淀粉芽孢杆菌SC-B15拮抗作用的赭霉菌丝弯曲、变形,出现大量空泡,内部原生质体分布不均。黄曲霉菌丝有部分肿大、凸起、变形现象。

|
| A:赭曲霉AS 3.4412对照组;B:赭曲霉AS 3.4412处理组;C:黄曲霉AS 3.870对照组;D:黄曲霉AS 3.870处理组 图 8 受到解淀粉芽孢杆菌SC-B15拮抗作用的曲霉菌菌丝变化 |
如图 9-10所示,按1%接种量接种曲霉菌孢子,与对照组相比,实验组的孢子萌发较少,说明SC-B15对曲霉孢子萌发有一定的抑制作用。
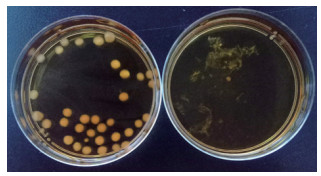
|
| 左:对照组;右:实验组 图 9 SC-B15对赭曲霉AS 3.4412孢子萌发影响 |
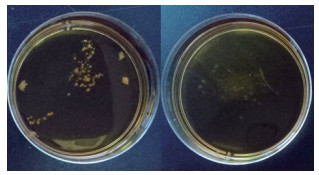
|
| 左:对照组;右:实验组 图 10 SC-B15对黄曲霉AS 3.870孢子萌发影响 |
芽孢杆菌(Bacillus spp.)作为自然界中具有抗逆优势的微生物菌群,大多为非致病性,并且很多种类都具有抑制真菌生长的能力[22],包括枯草芽孢杆菌(B. subtilis)、短小芽孢杆菌(B. pumilus)、地衣芽孢杆菌(B. lichniformis)及解淀粉芽孢杆菌(B. amyloliquefaciens)等[23-26]。解淀粉芽孢杆菌和枯草芽孢杆菌、地衣芽孢杆菌等10个有效发表种[27]被称为枯草芽孢杆菌近缘种群,该种群表型相近,大多能够产生较丰富的功能酶和功能蛋白[22],本文结合传统的16s rDNA结合β-甘露聚糖酶基的聚类分析进行鉴定,能够更加确证该菌株的分类地位,相比单一的分子鉴定方法,具有更多的明确性。
解淀粉芽孢杆菌(B. amyloliquefaciens)可以拮抗多数真菌的生长[28],已得到广泛的研究,但目前已知解淀粉芽孢杆菌多为拮抗单一真菌生长,Han等[29]从黄瓜根际土壤中分离得到的解淀粉芽孢杆菌B1408可减轻黄瓜枯萎病菌(Fusarium oxysporum f. sp. cucumerinum)诱导的危害。司世飞等[30]发现解淀粉芽孢杆菌B11可拮抗烟草赤星病菌(Alternaria alternata)。Siahmoshteh等[31]发现解淀粉芽孢杆菌UTB2能够抑制寄生曲霉(A. parasiticus)的生长。本研究中,发现解淀粉芽孢杆菌SC-B15对赭曲霉和黄曲霉的生长均具有较强的抑菌作用,并能一定程度上抑制霉菌孢子的萌发,霉菌孢子萌发是美军扩散和繁殖的主要途径,因此该菌株具有较好的应用价值预期。
本研究发现拮抗作用主要是解淀粉芽孢杆菌SC-B15发酵上清液产生的,因此对其作用温度、pH、蛋白酶耐受性等因素进行研究。该抑菌物质与其他报道的结果接近,大部分在中性及碱性环境中稳定,例如,陈成[32]获得的解淀粉芽孢杆菌HN-06的抗真菌物质其抑菌活性高的pH范围6-10,陈楠楠等[33]报道的解淀粉芽孢杆菌SSY2的抗菌物质可在pH 6-8的环境中保持稳定。本实验的抑菌物质在100℃处理30 min后对赭曲霉还有一定的抑菌作用,可能其抑菌主要成分也包含脂肽类物质,孙力军等[34]也有类似的报道,从豆豉中分离出的枯草芽孢杆菌(B.subtilis)NT-6的发酵液抗菌提取物的主要成分是抗菌脂肽类物质iturin、fengycin、surfactin同系物的混合物,在121℃条件下加热30 min活性不丧失,具有良好的耐热性;在对黄曲霉的抑菌实验中,抑菌物质对温度敏感,可能上清液中存在某种抑菌蛋白,对于抑菌蛋白的研究,刘洋等[35]报道内生芽孢杆菌1A通过分泌蛋白酶和纤维素酶,降解核桃根腐病菌等几种林木病原菌的细胞壁中蛋白质和纤维素,破坏其菌丝使得真菌的生长受到抑制。本实验的抑菌物质对胃蛋白酶敏感,对胰蛋白酶和木瓜蛋白酶不敏感,可能是由于胃蛋白酶具有一定的氨基酸序列选择特异性,优先断裂由芳香族氨基酸(如苯丙氨酸、色氨酸和酪氨酸)或亮氨酸形成的肽键[36],而胰蛋白酶能选择性的水解蛋白质中赖氨酸或精氨酸的羧基端肽键[37],木瓜蛋白酶可水解精氨酸和赖氨酸的羧基端[38],所以解淀粉芽孢杆菌SC-B15的抑菌蛋白的活性位点可能含有芳香族氨基酸或亮氨酸,无精氨酸和赖氨酸。对于解淀粉芽孢杆菌SC-B15上清液中脂肽和抑菌蛋白的分离纯化,还有待进一步研究。
4 结论从种植园土壤中筛选出一株生防菌株解淀粉芽孢杆菌SC-B15,能同时抑制赭曲霉和黄曲霉的生长,其代谢产物上清液有较强的抑制效果,能够影响菌丝形态和孢子萌发。抑菌物质在中性及碱性条件下稳定,拮抗赭曲霉热稳定性强,对胃蛋白酶敏感,对胰蛋白酶和木瓜蛋白酶不敏感。
| [1] |
Shahbazi Y, Shavisi N. Occurrence of aflatoxins and ochratoxin A in Gaz, a traditional Persian confection, and its ingredients[J]. Food Control, 2019, 98: 107-112. DOI:10.1016/j.foodcont.2018.11.023 |
| [2] |
Perrone G, Susca A, Cozzi G, et al. Biodiversity of Aspergillus species in some important agricultural products[J]. Studies in Mycology, 2007(59): 53-66. |
| [3] |
王健, 成桂红, 阮若云, 等. 动物源性食品中赭曲霉毒素A污染概况及检测方法研究进展[J]. 食品安全质量检测学报, 2018, 9(16): 4212-4217. DOI:10.3969/j.issn.2095-0381.2018.16.005 |
| [4] |
王守经, 胡鹏, 张奇志, 等. 畜禽饲料黄曲霉毒素的污染及其控制技术[J]. 农产品加工(学刊), 2010(10): 37-39. |
| [5] |
Benites AJ, Fernandes M, Boleto AR, et al. Occurrence of ochratoxin A in roasted coffee samples commercialized in Portugal[J]. Food Control, 2017, 73: 1223-1228. DOI:10.1016/j.foodcont.2016.10.037 |
| [6] |
Juan C, Zinedine A, Moltó JC, et al. Aflatoxins levels in dried fruits and nuts from Rabat-Salé area, Morocco[J]. Food Control, 2008, 19(9): 849-853. DOI:10.1016/j.foodcont.2007.08.010 |
| [7] |
Hassan ZU, Al-Thani R, Atia FA, et al. Evidence of low levels of aflatoxin M1 in milk and dairy products marketed in Qatar[J]. Food Control, 2018, 92: 25-29. DOI:10.1016/j.foodcont.2018.04.038 |
| [8] |
中国国家标准化管理委员会. GB 2761-2017.食品安全国家标准食品中真菌毒素限量[S].北京: 中国标准出版社, 2017.
|
| [9] |
宫小明, 马荣桧, 孙军, 等. 黄曲霉毒素生物防控菌的筛选及鉴定[J]. 微生物学杂志, 2015(2): 103-108. DOI:10.3969/j.issn.1005-7021.2015.02.019 |
| [10] |
鄢贵龙. 黄曲霉毒素的生物学去除方法[J]. 中国饲料, 2006(5): 29-31. DOI:10.3969/j.issn.1004-3314.2006.05.012 |
| [11] |
Hector R, Ines R, Francesca D, et al. Degradation of ochratoxin a by Brevibacterium species[J]. Journal of Agricultural and Food Chemistry, 2011, 59(19). |
| [12] |
Fuchs S, Sontag G, Stidl R, et al. Detoxification of patulin and ochratoxin A, two abundant mycotoxins, by lactic acid bacteria[J]. Food Chem Toxicol, 2008, 46(4): 1398-1407. DOI:10.1016/j.fct.2007.10.008 |
| [13] |
赵歉歉, 吴梦君, 董袁袁, 等. 枯草芽孢杆菌BS-Z15代谢产物抗真菌活性及对小鼠给药的安全性评价[J]. 天然产物研究与开发, 2018, 30(9): 1608-1613, 1620. |
| [14] |
朱新贵, 林捷. 几种食品微生物降解黄曲霉毒素作用的研究[J]. 食品科学, 2001(10): 65-68. DOI:10.3321/j.issn:1002-6630.2001.10.019 |
| [15] |
Akocak Pb, Churey Jj, Worobo Rw. Antagonistic effect of chitinolytic Pseudomonas and Bacillus on growth of fungal hyphae and spores of aflatoxigenic Aspergillus flavus[J]. Food Bioscience, 2015, 10: 48-58. DOI:10.1016/j.fbio.2015.01.005 |
| [16] |
章挺.枯草芽孢杆菌B-FS06对黄曲霉的抑制及活性物质的研究[D].南京: 南京师范大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10319-2007108692.htm
|
| [17] |
韩愈杰.黄曲霉拮抗菌株的分离筛选及对黄曲霉毒素的降解效果[D].保定: 河北农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10086-1015381925.htm
|
| [18] |
宫安东.镰刀菌和黄曲霉菌生防菌的分离及拮抗机理研究[D].武汉: 华中农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10504-1015387468.htm
|
| [19] |
李金芝.黄曲霉拮抗菌株的筛选、鉴定及其活性物质的初步研究[D].青岛: 青岛科技大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10426-1014194025.htm
|
| [20] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [21] |
刘勇, 李辉, 李金霞, 等. 特异PCR方法对枯草芽孢杆菌群的鉴定区分[J]. 饲料工业, 2010, 31(4): 52-54. |
| [22] |
陈楠楠, 秦平伟, 尹珺伊, 等. 解淀粉芽孢杆菌抗菌机制研究进展[J]. 中国微生态学杂志, 2018, 30(12): 1464-1469. |
| [23] |
Kilan-Feki O, Ben Khedher S, Dammak M, et al. Improvement of antifungal metabolites production by Bacillus subtilis V26 for biocontrol of tomato postharvest disease[J]. Biological Control, 2016, 95: 73-82. DOI:10.1016/j.biocontrol.2016.01.005 |
| [24] |
王明清, 张初署, 于丽娜, 等. 降解黄曲霉毒素B_1芽孢杆菌的筛选与鉴定[J]. 山东农业科学, 2018, 50(11): 71-75. |
| [25] |
贺惠文, 纪兆林, 徐敬友, 等. 地衣芽孢杆菌W10与化学药剂复配对桃褐腐病菌抑制活性的增效作用[J]. 亚热带植物科学, 2017, 46(4): 391-393. DOI:10.3969/j.issn.1009-7791.2017.04.019 |
| [26] |
刘俏, 权春善, 范圣第. 超滤解淀粉芽孢杆菌发酵液提取抗菌物质的研究[J]. 食品科技, 2006(7): 70-72. |
| [27] |
曹凤明, 杨小红, 马鸣超, 等. 枯草芽孢杆菌近缘种群鉴定方法研究进展[J]. 微生物学通报, 2014(5): 968-974. |
| [28] |
王继华, 徐世强, 张木清. 解淀粉芽孢杆菌的研究进展[J]. 亚热带农业研究, 2017, 13(3): 191-195. |
| [29] |
Han L, Wang Z, Li N, et al. Bacillus amyloliquefaciens B1408 suppresses Fusarium wilt in cucumber by regulating the rhizosphere microbial community[J]. Applied Soil Ecology, 2018. |
| [30] |
司世飞, 宋莉莎, 任静, 等. 一株抗烟草赤星病解淀粉芽孢杆菌的筛选及鉴定[J]. 河北大学学报:自然科学版, 2018, 38(4): 410-415. |
| [31] |
Siahmoshteh F, Hamidi-Esfahani Z, Spadaro D, et al. Unraveling the mode of antifungal action of Bacillus subtilis and Bacillus amyloliquefaciens as potential biocontrol agents against aflatoxigenic Aspergillus parasiticus[J]. Food Control, 2018, 89: 300-307. DOI:10.1016/j.foodcont.2017.11.010 |
| [32] |
陈成.一株解淀粉芽孢杆菌产抗真菌物质的研究[D].广州: 华南理工大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10561-1011044457.htm
|
| [33] |
陈楠楠, 尹珺伊, 王岩, 等. 解淀粉芽孢杆菌SSY2颉颃霉菌物质的鉴定及其理化性质研究[J]. 中国畜牧兽医, 2018, 45(11): 3221-3228. |
| [34] |
孙力军, 王雅玲, 刘唤明, 等. 抗菌豆豉发酵菌株的筛选及其脂肽组分鉴定和特性研究[J]. 中国生物工程杂志, 2013, 33(7): 50-56. |
| [35] |
刘洋, 朱天辉, 郑磊, 等. 一株内生拮抗细菌的分离鉴定及其抗菌机理研究[J]. 植物保护, 2016, 42(1): 33-39. DOI:10.3969/j.issn.0529-1542.2016.01.006 |
| [36] |
刘宇, 董平, 梁兴国. 胃蛋白酶的分离现状及其活性研究进展[J]. 生物学杂志, 2016, 33(3): 75-79. DOI:10.3969/j.issn.2095-1736.2016.03.075 |
| [37] |
郑文骏, 毛智翔, 黄琳娟, 等. 胰蛋白酶抑制剂在肿瘤治疗中的研究进展[J]. 检验医学与临床, 2018, 15(16): 2508-2511. DOI:10.3969/j.issn.1672-9455.2018.16.048 |
| [38] |
郑昆, 杨红. 木瓜蛋白酶在食品加工中的应用[J]. 生物化工, 2017, 3(5): 109-110. DOI:10.3969/j.issn.2096-0387.2017.05.031 |