2. 云南大学农学院,昆明 650000
2. School of Agriculture, Yunnan University, Kunming 650000
植物内生真菌(Endophytic fungi)是指整个或部分生活史存活于健康植物各种组织和器官内部,且不引发宿主植物明显病害症状的真菌[1]。在大多数情况下,内生真菌与植物之间是互惠共生的,一方面内生真菌通过植物体获得营养物质、庇护和传播;另一方面植物内生真菌可通过产生生物活性物质或借助信号转导对宿主植物提供保护,增强植物抗病、抗虫、抗干旱胁迫等能力[2]。已有研究表明,内生真菌能够产生次生代谢产物如萜类、生物碱、黄酮类和苯丙素类等[3];1994年朱至清等[4]首次报道从云南红豆杉树皮中分离出一株可以合成紫杉醇的内生真菌;王晓龙[5]对怀山药优势内生真菌的次生代谢产物进行研究,分离鉴定出8个化合物分别属于甾体、生物碱、脂肪酸及脂肪酸酯类成分。由于宿主不同内生真菌产生的次生代谢产物也不同,不仅可以产生与宿主相同或相似的次生代谢产物,而且还能产生宿主中不具备的新化合物,如苦马豆素(Swainsonine,SW)活性分子。SW是一种有毒生物碱,存在于豆科苦马豆属、黄芪属和棘豆属等多种植物中,可引起牲畜中毒。近年来研究发现SW的真正生产者是这些宿主植物的内生真菌[6]。这些研究结果表明了植物内生菌对宿主植物具有不可忽视的生理生化和代谢效应。
自然条件下由于与植物内生真菌菌群结构的复杂性和种类的多样性,许多与植物共生的内生真菌类群,以及内生真菌与宿主植物间的相互作用关系并未被完全阐明[7]。利用离体培养的植物细胞和分离纯培养的内生菌株建立有效的共培养体系,为探索特定内生菌菌株和植物细胞在生理生化层面的相互作用提供了一种可控的研究模型[8]。有研究从盾叶薯蓣根状茎中分离到一株内生真菌可以与盾叶薯蓣愈伤组织协调生长[7]。目前已有研究证明通过施加内生真菌能够改变葡萄的生理生化品质。黄丽华[9]通过对峙培养法建立了葡萄细胞与内生真菌的共培养体系表明两者共同培养能够调控愈伤组织理化性质;张秀英[10]通过研究葡萄细胞对内生真菌诱导子的理化响应证实了内生真菌提取物对植物细胞能够产生影响。但是关于葡萄内生真菌直接接触葡萄细胞的共培养方式所带来的生理生化响应目前尚不清楚。
本研究将分离自葡萄叶片的不同内生真菌菌株直接接种于具有合成花色苷能力的葡萄果肉细胞上,构建葡萄细胞与内生真菌的共培养体系,在细胞水平上研究与不同内生真菌共培养对葡萄细胞生长及类黄酮代谢途径影响的差异性。研究结果除了发掘到一批具有进一步研究和利用价值的内生真菌资源外,同时也为从庞大数量的内生菌中筛选具有不同潜在应用价值的内生菌资源提供必要方法和技术。
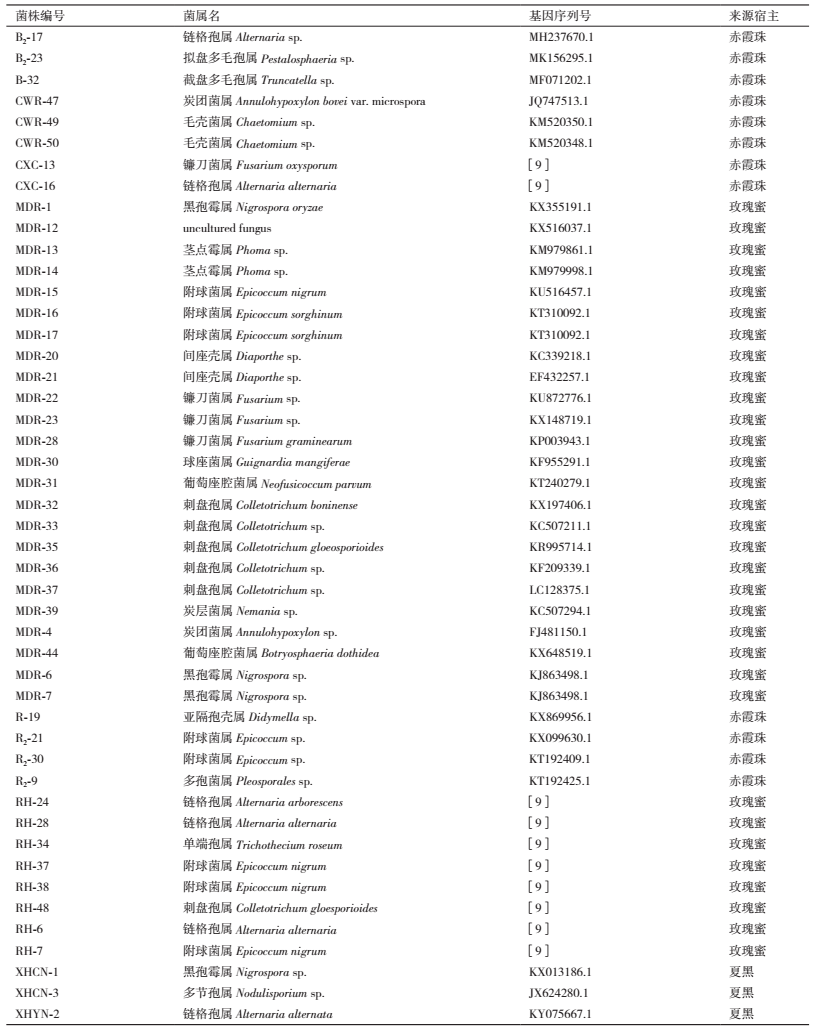
1 材料与方法 1.1 材料供试菌株:选取本实验室从赤霞珠(Vitis vinifera)、玫瑰蜜(V. Vinifera L.×V. labrusca L.)、夏黑葡萄(V. Vinifera L.×V. labrusca L.)的叶片中分离出的内生真菌菌株;各菌株在前期试验中已经通过形态和分子鉴定。本次试验共选取了47株内生真菌,18个属,其中链格孢属6株,附球菌属8株,黑孢霉属4株,镰刀菌属4株,刺盘孢属6株,间座壳属、毛壳菌属、葡萄座腔菌属、炭层菌属、炭团菌属各2株,单端孢属、多节孢属、截盘多毛孢属、茎点霉属、球座菌属、亚隔孢壳属、多孢菌属、拟盘多毛孢属各1株和1株未能归属的菌株(表 1)。
供试葡萄细胞:材料选用生长旺盛且长势一致紫色佳美果肉愈伤组织,并已继代培养5代以上。继代培养基为GS+0.2 mg/L KT+0.1 mg/L NAA+30 g/L蔗糖+7.6 g/L琼脂,pH为5.8。培养条件:25±2℃恒温箱中暗培养,约25 d继代1次。
1.2 方法 1.2.1 内生真菌与葡萄愈伤组织的共培养体系构建选取同一代相同来源且生长良好的愈伤组织1 g左右,接种于含葡萄细胞继代培养基的培养皿正中央,25±2℃条件下放入无光条件下培养7 d,同时将供试菌株置于PDA培养基上培养5 d左右,然后用蘸了无菌水的解剖针轻微蘸一下生长良好的相应菌株的菌落,接种于愈伤组织上,每个处理7个重复。愈伤组织对照以同样方式接种无菌水,内生真菌对照接种相应内生真菌不接种愈伤组织,以检测接种是否成功的阳性对照。从接种内生真菌后至接种后第6天,每天观察和统计愈伤组织褐化情况。并在共培养培养第6天后取出愈伤组织与内生真菌的共生体,液氮处理后置于-80℃冰箱中保存待用。
1.2.2 葡萄细胞的生理生化指标分析葡萄细胞增殖倍数(CIM)=(W样-m)/m
式中:W样为葡萄愈伤组织与内生真菌的共生体的质量(g);m为初始接种葡萄愈伤组织的质量(g)。
1.2.2.1 葡萄细胞花色苷总量的测定称取一定量鲜细胞(0.4 g左右),加入1 mL花色苷提取液(15 %盐酸(1.5 mol/L)-乙醇溶液)研磨,然后用花色苷提取液定容至5 mL,室温下超声提取30 min,离心(4℃,5 000 r/min,15 min),上清液即为花色苷提取液。花色苷的测定用分光光度计采用pH示差法测定。取两份1 mL的花色苷提取液,分别用pH 1.0 KCl和pH 4.5 CH3COONa缓冲液定容至6 mL,待反应平衡后(约60 min),用分光光度计分别测定两份溶液在700 nm和最大吸收峰波长535 nm处的吸光度值,以蒸馏水代替提取液做对照。花色苷总量用TAC(Total anthocyanins content)表示,通过以下公式计算各样品中花色苷含量[11]:
ΔA=(Aλ535-Aλ700)pH 1. 0-(Aλ535-Aλ700)pH 4. 5
TAC(mg/100 g)=(ΔA /ε L)× Mw × DF × V/ m × 100
式中:ε为矢车菊-3-葡萄糖苷的摩尔消光系数为26 900 L/mol /cm;L为比色皿的宽度(1 cm);Mw为矢车菊-3-葡萄糖苷的相对分子质量449.2 g /mol;DF为稀释倍数;V为提取液体积(mL);m为样品鲜重(g)。
1.2.2.2 苯丙氨酸解氨酶(PAL)活性的测定方法准确称取一定量愈伤组织细胞,加入少量PVP,1 mL预冷的0.05 mol/L pH 8.7硼酸缓冲液,迅速研磨后定容至5 mL,离心(4℃,10 min,8 000 r/min)。上清液即酶液。酶反应体系:0.05 mol/L pH 8.7硼酸缓冲液4 mL、0.02 mol/L苯丙氨酸溶液1 mL,酶液1 mL,40℃水浴反应1 h后,加入0.2 mL 6 mol/L HCl终止反应,以硼酸缓冲液代替酶液做为空白,在290 nm下测定OD值[10]:
PAL活性[U/(g. min)]=A290×V1/(V2×0.01×m×t)
式中:V1为提取酶液的总体积(mL);V2为测定时取用酶液体积(mL);m为样品鲜重(g);t为反应时间(min)。
1.2.3 数据分析运用Excel整理数据,制作图表,并用IBM SPSS Statistics 22.0软件对共培养后葡萄细胞的生理生化指标进行单因素方差分析,以及共培养后葡萄细胞的生理生化响应指数对试验所用不同内生真菌进行聚类分析。对葡萄细胞的褐化类型进行数字化标记:正常葡萄细胞标记为0,轻度褐化标记为1,中度褐化标记为2,高度褐化标记为3。其中葡萄细胞某指标的响应指数RI =(该指标样品测量值-该指标对照平均值)/该指标对照平均值。
2 结果 2.1 与不同内生真菌共培养能引起葡萄细胞不同程度的褐化与不同内生真菌菌株共培养后可以引起葡萄愈伤组织表现出不同程度的褐化作用,依据引起的愈伤组织褐化程度分成正常(未褐化)、轻度褐化、中度褐化、高度褐化4个等级(图 1)。所有参与测试的菌株中有12株内生真菌未造成细胞的明显褐化,8株内生真菌引起细胞轻度褐化,4株内生真菌造成细胞中度褐化,23株内生真菌造成细胞高度褐化(表 2。从菌株所属真菌属的层面分析发现,6株链格孢属(Alternaria)中4株未引起愈伤组织的褐化或者只引起轻度褐化,只有菌株RH-6引起葡萄细胞高度褐化。8株附球菌属(Epicoccum)中5株未引起愈伤组织的褐化或者只引起轻度褐化,菌株RH-38和MDR-17引起葡萄细胞高度褐化。4株黑孢霉属(Nigrospora)中只有菌株MDR-1引起葡萄细胞高度褐化,其余未造成愈伤组织的褐化或者只导致轻度褐化。所有镰刀菌属(Fusarium)均会造成细胞中度或者高度褐化。6株刺盘孢属(Colletotrichum)中只有RH-48未造成细胞褐化,其余均引起葡萄细胞中度或高度褐化。
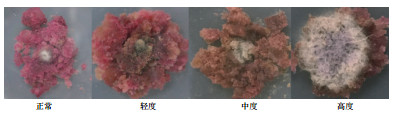
|
| 图 1 与内生真菌共培养后引起愈伤组织的不同程度的褐化类型 |
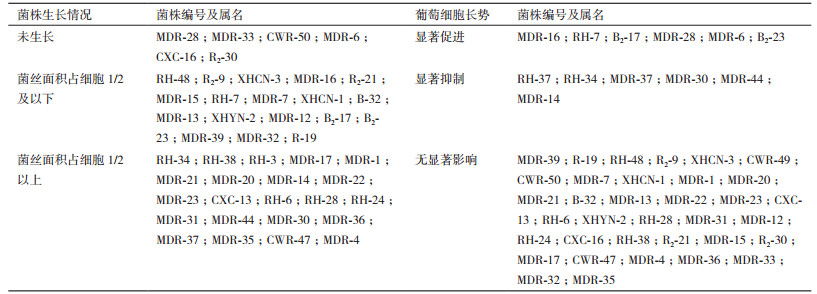
不同内生真菌菌株在葡萄愈伤组织上的生长状态差异巨大(表 3)。6株内生真菌在本次使用的细胞上未生长(同样方式直接接种到培养基上的相应内生真菌正常生长),对愈伤组织的生长和形态影响不明显。18株内生真菌在与细胞共培养6 d后菌落面积未达到细胞面积的一半,大部分菌株未引起愈伤组织的褐化或仅出现轻度褐化,只有菌株MDR-32(Colletotrichum boninense)和B-32(Truncatella sp.)使愈伤组织高度褐化。23株内生真菌在与细胞共培养6 d后菌落面积超过细胞面积的一半,并导致愈伤组织的严重褐化。接种不同内生真菌对葡萄细胞的生长有不同程度的影响。葡萄细胞与内生真菌共培养后,有6株内生真菌显著(P < 0.05)促进了葡萄细胞的生长(图 2),分别为:MDR-16(Epicoccum sorghinum)、RH-7(Epicoccum nigrum)、B2-17(Alternaria sp.)、MDR-28(Fusarium graminearum)、MDR-6(Nigrospora sp.)和B2-23(Pestalosphaeria sp.),其中菌株MDR-6对愈伤组织生长的促进作用最大,与对照相比增加了98.67%;6株内生真菌显著抑制了葡萄细胞的生长,分别为RH-37(Epicoccum nigrum)、RH-34(Trichothecium roseum)、MDR-37(Colletotrichum sp.)、MDR-30(Guignardia mangiferae)、MDR-44(Botryosphaeria dothidea)和MDR-14(Phoma sp.),其中菌株MDR-37对愈伤组织生长的抑制作用最严重,与对照相比增殖减少了100%。其余的菌株对细胞生长无显著差异。

|
| *表示相比对照有显著性差异(P < 0.05),**表示相比对照有极显著性差异(P < 0.01);CIM:葡萄细胞增殖倍数;TAC:花色苷总量;PAL:苯丙氨酸解氨酶活性;OXDG:褐化等级。 图 2 葡萄细胞与不同内生真菌共培养后生理生化响应指数及基于葡萄细胞生理生化相应的内生真菌聚类分析 |
大部分葡萄细胞的PAL活性在与内生真菌共培养后与对照相比差异不显著(P > 0.05),仅少部分与内生真菌菌株共培养不同程度地提高了葡萄细胞中PAL的活性,与内生真菌菌株MDR-23、RH-38、MDR-17、RH-37、MDR-44、RH-28和MDR-6的共培养引起葡萄细胞PAL的活性被显著(P < 0.05)提高;与CWR-49、MDR-16、CWR-47和RH-34四株菌的共培养极显著的(P < 0.01)提高了葡萄细胞PAL活性,其中菌株RH-34对PAL活性提高最多,与对照相比提高了77.80%。与不同内生真菌培养后大部分葡萄细胞的花色苷总量均被不同程度的降低,其中菌株MDR-1、MDR-23、CWR-49对葡萄细胞花色苷的合成抑制作用最大,与对照相比降低了100%。与菌株XHYN-2、RH-7、R2-21、XHCN-3和MDR-7共培养提高了葡萄细胞花色苷的总量,但未达到显著水平;与菌株B2-17、XHCN-1和B2-23共培养后葡萄细胞花色苷含量与对照相比无显著差异(图 2)。
2.4 基于细胞生理生化响应对共培养内生真菌菌株的聚类分析以共培养后葡萄细胞的生理生化响应值(RI)为分类依据对试验所用不同菌株进行系统聚类(组间连接)。聚类分析结果(图 2)表明,所研究的47株内生真菌整体上被划分为两大类群:Ⅰ类群包括41株内生真菌,它们与葡萄细胞共培养后大部分会引起细胞褐化;Ⅱ类群包括6株内生真菌,与葡萄细胞共培养后细胞未褐化仍处于正常生长状态且对葡萄细胞花色苷总量无显著影响。Ⅰ类群可进一步分为A、B、C、D四组,A组绝大多数菌株使葡萄细胞高度褐化,细胞增殖倍数较低,同时使葡萄细胞花色苷总量极显著降低;B组菌株使细胞中度褐化,促进了细胞的增殖;C组包括4株内生真菌,仅引起葡萄细胞轻度褐化或未褐化,且对葡萄细胞的增殖有一定的促进作用;D组菌株均未引起葡萄细胞褐化,对葡萄细胞的增殖以及酶活性均无显著影响,但对葡萄细胞花色苷总量具有极显著的抑制作用。将Ⅱ类群进一步分为E、F、G三组,E组菌株对葡萄细胞花色苷总量和PAL活性均无显著影响,对细胞增殖有不同程度的促进作用;F组和G均只包含一株内生真菌,分别是XHCN-3和XHYN-2,与葡萄细胞共培养后均提高了葡萄细胞的花色苷总量,其他指标与对照相比均无显著差异。
3 讨论内生真菌对植物的影响是多方面的,部分内生真菌有着调控宿主植物生长以及次生代谢途径的生物特性[12]。熊玉萍[13]从地黄内生真菌中筛选出3株能够显著促进植株的生长及生物量的内生真菌;内生真菌还可通过提高植物的叶绿素质量分数,增强光合作用,进而促进植物的生长[14-15];Peters等[16]将内生真菌与植物细胞进行共培养,发现内生真菌会显著促进植物细胞的生长。此外,由于与宿主植物长期共存,内生真菌与宿主具有相同或相似的生物合成途径,内生真菌不仅可以自身产生次级代谢产物,如杨梦莉等[17]从灯盏花内生真菌中分离出能够产黄酮类物质的内生真菌;Liu等[18]从赤霞珠葡萄叶片中分离出一株可以产白藜芦醇的内生真菌;而且还可以调控植物次生代谢途径,李群等[19]从灰毡毛忍冬‘渝蕾1号’中分离出6株内生真菌的诱导子在某些浓度下能显著地提高‘渝蕾1号’悬浮细胞中绿原酸的含量;再接种内生真菌能够提高葡萄叶片和果实的还原糖、总酚、总黄酮和白藜芦醇的含量[20];黄丽华等[9, 21]通过构建内生真菌-离体细胞对峙共培养体系发现部分内生真菌不仅可以显著提高葡萄细胞总酚、总黄酮的含量且使葡萄细胞产生新的化合物。这些研究说明内生真菌的存在会影响植物及植物细胞的生理生化指标。目前已有研究建立了内生真菌与葡萄细胞分开培养的对峙共培养体系,但是对于内生真菌与葡萄离体细胞直接接触的共培养试验还没有相关的研究。
本实验在细胞水平上建立愈伤组织与内生真菌直接接触的共培养体系,旨在构建可行的共培养体系并探索内生真菌与植物细胞共培养的相互作用机理及筛选出具有不同利用价值的内生真菌资源。研究发现与内生真菌共培养会造成葡萄细胞不同程度的褐化,按照植物内生真菌的存在不会对葡萄植株产生明显病害症状的定义来看,造成与内生真菌共培养葡萄细胞不同程度褐化的原因可能是因为适宜在葡萄愈伤组织上生长的内生真菌,相对生长较快,因此对葡萄细胞的伤害较大,褐化程度也会相对较大。细胞的增殖也会因为褐化而受到抑制,且褐化的葡萄细胞花色苷总量会被降低,但PAL活性要高于未褐化的,这可能是因为褐化后葡萄细胞次生代谢产物发生了改变,PAL作为次级代谢途径的关键酶,其活性的提高有利于植保素(黄酮、酚类等)的积累有助于植物抵抗外界不利因素的侵袭[22]。而在葡萄细胞上生长较慢的内生真菌基本不会造成细胞褐化,且葡萄细胞的生长、花色苷含量以及PAL活性不会受到显著的抑制作用,这可能是因为葡萄细胞未受到较大的伤害其生长及次生代谢均可正常进行。
4 结论选取18个属47株内生真菌与佳美葡萄(Vitis vinifera L. cultivar:Gamay)愈伤组织进行共培养。结果表明,接种不同内生真菌对葡萄细胞的生长有不同程度的影响,与菌株MDR-16、RH-7、B2-17、MDR-28、MDR-6和B2-23共培养对葡萄细胞增殖具有显著促进作用。与菌株R-19、MDR-39、RH-24、MDR-12、MDR-7、B2-23、MDR-16、MDR-6、MDR-13、R2-30、RH-48、CXC-16、R2-9、MDR-15、B2-17、RH-7、R2-21、XHCN-1、XHCN-3和XHYN-2共培养后对葡萄细胞的伤害作用较小;与菌株XHYN-2、RH-7、R2-21、XHCN-3和MDR-7共培养能够提高葡萄细胞花色苷的含量;与菌株MDR-16和MDR-6共培养既能显著促进葡萄细胞的生长又能显著提高葡萄细胞PAL活性。
| [1] |
Petrini O. Fungal endophytes of tree leaves[M]. New York: Springer-Verlag, 1991: 179-197.
|
| [2] |
Guo B, Wang Y, Sun X, et al. Bioactive natural products from endophytes:a review[J]. Biochemistry and Microbiology, 2008, 44(2): 136-142. DOI:10.1134/S0003683808020026 |
| [3] |
袁元.蒲公英内生真菌生物学特性及活性物质的研究[D].郑州: 河南工业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10463-1012461716.htm
|
| [4] |
邱德有, 黄美娟, 朱至清, 等. 一种云南红豆杉内生真菌的分离[J]. 真菌学报, 1994, 13(4): 314-316. |
| [5] |
王晓龙.怀山药内生菌的分离及其次生代谢产物的初步研究[D].郑州: 河南农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10466-1015733006.htm
|
| [6] |
Tan XM, Chen AJ, Wu B, et al. Advance of swainsonine biosynthesis[J]. Chinese Chemical Letters, 2018, 29(3): 417-422. DOI:10.1016/j.cclet.2017.08.040 |
| [7] |
袁丽红, 陆玉婷, 许琳, 等. 与盾叶薯蓣细胞共生培养的内生真菌分离及其生物学特性[J]. 生物加工过程, 2008, 6(6): 72-78. DOI:10.3969/j.issn.1672-3678.2008.06.014 |
| [8] |
Huang LH, Ao XJ, Shan H, et al. In vitro specific interactions revealed the infective characteristics of fungal endophytes to grapevine[J]. Vitis-Journal of Grapevine Research, 2017, 56(2): 71-77. |
| [9] |
黄丽华.内生真菌与葡萄细胞离体共培养体系的构建及其代谢互作[D].昆明: 云南大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10673-1016233524.htm
|
| [10] |
张秀英.酿酒葡萄细胞对三株内生真菌诱导子的生理生化响应[D].昆明: 云南大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10673-1015612460.htm
|
| [11] |
王艺菲, 辛秀兰, 陈亮, 等. pH示差法测定不同种类蓝果忍冬总花色苷含量[J]. 食品研究与开发, 2014, 35(7): 75-78. DOI:10.3969/j.issn.1005-6521.2014.07.021 |
| [12] |
Goh CH, Vallejos DFV, Nicotra A B, et al. The impact of beneficial plant-associated microbes on plant phenotypic plasticity[J]. Journal of Chemical Ecology, 2013, 39(7): 826-839. DOI:10.1007/s10886-013-0326-8 |
| [13] |
熊玉萍.地黄促生真菌的筛选及其作用机制的研究[D].郑州: 河南中医药大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10471-1016324568.htm
|
| [14] |
陈志为, 周艳芬, 樊月, 等. 台湾相思内生真菌的分离筛选及其对幼苗生长的影响[J]. 东北林业大学学报, 2019, 47(1): 61-64. DOI:10.3969/j.issn.1000-5382.2019.01.012 |
| [15] |
Wang QX, Yan N, Ji DG. In vitro growth and carbon utilization of the green-leaved orchid Dendrobium officinale are promoted by mycorrhizal associations[J]. Botanical Studies, 2013, 54(1): 1-9. DOI:10.1186/1999-3110-54-1 |
| [16] |
Peters S, Draeger S, Aust HJ, et al. Interactions of dual cultures of endophytic fungi with host and nonhost plant calli[J]. Mycologia, 1998, 90(3): 360-367. DOI:10.1080/00275514.1998.12026919 |
| [17] |
杨梦莉, 赖泳红, 郭凤根, 等. 灯盏花内生真菌分离及其产黄酮内生真菌的初步研究[J]. 西南农业学报, 2018, 31(2): 318-321. |
| [18] |
Liu Y, Nan L, Yan H, et al. Isolation and identification of resveratrol-producing endophytes from wine grape Cabernet Sauvignon[J]. Springerplus, 2016, 5(1): 1029-1042. DOI:10.1186/s40064-016-2571-0 |
| [19] |
李群, 汪超, 唐明, 等. 灰毡毛忍冬'渝蕾1号'内生菌对其悬浮细胞生物量及绿原酸含量的影响[J]. 植物生理学报, 2015, 51(11): 1997-2005. |
| [20] |
Yang MZ, Ma MD, Yuan MQ, et al. Fungal endophytes as a metabolic fine-tuning regulator for wine grape[J]. PLoS One, 2016, 11(9): e0163186. DOI:10.1371/journal.pone.0163186 |
| [21] |
Huang LH, Yuan MQ, Ao XJ, et al. Endophytic fungi specifically introduce novel metabolites into grape flesh cells in vitro[J]. PLoS One, 2018, 13(5): e0196996. DOI:10.1371/journal.pone.0196996 |
| [22] |
史娟, 杨之为. 葡萄体内苯丙烷代谢与其对霜霉病抗性的关系[J]. 西北农业学报, 2006, 15(4): 100-104. DOI:10.3969/j.issn.1004-1389.2006.04.026 |