2. 天津市天大天福生物技术有限公司,天津 300000
2. Tianjin Tianda Tianfu Biotechnology Limited, Tianjin 300000
近年来,由于全球气候的变化,土壤盐渍化已成为日益严峻的环境问题。高盐作为一种主要的非生物胁迫[1],对植物会产生渗透胁迫、质膜伤害、离子不平衡以及代谢紊乱等伤害,从而抑制植株的生长[2]。玉米(Zea mays L.)是世界上重要的粮食作物之一,广泛地用于畜牧业、工业以及养殖业等产业[3]。但是玉米耐盐性较差[4],这极大限制了玉米在盐渍化土壤上的生长,制约了全球玉米的生产与发展,因此提高盐渍化土地上玉米的产量及质量,是我国科研工作者首要的任务之一。
根际促生菌能在一定程度上提高植物对干旱,高盐和高温等非生物胁迫的耐受性。Jiang等[5]分离出4种溶磷菌株,包括巨芽孢杆菌(YM13)、肠杆菌(YM14)、普罗维登氏菌(TPM23)和青贮黏液杆菌(TPMX5),研究表明这4种菌在盐胁迫下具有高效的溶磷性,能够提高花生的生物量,对花生的生长具有促进作用。Lucio等[6]从油菜根际筛选分离得到芽孢杆菌LTAD-52,该菌能够溶磷,可以增加油菜茎的干重,将油菜的产量从21%提高到44%。研究表明,在200 mmol/L的氯化钠浓度下,将从紫苏根际分离的黄色葡萄球菌F-11、黄志亨柳菌F-9以及巨芽孢杆菌F-58接种在玉米幼苗根际,这些菌都可以显著减轻玉米幼苗受到的盐胁迫;F-11可以显著增加玉米幼苗的茎长和根长,最多增加一倍,F-9和F-58可以分别增加玉米鲜重45%和42%[7]。因此,利用根际促生菌可以减缓农作物受到的胁迫,为微生物开辟了一个新兴的利用途径。
本实验用10%的盐浓度培养基从玉米根际土壤筛选耐盐促生菌并验证其促生性。通过盆栽实验,用不同的方式处理玉米幼苗,测定幼苗生长及生理指标。探究耐盐促生菌提高玉米幼苗的耐盐性以及促进玉米幼苗生长的机制,以期获得在盐渍化土壤中能够促进玉米生长的根际耐盐促生菌,促进玉米在盐渍化土壤中的生长。
1 材料与方法 1.1 材料 1.1.1 土壤样品的收集土壤样品来自于天津大学试验田种植的玉米根际土壤,将玉米连根拔起,轻轻抖动去除非根际土,用无菌水将玉米根际土冲下并收集,4℃保存待用[8]。
1.1.2 培养基基础LB液体培养基:蛋白胨5.0 g,酵母提取物10.0 g,NaCl 10.0 g,用ddH2O溶解并定容至1 L。基础LB固体培养基:在基础LB液体培养基中添加琼脂粉15.0 g。无机磷培养基:葡萄糖10.0 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.3 g,MnSO4·4H2O 0.03 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,NaCl 0.3 g,Ca3(PO4)2 10.0 g,琼脂15.0 g,用ddH2O溶解并定容至1 L,pH值7.0-7.5。有机磷培养基:葡萄糖10.0 g,(NH4)2SO4 0.5 g,MgSO4·7H2O 0.3 g,MnSO4·4H2O 0.03 g,KCl 0.3 g,FeSO4·7H2O 0.03 g,NaCl 0.3 g,CaCO3 5.0 g,卵磷脂0.2 g,琼脂15.0 g,ddH2O 1 L,pH值7.0-7.5[9]。
1.1.3 供试玉米种子本实验室保存的两种不同品系的玉米种子,分别为优良玉米自交系1666和7922,分别记作品系1和品系2。
1.2 方法 1.2.1 根际耐盐促生菌的分离称取玉米根际土壤样品5 g(湿重),放入已灭菌的装有100 mL无菌水的250 mL锥形瓶中,置于摇床,震荡培养20 min(30℃、160 r/min)。吸取1 mL上清液放入已灭菌的试管中,加入9 mL无菌水稀释。用接种环蘸取上述稀释液,并分别在盐浓度为5%、6%、7%、8%、9%和10%的LB固体平板上进行划线。将上述平板置于30℃的恒温培养箱中培养24 h。选取不同盐浓度下LB平板中具有相同形态的菌落作为初选耐盐促生菌落,挑取盐浓度为10%固体LB平板中的初选耐盐菌落接种到盐浓度为10%的LB液体培养基中,在30℃进行富集培养24 h。将富集菌液稀释100倍,用接种环蘸取稀释液并接种于盐浓度为10%的LB固体培养基中,进行划线培养,培养温度为30℃,培养时间为24 h。取上述长势良好的单菌落进行后续实验。以上实验操作均在无菌条件下进行。
1.2.2 根际耐盐促生菌的生理生化及分子生物学鉴定根据《伯杰细菌鉴定手册》(第8版)和《常见细菌系统鉴定手册》对根际耐盐促生菌进行形态学观察和生理生化鉴定[10-11]。
采用SDS-CTAB法提取耐盐促生菌总DNA[12]。以提取的总DNA为模板,用细菌通用引物27F,5′-AGAGTTTGATCCTGGCTCAG-3′,1492R,5′-GGTTACCTTGTTACGACTT-3′进行PCR扩增,将PCR扩增产物送至金唯智公司测序。测序结果用DNAMAN进行拼接,将拼接好的序列去掉两端引物后,提交EzBioCloud数据库中的Identify程序(https://www.ezbiocloud.net/identify)进行比对,找出与所测菌株序列同源性较高的模式菌株类型,下载该菌株的16S rDNA序列,利用MEGA6.0中的Neighbor-joining analysis构建系统发育树。
1.2.3 根际耐盐促生菌溶磷特性的测定将根际耐盐促生菌接种在无机磷和有机磷固体培养基上,在30℃培养5 d后观察。
1.2.4 盆栽实验用无菌水将种子浸泡24 h。将保存的菌种在基础LB培养基中进行活化,并在摇床中培养至OD600值为0.6-0.8,离心,去上清,将沉淀菌体用无菌水重悬,即得到处理种子的菌液。营养土和蛭石配比为1:1,121℃灭菌1 h。盆栽试验设计,在托盘中放入蛭石,将预处理的种子进行萌发,待幼苗长至两叶一心时,选取长势一致的幼苗移栽至花盆中,每盆移2株,移栽时记录幼苗的根长和株高,并把幼苗移栽至相同高度。4种处理组合如下:空白对照组:不加菌,不加盐,记作CK组。加菌组:加菌,不加盐,记作CB组。加盐组:不加菌,加盐,记作CS组。加菌加盐组:加菌,加盐,记作CBS组。其中:加菌方式为根灌方式,每次在根际周围浇1 mL的处理种子菌液,每隔2 d浇一次;不加盐方式为植株浇无菌水,加盐方式为植株浇150 mmol/L的无菌盐溶液。每种组合3次重复,室温培养,每个托盘每次浇1.5 L的水或盐溶液,每隔3 d浇一次水,室温培养15 d后,分别进行生长生理指标的测定。
1.2.5 玉米幼苗生长生理指标的测定 1.2.5.1 株高和根长变化量的测定测量移栽前和移栽后培养15 d后的株高和根长,并计算株高和根长变化量。
1.2.5.2 叶绿素含量的测定取0.1 g新鲜叶片置于10 mL离心管中,加入5 mL 95%的乙醇,黑暗浸提48 h,直至叶片完全变白为准[13]。
1.2.5.3 抗氧化酶活性的测定采用愈创木酚法测定过氧化物酶(POD)活性[14],采用NBT还原法测定超氧化物歧化酶(SOD)活性[15],利用Aebi[16]的方法测定过氧化氢酶(CAT)的活性。
1.2.5.4 丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)法测定玉米新鲜叶片MDA的含量[17]。
1.2.6 数据分析利用软件SPSS 20.0进行数据显著性分析,利用OriginPro 9.0进行绘图分析。
2 结果 2.1 植物耐盐促生菌的生理生化及16S rDNA分子学鉴定经过盐浓度为10% LB培养基的筛选,从玉米根际土壤中筛选出一株根际耐盐促生菌Y1,革兰氏阳性菌,生理生化特征如表 1所示。
筛选的根际耐盐促生菌的16S rDNA基因的PCR目的条带大小为1 500 bp左右(图 1)。
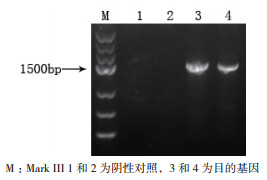
|
| 图 1 筛选菌株16S rDNA基因PCR扩增结果 |
对根际耐盐促生菌的16S rDNA的测序结果进行分析,利用DNAMAN进行拼接后显示其基因序列为1 360 bp,利用数据库EzBioCloud中的Identify功能,对基因序列进行同源性检索,结果显示测得的基因序列与模式菌株Kocuria rhizophila DSM 11926(T)的16S rDNA序列有100%的相似性,利用MAGA6.0进行系统进化分析,构建出如图 2的系统发育树,Y1代表筛选的根际耐盐促生菌,由系统发育树可知Y1与Kocuria rhizophila DSM 11926(T)同属于一个分支,并具有100%的同源性,结合形态特征及生理生化实验,认为筛选的这株根际耐盐促生菌为嗜根考克氏菌。
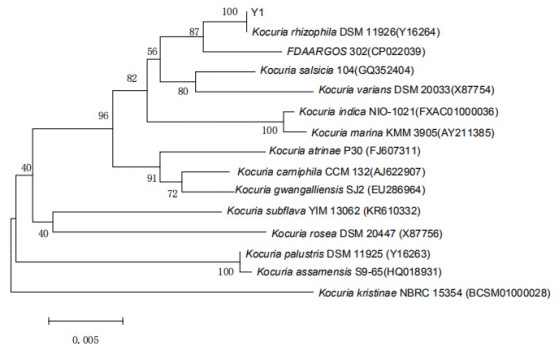
|
| 图 2 根际耐盐促生菌的系统发育树 |
无机磷培养基和有机磷培养基上均出现透明圈,表明根际耐盐促生菌能够溶解无机态和有机态的磷,并把两者从无效态转变成可供自身或植物所吸收的有效态的磷,从而证明此菌具有溶磷的特性。
2.3 根际耐盐促生菌对玉米幼苗生长影响 2.3.1 对植株株高、根长的影响玉米生长情况如图 3-4所示,CB组的玉米植株的长势明显比CK组玉米好,而CS组的生长状况明显比CK组差,并表现出萎蔫的症状,品系2玉米的症状更加明显。而在加盐情况下,接菌组与未接菌组相比,萎蔫程度前者明显好于后者。说明接种根际耐盐促生菌能够促进玉米植株的生长,同时,能缓解盐胁迫对玉米生长造成的危害。

|
| a:空白对照组(CK)b:加菌组(CB)c:加盐组(CS)d:加菌加盐组(CBS) 图 3 品系1玉米在四种处理方式下的生长情况 |

|
| a:空白对照组(CK)b:加菌组(CB)c:加盐组(CS)d:加菌加盐组(CBS) 图 4 品系2玉米在四种处理方式下的生长情况 |
如图 5和6所示,CB组的两种品系玉米幼苗株高和根长变化量比CK组显著增加,分别增加了44.96%和49.45%左右;CBS组的两种品系玉米的株高和根长也显著高于CS组,分别增加了1.2倍和1.17倍;与CK组相比,CS组的两种玉米品系的株高和根长指标显著下降。综合分析表明,盐胁迫下,玉米幼苗的生长受到抑制,但将Y1菌定殖在玉米根际可以缓解盐胁迫;在没有盐胁迫下,将Y1菌定殖在玉米根际也能促进玉米幼苗生长。

|
| 图 5 不同处理对两种品系玉米株高变化的影响 |

|
| 图 6 不同处理对两种品系玉米根长变化的影响 |
如图 7所示,CB组两种品系玉米幼苗的总叶绿素含量比CK组提高了74.44%左右;CBS组的总叶绿素含量比CS组提高了56.24%左右;而与CK组相比,CS组两种品系玉米幼苗的总叶绿素含量则显著降低。以上结果表明,在盐胁迫下,玉米幼苗鲜叶上的叶绿素合成受到抑制,影响幼苗光合作用;定殖Y1菌可以使叶绿素维持在较高的水平,从而降低盐胁迫对光合作用的影响。在没有盐胁迫下,定殖Y1菌可以增加玉米幼苗叶绿素的合成,促进幼苗叶片光合作用。
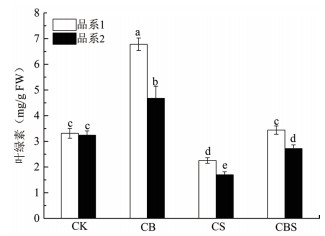
|
| 图 7 不同处理方式下玉米叶片总叶绿素含量 |
如图 8、9、10所示,CB组两种品系玉米幼苗叶片的CAT、POD和SOD活性与CK组相比显著下降,但差异性较小,这表明在没有盐胁迫下,定殖Y1菌反而使3种抗氧化酶活性降低。CBS组幼苗叶片的CAT活性显著大于CS组,品系1和品系2分别提高了1.18倍和0.61倍;而POD和SOD活性却显著低于CS组。CS组幼苗叶片的3种酶活都显著高于CK组,这表明在盐胁迫下,叶片会提高自身抗氧化酶活性来抵御盐胁迫。

|
| 图 8 不同处理下玉米叶片CAT酶的活性 |
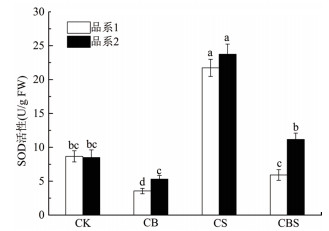
|
| 图 9 不同处理下玉米叶片SOD活性的测定 |
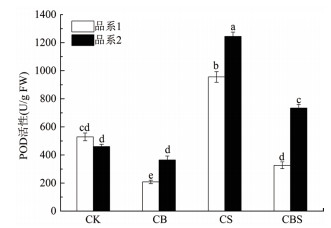
|
| 图 10 不同处理下玉米叶片POD活性的测定 |
如图 11所示,CB组两种品系玉米幼苗叶片MDA含量显著低于CK组,CK组的MDA含量是CB组含量的3.24倍左右,这表明在没有盐胁迫下,定殖Y1菌使叶片中MDA含量降低。CBS组幼苗叶片MDA含量显著低于CS组,CS组MDA含量是CBS组的3.08倍左右。这表明在盐胁迫下,定殖Y1菌使得叶片中MDA含量降低。与CK组相比,CS组幼苗叶片MDA含量显著增加,这表明盐胁迫下会增加叶片MDA含量。

|
| 图 11 不同处理下玉米叶片MDA的含量 |
土壤盐渍化会抑制农作物生长,进而降低农作物产量,是农业面临的一个重大难题[18]。为了降低高盐对农作物生长造成的毒害,利用耐盐促生菌来缓解盐对农作物的胁迫在近些年已得到发展。本研究以高盐作为条件,筛选出一株耐盐菌Y1,经鉴定为嗜根考克氏菌。目前,已知的分离自根际的嗜根考克氏菌的主要功能在于耐盐、分解有机污染物。Abhilash等[19]从植物根际分离出了嗜根考克氏菌,将其用于分解新型持续性有机污染物林丹,结果显示在中低浓度的林丹土壤中,嗜根考克氏菌能够分解林丹。全基因组测序表明,嗜根考克氏菌DNA中存在过氧化氢酶、烷基氢过氧化物还原酶,DyP型过氧化物酶和超氧化物歧化酶等多种抗氧化酶基因以及与植物相关的Ⅲ型PKS基因[20-21],植物Ⅲ型聚酮合成酶在植物次生代谢产物生物合成中起着非常重要的作用[22],因此这可以作为嗜根考克氏菌能作为根际促生菌的可能证据之一。同时本研究验证嗜根考克氏菌具有高效溶磷的特性,这进一步证实了此菌具有促进植物生长的可能。
研究表明,从不同胁迫环境中分离的根际菌对不同胁迫均具有耐受性,同时也具有促生作用,将这些根际菌定殖在植物根际可以增加植物的根长、株高、生物量、叶绿素含量、类胡萝卜素含量以及可溶性蛋白含量[23]。本实验中,CBS组的株高和根长变化量和叶绿素都显著高于CS组,这进一步证实了Tiwari等的研究。但是CBS组上述指标显著低于CB组,这表明在盐胁迫下,耐盐根际促生菌虽未完全解除盐对玉米生长的影响,但是在一定程度上缓解了盐对玉米植株生长带来的抑制作用。赵清[24]认为当植物受到盐胁迫时,体内的抗氧化酶活性显著增强,进而提高植物的抗氧代谢水平,降低因盐胁迫带来的植物细胞器功能的损伤。本实验中,CS组幼苗叶片的3种抗氧化酶活性比CK组显著增高,这与赵清的研究结果一致。虽然CS组幼苗叶片中的叶绿素含量较CK组有显著的降低,这可能是由于抗氧化酶并没有完全清除盐胁迫带来的损害,对幼苗叶片叶绿体造成一定的损伤。CBS组中POD和SOD活性却比CS组显著降低,这与潘晶等[25]的观点不一致。这可能是由于植物在受到盐胁迫后除了激活抗氧化系统,还可以通过非酶促系统如植物自身会产生为类胡萝卜素、抗坏血酸、谷胱甘肽、类黄酮、生育酚等物质来调节渗透压抵御盐胁迫[26]。无论是否有盐胁迫,在玉米幼苗根际定殖Y1菌都会降低玉米叶片MDA含量,这表明Y1菌可以通过降低叶片MDA含量来减缓盐胁迫的毒害。综上所述,嗜根考克氏菌可以作为根际促生菌促进植物生长,这对提高农作物产量具有重要意义。
4 结论在高盐条件下,从玉米根际土壤中分离出的Y1菌,经生理生化和16S rDNA分子生物学鉴定为嗜根考克氏菌,该菌具有溶磷特性。利用该菌进行盆栽实验,用不同方式处理玉米幼苗,15 d后测定玉米幼苗生长生理指标。经测定得出,在没有盐胁迫下,将嗜根考克氏菌定殖在玉米幼苗根际上,该菌可以通过提高叶片中叶绿素含量以及降低叶片中的MDA含量来增加株高和根长的变化量,从而促进玉米幼苗的生长;在盐胁迫下,该菌可以通过提高叶片中叶绿素含量、CAT活性以及降低叶片中的MDA含量来增加株高和根长的变化量,从而缓解盐对玉米幼苗生长的抑制,促进玉米幼苗的生长。
| [1] |
Ashraf M, Foolad MA. Improving plant abiotic-stress resistance by exogenous application of osmoprotectants glycine, betaine and proline[J]. Environ Exp Bot, 2007, 59: 206-216. DOI:10.1016/j.envexpbot.2005.12.006 |
| [2] |
Munns R, Tester M. Mechanisms of salinity tolerance[J]. Annu Rev Plant Biol, 2008, 59: 651-681. DOI:10.1146/annurev.arplant.59.032607.092911 |
| [3] |
Agmi RA. Alleviating the adverse effects of NaCl stress in maize seedings by pretreating seeds with salicylic acid and 24-epibrassinolide[J]. South Afr J Bot, 2013, 88: 171-177. DOI:10.1016/j.sajb.2013.07.019 |
| [4] |
Khodarahmpour Z, Ifar M, Motamedi M, et al. Effects of NaCl salinity on maize(Zea mays L.)at germination and early seedling stage[J]. Afr J Biotechnol, 2012, 11: 298-304. |
| [5] |
Jiang H, Qi P, Wang T, et al. Role of halotolerant phosphate-solubilising bacteria on growth promotion of peanut(Arachis hypogaea)under saline soil[J]. Ann Appl Biol, 2019, 174: 20-30. DOI:10.1111/aab.12473 |
| [6] |
Lucio V, Liliana I, Adriana F. Growth promotion of rapeseed(Brassica napus)associated with the inoculation of phosphate solubili-zing bacteria[J]. Applied Soil Ecology, 2018, 132: 1-10. DOI:10.1016/j.apsoil.2018.08.017 |
| [7] |
Aslam F, Ali B. Halotolerant bacterial diversity associated with Suaeda fruticosa(L.)forssk. improved growth of maize under Salinity Stress[J]. Agronomy-Basel, 2018, 8(8): 131. DOI:10.3390/agronomy8080131 |
| [8] |
Lavecchia A, Curci M, Jangid K, et al. Microbial 16S gene-based composition of a sorghum cropped rhizosphere soil under different fertilization managements[J]. Biology and Fertility of Soils, 2015, 51(6): 661-672. DOI:10.1007/s00374-015-1017-0 |
| [9] |
马骢毓.民勤退耕区次生草地土壤微生物多样性研究及优势植物根际促生菌资源筛选[D].兰州: 甘肃农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10733-1017824821.htm
|
| [10] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001.
|
| [11] |
布坎南RE, 吉本斯NE. 伯杰细菌鉴定手册[M]. 第8版. 北京: 科学出版社, 1984.
|
| [12] |
夏北成. 分子生物学方法在微生物生态学中的应用[J]. 中山大学学报:自然科学版, 1998, 37(2): 97-101. |
| [13] |
Wang M, Wang G, Ji J, et al. The effect of pds gene silencing on chloroplast pigment composition, thylakoid membrane structure and photosynthesis efficiency in tobacco plants[J]. Plant Sci, 2009, 177(3): 222-226. DOI:10.1016/j.plantsci.2009.04.006 |
| [14] |
徐朗莱, 叶茂炳. 过氧化物酶活力连续记录测定法[J]. 南京农业大学学报, 1989, 12(3): 82-83. |
| [15] |
Giannopolitis CN, Ries SK. Purification and quantitative relationship with water-soluble protein in seedling[J]. Plant Physiology, 1977, 59: 315-318. DOI:10.1104/pp.59.2.315 |
| [16] |
Aebi H. Catalase in vitro[J]. Methods Enzymol, 1984, 105(105): 121-126. |
| [17] |
Saranga Y, Kim YH, Janick J. Changes in tolerance to partial desiccation and in metabolite content of celery somatic embryos induced by reduced osmotic potential[J]. Journal of the American Society for Horticulturalence, 1992, 117(2): 342-345. DOI:10.21273/JASHS.117.2.342 |
| [18] |
Shrivastava P, Kumar R. Soil salinity:A serious environmental issue and plant growth promoting bacteria as one of the tools for its alleviation[J]. Saudi J Biol Sci, 2015, 22(2): 123-131. DOI:10.1016/j.sjbs.2014.12.001 |
| [19] |
Abhilash PC, Srivastava S, Singh N. Comparative bioremediation potential of four rhizospheric microbial species against lindane[J]. Chemosphere, 2011, 82(1): 56-63. DOI:10.1016/j.chemosphere.2010.10.009 |
| [20] |
Fallah MJ, Amir M, Nahid A, et al. Draft Genome sequence of Kocuria rhizophila RF, a radiation-resistant soil isolate[J]. Genome Announcements, 2016, 4(2): 15-16. |
| [21] |
陈鹏, 黄运红, 李非, 等. 炭样小单孢菌JXNU-1产抗生素JX对嗜根考克氏菌肽聚糖合成的影响及其机理[J]. 基因组学与应用生物学, 2016, 35(3): 603-609. |
| [22] |
李国辉, 李亿红, 钱冉, 等. 梨Ⅲ型聚酮合成酶家族的比较基因组学研究及表达模式分析[J]. 植物生理学报, 2018, 54(6): 1005-1017. |
| [23] |
Tiwari S, Singh P, Tiwari R, et al. Salt-tolerant rhizobacteria-mediated induced tolerance in wheat(Triticum aestivum)and chemical diversity in rhizosphere enhance plant growth[J]. Biol Fertility Soils, 2011, 47: 907-916. DOI:10.1007/s00374-011-0598-5 |
| [24] |
赵清.拟南芥chyB和DREB2A基因对转基因烟草抗逆的研究[D].天津: 天津大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-10056-1014036120.htm
|
| [25] |
潘晶, 黄翠华, 罗君, 等. 盐胁迫对植物的影响及AMF提高植物耐盐性的机制[J]. 地球科学进展, 2018, 33(4): 361-372. |
| [26] |
尹永强, 胡建斌, 等. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展[J]. 中国农学通报, 2007, 23(1): 105-110. DOI:10.3969/j.issn.1000-6850.2007.01.025 |





