2. 福建省银丰干细胞工程有限公司,泉州 362000;
3. 福建医科大学附属第二医院,泉州 362000;
4. 福建省海洋藻类活性物质制备与功能开发重点实验室,泉州 362000
2. Yinfeng Stem Cell Engineering Co., Quanzhou 362000;
3. Second Affiliated Hospital, Fujian Medical University, Quanzhou 362000;
4. Fujian Province Key Laboratory for the Development of Bioactive Material from Marine Algae, Quanzhou 362000
美国NCI筛选出了几万个天然抗肿瘤化合物,约5%来源于海洋生物,其中来自海洋植物的3.5%具有抗肿瘤活性[1]。我国漫长的海岸线横跨热带、亚热带和温带,复杂的海域地理环境造就了我国海洋生物的多样性,为我国天然药物开发与研究提供极丰富的自然资源。其中浒苔生长迅速,生物量较大,是重要的海洋植物资源。在分类学上,浒苔属(Enteromorpha)属于绿藻门(Chlorophyta),石莼目(Ulvales),石莼科(Ulvaceae),主要有条浒苔、扁浒苔、浒苔、肠浒苔及缘管浒苔5种[2]。2008年绿潮藻类曾在我国黄海中、南部海域爆发成灾,其实浒苔是具有较高营养价值的藻类资源,其干物质中粗蛋白含量约10%-35%,其中条浒苔、肠浒苔(福建海域)粗蛋白含量约34%;浒苔中必需氨基酸与非必需氨基酸的比值(EAA/NEAA)为0.62,且氨基酸种类齐全,其必需氨基酸(EAA)占氨基酸总量(TAA)约40%,氨基酸评分约80,显著高于紫菜(54)和海带(47)[2],是优质的海洋植物蛋白质来源之一。目前,关于浒苔等多数海藻的研究与开发主要集中在碳水化合物,而对其蛋白质及深加工的研究鲜有报道[3-4]。
天然植物蛋白质除提供能量和氨基酸外,一些来自蛋白质原有序列中的小肽还具有多种生理功能,其不易被消化系统酶系降解,具备口服给药发挥生理功能的条件[5]。此外,其相比于小分子化学药物,对目标肿瘤具备高亲和力、高特异性、低毒性[6-7];与抗体药物相比,免疫原性低、组织渗透性强;还具备良好的溶解性与保湿性,高浓度下黏度低、热稳定等物理特性,为规模化生产提供较好的物理特性基础[8-9]。酶解蛋白制备活性小肽是当前较为普遍的技术,酶解具有专一性强、条件温和等优点[10];研究认为,目前酶法制备获得小肽的关键在于蛋白质的来源、酶的选择及酶解工艺的优化与控制[11]。目前已从天然蛋白质原有序列中释放出了如免疫调节肽[12]、降血脂肽[13]、降血压肽[14]、促钙吸收肽[15]、抗肿瘤肽[16]、抗菌肽[17]等功能性肽,其中浒苔在食用、医药和生物医学等方面也表现出具有巨大市场潜力和较高的研究价值。
基于此,本研究以条浒苔(福建海域)为原材料,采用特异性蛋白酶酶解制备功能小肽,分离获得不同分子量区间小肽混合液,以血管内皮细胞(HUVEC)和肺癌细胞(NCI-H446、NCI-H460、A549)为研究对象,体外初步评价酶法制备的条浒苔多肽抗肺癌生物活性。为后续小分子天然活性肽的商业开发、纯化与抗肿瘤机制研究奠定基础,亦为探索条浒苔资源高值化利用提供新途径。
1 材料与方法 1.1 材料浒苔(干品)由福建福清海兴保健食品有限公司提供(福建海域,条浒苔);木瓜蛋白酶(酶活力:2.0×105 U/g)购自南宁庞博生物工程;恒温振荡水浴锅(常州国华电器);冷冻干燥机(东京理化);超滤装置(海滨仪器);倒置荧光显微镜(Nikon TE2000);流式细胞仪(BD FACS Calibur);9602G酶标仪(Perlong);培养瓶、培养板、Transwell(Corning);Hoechst33342、PI染色试剂盒(碧云天生物技术研究所);顺铂、MTT、ECM、VEGF均购自Sigma;高糖DMEM、RPMI-1640、M199、胎牛血清(FBS)购自Gibco;RNase A购自上海生工;血管上皮细胞(HUVEC)、肺癌NCI-H460、NCI-H446、A549细胞均来自ATCC细胞库。
1.2 方法 1.2.1 浒苔蛋白提取、酶解及超滤分离浒苔60℃烘干粉碎至180目[18],采用碱提酸沉法提取浒苔蛋白,并根据预实验优化的酶解条件:25:1(W/V)比例加入蒸馏水充分溶胀3 h,调整酶解条件(pH 7.25)后室温放置稳定1 h,加入1 250 U/g木瓜蛋白酶,45.7℃低速振荡酶解120 min,90℃灭活15 min,4 000 rpm离心10 min收集上清液,经微孔滤膜(10 μm)微滤去杂质后,依次通过截留分子量为2 kD、6 kD、12 kD的超滤膜分级超滤,获得多肽各组分冻干备用,根据量效关系预实验,本研究以实验终浓度为0.5 mg/mL的各分子量浒苔多肽处理48 h进行分析研究。
1.2.2 细胞增殖实验将细胞接种于96孔板(1×105 cells/200 μL·孔),待贴壁后,以0.5 mg/mL终浓度的多肽组分Ⅱ(2 kD < M < 6 kD)处理细胞(下面细胞处理方法与此相同),设置PBS处理的空白组,设置1 μg/mL顺铂(DDP)处理的阳性组[19];48 h后MTT法检测并计算细胞的相对增殖率(Relative grow rate,RGR),每组3个复孔,实验重复5次。
1.2.3 细胞氧化应激实验将HUVEC细胞接种于96孔板(1×105 cells /200 μL·孔),待贴壁后,处理同1.2.2,同时设置PBS处理的对照组;37℃、5% CO2培养箱培养48 h后弃培养基,加入DMEM培养基(含10% FBS)稀释的H2O2至终浓度500 µmol/L,以加入同样体积的无菌去离子水作为阴性对照计算相对存活率(Relative survival rate,RSR)。每组3个复孔,实验重复5次。
1.2.4 体外小管形成实验在4℃条件下过夜融化ECM,用无血清DMEM按2:1稀释后,加入96孔板(60 μL/孔),置于37℃培养箱待ECM凝固,每孔加入100 μL的HUVEC细胞悬液(2.5×105 cells/mL),细胞处理同1.2.2,同时设置PBS处理的对照组;置于37℃、5% CO2培养箱培养12 h。倒置显微镜下随机取5个视野观察小管形成情况。每组3个复孔,实验重复5次。
1.2.5 细胞凋亡实验将肺癌细胞接种于96孔板(1×105 cells/200 μL·孔),待贴壁后,细胞处理同1.2.2,同时设置PBS处理的对照组,培养48 h后采用Hoechst33342染色法分析肿瘤细胞凋亡情况,在荧光显微镜下观察蓝色荧光,每组3个复孔,实验重复5次。
1.2.6 细胞迁移实验在Transwell下室加入500 μL的M199培养基(含10 ng/mL VEGF、10% FBS),上室加入100 μL的M199(不含FBS),37℃培养箱内平衡1 h;弃上室培养基,每孔加入100 μL肺癌细胞悬液(2.5×105 cells/mL),细胞处理同“细胞增殖实验”,同时设置PBS处理的对照组;置于培养箱培养18 h,棉签擦去上室细胞,0.1%结晶紫染色,显微镜观察穿过膜附着在下室的细胞,随机取5个视野拍照,并用Image J软件统计细胞个数,计算迁移率。每组3个复孔,实验重复5次。
1.2.7 细胞周期测定实验将肺癌细胞接种于6孔板(1×105 cells/2 mL·孔),待贴壁后,处理同1.2.5,同时设置PBS处理的对照组;培养48 h后收集各组细胞,1 200 r/min离心5 min,弃上清液,用PBS重复清洗3次后,加入含100 U/mL RNase A的终浓度为5 μg/mL的PI,4℃避光孵育30 min后用流式细胞仪检测细胞周期过程中各期的细胞相对含量。实验重复5次。
1.2.8 统计学分析所有数据采用SPSS19.0软件分析与处理,计量数据以x±s表示,组间比较单因素方差分析,P < 0.01表现为显著差异,P < 0.05表现为差异,均有统计学意义。
2 结果 2.1 浒苔多肽的超滤分离木瓜蛋白酶在最优条件下酶解条浒苔蛋白质,经超滤得到分子量范围为:Ⅰ(M < 2 kD)、Ⅱ(2 kD < M < 6 kD)、Ⅲ(6 kD < M < 12 kD),各分子量的产物作用浓度0.5 mg/mL,MTT分析抗肿瘤活性。结果(图 1)显示,与Ⅰ、Ⅲ、PBS组相比较,浒苔多肽组分Ⅱ对上述三种肺癌细胞的RGR最低(P < 0.01),组分Ⅱ对A549和H446处理组与DDP处理组相比,RGR略低(P < 0.05),组分Ⅱ对H460处理组与DDP处理组相比,RGR差异不大(P > 0.05)。因此,选取活性组分Ⅱ(2 kD < M < 6 kD)进行后续的实验研究。
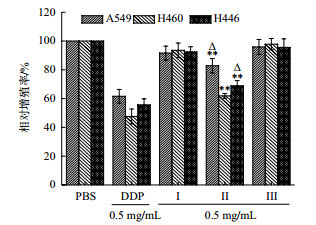
|
| n= 5, x±s. **P < 0.01 vs Ⅰ, Ⅲ and PBS group, △P < 0.05 vs DDP group 图 1 超滤分离不同分子量酶解液对肺癌细胞抑制能力 |
MTT检测结果(图 2)显示,组分Ⅱ(0.5 mg/mL)对HUVEC的相对增殖率为83.6%,与PBS组(98.1%)对比差异不大(P < 0.05)。2-6 kD的浒苔多肽对正常细胞HUVEC的抑制作用有限。
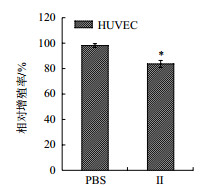
|
| n= 5, x±s. *P < 0.05 vs PBS 图 2 酶解Ⅱ组分对HUVECs增殖的影响 |
结果(图 3)显示,PBS处理组的HUVEC细胞可自行排列,并伸出细丝连接周围其他细胞形成较多节点,长度较长的管腔结构;组分Ⅱ(0.5 mg/mL)处理的HUVEC细胞呈散点状分布,基本不能连接成环,亦不能形成小管。结果表明,2-6kD的浒苔多肽具有抑制小管的形成。
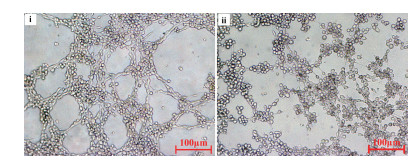
|
| n= 5, x±s. ⅰ: PBS; ⅱ: Ⅱ group 图 3 酶解Ⅱ组分对小管形成的影响 |
结果(图 4)所示,组分Ⅱ(0.5 mg/mL)处理的HUVEC细胞相对存活率为82.1%,与PBS组(41.8%)相比均有极显著差异(P < 0.01)。结果表明,2-6 kD的浒苔多肽具有抗氧化作用。
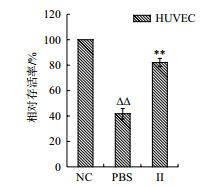
|
| n= 5, x±s. **P < 0.01 vs PBS, △△P < 0.01 vs Ⅱ group 图 4 酶解Ⅱ组分的抗氧化作用 |
结果(图 5)显示,组分Ⅱ(0.5 mg/mL)处理的A549、H446、H460肺癌细胞相对增殖率分别为82.8%、61.9%和58.8%,与PBS组比较有显著差异(P < 0.01)。Ⅱ处理组中,H446和H460相对增值率显著低于A549(P < 0.01)。结果表明2-6 kD的浒苔多肽能有效抑制上述3种肺癌细胞的增殖,且对H446、H460的抑制效果好于A549。
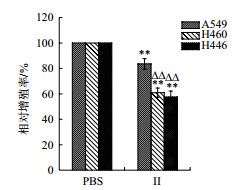
|
| n= 5,x±s. **P < 0.01 vs PBS group,△△P < 0.01 vs A549,下同 图 5 酶解Ⅱ组分对肺癌增殖的影响 |
结晶紫染色观察结果显示(图 6-A),组分Ⅱ(0.5 mg/mL)处理的三种肺癌细胞迁移数量显著少于PBS组。统计分析表明(图 6-B),组分Ⅱ处理的3种肺癌细胞迁移率与PBS组比较显著差异(P < 0.01);Ⅱ处理组中,H446和H460的迁移率显著低于A549迁移率(P < 0.01)。结果表明,2-6 kD的浒苔多肽能够有效抑制上述3种肺癌细胞的迁移,且对H446、H460的迁移抑制强于A549。
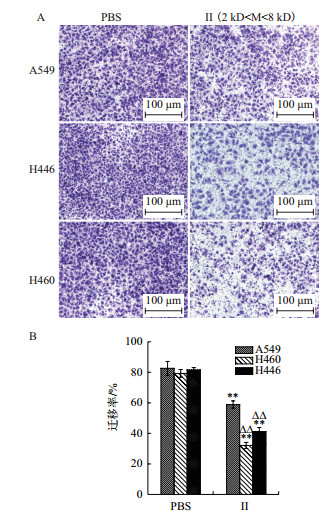
|
| 图 6 酶解Ⅱ组分对肺癌细胞迁移的影响 |
荧光显微镜观察Hoechst33342染色的结果(图 7)所示,PBS处理组的肿瘤细胞呈现弱蓝色荧光;组分Ⅱ处理的A549、H446、H460肺癌细胞组出现大量凋亡,细胞核呈现强蓝色荧光;组分Ⅱ处理组中,H446和H460比A549凋亡更多。结果表明2-6 kD的浒苔多肽能有效诱导上述3种肺癌细胞的凋亡。
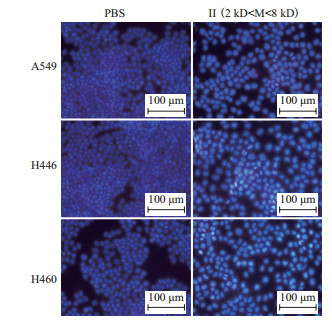
|
| 图 7 酶解Ⅱ组分对肺癌细胞凋亡的影响 |
流式细胞仪对浒苔多肽处理的A549、H446、H460细胞周期时相的时间动力学分析结果(图 8-A)显示,所有图中均存在一个较大的碎片峰(图中蓝色部分),可能由于浒苔多肽的作用,导致肺癌细胞膜与胞内物质出现分离,在反复吹打回收细胞时导致部分细胞破裂。G2/M期细胞数统计结果(图 8-B)所示,组分Ⅱ处理的A549、H446、H460肺癌细胞,G2/M期肺癌细胞所占比例分别为13.3%、20.3%和20.8%,显著高于PBS组(P < 0.01),且Ⅱ处理组H446、H460的G2/M期所占比例与A549也有显著差异(P < 0.01)。结果表明2-6 kD的浒苔多肽能阻滞肺癌细胞周期于G2/M期。
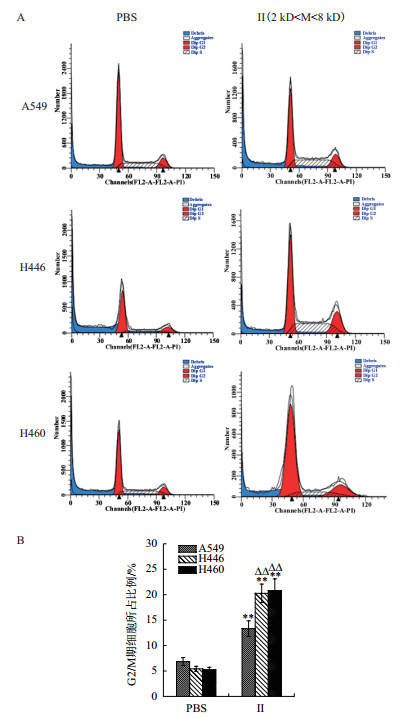
|
| 图 8 酶解Ⅱ组分对肺癌细胞周期的影响 |
目前,随着制药技术的更新换代,人们对天然活性小肽的认识不断加深,相对于其他的给药途径,天然小肽类药物的经鼻、肺部或口服等给药途径表现出更具可行性及商业价值[19-20]。天然植物蛋白质释放的小肽是近几年抗肿瘤新型药物的研究热点,其中浒苔属的小分子肽药用研发价值已逐渐被人发掘[21],本研究为条浒苔蛋白质资源高值化利用(功能食品、保健饮料、肽类药物等商业开发)探索提供新的途径。本文充分利用浒苔藻类资源丰富的优势,在前人的研究基础上,通过大量酶解条浒苔蛋白以筛选更多的抗肿瘤活性多肽。研究结果表现为:(1)经木瓜蛋白酶解的小于2 kD和6-12 kD条浒苔多肽对三种肺癌细胞未有明显的抑制作用;其2-6 kD条浒苔多肽对小管形成有一定抑制作用,说明其有抗血管生成能力,间接抑制肿瘤细胞的转移,但其对HUVEC的增殖抑制作用不强,说明其对正常细胞的损害不大;(2)2-6 kD条浒苔多肽可抑制H2O2引起的氧化应激,说明其具有一定的抗氧化能力,该结果与氧化应激是肿瘤一个重要的诱发因素和病理特征的研究结论是一致的[22-23];(3)2-6 kD条浒苔多肽对三种肺癌抑制增殖、促进凋亡、细胞周期阻滞等具有一定的作用效果,表明其有一定的抗肺癌能力;细胞周期的实验结果与目前发现的一些多肽抗肿瘤研究结果一致[24-25],其作用机制还有待进一步研究;(4)2-6 kD条浒苔多肽抑制H446、H460增殖与迁移、促进凋亡、细胞周期阻滞等作用均表现强于对A549细胞的作用,推测可能对小细胞肺癌模型(H446、H460)和非小细胞肺癌模型(A549)的作用机制不同,仍有待进一步研究。
4 结论经初步筛选及评价,本研究以木瓜蛋白酶最佳酶解条件:料液比1:25、加酶量1250 U/g pro、温度45.7℃、pH 7.2、震荡酶解时间120 min,酶解条浒苔蛋白获得的2-6 kD的多肽混合液,通过对三种肺癌细胞(A549、H446、H460)和HUVEC处理作用,表明该分子量范围内的多肽混合液中,存在能一定程度抑制小管形成及抗氧化作用,和抑制肺癌细胞增殖、促进凋亡、阻滞细胞周期等作用的小分子多肽,且其抑制H446、H460增殖与迁移、促进凋亡、细胞周期阻滞等作用均表现强于对A549细胞的作用。本课题组下一步将进一步缩小范围,分离纯化解析活性多肽组成,并开展机制和动物实验研究。
| [1] |
Hu YJ, Chen G, Hu J, et al. Statistical research on the bioactivity of new marine natural products discovered during the 28 years from 1985 to 2012[J]. Marine Drugs, 2015, 13(1): 202-221. DOI:10.3390/md13010202 |
| [2] |
许凯霞, 李亮, 邵长伦, 等. 海洋中药浒苔化学成分研究[J]. 中国海洋药物, 2015, 34(1): 1-6. |
| [3] |
杨青春, 王凯, 陈绍红, 等. 浒苔多糖的分离纯化及其对小鼠淋巴细胞活性的影响[J]. 中国海洋药物, 2015, 34(6): 41-48. |
| [4] |
李锋, 蔡振辉, 陈金梅, 等. 浒苔多酚的抗氧化及改善胰岛素抵抗作用[J]. 现代食品科技, 2016, 32(8): 34-41. |
| [5] |
冯地桑, 陈龙楷, 权桂兰, 等. 蛋白多肽类药物口服微球给药系统的研究进展[J]. 中国医药工业杂志, 2016, 47(11): 1464-1469. |
| [6] |
刘宸畅, 徐雪莲, 孙延龙, 等. 海洋小分子药物临床研究进展[J]. 中国海洋药物, 2014, 34(1): 73-89. |
| [7] |
许文彦, 赵思蒙, 曾广智, 等. 一些重要天然活性环肽化学和生物活性研究进展[J]. 药学学报, 2012, 47(3): 271-279. |
| [8] |
胡楠, 卞筱泓, 许激扬. 抗肿瘤活性多肽的研究现状[J]. 中国现代应用药学, 2015, 32(9): 1155-1160. |
| [9] |
李睿, 吴宗好, 陈卫东. 小分子多肽的来源新进展[J]. 中南药学, 2016(2): 175-178. |
| [10] |
邱娟, 沈建东, 翁凌, 等. 利用牡蛎制备ACE抑制肽的工艺优化[J]. 食品科学, 2017, 38(16): 165-172. DOI:10.7506/spkx1002-6630-201716026 |
| [11] |
蔡康鹏, 蔡水淋, 吴靖娜, 等. 海洋贝类活性肽研究进展[J]. 渔业研究, 2016, 38(2): 157-164. |
| [12] |
Zerfas BL, Gao J. Recent advances in peptide immunomodulators[J]. Current Topics in Medicinal Chemistry, 2015, 16(2): 187-205. DOI:10.2174/1568026615666150701114638 |
| [13] |
Shi WT, Hou W, Liu D, et al. The hypolipidemic effects of peptides prepared from Cicer arietinum in ovariectomized rats and HepG2 cells[J]. Journal of the Science of Food & Agriculture, 2018, 99(2): 576-586. |
| [14] |
Lee SY, Sun JH. Antihypertensive peptides from animal products, marine organisms, and plants[J]. Food Chemistry, 2017, 228: 506-517. DOI:10.1016/j.foodchem.2017.02.039 |
| [15] |
Hou HS, Wang X, Zhu Q, et al. A novel calcium-binding peptide from Antarctic krill protein hydrolysates and identification of binding sites of calcium-peptide complex[J]. Food Chemistry, 2017, 243: 389-395. |
| [16] |
Chaichana CA, Khamwut J, Jaresitthikunchai N, et al. A novel anti-cancer peptide extracted from Gynura pseudochina rhizome: cytotoxicity dependent on disulfide bond formation[J]. International Journal of Peptide Research & Therapeutics, 2018(5): 1-9. |
| [17] |
孟春英, 王茂剑, 张健, 等. 仿刺参体壁中抗菌肽的分离及抑菌活性[J]. 食品科学, 2016, 37(7): 33-38. |
| [18] |
滕瑜, 张双灵, 刘丛力, 等. 正交试验法优化浒苔干燥工艺[J]. 安徽农业科学, 2012, 40(1): 102-103. DOI:10.3969/j.issn.0517-6611.2012.01.040 |
| [19] |
杜昭明, 徐寒梅, 王轶博, 等. 长效蛋白多肽类药物技术研究进展[J]. 药物生物技术, 2017, 24(1): 63-67. |
| [20] |
周洁雨, 张兰, 毛世瑞. 蛋白及多肽药物干粉吸入剂研究新进展[J]. 药学学报, 2015, 50(7): 814-823. |
| [21] |
Harnedy PA, FitzGerald RJ. Bioactive proteins, peptides, and amino acids from macroalgae[J]. Journal of Phycology, 2011, 47(2): 218-32. DOI:10.1111/j.1529-8817.2011.00969.x |
| [22] |
Lee YM, Lee G, Oh TI, et al. Inhibition of glutamine utilization sensitizes lung cancer cells to apigenin-induced apoptosis resulting from metabolic and oxidative stress[J]. International Journal of Oncology, 2015, 48(1): 399-408. |
| [23] |
Zhang L, Li L, Gao G, et al. Elevation of GPRC5A expression in colorectal cancer promotes tumor progression through VNN-1 induced oxidative stress[J]. International Journal of Cancer, 2017, 140(12): 2734. DOI:10.1002/ijc.30698 |
| [24] |
阮之平, 田涛, 焦敏, 等. 蟾蜍活性多肽对不同肿瘤细胞的抗癌功能及机制研究[J]. 现代肿瘤医学, 2015, 23(15): 2100-2104. |
| [25] |
王强, 刘艳如, 陈宇东, 等. 蜂毒多肽对人膀胱癌T24细胞增殖的抑制作用[J]. 白求恩医学杂志, 2014, 12(3): 213-215. |




