2. 广东省微生态制剂工程技术研究中心,广州 510640
2. Guangdong Microecological Preparation Engineering Technology Research Center, Guangzhou 510640
表面活性素(Surfactin)是芽孢杆菌经过非核糖体途径合成的次级代谢产物,由7个氨基酸肽链和一个脂肪酸构成[1],是目前报道的最有效的脂肽类生物表面活性剂[2]。此外,由于Surfactin还具有高效抑菌、抗肿瘤和抗病毒等[3]生物活性以及稳定性好、生物相容性好、易被自然降解等优良的理化性质[4],因而在农业、医药、食品、畜牧、环保等众多领域均有广阔的应用前景[5]。
然而,由于天然野生型菌株发酵产Surfactin的能力极低(一般不超过600 mg/L)[6],导致其工业化生产成本高,进而严重阻碍了Surfactin的大规模生产应用[7]。目前,关于野生型菌株的育种手段主要有诱变育种、原生质体融合育种和基因工程育种。随机诱变育种由于突变的不定向性,导致筛选工作量大,改造成功率低。而基因工程虽可对基因组的任一靶点实现精准编辑,但由于表面活性素的生物合成过程所涉及的调控靶点众多且不完全清晰[8],因此通过单一基因的改造往往无法有效提高目标产物的产量,难以获得满足工业生产需求的工程菌。原生质体融合作为一种传统的育种手段能够有效地将两亲本的优良性状结合到一起,有望获得高产Surfactin的优良融合菌株。目前,原生质体融合在育种方面已取得了很大的成就。例如,姜雄韬等[9]通过原生质体融合技术获得了产细菌素能力强的融合菌株。Sun等[10]通过原生质体融合技术获得了能在高温条件下产胞外多糖的融合菌株。因此,利用原生质体融合技术定向重组芽孢杆菌种间优良遗传特性,以获得Surfactin合成能力更强的优良融合菌株,已成为一种重要的研究手段。
暹罗芽孢杆菌为本实验室自己分离的菌株,具有广谱抗菌的效果,能产生Surfactin,且其发酵液的抗菌性质稳定[11]。而纳豆芽孢杆菌作为一种纳豆发酵菌,不仅能产生易被人体吸收的氨基酸、有机酸、寡聚糖等营养成分,还能产生Surfactin[12-13]。因此,本研究拟通过对纳豆芽孢杆菌和暹罗芽孢杆菌进行原生质体融合,以期获得产Surfactin能力更强,且性能优异的融合菌株,为Surfactin的进一步产业化应用夯实基础。
1 材料与方法 1.1 材料菌株:纳豆芽孢杆菌、暹罗芽孢杆菌保藏于广东省微生态制剂工程技术研究中心。主要试剂:SMM(蔗糖0.5 mol/L、MgCl2 20 mmol/L和顺丁烯二酸20 mmol/L,pH 6.5)115℃,高压蒸汽灭菌20 min。10 mg/mL溶菌酶母液:称取0.1 g溶菌酶定容至10 mL,过滤除菌。PEG:称取5 g PEG6000定容至10 mL,pH 9.0。
再生培养基:蛋白胨1%,酵母粉0.5%,牛肉膏0.5%,NaCl 0.5%,MgCl2 4.01 g/L,甘露醇0.3 mol/L,pH 7.2,121℃,高压蒸汽灭菌30 min。
Landy发酵培养基(g/L):葡萄糖20,L-谷氨酸5,KH2PO4 1,MgSO4·7H2O 0.5,KCl 0.5,酵母粉1,L-苯丙氨酸2×10-3,MgSO4 5×10-3,CuSO4·5H2O 0.16×10-3,FeSO4·7H2O 0.15×10-3,pH 7.0,115℃,高压蒸汽灭菌20 min。
LB培养基(g/L):胰蛋白胨10,酵母粉5,NaCl 10,pH7.4,121℃,高压蒸汽灭菌30 min。
CPC-BTB溶液:0.1 mol/L PBS(Na2HPO4/NaH2PO4,pH8.0),0.2 mmol/L CPC(氯代十六烷基吡啶)和0.2 mmol/L BTB(溴百里酚蓝)用PBS溶解,取等量的CPC、BTB溶液混合即为CPC-BTB溶液。
Surfactin标品购置于Sigma公司;其他试剂均为分析纯。
1.2 方法 1.2.1 原生质体制备 1.2.1.1 最适酶浓度筛选将两菌株按1%的接种量二次接种于LB培养基中,37℃、200 r/min条件培养至对数中期,收集10 mL菌液,用无菌水洗涤菌体2次,最后用SMM溶液调整菌体浓度为1×107CFU/mL。加入不同浓度的溶菌酶,37℃酶解30 min,酶解完成后立即洗涤菌体2次。分别用无菌水和SMM溶液稀释菌液至10-5,静置30 min后取0.1 mL菌液涂布于再生培养基。
1.2.1.2 最佳酶解时间筛选同上述方法调整两亲本菌株的浓度至1×107CFU/mL,在最佳酶解浓度条件下,分别设置不同的酶解时间来探究时间对亲本菌株原生质体形成的影响。将酶解完成后的菌液立即离心、洗涤菌体2次。分别用无菌水和SMM溶液稀释菌液至10-5,静置30 min后取0.1 mL菌液涂布于再生培养基。
原生质体的形成率和再生率计算:
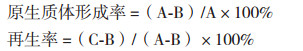
其中,A:溶菌酶处理前再生平板上的菌落数;B:溶菌酶处理后未原生质体化的菌落数;C:溶菌酶处理后再生平板上的菌落数。
1.2.2 原生质体的灭活标记分别采用紫外灭活和热灭活两种方式对亲本菌株进行灭活标记,不同的灭活方式对亲本菌株损伤的生理部位不同,紫外灭活主要作用在DNA上使原生质体失活,而热灭活主要作用在细胞质中的一些蛋白酶上,使其达到失活的效果。当两原生质体发生融合,它们在生理性状上达到互补,从而能够在再生培养基上再生出来。
1.2.2.1 纳豆芽孢杆菌原生质体紫外灭活在最佳酶浓度、最佳的酶解时间下制得纳豆芽孢杆菌原生质体溶液。取3 mL原生质体菌液放置于6 cm的平板中在15 w的紫外灯下照射不同时间,取0.1 mL菌液涂布于再生培养基,观察其灭活效果。
1.2.2.2 暹罗芽孢杆菌原生质体热灭活在最佳酶浓度、最佳的酶解时间下制得暹罗芽孢杆菌原生质体溶液。取3 mL原生质体菌液于试管中,放置于85℃的水浴锅中进行不同时间的灭活处理,取0.1 mL菌液涂布于再生培养基,观察其灭活效果。
1.2.3 原生质体融合取等量的灭活两亲株混合5 min,4 000 r/min离心15 min收集菌体,向沉淀中加入0.2 mL的CaCl2溶液,并用移液枪轻轻吹打充分溶解菌体。再缓慢向溶液中加入50%的PEG6000 1.8 mL,充分混匀菌体,放置于38℃的水浴锅中15 min。融合完成后,立即加入5倍体积的SMM溶液进行稀释,离心、洗涤菌体2次。最后取0.1 mL菌液涂布于再生培养基,培养24 h。
1.2.4 融合子的鉴定参考Nishito等[14]文献,对纳豆芽孢杆菌和暹罗芽孢杆菌中的SP片段和IT片段进行扩增,两个片段分别只能在一株亲本菌株中扩增出来,而无法在另一株亲本菌株中扩增。通过设计引物对Sp-F(5'-ATGAAGTTTACGGAATTTA-3')、Sp-R(5'-TTATAAAAGCTCTTCGTA CG-3')和IT-F(CAACGGTATCGAAGCA)、IT-R(CGTCTCGGGTATCATTT)来鉴定菌株的阳性融合子,PCR反应条件为:预变性94℃ 10 min,变性94℃ 35 s,48℃ 35 s,72℃ 40 s,30个循环,72℃ 10 min,4℃ forever。最后将PCR产物进行琼脂糖凝胶电泳检测。
1.2.5 高产Surfactin菌株的筛选高产Surfactin菌株的高通量筛选,采用本实验室在Yang等[6]文献的基础上改良和优化的BTB-CPC法(另文报道),通过BTB-CPC溶液与脂肽Surfactin发生的显色反应可以快速检测发酵液中脂肽Surfactin的含量。其反应原理为Surfactin与CPC-BTB反应可以将BTB置换出来,从而发生颜色变化,然后在615 nm的波长下测定其吸光度来确定Surfactin的含量。先配制CPC-BTB溶液,静置2 h使溶液达到稳定,再取160 μL的CPC-BTB溶液,放入96孔板中,在加入20 μL的发酵上清液,在室温条件下反应5 min,最后在615 nm的波长下测定其吸光度,根据吸光度的大小来初筛高产Surfactin菌株。
1.2.6 融合菌株Surfactin的提取通过酸沉淀甲醇抽提法[15]来提取Surfactin,将初筛菌株按1%的接种量接种于Landy培养基中发酵48 h,再将发酵液经过4℃,8 000 r/min离心,收集上清,调其pH值到2.0,放置于4℃的冰箱静置过夜沉淀,8 000 r/min离心收集沉淀,再将沉淀用pH为2.0的蒸馏水洗涤2次后冷冻干燥,冻干粉用甲醇抽提两次,旋转蒸发后用甲醇定容至10 mL备用。
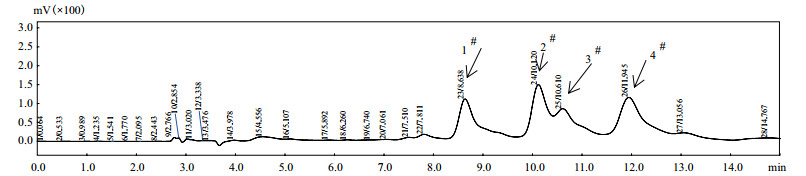
1.2.7 融合菌株Surfactin的液相检测取上述提取的脂肽溶液经过HPLC确定其Surfactin的含量。Surfactin色谱条件:色谱柱Ultimate® AQ-C18(5.0 μm,4.6×250 mm);紫外检测波长,205 nm;柱温,25℃;流动相:甲醇/水(含1‰三氟乙酸)=90:10;流速:1 mL/min;进样量:20 μL。经过液相检测其Surfactin有4个峰,通过计算4个峰面积总和来计算Surfactin的浓度。
1.2.8 融合菌株的电镜观察以1%的接种量接种亲本菌株和F8菌株于液体LB培养基中培养,取2 mL菌液用PBS溶液离心(5 000 r/min,5min)洗涤4次,用2%的戊二醛溶液4℃处理过夜,再用PBS洗涤4次,每次10 min。用1%的饿酸溶液固定样品3 h,小心去除饿酸废液,再用PBS洗涤3次,每次10 min。然后分别用30%、50%、70%、80%和90%体积分数的乙醇处理样品,每次10 min,最后用100%的乙醇处理2次。样品处理完后放置于粘样台上,进行离子喷镀,扫描电镜观察。
1.2.9 融合菌株的稳定性分析将融合菌株接种至LB培养基中进行传代培养5代,再通过PCR扩增其中的Sp和It片段,检测其融合子是否稳定。
1.2.10 数据分析表中的所以数据分析均采用Origin软件分析。
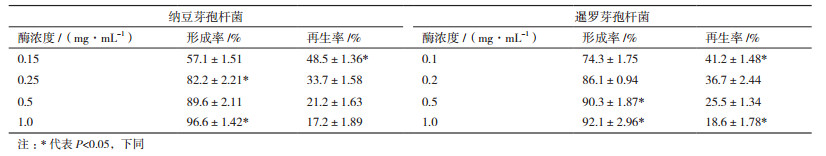
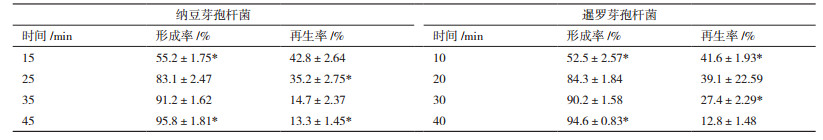
2 结果 2.1 亲本菌株的原生质体制备 2.1.1 纳豆芽孢杆菌和暹罗芽孢杆菌原生质体制备的最适酶浓度筛选由于不同的芽孢杆菌对酶的敏感程度不同,制备原生质体所需的酶浓度也不一样。从表 1中可以看出,纳豆芽孢杆菌原生质体的形成率随着酶浓度的增加而增加,但再生率总体上随着酶浓度的增加而降低。综合原生质体的形成率和再生率结果,得出纳豆芽孢杆菌的最佳酶浓度为0.25 mg/mL,暹罗芽孢杆菌的最佳酶浓度为0.2 mg/mL。
在一定的酶浓度下,原生质体形成率随时间的增加而增加,但如果酶解时间过长,最后对原生质体的再生会产生很大负面影响。
表 2为纳豆芽孢杆菌在酶解浓度为0.25 mg/mL、暹罗芽孢杆菌酶浓度为0.2 mg/mL时,原生质体的形成率和再生率结果。从表 2可以看出,综合原生质体的形成率和再生率指标,纳豆芽孢杆菌和暹罗芽孢杆菌最佳酶解的时间分别为25 min和20 min。
对于没有标记特性的菌株进行原生质体融合,灭活标记是一种常用的标记方法。将纳豆芽孢杆菌进行紫外灭活结果见图 1。图 1显示在灭活时间为40 min时纳豆芽孢杆菌原生质体大部分已经失活,但将原液涂布于再生培养基上,再生培养基上有很多的菌株长出,延长灭活时间为80 min时,平板上没有菌落长出,所以最后确定紫外灭活时间为80 min可达到100%灭活。而暹罗芽孢杆菌的原生质体在85℃的条件下灭活40 min后,经过涂布再生平板检测没有菌落长出,故确定暹罗芽孢杆菌的原生质体的灭活条件为在85℃的条件下灭活40 min。

|
| A;纳豆芽孢杆菌原生质体紫外灭活;B;暹罗芽孢杆菌原生质体体热灭活< 图 1 亲本菌株原生质体的灭活标记 |
对于灭活标记后的原生质体,无法单独在培养基中生长,当其融合后才能在培养基中长出。按上述的融合方法进行纳豆芽孢杆菌和暹罗芽孢杆菌的原生质体融合后,涂布到再生平板上在37℃培养24 h,从再生平板上长出的菌落认定为拟融合子。其结果如图 2,两亲本的对照组无菌落长出,说明菌株灭活标记完全,而再生平板上有菌落长出,说明菌株发生了融合。

|
| A:暹罗芽孢杆菌原生质体热灭活后的再生平板;B:纳豆芽孢杆菌原生质体紫外灭活后的再生平板;C:两个原生质体融合后的再生平板 图 2 原生质体融合结果 |
采取多重PCR的方法来鉴定两亲本菌株的阳性融合子。根据PCR结果(图 3)可知,在再生平板上长出的菌株大部分能扩增出两条单一条带,而在单个亲本菌株中分别只能扩增出一条带,说明两亲本菌株发生了融合。挑出阳性融合子做进一步的高产Surfactin的筛选。

|
| M:DNA Marker;P:暹罗芽孢杆菌IT片段;n:纳豆芽孢杆菌SP片段;1-20为拟融合子。下同 图 3 拟融合子菌株的PCR鉴定 |
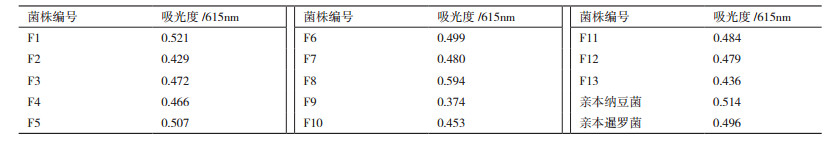
挑取PCR鉴定为阳性的再生平板上融合菌株于48孔板中发酵48 h,取等量菌体发酵液离心,将CPC-BTB溶液与发酵上清液反应。结果(图 4)表明,在筛选的215株菌株中,大部分菌株反应后的吸光度在615 nm下的吸光度要比原始亲株低,只有少数的融合菌株反应后的吸光度要高,其部分结果见表 3。将吸光度较亲本菌株高的融合菌株进一步摇瓶复筛,再通过HPLC检验,最终选出目的菌株。
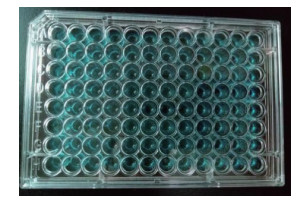
|
| 图 4 高产Surfactin融合菌株的初筛 |
通过酸沉淀甲醇抽提的方法提取发酵液中的脂肽物质,根据不同的Surfactin标准溶液在205nm处吸收峰峰面积绘制Surfactin的标准曲线,得到的标准品浓度与峰面积之间的关系为:y=2×107x+7×106,R2=0.951 9。用同样的方法测定发酵液中Surfactin的含量,如表 4所示。
图 5为Surfactin标准品的液相图,确定其Surfactin4个峰的出峰时间。纳豆芽孢杆菌、暹罗芽孢杆菌和融合菌株F8的Surfactin含量的液相比对如图 6,其Surfactin主要是1#峰和3#峰的两个同系物增加,而其余Surfactin的两个同系物无明显变化。
|
| 图 5 Surfactin标品图(1#、2#、3#、4#为Surfactin峰) |

|
| 图 6 融合菌株与亲本菌株的Surfactin液相比对图 |
通过电镜扫描观察(图 7)发现,纳豆芽孢杆菌、暹罗芽孢杆菌及融合菌株F8在放大5万倍后,其形态上都为杆状,菌体直径无明显变化。而融合后的菌株F8在菌体长度上相对于两亲本菌株都有所加长,说明融合后的菌株在形态上发生了变化。

|
| A:融合菌株F8;B:暹罗芽孢杆菌;C:纳豆芽孢杆菌 图 7 融合菌株和亲本的电镜扫描(左5万倍,右3万倍) |
原生质体融合育种过程中,融合菌株经过多次传代后容易发生退化,导致菌株又恢复到以前的状态。在对融合菌株F8进行5代的传代后继续扩增其中的Sp和It片段,验证融合菌株是否稳定,PCR结果如图 8,可以看出2条带存在于融合菌株F8中,说明融合子F8稳定。
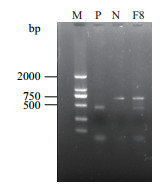
|
| 图 8 融合菌株F8 Sp和It片段的PCR扩增 |
Surfactin作为一种极具应用前景的物质,受到了科学家们的广泛青睐,而解决当前野生型菌株产Surfactin的能力低也是研究的重点问题。原生质体融合作为一种传统的育种技术,其优点是可以结合两亲本菌株的优良性状,并且操作简单、方便[16]。本研究中通过将两株产Surfactin能力都不强的亲本菌株进行原生质体融合,获得了产Surfactin能力强的融合新菌株。其原因可能是原生质体发生融合后,两菌株的基因组发生插入、交换等一系列的重组变化后,使菌株产Surfactin的能力得到了提高。对于高产Surfactin菌株的筛选,主要的问题是如何快速的筛选出目的菌株。在以前的研究中,Surfactin高产菌株的筛选主要还是集中在离子对平板法、琼脂柱法、琼脂扩散法、血平板法和蓝色凝胶平板法等[17-18],本实验对部分方法进行了尝试发现,琼脂柱法和血平板法都不能够准确的筛选出目的菌株,可能原因是芽孢杆菌能够产生很多和Surfactin性质相近的物质,如抗菌蛋白、糖脂等。这些都将会对筛选结果产生很大的干扰,导致筛选误差增大[19-20]。参考Yang等[6]关于Surfactin显色反应的筛选方法,本实验室在该方法的基础上改良和优化了CPC-BTB法(另文报道),能够快速对高产Surfactin菌株进行初筛。该方法相比于其它的一些Surfactin筛选方法,能够通过吸光度的测定快速筛选出我们的目的菌株,大量节约了筛选时间和工作量。对于最终筛选得到的融合菌株F8,经过HPLC验证,其产Surfactin能力得到了提高,说明该方法能够有效地对高产Surfactin菌株进行筛选。
本研究通过多重PCR技术来鉴定融合子,相比于以前通过RFLP标记技术、SSR标记技术、AFLP标记技术和其他一些鉴定技术[21],该方法更为简单、方便。之前研究在做原生质体融合时,先筛选出所需的目的菌株,然后对目的菌株进行融合子鉴定,这样浪费时间,因为原生质体之间自己本身也会发生融合,导致在进行目的菌株筛选时要筛选更多的菌株。而通过双重PCR技术确定是融合子后再进一步的筛选将节省大量的时间。
另外,在研究中发现融合菌株不稳定,经过几次传代之后菌株的融合性状消失,PCR扩增差异片段消失。本研究中的融合子F8经过5次以上传代后还能扩增出两条差异片段,说明该融合子已经稳定,其他7株没有扩增出特异差异片段,说明融合性状丢失。F8融合菌株的电镜形状观察也表明融合菌株在形态上长度变长了,这进一步证明了F8是融合了亲本的基因组,至于基因组是如何变化的,本团队将进一步进行融合子的全基因测序。
4 结论原生质体融合技术可以提高野生型菌株产Surfactin的能力。对原生质体制备条件进行酶浓度和酶解时间优化,最适合纳豆芽孢杆菌和暹罗芽孢杆菌原生质体制备的酶浓度分别为0.25 mg/mL和0.2 mg/mL,最佳的酶解时间为25 min和20 min。最后使得其原生质体形成率分别为83.1%和84.3%。再经过PEG6000促使原生质体发生融合,融合条件为50%的PEG6000在38℃下融合时间15 min,并利用PCR融合子鉴定和Surfactin高通量筛选技术,最后从215株融合菌株中筛选出一株F8菌株,其产Surfactin能力相较于纳豆芽孢杆菌提高了33.3%,暹罗芽孢杆菌提高了60%,通过电镜扫描发现融合菌株F8的形态相对于亲本菌株都有所加长,并且融合菌株F8能稳定遗传。
| [1] |
Jiang J, Gao L, Bie X, et al. Identification of novel surfactin derivatives from NRPS modification of Bacillus subtilis and its antifungal activity against Fusarium moniliforme[J]. BMC Microbiology, 2016, 16(1): 31-37. DOI:10.1186/s12866-016-0645-3 |
| [2] |
Wei YH, Wang LF, Chang JS. Optimizing iron supplement strategies for enhanced surfactin production with Bacillus subtilis[J]. Biotechnology Progress, 2010, 20(3): 979-983. |
| [3] |
翟少伟, 李剑, 史庆超. 抗菌脂肽Surfactin的抗菌活性及应用[J]. 动物营养学报, 2015, 27(5): 1333-1340. DOI:10.3969/j.issn.1006-267x.2015.05.001 |
| [4] |
Zhu L, Xu Q, Jiang L, et al. Polydiacetylene-based high-throughput screen for surfactin producing strains of Bacillus subtilis[J]. PLoS One, 2014, 9(2): 1432-1441. |
| [5] |
Banat IM, Franzetti A, Gandolfi I, et al. Microbial biosurfactants production, applications and future potential[J]. Applied Microbiology and Biotechnology, 2010, 87(2): 427-444. DOI:10.1007/s00253-010-2589-0 |
| [6] |
Yang H, Yu H, Shen Z. A novel high-throughput and quantitative method based on visible color shifts for screening Bacillus subtilis THY-15 for surfactin production[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(8): 1139-1147. |
| [7] |
Hu F, Liu Y, Li S. Rational strain improvement for surfactin production: enhancing the yield and generating novel structures[J]. Microbial Cell Factories, 2019, 18(1): 42. DOI:10.1186/s12934-019-1089-x |
| [8] |
Wu Q, Zhi Y, Xu Y. Systematically engineering the biosynthesis of a green biosurfactant surfactin by Bacillus subtilis 168[J]. Metabolic Engineering, 2018, 52(1): 87-89. |
| [9] |
姜雄韬, 顾青. 产细菌素乳酸菌原生质体融合[J]. 中国食品学报, 2017, 17(7): 214-220. |
| [10] |
Sun SS, Luo YJ, Cao SY, et al. Construction and evaluation of an exopolysaccharide-producing engineered bacterial strain by protoplast fusion for microbial enhanced oil recovery[J]. Bioresource Technology, 2013, 144(2013): 44-49. |
| [11] |
许本宏, 林俊芳, 叶志伟, 等. 带鱼肠道中芽孢杆菌的分离鉴定及其发酵液抗菌性质研究[J]. 水产科学, 2018, 37(2): 193-200. |
| [12] |
Sumi H, Yanagisawa Y, Yatagai C, et al. Natto Bacillus as an oral fibrinolytic agent: nattokinase activity and the ingestion effect of Bacillus subtilis natto[J]. Food Science and Technology Research, 2004, 10(1): 17-20. DOI:10.3136/fstr.10.17 |
| [13] |
王青云, 林亲录, 彭宽, 等. 纳豆芽孢杆菌Bna05菌株产抗霉脂肽的鉴定[J]. 微生物学通报, 2017, 44(11): 2660-2668. |
| [14] |
Nishito Y, Osana Y, Hachiya T, et al. Whole genome assembly of a natto production strain Bacillus subtilis natto from very short read data[J]. BMC Genomics, 2010, 11(1): 243-251. DOI:10.1186/1471-2164-11-243 |
| [15] |
Das P, Mukherjee S, Sen R. Antimicrobial potential of a lipopeptide biosurfactant derived from a marine Bacillus circulans[J]. Journal of Applied Microbiology, 2010, 104(6): 1675-1684. |
| [16] |
梁小龙, 赵峰, 史荣久, 等. 原生质体融合构建高效产脂肽工程菌[J]. 中国生物工程杂志, 2014, 34(11): 76-84. |
| [17] |
Li Wj, Wan Y, Li T, et al. High throughput screening of lipid metabolites in blood based on the data-independent acquisition mode[J]. Asian Journal of Ecotoxicology, 2017, 4: 46-55. |
| [18] |
Ohsugi T, Ikeda S, Sumi H. Anti-platelet aggregation and anti-blood coagulation activities of dipicolinic acid, a sporal component of Bacillus Subtilis Natto[J]. Food Science and Technology Research, 2005, 11(3): 308-310. DOI:10.3136/fstr.11.308 |
| [19] |
于慧敏.表面活性素的诱导型高产菌株构建及高密度发酵培养[C]. 2015年中国化工学会年会论文集.北京: 中国化工学会, 2015.
|
| [20] |
花榜清, 刘振民, 吴正钧, 等. 类芽孢杆菌抗菌物质的研究进展[J]. 应用化工, 2018, 47(7): 152-157. |
| [21] |
Bona CMD, Stelly D, Jr JCM, et al. Fusion of protoplasts with irradiated microprotoplasts as a tool for radiation hybrid panel in citrus Fusão de protoplastos com microprotoplastos irradiados como ferramenta para painel híbrido de radiação em citros[J]. Pesquisa Agropecuária Brasileira, 2009, 44(12): 1616-1623. DOI:10.1590/S0100-204X2009001200008 |