2. 开江县动物疫病预防控制中心,达州 636250
2. Animal Disease Prevention and Control Center of Kaijiang County, Dazhou 636250
猪圆环病毒2型(Porcine circovirus type 2,PCV2)属于无囊膜的、单股、环状、负链DNA病毒,是已知最小的动物病毒之一,是断奶仔猪多系统衰竭综合征(PMWS)、皮炎和肾病综合征(PNDS)的主要病原[1]。猪感染PCV2后,机体发生免疫抑制,进而出现免疫缺陷,淋巴细胞缺失,以及淋巴组织中巨噬细胞浸润等与PMWS相关的病理特征,主要在呼吸、泌尿、肠道、淋巴、心血管、神经、生殖和被膜系统上表现出临床症状[2-3]。PCV主要分为3个基因型,即PCV1、PCV2和PCV3。有研究表明,PCV1与PCV2基因序列的同源性小于80%,但是PCV1毒株间基因序列的同源性大于99%,PCV2毒株间基因序列的同源性大于96%。2016年,美国学者Phan等[4]首次从猪心脏等样品中分离出PCV3,通过宏基因组测序发现其为一种先前未知的新型猪圆环病毒(即猪圆环病毒3型,PCV3)。PCV2作为猪圆环病毒家族中非常重要的成员,也是猪群中最常见的猪圆环病毒基因型,于1991年在加拿大首次被发现[1]。在临床病例中,PCV2常与猪繁殖与呼吸综合征病毒(PRRSV)、猪细小病毒(PPV)、猪伪狂犬病毒(PRV)等繁殖障碍性病原混合感染,出现母猪流产、产木乃伊胎等临床症状,严重影响全球养猪业持续健康发展[5]。
PCV2为二十面体对称病毒,基因组大小约为1 760 bp,包括11个开放性阅读框(ORFs),其中ORF1和ORF2为两个主要的ORF[6],ORF1作为PCV2最大的ORF,主要编码病毒复制蛋白,即Rep蛋白,不同毒株间ORF1基因编码蛋白序列的同源性大于86%[7]。ORF3被ORF1所包含,但转录方向与ORF1相反,其编码一种诱导宿主细胞凋亡的病毒非结构蛋白[8]。Cap蛋白由ORF2基因编码,分子量大小约27. 8 kD,由233-234个氨基酸构成,PCV1与PCV2的Cap蛋白同源性较低,而PCV1或PCV2分离毒株间Cap蛋白同源性则较高。Cap蛋白N端富含碱性氨基酸,序列高度保守,前41个氨基酸是Cap蛋白的核定位信号肽序列,其中第12-18位和第34-41位氨基酸对于Cap蛋白的核定位起着决定性作用。第69-83位和第117-131位氨基酸作为Cap蛋白的两个主要特异性抗原表位,其中第117-131位(B-133)表位可作为PCV2感染的血清学标记,用于检测PCV2抗体效价。Cap蛋白作为PCV2主要的结构蛋白和免疫相关蛋白,在PCV2的感染和机体免疫过程中起着重要作用[9-10]。鉴于此,Cap蛋白常作为PCV2的靶蛋白应用于疫苗和诊断方法的研究[11-13]。有学者采用原核表达PCV2重组Cap蛋白,并以纯化后重组Cap蛋白为免疫原五次免疫产蛋鸡,制备抗Cap蛋白的多克隆抗体IgY,研制PCV2 Cap蛋白检测试剂盒[14]。本研究以猪圆环病毒2型Cap蛋白编码基因为参考序列,以PCV2毒株(CAU0673)基因为模板,设计特异性引物,进行Cap蛋白的诱导表达,Ni-NTA树脂亲和层析纯化和复性;复性后的重组Cap蛋白与弗氏佐剂混匀乳化,经背部皮下多点注射4次,免疫新西兰大耳白兔,制备兔抗Cap蛋白多克隆抗体,为PCV2抗体检测方法的研发奠定基础。
1 材料与方法 1.1 材料pET30a(+)载体购于Novagen公司;Ni-NTA树脂购于QIAGEN公司;PCV2毒株(CAU0673)、PCV2阳性猪血清购于中国兽医药品监察所;Trans109和BL21(DE3)感受态由家畜疫病病原生物学国家重点实验室抗体工程课题组保存;DNA Marker、蛋白Marker、BamH I和Xho I限制性酶购于宝生物工程(大连)有限公司;质粒提取试剂盒、DNA胶回收试剂盒和PCR清洁试剂盒购于AxyPrep公司;异丙基-β-D-硫代半乳糖甘(IPTG)、辣根过氧化物酶(HRP)标记兔抗猪IgG、HRP标记羊抗兔IgG和FITC标记的羊抗兔IgG购于SIGMA公司;蛋白胨、酵母提取物购于OXOID公司;卡那霉素购于Hyclone公司;猪圆环病毒2型灭活疫苗分别购于上海海利生物技术股份有限公司、普莱柯生物工程股份有限公司;普通级新西兰大白兔购于中国农业科学院兰州兽医研究所实验动物中心;其他试剂为国产分析纯。
1.2 方法 1.2.1 pET30a-PCV2-Cap重组载体的构建与鉴定以Cap蛋白编码基因为参考序列(GenBank:DQ-235696),进行引物设计。上游引物P1:5' -CGCGGATCCATGACGTATCCAAGGAGGCGTTTC-3',划下横线处为BamH I限制性酶切位点;下游引物P2:5'-CCGCTCGAGTCTTAGGGTTAAGTGGGGGGTCTTT-3',划下横线处为Xho I限制性酶切位点,引物由Invitrogen(上海)公司合成。以PCV2毒株(CAU0673)基因为模板,PCR扩增,获取目的基因片段。采用BamH I和Xho I双酶切pET30a(+)载体和DNA扩增产物,酶切产物经T4酶16℃连接18 h,将成功构建的pET30a-PCV2-Cap重组质粒转入大肠杆菌BL21(DE3)感受态细胞,涂布于卡那霉素抗性的LA平板,37℃培养12 h。挑取单菌落200 r/min摇菌培养,离心收菌,提取质粒,对重组质粒分别进行PCR鉴定和BamH I、Xho I双酶切鉴定,并送GENEWIZ(金唯智)公司测序。
1.2.2 重组Cap蛋白表达、纯化、复性及鉴定优化诱导表达条件,将鉴定完毕的重组表达菌接种于LB培养液,在终浓度为1 mmol/L IPTG 37℃诱导表达6 h,12 000 r/min离心收菌,PBS液悬浮洗涤,300 W超声破碎,8 000 r/min离心分离裂解液和沉淀,SDS-PAGE电泳分析。采用不同pH值的亲和层析液对重组Cap蛋白进行Ni-NTA亲和层析纯化,层析液包括:洗涤缓冲液(pH8.0)、2 mol/L尿素和B缓冲液(pH8.0),将溶解后样品与Ni- NTA树脂柱26℃结合40 min,采用C缓冲液(pH6.3)、D缓冲液(pH5.9)、E缓冲液(pH4.5)洗脱、收集样品,再采用不同浓度梯度的尿素(即8 mol/L、4 mol/L、2 mol/L、1 mol/L)和PBS液透析复性纯化后的重组Cap蛋白,最后进行SDS-PAGE分析。将纯化的复性重组Cap蛋白转印至PVDF膜,先后进行5%脱脂奶粉室温封闭,PCV2阳性猪血清(稀释比例为1:100)室温摇床孵育,PBST缓冲液洗涤,HRP标记兔抗猪IgG(稀释比例为1:5 000)室温摇床孵育,PBST缓冲液洗涤,HRP-DAB底物显色,暗室中曝光等操作步骤,对重组Cap蛋白进行Western blot鉴定。
1.2.3 多克隆抗体的制备选取12只健康、大小相近的雄性新西兰大耳白兔,分为4组,每组3只,分别为PCV2(LG毒株)灭活疫苗组(海利)、PCV2(SH毒株)灭活疫苗组(普莱柯)、PCV2重组Cap蛋白抗原组和阴性对照组(PBS液)。免疫原经背部多点皮下注射,按基础免疫和加强免疫两个阶段进行,海利组、中牧组基础免疫剂量为0.5猪剂量/只,加强免疫剂量为1头份/只,总共免疫4次,每次间隔时间为14 d。重组Cap蛋白组基础免疫时,采用重组Cap蛋白与完全弗氏佐剂等体积混匀乳化,免疫剂量为200 μg /只;加强免疫时,采用重组Cap蛋白与不完全弗氏佐剂等体积混匀乳化,免疫剂量为400 μg /只,总共免疫4次,每次间隔时间为14 d;阴性对照组按照同样方法进行皮下注射(表 1)。每次免疫前,耳缘静脉采血1-2 mL,最后一次加强免疫后7 d,颈动脉放血,3 000 r/min离心分离血清,-20℃保存。
PCV2全病毒蛋白、重组Cap蛋白和pET30a空载体经SDS-PAGE分离后,转印至PVDF膜,以制备的Cap蛋白多克隆抗血清(稀释比例为1:1 000)作为一抗,以辣根过氧化酶标记的山羊抗兔IgG(稀释比例为1:5 000)作为二抗,进行Western blot反应,鉴定多克隆抗体的反应原性,其他反应条件同1.2.2。
1.2.4.2 抗体效价测定采用本实验室已建立的间接ELISA方法对免疫兔血清抗体效价进行检测,将重组Cap蛋白以100 mL/孔包被于96孔的聚苯乙烯ELISA板,按照1/200、1/400、1/800、1/1 600、1/3 200、1/6 400、1/1 2 800、1/2 5 600倍比梯度稀释待检免疫兔血清,待检样品为每试验组免疫后0 d、14 d、28 d、42 d、56 d的兔血清。操作步骤如下:加待检样品100 μL/孔,未免疫兔血清为阴性对照,37℃孵育0.5 h,洗涤液洗板3次;加辣根过氧化酶标记的山羊抗兔IgG(稀释比例为1:7 000)100 μL/孔,37℃孵育0.5 h,洗涤液洗板3次;加TMB显色液100 μL/孔,室温避光孵育20 min,终止液终止反应,酶标仪读取OD450值,若待检样OD450值≥2.1倍阴性对照样OD450值,则判为是PCV2抗体阳性。
1.2.4.3 间接免疫荧光检测将PCV2毒株(CAU0673)接种于单层培养的PK-15细胞,37℃、5% CO2条件下培养48 h,采用4%多聚甲醛4℃固定接毒后的PK-15细胞30 min,PBS液洗涤3次,5 min/次,5%脱脂奶粉37℃封闭1 h;分别将四种免疫原制备的多克隆抗血清和非免疫兔血清作为一抗,3%BSA为稀释液,稀释比例为1:100,37℃孵育1 h,PBST洗涤3次,5 min/次;以FITC标记的羊抗兔IgG为二抗,PBST为稀释液,稀释比为1:300,37℃孵育1 h,PBST洗涤3次,5 min/次,最后加PBS覆盖封片,于荧光显微镜下观察。
2 结果 2.1 pET30a-PCV2-Cap重组载体的构建结果以PCV2毒株(CAU0673)的基因为模板,P1、P2为引物,扩增获得1条大小约702 bp的目的片段,而阴性对照组无目的片段(图 1),与预期结果相符合。构建的pET30a-PCV2-Cap重组质粒经BamH I、Xho I酶切鉴定,在702 bp和5 422 bp处出现目的基因片段的pET30a(+)载体片段(图 2)。

|
| M:DNA分子质量标准DL2 000;1:PCV2-Cap的PCR扩增产物;2:阴性对照 图 1 PCV2-Cap片段PCR扩增 |

|
| M:DNA分子质量标准DL2 000;1:重组质粒pET30a-PCV2-Cap;2:重组质粒pET30a-PCV2-Cap双酶切产物 图 2 重组质粒的酶切鉴定 |
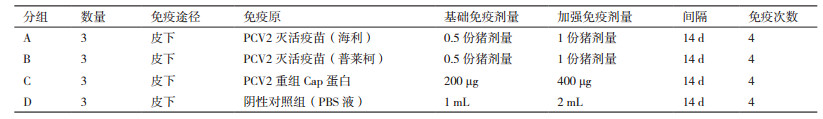
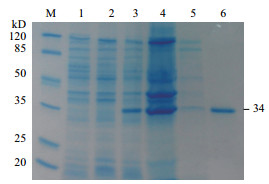
重组表达菌BL21(DE3)在最适宜条件下诱导表达,经SDS-PAGE电泳分析,在34 kD处出现目的条带,与理论值相一致,同时发现目的蛋白主要以包涵体形式存在(图 3)。复性后重组Cap蛋白转印至PVDF膜,进行Western blot鉴定,试验结果(图 4)显示,在34 kD处出现特异性的显色条带,而pET30a空载体处无特异性条带。这表明重组Cap蛋白与PCV2阳性猪血清发生特异性反应,拥有良好的反应原性。
|
| M:蛋白Marker;1:pET30a空载体;2:诱导前菌体;3:诱导后菌体;4:诱导超声破碎后沉淀;5:诱导菌超声破碎后上清液;6:复性纯化PCV2-Cap蛋白 图 3 重组Cap蛋白SDS-PAGE分析 |
|
| M:蛋白Marker;1:复性后重组Cap蛋白;2:pET30a空载体 图 4 重组Cap蛋白Western blot分析 |
Western blot鉴定结果(图 5)显示,重组Cap蛋白免疫制备的兔多克隆抗体与PCV2全病毒蛋白、重组Cap蛋白均发生特异性反应,在34 kD处出现特异性目的条带,而pET30a空载体处无特异性的目的条带,阴性对照兔血清与PCV2全病毒蛋白、重组Cap蛋白均未发生特异性反应,表明制备的多克隆抗体具有良好的反应原性。

|
| 1和4:PCV2全病毒蛋白;2和5:复性后重组Cap蛋白;3和6:pET30a空载体 图 5 兔抗血清的Western blot分析 |
经间接ELISA检测表明,采用重组Cap蛋白制备的多克隆抗体的抗体效价显著高于两种商品化的疫苗组,海利组抗体效价为1:3 200,普莱柯组抗体效价为1:1 600,而重组Cap蛋白组抗体效价为1:12 800(图 6)。
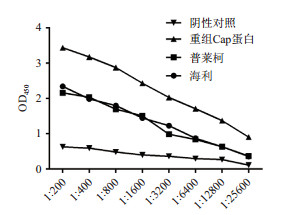
|
| 图 6 兔血清的抗体效价 |
重组Cap蛋白制备的多克隆抗体与PCV2全病毒抗原发生特异反应,在荧光显微镜下观察可见荧光(图 7-B);而阴性对照组(PBS液作为免疫原)未出现荧光(图 7-A)。

|
| A:阴性对照组兔血清;B:兔抗Cap蛋白多克隆抗体;C:白光下细胞图片 图 7 多克隆抗体的间接免疫荧光检测 |
PCV2作为目前已知最小的动物病毒,是断奶仔猪多系统衰竭综合征的重要病原。PCV2编码的Cap蛋白通过干扰素调节因子3(IRF3)与核转录因子кB(NF-кB)抑制干扰素,Rep蛋白则通过NF-кB激活干扰素,两者在调控方面表现出相反的功能,进而影响宿主先天性免疫反应[15]。Cap蛋白作为PCV2的主要结构蛋白,常用于PCV2疫苗和诊断方法的研究。有学者[16]将缺少N端核定位信号的Cap蛋白基因分成7个连续重叠的DNA片段Cap(1-7),采用细菌展示载体系统(APEx)对Cap蛋白上的抗原表位进行深入研究,发现Cap6是Cap蛋白上的抗原优势区域,Cap6-2为抗原优势表位,为PCV2血清学诊断和抗原检测奠定了基础。目前,有学者采用杆状病毒系统、枯草芽孢杆菌等对Cap蛋白进行表达研究[17-18]。
本研究通过PCR扩增Cap蛋白编码基因,成功构建pET30a-PCV2-Cap重组载体,在BL(DE3)宿主菌中IPTG诱导表达,得到大小约为34 kD的重组Cap蛋白,并发现Cap蛋白以包涵体形式表达,该存在形式有效避免了重组Cap蛋白被蛋白酶所降解。充分利用载体自带的His标签,通过Ni-NTA树脂亲和层析纯化,得到高纯度的目的重组蛋白。重组Cap蛋白与PCV2阳性猪血清发生特异性反应,表明该重组Cap蛋白具有很好的反应原性和特异性。复性后的重组Cap蛋白与弗氏佐剂混匀乳化,经背部多点免疫新西兰大耳白兔,制备兔抗Cap蛋白多克隆抗体,并同时采用两种不同厂家的商品化疫苗进行平行试验。结果发现Cap蛋白免疫的兔抗血清特异性良好,与PCV2重组Cap蛋白和全病毒抗原均发生特异性反应。重组Cap蛋白组与两家商品化疫苗组相比,其抗体效价高,达到1:12 800,显著高于商品化疫苗组。
本研究采用大肠杆菌pET30a(+)表达载体原核表达完整的PCV2 ORF2基因,得到富含抗原表位的重组Cap蛋白。pET30a(+)载体作为非常成熟的表达载体,其表达效率高、易于培养,拥有其他表达方式不具备的优势。多克隆抗体作为重要的免疫诊断材料,其与单克隆抗体相比有着独特的优势,能识别多个抗原表位,即使少数几个抗原表位被破坏或者抗原构象改变,实验的结果也不会受到影响,并且制备方法较易、成本较低。两种商品化疫苗均为灭活疫苗,海利组为PCV2 LG毒株的全病毒灭活疫苗,该毒株为PCV2中国分离株,与我国目前主要流行毒株处在同一亚型,并采用水质“海金稳”佐剂制备的灭活疫苗;普莱柯组为PCV2专利毒株SH毒株,该疫苗毒株是从临床症状典型的猪群中分离出来的PCV2流行毒株,采用进口的W/O/W双相佐剂制备的灭活疫苗,这或许是两种免疫原制备的多克隆抗体效价出现差异的原因。
4 结论本研究成功表达了PCV2 Cap蛋白,并成功制备了兔抗PCV2 Cap蛋白多克隆抗体,为建立PCV2抗体检测方法和疫苗的研究奠定了基础。
| [1] |
韦平, 秦爱建. 重要动物病毒分子生物学[M]. 北京: 科学出版社, 2008.
|
| [2] |
王小波, 周金柱, 俞天奇, 等. 猪皮炎肾病综合征的病理学观察[J]. 中国兽医学报, 2016(1): 162-165. |
| [3] |
王小波, 王海燕, 高杏, 等. 家养野猪自然感染猪圆环病毒2型的病理学观察[J]. 中国兽医学报, 2014, 34(8): 1314-1318. |
| [4] |
Palinski R, Piñeyro P, Shang P, et al. A novel porcine circovirus distantly related to known circoviruses is associated with porcine dermatitis and nephropathy syndrome and reproductive failure[J]. J Virol, 2016, 91(1): 1-13. |
| [5] |
Ou YT, Zhang XW, Liu XH, et al. Co-infection of swine with porcine circovirus type 2 and other swine viruses[J]. Viruses, 2019, 11(185): 1-14. |
| [6] |
Huang Z, Su S, Wei CY, et al. Complete genome sequence of a novel field strain of rearranged porcine circovirus type 2 in southern China[J]. J Virol, 2012, 86(19): 10895-10895. DOI:10.1128/JVI.01817-12 |
| [7] |
Hua T, Wang X, Bai J, et al. Attenuation of porcine circovirus type-2b by replacement with the Rep gene of porcine circovirus type-1[J]. Virus Res, 2013, 173(2): 270-279. DOI:10.1016/j.virusres.2013.02.007 |
| [8] |
Karuppannan AK, Kwang J. ORF3 of porcine circovirus 2 enhances the in vitro and in vivo spread of the of the virus[J]. Virology, 2011, 410(1): 248-256. DOI:10.1016/j.virol.2010.11.009 |
| [9] |
Nawagitgul P, Morozov I, Bolin SR, et al. Open reading frame 2 of porcine circovirus type 2 encodes a major capsid protein[J]. J Gen Virol, 2000, 81(9): 2281-2287. DOI:10.1099/0022-1317-81-9-2281 |
| [10] |
Santos MR, Assao VS, Santos FAA, et al. Utilization of phage display to identify antigenic regions in the PCV2 capsid protein for the evaluation of serological responses in mice and pigs[J]. Arch Virol, 2018, 163(7): 1877-1887. DOI:10.1007/s00705-018-3816-8 |
| [11] |
赵晓云, 乔绪稳, 陈瑾, 等. 利用E. coli表达猪圆环病毒2型Cap蛋白生产病毒样颗粒疫苗[J]. 中国农业科学, 2015, 48(5): 976-986. |
| [12] |
吴洋, 李庆伟, 杨娜娜. 猪PCV2 ORF2蛋白I-ELISA检测方法的建立及猪场血清抗体检测分析[J]. 免疫学杂志, 2015(1): 71-73. DOI:10.3760/cma.j.issn.1673-4394.2015.01.017 |
| [13] |
欧云文, 马小元, 王俊, 等. 猪圆环病毒2型ORF2基因的原核表达及反应原性分析[J]. 动物医学进展, 2017, 38(4): 1-6. DOI:10.3969/j.issn.1007-5038.2017.04.001 |
| [14] |
张遥遥, 张小莺, 李新平. 猪圆环病毒2型Cap基因的原核表达及IgY多抗的制备[J]. 中国兽医科学, 2017, 47(6): 727-732. |
| [15] |
张蕾, 代松宝, 张丽琳, 等. PCV2逃逸宿主天然免疫的分子机制研究[J]. 华北农学报, 2018, 33(2): 149-156. |
| [16] |
徐文娟, 张瑛杰, 李青青, 等. 利用细菌展示技术系统地筛选猪圆环病毒2型衣壳蛋白的线性抗原区域[J]. 中国预防兽医学报, 2016, 38(5): 398-402. DOI:10.3969/j.issn.1008-0589.2016.05.13 |
| [17] |
张晓, 尹秀凤, 徐凯, 等. 猪圆环病毒2型Cap蛋白在杆状系统中的表达与纯化[J]. 中国动物传染病学报, 2015(4): 53-56. DOI:10.3969/j.issn.1674-6422.2015.04.009 |
| [18] |
陈灵艳, 陈先进, 蒋烨, 等. 猪圆环病毒衣壳蛋白在枯草芽孢杆菌中的表达研究[J]. 生物技术通报, 2016, 32(5): 140-145. |