生菜(Lactuca sativa L.)是我国广受欢迎的生食叶类蔬菜之一,含有丰富的膳食纤维和多种维生素[1]。据统计,2011-2016年间,北京市叶类蔬菜种植面积占蔬菜总种植面积的比重逐年上升,由44.0%提高到45.9%[2]。2013年叶类蔬菜在北京的播种面积为3×104 hm2,其中生菜占比为14.4%,产量达2×108 kg[3-4]。在露天和温室种植过程中,温度过高或过低都会对生菜的生长产生不利的影响,且连续种植容易导致连作障碍的发生,在一定程度上会影响生菜的品质及产量[5-6]。此外,由于耕地面积有限,人们为了追求高产,加大了化肥农药的使用量,造成了土壤质量劣变,水资源和空气的污染等不可逆的环境问题[7]。
研究发现,合理的轮作对于土壤质量的改善具有一定的作用[8]。运用轮作可以增加谷子、黄瓜、马铃薯等作物的产量,提高土壤中变形菌门、酸杆菌门和浮霉菌门等微生物的活性[9-11]。目前我国在应用轮作来缓解连作障碍的研究主要集中在大豆、棉花等作物上,有关于生菜的研究报道较少。生菜连作过程中主要的病害有霜霉病、菌核病、灰霉病、软腐病和病毒病等[12]。目前,国内对于生菜病害的防治主要采取在种植过程中施用化肥和农药,长期使用会使病原菌的耐药性增强,并且价格较为昂贵[13]。此外,已有将十字花科蔬菜与生菜进行轮作的研究,结果表明轮作不仅提高了经济效益,对于病虫害的预防也具有一定的作用[14]。本文应用高通量测序技术对生菜轮作及连作不同阶段中土壤细菌群落结构和多样性进行了分析,研究生菜不同的种植模式对土壤微生物的影响,为保护土地资源,缓解生菜连作障碍,实现土壤的可持续发展提供理论基础。
1 材料与方法 1.1 材料试验位于北京市昌平区农作物品种试验展示基地(东经116.14°,北纬40.19°)的塑料大棚中进行,土地长50 m,宽8 m,种植密度为80株/畦,株距0.3×0.3 m。土壤类型为沙壤土[15],施用有机肥4.5×104 kg/hm2,试验土壤基本理化指标:土壤碱解氮153.21 mg/kg,土壤速效磷270 mg/kg,土壤速效钾312.45 mg/kg,pH 6.90。种植生菜品种为北散生2号,菠菜为越冬菠菜。
1.2 方法 1.2.1 大田试验设计种植期间施肥量和灌水量均保持一致。试验于2016年9月-2018年6月期间进行,试验田土壤样品分为对照与处理两组,对照组为生菜连作(N)5次和8次,处理组为生菜-菠菜轮作(S)3轮和4轮的生菜土壤样品,具体样品信息见表 1。对照和处理各设有12畦,其间有2畦保护行,畦长6.5 m,宽1.2 m,对照组在冬季有田闲期。样品命名方法为连作(N)/轮作(S)_种植年份_种植次(轮)数_定植(1)/收获(2),例:N_17_5_1表示2017年第5次生菜种植前。
用5点取样法在蔬菜定植前和收获后进行采样,采样深度为0-20 cm。样品采集后装入采样袋,编号标记,放入保温箱中1 h内带回实验室放于-40℃冰箱储藏备用。采收新鲜的植株,每畦随机取9株,每个处理3次重复,测定植株的鲜重;分别采用苯酚比色法、磷钼酸比色法、苯磷酸二钠比色法,高锰酸钾比色法测定土壤脲酶、土壤蔗糖酶、土壤酸性磷酸酶和土壤过氧化氢酶活性[16]。
1.2.3 土壤微生物基因组DNA的提取及16S rRNA基因PCR扩增土壤总DNA基因组的提取用DNA提取试剂盒进行,每个样品设3个平行。采用引物[17]338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)扩增土壤微生物16S rRNA基因的V3-V4区。20 μL PCR反应体系:FastPfu Buffer(5×)4.0 μL,dNTPs(2.5 mmol/L)2.0 μL,DNA模板10 ng,FastPfu Polymerase 0.4 μL,引物F(5 μmol/L)0.8 μL,引物R(5 μmol/L)0.8 μL,BSA 0.2 μL,补ddH2O至20 µl。PCR反应条件:95℃,3min;95℃,30 s,50℃,30 s,72℃,45 s,25个循环;72℃,10 min。扩增后的PCR产物进行2%琼脂糖凝胶电泳,经纯化后的样品用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行定量检测,每个样品将重复的3个PCR产物混合后进行测定。采用Illumina MiSeq PE300测序平台对PCR扩增产物进行双端测序分析。测序委托上海美吉生物医药科技有限公司完成。
1.2.4 数据统计用Usearch(vsesion 7.0 http://drive5.com/uparse/)对优化序列提取非重复序列,便于降低分析中间过程冗余计算量,去除没有重复的单序列;按照97%相似性对非重复序列(不含单序列)进行OTU聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。为了得到每个OTU对应的物种分类信息,采用RDP classifier(http://rdp.cme.msu.edu/)贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各个分类学水平:统计各样本的群落组成。利用R语言vegan包统计并绘制群落柱形图、韦恩图、PCA图、ANOSIM图和LEfSe图。其中,韦恩图可用于统计多个样本中共有和独有的OTU数目,直观的表现环境样本在不同分类水平上组成的相似性[18]。主成分分析(PCA),是一种对数据进行简化分析的技术,这种方法可以有效地找出数据中最“主要”的元素和结构,将原有的复杂数据降维,揭示数据背后的简单结构[19]。ANOSIM分析用来检验组间的差异是否显著大于组内差异,从而判断分组是否有意义[20]。LEfSe分析用于发现高维生物标识和揭示基因组的特征,使用non-parametric factorial Kruskal-Wallis(KW)sum-rank test(非参数因子克鲁斯卡尔-沃利斯秩和验检)检测具有显著丰度差异特征,并找到与丰度有显著性差异的类群,最后,用线性判别分析(LDA)来估算每个组分(物种)丰度对差异效果影响的大小[21]。RDA分析即冗余分析,是环境因子约束化的PCA分析,可以将样本和环境因子反映在同一个二维排序图上,从图中可以直观地看出样本分布和环境因子间的关系[22]。
2 结果 2.1 序列质量控制及细菌群落组成分析通过Illumina高通量测序并优化后,土壤样品共获得原始Reads 961 416条,质量控制后共获得有效序列46 865条,总碱基数422 267 957 bp,平均碱基长度为52 783 495 bp,其中421-440 bp和441-460 bp的碱基分别占总序列的45.65%和54.35%。如表 2所示,随着连作次数的增加,土壤中细菌的多样性和丰富度逐渐降低,OTU从2 793下降到2 623,Shannon指数从6.64下降到6.57,而轮作土壤中细菌的多样性和丰富度有所增加,OTU从2 790上升到2 806,Shannon指数从6.66上升到6.79。在经过相同的种植时间后,轮作土壤的Shannon指数高于连作,这表明两种种植方式对土壤中细菌群落结构产生了影响,短时间的连作和轮作可以增加土壤中细菌群落的多样性,且轮作的增加幅度稍高于连作。
土壤样品共检测到细菌40个门,89个纲,190个目,371个科,693个属。如图 1所示,其中连作土壤中相对丰度大于1%的细菌门有8个,轮作有9个。所有样品中88%以上的细菌序列属于变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)。而拟杆菌门(Bacteroidetes),芽单胞菌门(Gemmatimonadetes)和硝化螺旋菌门(Nitrospirae)和浮霉菌门(Planctomycetes)的相对丰度占比均低于5%。随着连作次数的增加细菌门水平的相对丰度也逐渐产生变化,变形菌门、厚壁菌门和放线菌门在连作过程中的占比逐渐下降,而酸杆菌门和绿弯菌门的相对丰度所占比例有所增加。轮作土壤样品中变形菌门和放线菌门的相对丰度占比呈现上升趋势,厚壁菌门、酸杆菌门和绿弯菌门的占比有所下降。
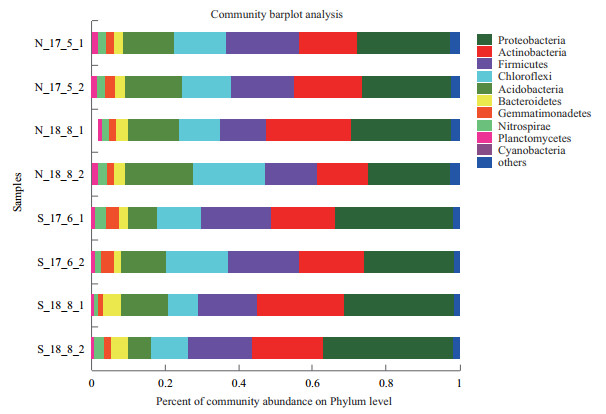
|
| 图 1 各土壤样品在门分类水平上细菌类群比较 |
本次共从数据库对比鉴定出694个属,如图 2所示。生菜连作5次后相对丰度占比较高的菌属依次为芽孢杆菌属(Bacillus)、酸杆菌(Acidobacteria_ norank)和JG30-KF-CM45_norank,而连作8次后厌氧绳菌(Anaerolineaceae_norank)的相对丰度占比逐渐增加,成为连作土壤中丰度占比较高的菌属。在生菜-菠菜轮作过程中丰度占比菌属较高的为芽孢杆菌属(Bacillus)、酸杆菌(Acidobacteria_ norank)和JG30-KF-CM45_norank,变化较为稳定。另外,壤霉菌属(Agromyces)、节细菌属(Arthrobacter)、黄杆菌属(Flavobacterium)、溶杆菌属(Lysobacter)、微细菌属(Microbacterium)和Pseudarthrobacter,在经过4轮轮作后丰度大于1%,逐渐成为土壤中的优势菌属,而在连作过程中的占比均在0.15%-0.82%范围内。

|
| 图 2 各土壤样品在属分类水平上细菌类群比较 |
对最后一次种植的土壤样品进行分析,韦恩图如图 3所示,第8次连作前后土壤样品中OTU分别为2 465、2 623,第4次轮作前后土壤样品中OTU为2 685和2 806,4个土壤样品共有OTU的数量为1 691,分别占样品总OTU的68.60%、64.47%、62.98%、60.26%。轮作土壤样品中特有的OTU占比为4.34%、2.55%,连作样品中为7.08%、6.41%。可见,轮作模式下土壤细菌群落的多样性高于连作。
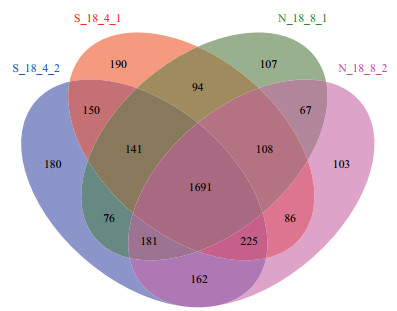
|
| 图 3 土壤样品中细菌多样性的相关性分析 |
如图 4所示,主成分1(PC1)可解释全部土壤样品细菌群落多样性的20.98%,主成分2(PC2)可解释土壤样品细菌群落的17.49%,两者总计可解释样品的38.47%。其中轮作土壤样品主要集中在PC1和PC2的负值区域,连作土壤样品大部分集中在PC1的负值区域和PC2的正值区域。这样的结果与ANOSIM统计分析的结果相类似,如图 5所示,分析表明连作与轮作土壤细菌群落存在显著差异(R=0.354 2,P=0.04)。

|
| 图 4 基于OTU水平的PCA分析 |
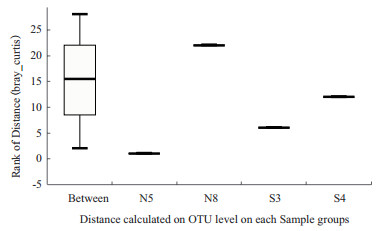
|
| 图 5 基于OTU水平的ANOSIM分析 |
组间样品菌群差异性分析结果见图 6。与轮作土壤样品相比较,连作有21个菌属发生改变,包括g_norank_p_Latescibacteria、g_norank_f_BIrii41、g_norank_c_Ardenticatenia、g_11_24、g_Panacagrimonas、g_norank__f_env__OPS_17、g_norank_c__OPB35__soil__group、蛭微菌属(Bdellovibrio)、g_unclassified_f_FamilyI_o__SubsectionIV、g_unclassified_f__Blastocatellaceae__Subgroup_4_、珊瑚状放线菌属(Actinocorallia)、g_norank_f_FamilyI_o_SubsectionIV、g_norank_c_BD7_11、苯基杆菌属(Phenylobacterium)、g_norank_c_Pla3_lineage、索氏菌属(Thauera)、g_norank_o_MVP_88、Inquilinus、Tepidanaerobacter和g_norank_o_Lineage_IIb的相对丰度显著升高;而鞘氨醇单胞菌属(Sphingomonas)、芽胞杆菌目未知菌属(g_unclassified_o_Bacillales)、类诺卡氏菌科未知菌属(g_unclassified_f_Nocardioidaceae)、Ilumatobacter、类芽孢杆菌属(Paenibacillus)、马杜拉放线菌属(Actinomadura)、Solirubrobacter、Iamia、中慢生根瘤菌属(Mesorhizobium)、g_unclassified_f_Phyllobacteriaceae、g_norank_o_Ardenticatenales、Skermanella、Cohnella、特吕珀菌属(Truepera)、Lautropia、Anaerotruncus、Limnobacter、Haloactinopolyspora、Defluviicoccus、g_norank_f_MNC12、贫养杆菌属(Modestobacter)、Marinimicrobium、房间芽孢杆菌属(Domibacillus)、Parafilimonas、丙酸杆菌科未知菌属(g_unclassified_f_Propionibacteriaceae)和g_norank_f_Euzebyaceae而的相对丰度显著降低。
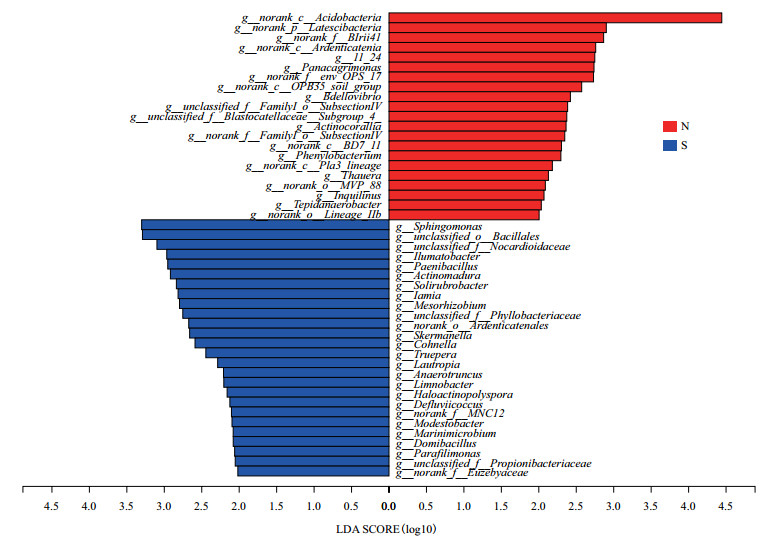
|
| 图 6 LEfSe分析属水平下LDA值分布柱状图 |
轮作和连作相同种植时间下生菜的产量如图 7所示,连作与轮作生菜产量变化有所差异。同一时期相比,轮作种植方式下生菜的产量为连作的1.06、1.05、1.23和1.38倍,产量差距不断增大。轮作模式下生菜产量变化较为稳定,均在5.40 kg/m2左右,而在连作种植方式下,生菜的产量随着连作次数的增加而降低,生菜的产量在第5次和第8次出现显著下降与第1次种植相比分别下降了19.9%和21.20%。

|
| 图 7 不同处理对生菜产量的影响 |
本次实验中土壤过氧化氢酶的变化最为明显,从图 8中可以看出,随着生菜的种植,土壤中过氧化氢酶活性逐渐升高。在经过相同的种植时间后,连作和轮作处理的土壤中过氧化氢酶活性增加显著,分别提高了54.22%和73.97%。在连作时,除第2次收获后土壤过氧化氢酶活性增加外,其余批次种植时收获后酶活性均下降,且第5次收获时酶活性显著下降20.7%。在生菜-菠菜轮作时,第1次生菜收获后过氧化氢酶活性下降较为显著,其后生菜种植收获时酶活性增加。
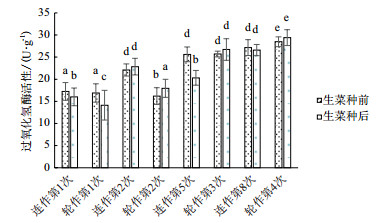
|
| 图 8 不同处理对土壤过氧化氢酶活性的影响 |
在属水平下,生菜产量、过氧化氢酶活性和土壤细菌群落的相关性分析结果如图 9所示。RDA分析的前两个轴总共解释了41.93%的群落变化,RDA1轴解释了34.84%,RDA2轴解释了7.09%。其中生菜产量对土壤细菌群落的影响最显著(P=0.044),且过氧化氢酶活性与生菜产量呈正相关。此外,芽孢杆菌属与生菜产量和过氧化氢酶活性呈正相关,norank_o_JG30-KF-CM45、厌氧绳菌科和酸杆菌纲和生菜产量及过氧化氢酶活性呈负相关。
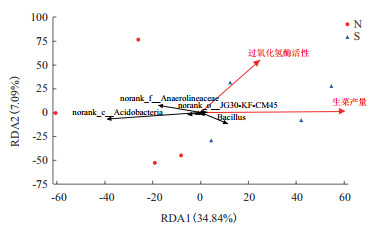
|
| 图 9 生菜产量、过氧化氢酶活性在细菌菌属分类水平下的冗余分析 |
利用高通量测序技术分析生菜连作及生菜-菠菜轮作过程中细菌群落的变化。本次实验中各样品的覆盖率均达到98%以上,证明本次测序结果代表了样品中微生物的真实情况。多样性指数越高说明细菌群落的多样性越高,它由群落的多样性和丰富度两部分组成[23-24]。在本次实验中,两种种植方式的多样性指数有所差异,轮作土壤中细菌群落的Shannon指数大于连作,这表明两种种植方式对土壤细菌群落结构产生了影响。随着生菜多次连续种植,土壤中细菌多样性逐渐下降,而生菜-菠菜轮作土壤中细菌群落的多样性和丰富度有所增加。研究表明,连作会导致土壤可培养细菌、放线菌数量显著降低,真菌数量显著增加,微生物群落由细菌型向真菌型转变,降低土壤中细菌的多样性,而轮作会增加土壤中细菌的多样性,与本次实验结果相符[25-27]。此外,主成分分析和ANOSIM分析表明两种种植方式下土壤细菌群落存在显著差异。
研究发现,鞘氨醇单胞菌属可以吸附土壤中的Cd、降解多种芳香族化学污染物[28]。在生菜连作土壤中鞘氨醇单胞菌属的丰度显著降低,可能会影响Cd和芳香族化学污染物在土壤中的降解,导致其在土壤中不断积累,危害到生菜植株的生长。生菜-菠菜轮作种植后土壤中芽孢杆菌属、假单胞菌属、硝化螺旋菌属、壤霉菌属、节细菌属、黄杆菌属、溶杆菌属和微细菌属相对丰度均大于连作土壤,而酸杆菌目在轮作过程中相对丰度下降。张立成等[27]通过对稻-稻-油菜轮作后土壤中细菌群落进行分析,发现轮作后土壤中酸杆菌、厚壁菌和浮霉菌所占细菌比例小于连作土壤,变形菌和芽单胞菌构成了轮作土壤中的优势菌群,与本实验中酸杆菌和芽孢杆菌属的变化趋势相符。杨尚东等[25]研究表明,番茄轮作后显著增加了土壤中的微生物数量,维持较高的细菌多样性之外,假单胞杆菌属等生防菌、促生菌种属的丰度逐渐增加,这与本实验轮作过程中假单胞菌属的丰度增加结果一致。梁志婷等[29-32]研究发现,溶杆菌属和节细菌属是轮作模式下土壤中的特异优势菌属,在降解化合物和植物病害防治方面具有巨大作用,这两个菌属同样在生菜-菠菜轮作过程中属于土壤中的优势菌属。在彭三妹等[33]的研究中,蔬菜与杭白菊轮作后,节细菌属和黄杆菌属成为土壤中的优势菌属,这些菌的增加可能会通过影响连作杭白菊的生长来缓解连作障碍。从细菌群落结构柱状图和生菜产量变化中可以看出,随着连作次数的增加,土壤中厌氧绳菌科的丰度不断上升,与此同时生菜的产量不断下降,与RDA分析中发现厌氧绳菌科与生菜产量呈负相关的结果相一致。厌氧绳菌是绿弯菌门的代表类群,是一类兼性厌氧生物,在光合作用中不产生氧气,不能固氮,可以分解有机物,并在厌氧环境中可以起到降解作用[34-35]。
研究发现种植方式在一定程度上可以有效地控制连作障碍的发生,合理轮作不仅可以提高土壤酶活性,也可以通过更换作物的种植减少土壤病原菌的繁殖,提高作物产量[36]。本次实验的同一种植时期内,轮作模式下土壤过氧化氢酶活性均高于连作。过氧化氢酶主要分解土壤中的过氧化氢,对于改善土壤肥力、促进降解土壤中的污染物具有极其重要的作用[37-38]。杨凤娟等[39]的研究中发现,黄瓜轮作后土壤微生物结构得到改善,细菌、放线菌数量增加,真菌数量减少,土壤过氧化氢酶活性提高。土壤中过氧化氢酶与放线菌及作物产量呈正相关,与本次实验连作过程中生菜在第5次种植时产量明显下降,过氧化氢酶活性呈下降趋势,放线菌门的相对丰度也逐渐降低的研究结果相似[40-41]。
从群落结构图的总体上看,大部分细菌的多样性和丰度变化不大。在连作土壤中细菌对连作的影响较小,相较真菌的优势性来看,细菌并不能够占据主导地位,在土壤中发挥的作用较小[26]。通过对轮作模式下甘薯根际微生物的研究,发现轮作显著提高甘薯根际土壤线虫群落多样性,使甘薯根际土壤线虫群落结构更加稳定,显著提高甘薯产量,降低病情指数[42]。轮作可以使土壤中多种真菌种群在土壤中共存,互相制约,防止病原真菌的过度繁殖,抑制病虫害的发生,使土壤中有机质、微生物量碳、微生物量氮含量提高,土壤酶活性增强,有益于保持土壤肥力和生产力,改善土壤生态环境[43]。马铃薯、大蒜等作物在连作5-20年后,连作障碍较为严重,本实验由于生菜的生长周期较短,在第5次种植后产量和过氧化氢酶活性下降明显[44-45],出现连作障碍。
研究应用高通量测序技术研究生菜连作和生菜-菠菜轮作土壤中细菌群落的结构变化。通过对两种种植模式下土壤的分析可知,轮作土壤中多样性指数和丰富度均高于连作,表明轮作对于土壤中细菌群落结构的改善具有重要影响。轮作模式下土壤中有益菌群的丰度、过氧化氢酶活性及生菜产量均高于连作,证明应用菠菜与生菜进行轮作对于增加土壤中有益菌群的含量、提高生菜产量具有一定的作用。
4 结论本研究发现连作与轮作土壤中细菌群落差异较为明显。其中,生菜产量对土壤细菌群落的影响最为显著,同时,芽孢杆菌属和过氧化氢酶活性与生菜产量呈正相关。与连作相比,轮作后土壤中细菌的丰富度和多样性有所增加,如:假单胞菌属、芽孢杆菌属、溶杆菌属等相对丰度逐渐增加。轮作增加了生菜的产量,提高了土壤过氧化氢酶活性。
| [1] |
Kim MJ, Moon Y, Kopsell DA, et al. Nutritional value of crisphead 'Iceberg' and Romaine Lettuces(Lactuca sativa L.)[J]. Journal of Agricultural Science, 2016, 8(11). |
| [2] |
Gao XZ, Liu YQ, Chang Q, et al. Microbiological survey of field-grown and retail lettuce in Beijing[J]. Journal of Food Safety, 2018, 38. |
| [3] |
杨鑫, 穆月英, 王晓东. 北京市蔬菜生产及其特征分析[J]. 中国农学通报, 2016, 32(13): 182-190. DOI:10.11924/j.issn.1000-6850.casb15110119 |
| [4] |
范双喜. 北京市叶类蔬菜产业发展研究[M]. 北京: 中国农业出版社, 2014.
|
| [5] |
Qiu P, Nguyen V, Guan G, et al. Occurrence of powdery mildew caused by Golovinomyces orontii, on Lactuca sativa, var. ramosa, (lettuce)in China[J]. Crop Protection, 2018, 110: 108-111. DOI:10.1016/j.cropro.2018.04.005 |
| [6] |
胡俊杰, 赵文若, 刘畅. 日本莴苣引种栽培技术[J]. 北方园艺, 2008(9): 80. |
| [7] |
Du JB, Han TF, Gai JY, et al. Maize-soybean strip intercropping:Achieved a balance between high productivity and sustainability[J]. Journal of Integrative Agriculture, 2018, 17(4): 747-754. DOI:10.1016/S2095-3119(17)61789-1 |
| [8] |
黄锦法, 曹志洪, 李艾芬, 等. 稻麦轮作田改为保护地菜田土壤肥力质量的演变[J]. 植物营养与肥料学报, 2003, 9(1): 19. DOI:10.3321/j.issn:1008-505X.2003.01.004 |
| [9] |
牛倩云, 韩彦莎, 徐丽霞, 等. 作物轮作对谷田土壤理化性质及谷子根际土壤细菌群落的影响[J]. 农业环境科学学报, 2018, 37(12): 2802-2809. DOI:10.11654/jaes.2018-0128 |
| [10] |
杨威, 闫海霞, 刘廷武, 等. 黄瓜和草菇轮作对后茬黄瓜根围细菌多样性及土壤酶活性的影响[J]. 江苏农业科学, 2018, 46(5): 124-128. |
| [11] |
Wright PJ, Falloon RE, Hedderley D. A long-term vegetable crop rotation study to determine effects on soil microbial communities and soilborne diseases of potato and onion[J]. New Zealand Journal of Experimental Agriculture, 2017, 45(1): 26. |
| [12] |
崔素兰, 崔树林. 莴苣常见病害识别与防治[J]. 中国果菜, 2007(6): 35-35. DOI:10.3969/j.issn.1008-1038.2007.06.031 |
| [13] |
黄凤莲. 蔬菜灰霉病的综合防治[J]. 湖南农业科学, 2000(4): 39. DOI:10.3969/j.issn.1006-060X.2000.04.021 |
| [14] |
靳博红.太白高山蔬菜轻简高效轮作模式及栽培技术研究[D].杨凌: 西北农林科技大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10712-1018974519.htm
|
| [15] |
钟连全, 王立府, 齐长红, 等.浅谈昌平草莓种苗繁殖技术[C].第六届全国草莓大会论文集. 2009: 259-262. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-EGYP200912001059.htm
|
| [16] |
中国科学院南京土壤研究所. 土壤理化分析[M]. 上海: 上海科学技术出版社, 1978.
|
| [17] |
王鹏, 陈波, 张华. 基于高通量测序的鄱阳湖典型湿地土壤细菌群落特征分析[J]. 生态学报, 2017, 37(5): 1650-1658. |
| [18] |
Ji P, Rhoads WJ, Edwards MA, et al. Impact of water heater temperature setting and water use frequency on the building plumbing microbiome[J]. The ISME Journal, 2017, 11(6): 1318. DOI:10.1038/ismej.2017.14 |
| [19] |
Chen X, Hou F, Wu Y, et al. Bacterial and fungal community structures in loess plateau grasslands with different grazing intensities[J]. Frontiers in microbiology, 2017, 8: 606. DOI:10.3389/fmicb.2017.00606 |
| [20] |
Leung MHY, Chan KCK, Lee PKH. Skin fungal community and its correlation with bacterial community of urban Chinese individuals[J]. Microbiome, 2016, 4(1): 46. DOI:10.1186/s40168-016-0192-z |
| [21] |
Guerrero-Preston R, Godoy-Vitorino F, Jedlicka A, et al. 16S rRNA amplicon sequencing identifies microbiota associated with oral cancer, human papilloma virus infection and surgical treatment[J]. Oncotarget, 2016, 7(32): 51320. |
| [22] |
Shen L, Wu H, Gao Z, et al. Comparison of community structures of Candidatus Methylomirabilis oxyfera-like bacteria of NC10 phylum in different freshwater habitats[J]. Scientific Reports, 2016, 6: 25647. DOI:10.1038/srep25647 |
| [23] |
Harch BD, Correll RL, Meech W, et al. Using the Gini coefficient with BIOLOG substrate utilisation data to provide an alternative quantitative measure for comparing bacterial soil communities[J]. Journal of Microbiological Methods, 1997, 30(1): 0-101. |
| [24] |
Staddon WJ, Duchesne LC, Trevors JT. Microbial diversity and community structure of postdisturbance forest soils as determined by sole-carbon-source utilization patterns[J]. Microbial Ecology, 1997, 34(2): 125-130. |
| [25] |
杨尚东, 李荣坦, 吴俊, 等. 番茄连作与轮作土壤生物学特性及细菌群落结构的比较[J]. 生态环境学报, 2016, 25(1): 76-83. |
| [26] |
殷继忠, 李亮, 接伟光, 等. 连作对大豆根际土壤细菌菌群结构的影响[J]. 生物技术通报, 2018, 34(1): 230-238. |
| [27] |
张立成, 肖卫华, 彭沛宇, 等. 稻-稻-油菜轮作土壤细菌群落的特征[J]. 应用与环境生物学报, 2018, 24(2): 276-280. |
| [28] |
Aislabie J, Saul DJ, Foght JM. Bioremediation of hydrocarbon-contaminated polar soils[J]. Extremophiles, 2006, 10(3): 171-179. DOI:10.1007/s00792-005-0498-4 |
| [29] |
梁志婷, 邓建强, 王自奎, 等. 陇东旱塬区不同粮草轮作模式下土壤细菌群落组成特征[J]. 草业学报, 2017, 26(8): 180-191. |
| [30] |
Zhang W, Huffman J, Li S, et al. Unusual acylation of chloramphenicol in Lysobacter enzymogenes, a biocontrol agent with intrinsic resistance to multiple antibiotics[J]. BMC Biotechnology, 2017, 17(1): 59. |
| [31] |
姬广海. 溶杆菌属及其在植物病害防治中的研究进展[J]. 云南农业大学学报:自然科学版, 2011, 26(1): 124-130. |
| [32] |
Fernándezgonzález AJ, Martínezhidalgo P, Cobodíaz JF, et al. The rhizosphere microbiome of burned holm-oak:potential role of the genus Arthrobacter in the recovery of burned soils[J]. Scientific Reports, 2017, 7(1): 6008. DOI:10.1038/s41598-017-06112-3 |
| [33] |
彭三妹, 王博林, 徐建中, 等. 不同条件下连作杭白菊内生菌群的T-RFLP分析[J]. 中国中药杂志, 2014, 39(24): 4763. |
| [34] |
刘昌, 黄莺, 陈雪, 等. 有机、无机肥配施比例对植烟土壤细菌组成及烤烟产质量的影响[J]. 河南农业科学, 2018, 47(6): 52-58. |
| [35] |
陈力力, 刘金, 李梦丹, 杨伊磊, 邹应斌, 黄敏. 不同耕作方式稻田土壤细菌的多样性[J]. 微生物学杂志, 2018, 38(4): 62-70. DOI:10.3969/j.issn.1005-7021.2018.04.009 |
| [36] |
苗钰婷. 设施土壤酶活性的研究进展[J]. 南方农机, 2018, 49(10): 115. DOI:10.3969/j.issn.1672-3872.2018.10.100 |
| [37] |
王建, 祁迎春, 冯琦, 等. 黄土高原油污土壤植草恢复与土壤CAT活性的关系[J]. 陕西农业科学, 2016, 62(6): 6-11. DOI:10.3969/j.issn.0488-5368.2016.06.002 |
| [38] |
关松荫. 土壤酶与土壤肥力[J]. 土壤通报, 1980(6): 19-21. |
| [39] |
杨凤娟, 吴焕涛, 魏珉, 等. 轮作与休闲对日光温室黄瓜连作土壤微生物和酶活性的影响[J]. 应用生态学报, 2009, 20(12): 2983-2988. |
| [40] |
孙正国. 连作西瓜的根际土壤酶活性和微生物多样性[J]. 水土保持研究, 2015, 22(5): 46-51. |
| [41] |
李倩, 巴图, 刘景辉, 等. 保水剂施用方式对土壤酶活性及马铃薯产量的影响[J]. 西北农林科技大学学报:自然科学版, 2017, 45(5): 116-122. |
| [42] |
乔月静, 刘琪, 曾昭海, 等. 轮作方式对甘薯根际土壤线虫群落结构及甘薯产量的影响[J]. 中国生态农业学报(中英文), 2019, 27(1): 20-29. |
| [43] |
陈丹梅, 陈晓明, 梁永江, 等. 种植模式对土壤酶活性和真菌群落的影响[J]. 草业学报, 2015, 24(2): 77-84. |
| [44] |
徐雪风, 回振龙, 李自龙, 等. 马铃薯连作障碍与土壤环境因子变化相关研究[J]. 干旱地区农业研究, 2015(4): 16-23. |
| [45] |
尹彦舒, 崔曼, 崔伟国, 等. 大蒜连作障碍形成机理的研究进展[J]. 生物资源, 2018, 40(2): 141-147. |