2. 广西高校干细胞与医药生物技术重点实验室,桂林 541004;
3. 广西师范大学生物医学 研究中心,桂林 541004
2. Guangxi Universities Key Laboratory of Stem Cell and Biopharmaceutical Technology, Guilin 541004;
3. Biomedical Research Center, Guangxi Normal University, Guilin 541004
在小鼠中,多能祖细胞(Multi-potent progenitors,MPPs)是由造血干细胞分化而来,随后开始向两个方向分化,形成共同髓系祖细胞(Common myeloid progenitors,CMPs)和共同淋巴祖细胞(Common lymphoid progenitors,CLPs)。CLPs主要负责分化产生各种淋巴系细胞(包括T、B细胞和NK细胞等),而CMPs则进一步向下游分化形成粒细胞/巨噬细胞祖细胞(Granulocyte/macrophage progenitors,GMPs)和巨核细胞/红系祖细胞(Megakaryocyte/erythrocyte progenitors,MEPs)。GMPs主要负责分化为粒细胞、巨噬细胞、单核细胞和树突状细胞等,MEPs则最终分化形成血小板和红细胞[1]。近期研究表明,肿瘤的发生与骨髓细胞生成的内部紊乱有关[2]。由GMPs分化形成的未成熟子细胞,统称为髓源性抑制细胞(Myeloid-derived suppressor cells,MDSCs),大量累积[3-5]。MDSCs不仅能抑制T细胞增殖和功能活性,并且能直接参与肿瘤发育和血管生成等细胞过程进而促进肿瘤细胞生长和转移[6-7],这是导致肿瘤加速生长和免疫逃逸的主要“元凶”之一[8]。因此,本实验以免疫系统中较上游的祖细胞为切入点,研究炎症和肿瘤对机体免疫系统的影响。
1 材料和方法 1.1 材料 1.1.1 实验动物实验使用C57BL/6小鼠(对照组,炎症模型组:AOM/DSS处理4周,肿瘤模型组:AOM/DSS处理12周)。
1.1.2 实验耗材细胞培养皿、各种规格离心管、1 mL注射器、细胞筛、各种规格吸头,手术盘以及剪刀镊子等。
1.1.3 实验试剂Azoxymethane(AOM,Sigma)、Dextran Sulfate Sodium Salt(DSS,YEASEN)、Anti-mouse Sca-1-PE-Cy7、Anti-mouse c-Kit-APC-eFluor780、Anti-mouse CD34-FITC、Anti-mouse CD135 APC、Anti-mouse CD90.1-PerCP-Cy5.5、Anti-mouse CD127 PerCP-Cy5.5、Mouse Hematopoietic Lineage Antibody Cocktail FITC、Anti-mouse CD16/32-PerCP-Cy5.5、Anti-mouse CD4-PE、Anti-mouse CD8-PE-Cy7、Anti-mouse B220-PerCP-Cy5.5、Anti-mouse Gr-1-APC、Anti-mouse CD11b-PE-Cy7、7-AAD、固定/渗透试剂Cell fixation and cell permeabilization kit(eBioscience)、FBS、DMEM Basic(Gibco)、20×PBS缓冲液(上海生工生物工程有限公司)、双抗、红细胞裂解液、苏木素染液和伊红染液(Solarbio)等。
1.1.4 实验仪器流式细胞仪(BD)、冷冻离心机、超纯净去离子水组合系统(Thermo)、石蜡切片机和石蜡包埋仪(Leica)等。
1.2 方法 1.2.1 小鼠炎症性结肠癌模型构建用生理盐水将100 mg AOM原液稀释至1.25 mg/mL,选年龄性别相当的小鼠随机分配3个组(对照组(N)、炎症组(I)和肿瘤组(T)),按12.5 mg/kg小鼠体重对肿瘤组小鼠行单次腹腔注射AOM,继而喂以含2%DSS的饮用水和普通饲料,喂药周期以给药1周停药2周循环,停药期间喂以正常饮用水,对照组小鼠则注射等量生理盐水,喂正常饮用水。肿瘤组小鼠处理8周后,对炎症组小鼠行单次腹腔注射AOM并按给药周期给药。肿瘤组腹腔注射12周(4个给药周期,炎症组4周)后,处死小鼠进行下一步实验。
1.2.2 小鼠结肠石蜡切片和HE染色处死小鼠,取结肠并沿径向剖开,用PBS清洗结肠;并沿径向卷起并投入波氏固定液中24 h,后流水冲洗6 h或过夜。将结肠组织修整后依次经浓度梯度酒精(50%、60%、70%、80%、90%、95%Ⅰ、95%Ⅱ、100%Ⅰ、100%Ⅱ)脱水各35 min,在依次用二甲苯:乙醇=1: 1溶液10 min,二甲苯Ⅰ、二甲苯Ⅱ各10 min,随后将结肠组织投入58-6 0℃石蜡中透蜡2-3 h。将组织包埋在蜡块中进行切片,厚度为4-5 μm;切片于38.5℃温水上展片,待切片充分展平后捞至载玻片上进行烤片。随后切片经二甲苯Ⅱ和二甲苯Ⅰ各15 min、二甲苯:乙醇=1: 1溶液10 min脱蜡,紧接着将切片按顺序放入逆浓度梯度酒精和二次水中各5 min。将切片至于苏木素染液中室温条件下染色15-2 0 min,后放入水中洗去多余染液,并放入分化液中3-5 s,取出切片放入水中终止分化。随后至于伊红染液中染色5 min,后放入水中洗去多余的染液。95%Ⅰ、95%Ⅱ、100%Ⅰ、100%Ⅱ酒精各2 min,二甲苯Ⅰ、二甲苯Ⅱ各2 min脱水透明,镜检封片成像。
1.2.3 小鼠骨髓细胞单细胞悬液的制备脱颈处死小鼠,剪后肢并剔除股骨与胫骨上的肌肉,并将骨头至于PBS中。用吸有DMEM完全培养基的注射器将骨腔内的骨髓组织吹出,并用移液器反复吹打成单个悬浮细胞,经300×g离心5 min(下同)后,弃上清液并加入1 mL红细胞裂解液,2 min后加入足量的PBS终止裂解,离心弃上清液。加6 mL PBS重悬细胞,用70 μm细胞筛过滤后待用。
1.2.4 细胞丰度分析取骨髓单细胞悬液1 mL于2 mL离心管中离心,弃上清液,4℃避光孵育抗体30 min。后用PBS清洗细胞,并用1 mL PBS重悬细胞,进行流式细胞分析。
1.2.5 细胞周期分析取骨髓单细胞悬液4 mL,离心弃上清液,避光孵育抗体30 min。加入500 μL固定液充分混匀,固定1 h,加入渗透液2 mL轻轻吹打均匀,750×g离心10 min,弃上清液,室温避光孵育7-AAD染液1 h。随后加入渗透液3 mL清洗细胞,并用3 mL渗透液重悬细胞,进行流式细胞分析。
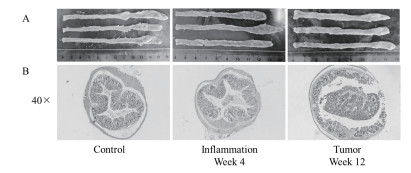
2 结果 2.1 小鼠炎症性结肠癌模型构建小鼠炎症性结肠癌模型可以提供结肠炎和结肠癌两组实验动物。用AOM和DSS联合诱导小鼠4周,小鼠结肠可产生明显的炎症,诱导12周后可形成成熟的结肠癌,主要表现为炎症组和肿瘤组小鼠结肠(平均长度分别为:9.3 cm和9.0 cm)较正常对照组小鼠结肠(11.6 cm)显著缩短(图 1-A)。不仅如此,病理切片结果明显表现出炎症和肿瘤发生的情况(图 1-B)。
|
| A小鼠结直肠外观;B小鼠结直肠H & E染色 图 1 AOM/DSS处理后小鼠结直肠炎症和肿瘤发生情况 |
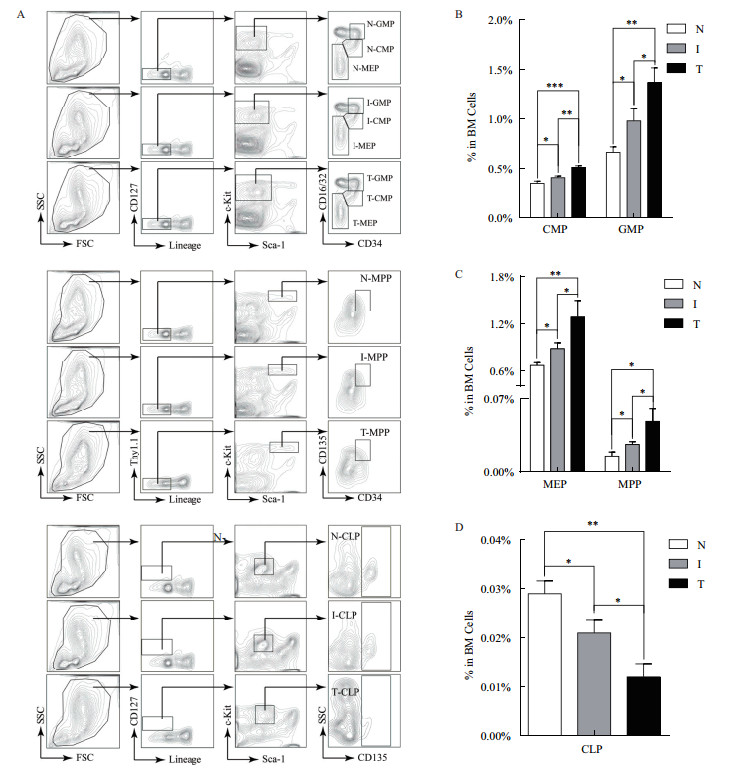
为检测小鼠炎症和肿瘤进程中HPCs丰度的变化,对对照组、炎症组和肿瘤组小鼠骨髓细胞进行了流式细胞分析(图 2-A)。结果显示炎症和肿瘤状态下,小鼠骨髓中HPCs丰度呈特征性变化。主要表现为无论是肿瘤组与炎症组,还是肿瘤组/炎症组与对照组相比髓系祖细胞CMPs和GMPs的丰度均显著性增加,而淋巴系祖细胞CLPs的丰度表现出显著减少。如在正常生理条件下,CMPs细胞丰度为0.347%±0.024%,在炎症和肿瘤状态下其丰度分别为0.405%±0.018%和0.509%±0.017%,且肿瘤状态下CMPs丰度显著高于炎症状态(图 2-B)。GMPs在肿瘤和炎症状态下的含量分别为0.982%±0.123%和1.367%±0.150%,两者相比,肿瘤状态下GMPs含量显著高于炎症状态并且均显著高于正常生理状态下GMPs的含量(0.660%±0.057%,图 2-B)。MEPs也表现出同样的变化(N:0.665%±0.038%、I:0.875%±0.075%以及T:1.283%±0.206%,图 2-C),而对于CLPs而言,其在正常生理状态下的丰度为0.029%±0.003%,炎症和肿瘤状态下分度分别为0.021%±0.003%和0.012%±0.003%(图 2-D)。炎症和肿瘤小鼠的CLPs丰度显著低于正常小鼠。此外,处于更上游的MPPs随着炎症和肿瘤的发生表现出细胞含量的显著增加(N:0.015%±0.004%、I:0.026%±0.03%以及T:0.048%±0.012%,图 2-C)。上述结果表明小鼠炎症和肿瘤发生中HPCs发生着特征性变化(主要偏向髓系细胞生成),提示了正常生理状态与炎症及肿瘤发生中的免疫系统特征性改变存在着递进性的联系。揭示了慢性炎症诱导免疫系统免疫能力的逐渐失衡可能是肿瘤形成的原因之一。
|
| A小鼠造血祖细胞流式细胞分析;B-D小鼠造血祖细胞丰度分析统计(N、I和T分别代表对照组、炎症组和肿瘤组;*P < 0.05,**P < 0.01和***P < 0.001,下同) 图 2 小鼠造血祖细胞丰度分析 |
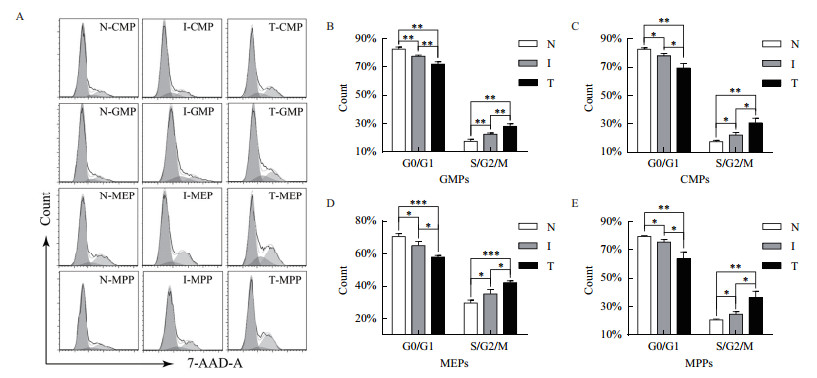
为检测不同病理状态下(炎症和肿瘤)小鼠HPCs的增殖活性,利用7-AAD标记HPCs核酸,通过核酸的含量来检测其细胞周期时相分布。结果显示,随着炎症和肿瘤的发生,HPCs进入分裂期的细胞显著增加,其分裂能力显著强于正常生理状态下的分裂能力(CMPs:17.33%±1.03(N)、22.09%±1.78%(I)和30.63%±3.30%(T);GMPs:17.41%±1.49%(N)、22.50%±0.89%(I)和28.07%±1.77%(T);MEPs:29.50%±1.81%(N)、35.10%±2.65(I)和42.10%±1.15%(T)以及MPPs:20.57%±0.59%(N)、24.55%±1.84%(I)和36.22%±4.57%(T),图 3),与炎症和肿瘤状态下小鼠HPCs丰度的结果一致。由细胞丰度和周期的结果可知,在炎症和肿瘤状态下,髓系祖细胞的分裂能力增强,其数量不断积累。这提示了在炎症和肿瘤状态下HSPCs的髓系偏向。
|
| A小鼠造血祖细胞周期流式细胞分析;B-E小鼠造血祖细胞周期统计分析 图 3 小鼠造血祖细胞周期分析 |
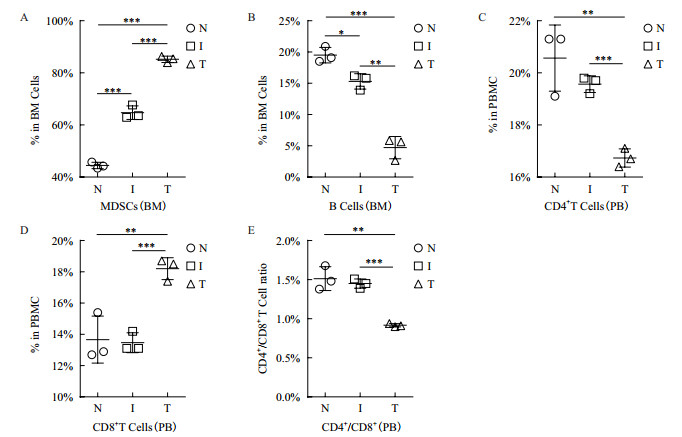
为进一步验证炎症和肿瘤状态下HSPCs偏向髓系分化,本研究继续分析了小鼠骨髓(Bone marrow,BM)中髓系和淋巴系免疫细胞的产生情况。结果显示,在炎症和肿瘤状态下,小鼠骨髓中MDSCs(CD11b+Gr-1+)比例显著高于正常生理状态(N:44.47%±1.22%、I:64.73%±2.60%以及T:85.20%±1.21%,图 4-A)。相反,小鼠骨髓中淋巴系B细胞(B220+)比例则随着炎症和肿瘤的发生而显著下降(N:19.50%±1.25%、I:15.23%±1.82%以及T:4.71%±1.78%,图 4-B)。分析结果说明,HSPCs在炎症和肿瘤进程中偏向髓系分化。
|
| A-B小鼠骨髓中B细胞和MDSCs含量的统计分析;C-D小鼠外周血中CD4+T细胞和CD8+T细胞含量的统计分析;E小鼠外周血CD4+/CD8+T细胞比值(BM、PB和PBMC分别为:骨髓、外周血和外周血单个核细胞) 图 4 小鼠骨髓和外周血中免疫细胞含量的统计分析 |
为检测炎症和肿瘤状态下免疫机体免疫系统的免疫能力,本研究分别检测了外周血(Peripheral blood,PB)中CD4+和CD8+T细胞的含量。通过CD4+/CD8+T细胞比值推测免疫系统的细胞免疫状态。CD4+/CD8+T细胞的比值作为免疫调节的一项指标,正常值约1.4-2.0之间,超出或低于此范围则表明细胞免疫功能失衡[9]。研究发现,与对照组小鼠CD4+和CD8+T细胞含量(分别为:20.57%±1.27%和13.67%±1.50%)相比,在炎症状态下的CD4+和CD8+T细胞含量(分别为:19.56%±0.32%和13.47%±0.64%)无明显变化,CD4+/CD8+T细胞比值(分别为:1.51±0.15和1.45±0.06)也无明显差异。但是在肿瘤状态下,CD4+T细胞含量(16.73%±0.35%)显著降低而CD8+T细胞含量(18.20%±0.70%)显著增加,CD4+/CD8+T细胞比值(0.917)也明显低于正常水平(图 4-C-E)。结果表明:在肿瘤状态下CD4+/CD8+T细胞比值显著下降,说明小鼠细胞免疫功能下降。
3 讨论长期以来,癌症与慢性炎症两者间的关系备受关注。许多研究指出慢性炎症与肿瘤发生密切相关,并能促进肿瘤的进程[10-12]。然而,人们对慢性炎症与癌症两者关系的潜在机制知之甚少。为此,我们以AOM/DSS诱导的小鼠炎症性结肠癌模型为研究基础,分别对炎症和肿瘤状态下造血祖细胞的丰度和周期状态进行了分析,并检测了一些终末分化的免疫细胞含量变化,旨在诠释慢性炎症和肿瘤进程中免疫系统的变化规律。
经过研究和分析发现,炎症和肿瘤进程中,免疫系统调节异常,髓系造血祖细胞异常增加,HSPCs偏向髓系分化;炎症和肿瘤能不同程度的诱发免疫抑制作用;慢性炎症可能会逐渐诱导免疫系统的失衡,导致免疫系统的免疫能力下降,从而使肿瘤细胞得以规避免疫系统的监视和抑制,并最终导致肿瘤的发生。
在小鼠的免疫系统中,HSPCs偏向髓系分化可能是机体应激的结果。有研究报道,Toll样受体(TLR),一种能识别微生物或病毒成分并引发先天免疫反应的生物分子,除了在成熟的免疫细胞中表达外,在早期的造血祖细胞也有表达,说明早期的造血祖细胞能够直接响应外界的刺激,如炎症和外伤感染等[13]。由此可以推断HSPCs的髓系偏向和髓系造血祖细胞特别是GMPs的积累,与炎症和肿瘤的发生相关。此外,免疫系统在肿瘤发生与衰老进程中的调节和变化具有诸多相似之处。在本研究组的前期研究中发现,小鼠衰老进程中HSPCs也出现偏向髓系分化的现象[14]。Peng等[15]的研究也提出,人类HSCs也随着衰老进程而偏向髓系分化,因此,HSPCs偏向髓系分化可能是机体应激、衰老进程乃至肿瘤进程中的一个共同特征。
本研究发现,在肿瘤状态下,小鼠细胞免疫功能下降,结果与其他研究相一致[16-18]。肿瘤的生成和发育与机体免疫功能状态有着紧密的联系。由外周血T淋巴细胞(CD4+和CD8+T细胞)构成的细胞免疫是抗肿瘤免疫的重要形式。在临床上,使用CD4+/CD8+T细胞比值来衡量免疫系统状态。本研究发现,在荷瘤小鼠PB中,CD4+/CD8+T细胞比值显著下降,说明肿瘤可能干扰和调控机体免疫系统,导致机体细胞免疫功能失衡。
在肿瘤多发的今天,肿瘤干扰和调控免疫系统一直是该领域的热门研究内容。肿瘤的发生与免疫系统的调节异常有关,但是肿瘤如何影响免疫系统的发育和调节仍未有清晰的认识。HSPCs的髓系偏向并伴随着肿瘤的免疫抑制可能是肿瘤发生中的共同特性。在肿瘤的治疗中,解决HSPCs髓系偏向问题可能才是肿瘤治疗的关键所在。
4 结论在炎症和肿瘤进程中,造血-免疫系统调节异常,髓系祖细胞包括MPPs、CMPs和GMPs丰度和细胞分裂能力显著性增加,而淋巴系祖细胞CLPs分度和细胞分裂能力均显著下降,揭示了HSPCs发生髓系偏向。肿瘤状态下,小鼠外周血CD4+/CD8+T细胞比值下降,说明肿瘤可能干扰和调控机体免疫系统,导致机体细胞免疫功能紊乱。此外,炎症和肿瘤状态下的免疫系统两者间存在着密切的关系,慢性炎症可能通过诱导造血-免疫系统的失衡,使得肿瘤细胞得以规避免疫系统的监视和抑制作用并最终导致肿瘤的形成。
| [1] |
Doulatov S, Notta F, Laurenti E, et al. Hematopoiesis:a human perspective[J]. Cell Stem Cell, 2012, 10(2): 120-136. DOI:10.1016/j.stem.2012.01.006 |
| [2] |
Wu WC, Sun HW, Chen HT, et al. Circulating hematopoietic stem and progenitor cells are myeloid-biased in cancer patients[J]. Proc Natl Acad Sci USA, 2014, 111(11): 4221-4226. DOI:10.1073/pnas.1320753111 |
| [3] |
Kusmartsev S, Gabrilovich DI. Immature myeloid cells and cancer-associated immune suppression[J]. Cancer Immunol Immunother, 2002, 51(6): 293-298. DOI:10.1007/s00262-002-0280-8 |
| [4] |
Pu S, Qin B, He H, et al. Identification of early myeloid progenitors as immunosuppressive cells[J]. Scientific Reports, 2016, 6(1): 23115. DOI:10.1038/srep23115 |
| [5] |
Gabrilovich DI. Myeloid-derived suppressor cells[J]. Cancer Immunol Res, 2017, 5(1): 3-8. DOI:10.1158/2326-6066.CIR-16-0297 |
| [6] |
Bronte V, Serafini P, De Santo C, et al. IL-4-induced arginase 1 suppresses alloreactive T cells in tumor-bearing mice[J]. J Immunol, 2003, 170(1): 270-278. DOI:10.4049/jimmunol.170.1.270 |
| [7] |
Parker KH, Beury DW, Ostrand-Rosenberg S. Myeloid-Derived suppressor cells:critical cells driving immune suppression in the tumor microenvironment[J]. Adv Cancer Res, 2015, 128: 95-134. DOI:10.1016/bs.acr.2015.04.002 |
| [8] |
Gabrilovich DI, Ostrand-Rosenberg S, Bronte V. Coordinated regulation of myeloid cells by tumours[J]. Nat Rev Immunol, 2012, 12(4): 253-268. DOI:10.1038/nri3175 |
| [9] |
沈关心, 周汝麟. 现代免疫学实验技术[M]. 第2版. 武汉: 湖北科技出版社, 2002.
|
| [10] |
Bunt SK, Pratima S, Clements VK, et al. Inflammation induces myeloid-derived suppressor cells that facilitate tumor progression[J]. Journal of Immunology, 2006, 176(1): 284-290. DOI:10.4049/jimmunol.176.1.284 |
| [11] |
Arwert EN, Lal R, Quist S, et al. Tumor formation initiated by nondividing epidermal cells via an inflammatory infiltrate[J]. Proc Natl Acad Sci USA, 2010, 107(46): 19903-19908. DOI:10.1073/pnas.1007404107 |
| [12] |
Chow MT, Moller A, Smyth MJ. Inflammation and immune surveillance in cancer[J]. Semin Cancer Biol, 2012, 22(1): 23-32. DOI:10.1016/j.semcancer.2011.12.004 |
| [13] |
Nagai Y, Garrett KP, Ohta S, et al. Toll-like receptors on hematop-oietic progenitor cells stimulate innate immune system replenish-ment[J]. Immunity, 2006, 24(6): 801-812. DOI:10.1016/j.immuni.2006.04.008 |
| [14] |
张立杰, 李晓玉, 岑由飞, 等. 衰老进程中小鼠造血干/祖细胞特征性改变对老年免疫失衡的影响[J]. 生物技术通报, 2018, 34(8): 199-203. |
| [15] |
Pang WW, Price EA, Sahoo D, et al. Human bone marrow hematop-oietic stem cells are increased in frequency and myeloid-biased with age[J]. Proc Natl Acad Sci USA, 2011, 108(50): 20012-20017. DOI:10.1073/pnas.1116110108 |
| [16] |
Das S, Karim S, Datta Ray C, et al. Peripheral blood lymphocyte subpopulations in patients with cervical cancer[J]. Int J Gynaecol Obstet, 2007, 98(2): 143-146. DOI:10.1016/j.ijgo.2007.04.011 |
| [17] |
Liu G, Ren H, Sun XJ, et al. Distribution of natural killer cells and T-lymphocyte subsets in peripheral blood, gallbladder cancer and surrounding tissue[J]. Hepatobiliary Pancreat Dis Int, 2007, 6(1): 81-86. |
| [18] |
Wang L, Shen Y. Imbalance of circulating T-lymphocyte subpopu-lation in gastric cancer patients correlated with performance status[J]. Clin Lab, 2013, 59(3-4): 429-433. |




