2. 浙江孚诺医药股份有限公司,东阳 322100;3;
3. 上海中医药大学中药研究所,上海 201203
2. Zhejiang Fonow Medicine Co. Ltd., Dongyang 322100;
3. Institute of Chinese Materia Medica, Shanghai University of Traditional Chinese Medicine, Shanghai 201203
从植物和细菌中分离出来的多种核糖体失活蛋白(Ribosome-inactivating protein,RIP)不可逆的抑制真核生物细胞蛋白合成,作为一种潜在的抗肿瘤蛋白药物已被广泛研究和应用[1-3]。2011年发现的来源于类鼻疽伯克霍尔德菌的致死因子(Burkholderia lethal factor 1,BLF1),是一种新型细菌来源的RIP,其表现出一定的抗肿瘤活性[3]。该细菌因子通过对真核生物转录翻译因子4A(eukaryotic initiation translation factor 4A,eIF4A)第339位谷氨酰胺的脱酰胺作用,使eIF4A丧失mRNA解螺旋酶活性,将蛋白质合成抑制在翻译起始阶段[4-6]。
现有研究结果表明,与其他一些植物来源的Ⅰ型RIP类似[7],BLF1本身自主进入肿瘤细胞的效率较低,通常难以有效发挥其抗肿瘤活性。细胞穿膜肽(Cell penetrating peptide,CPP)是一类被广泛关注的体内药物运输载体,其可以跨越细胞膜将寡核苷酸、多肽和蛋白等高效运输进入细胞内部[8-11],本课题组前期研究发现的来源于人肝素结合表皮生长因子(HB-EGF)的一种高效穿膜肽(命名为HBP),可以将植物来源的多种Ⅰ型RIP如苦瓜MAP30、α-MMC和栝楼TCS等有效导入到肿瘤细胞内发挥其药理活性[12-13]。本研究尝试将HBP与细菌来源的BLF1进行融合表达,以通过提高BLF1进入肿瘤细胞的效率来加强其抗肿瘤药理作用效果。
齐墩烷型皂苷化合物是植物中一类重要的药理活性成分。这类植物皂苷通常由一个或多个糖链连接到五环三萜皂甙元组成。研究表明,皂苷化合物可以显著增强植物来源的皂草素、植物血凝素等Ⅰ型RIP对肿瘤细胞的毒性[14-15]。商陆皂苷甲(EsA)是从药用植物商路根部分离得到的一种五环三萜类皂苷,已知的生物学活性包括调节免疫应答,诱导细胞增殖和凋亡以及抗炎症等[16]。测试浓度下ESA没有表现出溶血作用,因此将其用于研究在ESA存在下BLF1,BLF-HBP重组蛋白进入细胞效率,抗肿瘤活性以及诱导细胞凋亡能力的变化。
本研究将穿膜肽HBP与BLF1融合,以及与皂苷ESA联用,通过联合使用这两种策略建立了一种提高蛋白药物药效的方式,并成功提高蛋白药物BLF1的抗肿瘤活性,旨为BLF1进一步在抗肿瘤领域的应用奠定基础。
1 材料与方法 1.1 材料构建在表达质粒pET16b上的BLF1基因及表达载体构建的引物由苏州泓迅生物科技有限公司合成。大肠杆菌BL21(DE3)和DH5α购自北京康为世纪生物科技有限公司,表达质粒pET16b和EGFP-HBP-pET28a为本实验室保藏。人宫颈癌细胞(HeLa)、人非小细胞肺癌细胞(A549)、人乳腺癌细胞(MCF-7)、人肝癌细胞(HepG2)均为本实验室保存。异丙基硫代半乳糖苷(IPTG)、噻唑蓝(MTT)等均购自碧云天公司。商陆皂苷甲(EsA)购自新铂化学技术有限公司。重组蛋白序列测定由华大基因完成。
1.2 方法 1.2.1 重组质粒的构建BLF1-pET28a表达载体构建:以BLF1-pET16b为模板扩增BLF1片段,用含Nde Ⅰ的正向引物5' -GGGTTTGCCATATGCCGAATAGTCTGGAAG-3' 与含Xho Ⅰ的反向引物5' -CCGCTCGAGTTACTGTTTGCGTTGTTGC-3' 通过PCR扩增后,再以Nde Ⅰ和Xho Ⅰ双酶切回收的PCR产物,与同样双酶切处理的载体EGFP-HBP-pET28a连接。
BLF1-HBP-pET28a表达载体构建:以BLF1-pET16b为模板扩增BLF1片段,用含Nde Ⅰ的正向引物5' -GGGTTTGCCATATGCCGAATAGTCTGGAAG-3' 与含BamH Ⅰ的反向引物5' -CGACGTCGACTTATTTGTATTTACGCAGG-3' 通过PCR扩增后,再以Nde Ⅰ和BamH Ⅰ双酶切回收的PCR产物,与同样双酶切处理的载体EGFP-HBP-pET28a连接。以大肠杆菌DH5α为宿主菌转化重组质粒,以菌液为模板,用上述引物PCR扩增,待菌落PCR验证正确后送公司测序,进行序列比对确认重组质粒序列正确性。
1.2.2 重组蛋白的表达与纯化将重组质粒转化大肠杆菌BL21(DE3)菌株,将得到的阳性克隆接种到含30 mL LB培养基的锥形瓶中(含50 μg/mL卡那霉素),37℃培养12 h,然后将2%的菌液接种于含200 mL的LB培养基的锥形瓶中于37℃培养,待菌液浓度OD600达到0.4-0.6时,加入1 mmol/L IPTG,在16℃下诱导表达16 h。3 500 r/min离心15 min收集菌体,重悬于缓冲液(20 mmol/L Tris-HCl,10%甘油,0.5 mol/L NaCl,pH 8.5)中,然后超声破碎,12 000 r/min离心后取上清液在NI-NTA亲和层析柱中进行亲和层析分离。经梯度洗涤后,用含有200 mmol/L咪唑的缓冲液洗脱收集目标蛋白。经过透析液(20 mmol/L Tris-HCl,10%甘油,0.5 mol/L NaCl,pH 7.2)透析去除咪唑,以SDS-PAGE检测目的蛋白。纯化的重组蛋白在过滤除菌后-80℃保存。
1.2.3 体外细胞的培养RPMI-1640(10%胎牛血清和1%青霉素-链霉素)用于培养A549和HeLa细胞株,DMEM培养基(10%胎牛血清和1%青霉素-链霉素)用于MCF-7和HepG2细胞株,培养箱温度为37℃,并且含有5% CO2。
1.2.4 药物蛋白的体外细胞生长抑制试验细胞按每孔1×104个接种于96孔板中培养24 h。检测EsA对HepG2、MCF-7、A549和HeLa细胞生长抑制作用时,将不同浓度的EsA(0、5、25、50、75、100 μmol/L)分别与上述4种细胞孵育48 h;检测BLF1或BLF1-HBP重组蛋白对HepG2、MCF-7、A549和HeLa细胞的生长抑制能力时,将不同浓度梯度(0、0.123、0.37、1.11、3.33、10 μmol/L)的BLF1或BLF1-HBP重组蛋白(存在50 μmol/L EsA时,BLF1或BLF1-HBP重组蛋白浓度为0、0.32、1.6、8、40、200 nmol/L)分别与上述4种细胞孵育48 h。然后弃去原有培养基,用终浓度0.5 mg/mL的MTT溶液在37℃下孵育3 h。弃去MTT溶液后每孔加入150 μL二甲基亚砜(DMSO),通过酶标仪(吸收波长490 nm)测定每孔的吸光度以确定细胞存活率。药物对肿瘤细胞的半抑制浓度(IC50)通过GraphPad Prime 6软件计算得到。
1.2.5 激光共聚焦实验将细胞按每孔1×105个接种在24孔板中并培养24 h。然后在存在或无50 μmol/L EsA的情况下,用FITC标记的50 μmol/L的BLF1或BLF1-HBP与细胞孵育6 h。随后,用PBS冲洗细胞3次,加入4%多聚甲醛(PFA)。固定30 min后,用PBS洗涤细胞2次,并用DAPI染色45 min。此后,通过激光扫描共聚焦显微镜(LSCM)检测BLF1重组蛋白在细胞中荧光强度。
1.2.6 凋亡分析将HeLa细胞按每孔1×106个接种在6孔板中培养24 h。分别加入50 μmol/L的EsA,0.5 nmol/L BLF1,0.5 nmol/L BLF1-HBP;存在EsA时,EsA浓度为50 μmol/L,BLF1或BLF1-HBP浓度为0.1、0.5、2.5、5 nmol/L。处理48 h后,收获细胞并用PBS洗涤2次。然后将细胞重新悬浮于100 μL结合缓冲液中。此后,加入5 μL Annexin V-FITC和5 μL碘化丙啶(PI),将细胞在20℃下在黑暗中孵育20 min,然后加入400 μL结合缓冲液。通过FACScan流式细胞仪对经处理的样品进行分析。
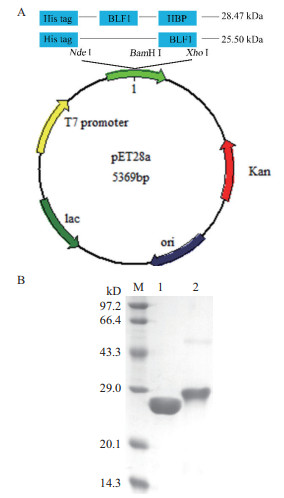
2 结果 2.1 BLF1重组蛋白的表达和纯化为了增加BLF1进入肿瘤细胞效率以有效发挥其药理活性,首先构建了BLF1以及融合了穿膜肽的BLF1-HBP重组表达载体(图 1-A)并进行表达与纯化,两种目的蛋白在16℃下均为可溶性表达,然后通过NI-NTA亲和层析纯化目的蛋白。纯化得到的BLF1(25.5 kD)和BLF1-HBP(28.47 kD)用12%的SDS-PAGE检测,凝胶扫描软件分析显示两种蛋白的纯度都在90%以上,可用于后续药理活性研究。
|
| M:蛋白分子质量标准;1:纯化后的BLF1蛋白;2:纯化后的BLF1-HBP蛋白 图 1 BLF1和BLF1-HBP重组蛋白的表达载体构建(A)和重组蛋白的SDS-PAGE分析(B) |
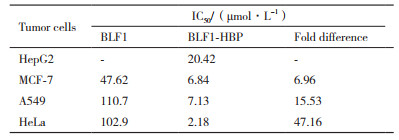
用细胞生长抑制实验(MTT法)分别检测BLF1和BLF1-HBP重组蛋白对4种肿瘤细胞(HepG2、MCF-7、A549和HeLa)的生长抑制能力。结果(图 2)表明重组蛋白对不同种类肿瘤细胞都具有抑制效应,且抑制作用具有剂量依赖性,而且HBP穿膜肽的引入可显著增强BLF1对不同肿瘤细胞的毒性。融合穿膜肽HBP的BLF1对MCF-7、A549、HeLa的药效比没有融合穿膜肽的BLF1分别提高6.96倍、15.53倍、47.16倍(表 1),单独的BLF1对HepG2细胞几乎没有显示出抑制效果,而HBP-BLF1对HepG2细胞的抑制活性明显提高,其IC50值约20.4 μmol/L。

|
| 图 2 BLF1和BLF1-HBP重组蛋白对不同肿瘤细胞的抑制效果 |
穿膜肽HBP引入后BLF1对不同肿瘤细胞的抑制效果均有明显提升。由于皂苷类化合物可显著增强植物来源的RIP对肿瘤细胞的毒性,因此我们首先对一些来源于传统中药的皂苷化合物进行了筛选,从中选择了溶血作用最低的EsA,然后以MTT法检测5-100 μmol/L的EsA对4种肿瘤细胞(HepG2,MCF-7,A549,HeLa)的生长抑制能力。结果(图 3-A)显示,5-75 μmol/L的EsA对上述4种肿瘤细胞没有表现出生长抑制能力,当EsA浓度达到100 μmol/L时才对上述4种肿瘤细胞表现出明显的毒性。我们选择50 μmol/L的EsA与BLF1和BLF1-HBP重组蛋白联用。

|
| 图 3 仅EsA或BLF1和BLF1-HBP重组蛋白与EsA联用时对不同类型肿瘤细胞的抑制效果(A,B)及EsA存在下重组蛋白对不同种类肿瘤细胞的半抑制浓度(IC50)的影响(C) |
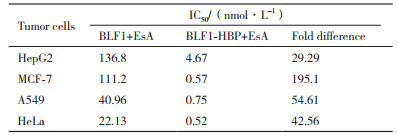
随后我们在50 μmol/L的EsA存在下,BLF1以及BLF1-HBP重组蛋白对4种肿瘤细胞(HepG2,MCF-7,A549,HeLa)的MTT实验结果如图 3-B及表 2所示。以直方图(图 3-C)直接表示EsA的存在与否对重组蛋白IC50数值的影响。结果显示,EsA的存在,显著提高了BLF1以及BLF1-HBP重组蛋白对4种肿瘤细胞抑制作用。例如,在EsA存在下,BLF1对HeLa细胞IC50值为22.13 nmol/L,未加EsA时的IC50值则为102 900 nmol/L,因此EsA的存在可使BLF1对肿瘤细胞抑制活性提高约4 650倍;类似的情况也出现在融合了HBP的BLF1-HBP重组蛋白上,其在EsA存在下抗肿瘤活性也大大提高,如对MCF-7细胞药效从EsA不存在时的IC50值6 840 nmol/L下降到0.52 nmol/L,使得BLF1-HBP对MCF-7细胞的生长抑制活性增强12 000倍之多。
同时,同样在EsA存在下,引入穿膜肽的BLF1-HBP对MCF-7的抑制作用比未引入穿膜肽的BLF1重组蛋白更是进一步提高了约195.3倍。这些实验结果表明,穿膜肽HBP的引入,可显著提高BLF1重组蛋白对肿瘤细胞生长的抑制活性;与EsA的联用,更能使BLF1重组蛋白的抗肿瘤活性得到进一步的发挥,促进RIP在细胞内高效发挥抑制蛋白质合成、诱导细胞凋亡的作用。
2.4 BLF1和BLF1-HBP重组蛋白进入细胞效率分析为了观察这种提升是否是由于EsA促进重组蛋白进入细胞效率的提高而导致药效增强,我们以激光共聚焦显微镜来观察EsA对两种重组蛋白进入细胞效率的影响。将FITC标记的BLF1及BLF1-HBP重组蛋白(50 μmol/L)在有无EsA(50 μmol/L)存在下与HeLa细胞分别孵育6 h,以激光共聚焦显微镜观察实验结果。研究显示,没有融合穿膜肽的BLF1与HeLa细胞共孵育后,未能在胞内观察到明显的荧光信号,而融合穿膜肽的BLF1-HBP与HeLa细胞共孵育后可在胞内观察到强烈的荧光信号(图 4-A),表明HBP可大大促进BLF1-HBP重组蛋白的跨膜转运。同时也观察到在EsA存在下,BLF1和BLF1-HBP两种重组蛋白在HeLa细胞中的荧光强度均有提高,与无EsA时共孵育后BLF1在HeLa细胞中几乎没有荧光的情况相比,在EsA存在下共孵育后可观察到明显的荧光。在EsA存在下,BLF1-HBP在细胞中的荧光强度可比无EsA时增强1.4倍(图 4-B),这个结果表明,EsA可有效提升BLF1及BLF1-HBP重组蛋白进入细胞的效率,特别是在无穿膜肽帮助跨膜转运的情况下,这种提升效果尤其明显,当然,有穿膜肽的情况下的穿膜效率更高。

|
| 图 4 激光共聚焦检测FITC标记的重组蛋白进入细胞效率(A)及重组蛋白在细胞中的荧光强度(B) |
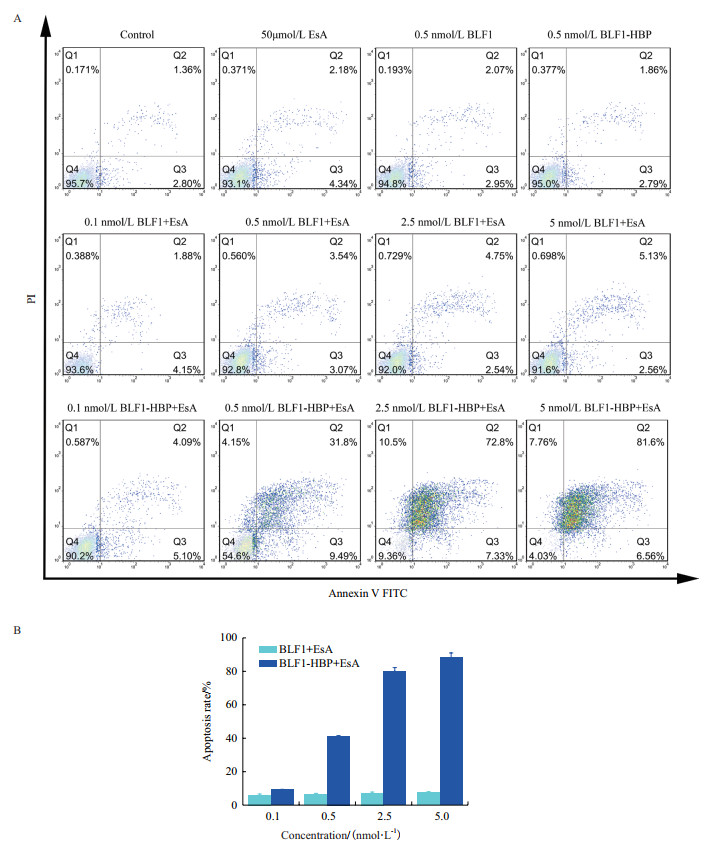
前期实验结果展示了与EsA的合用可大幅度提升BLF1或BLF1-HBP融合蛋白对肿瘤细胞的生长抑制能力。为了阐明这种作用效果的抗肿瘤效应,我们通过Annexin V-FITC/FACS法经流式细胞仪对重组蛋白抗肿瘤活性进行分析。结果显示,与HeLa细胞孵育48 h后,仅用EsA(50 μmol/L)或者BLF1(0.5 nmol/L)处理的HeLa细胞基本无凋亡现象(图 5-A);而且即使在EsA存在下,没有融合穿膜肽的BLF1(0.5 nmol/L)诱导HeLa细胞凋亡的活性也很低(仅6.6%,图 5-B)。但融合有穿膜肽的BLF1-HBP(0.5 nmol/L)对HeLa细胞凋亡率则显著提升(达41.29%,是前者的6.26倍)。当BLF1-HBP浓度为0.1-5 nmol/L时,其诱导的细胞凋亡率可为9.19%-88.16%(图 5-B)。因此EsA存在下,穿膜肽HBP显著增强BLF1蛋白诱导细胞凋亡的能力。
|
| 图 5 BLF1重组蛋白在HeLa细胞中诱导的凋亡检测(A)及HeLa细胞的凋亡率直方图(B) |
类似于大多数植物来源的Ⅰ型RIP[7],微生物来源的BLF1自身也难以自主进入细胞有效发挥其药理活性。为提升BLF1的抗肿瘤效果,改善提高其进入细胞的效率不失为一种简便有效的策略。本研究将BLF1与课题组前期研究发现的一种高效人源性穿膜肽HBP融合[17],在大肠杆菌BL21(DE3)中进行表达并通过NI-NTA亲和层析纯化获得目的蛋白。MTT实验的结果显示引入HBP穿膜肽后,BLF1-HBP重组蛋白比引入前对HeLa细胞的活性提升了47.16倍,与课题组前期研究报道的HBP融合RIP后可以有效提升RIP对肿瘤细胞毒性的结果一致[12-13, 18]。而且从实验中也发现,没有融合穿膜肽的BLF1对HepG2肝癌细胞的生长几乎没有抑制效果,而融合穿膜肽的BLF1-HBP对肝癌细胞HepG2的活性显著提高,IC50值达20.42 μmol/L,穿膜肽HBP的引入拓展了作为RIP成员之一的BLF1毒蛋白对肿瘤细胞的适用范围。融合了穿膜肽HBP后可有效提高BLF1对4种肿瘤细胞的生长抑制作用,但HBP对BLF1药效增强程度对4种细胞不完全相同。课题组前期对HBP的研究表明HBP通过结合细胞表面硫酸乙酰肝素蛋白聚糖(HSPG)进入细胞[12],因此我们推测可能是由于不同细胞表面HSPG表达种类和数量的差异导致BLF1-HBP对不同肿瘤细胞生长抑制效果各异,其机制有待于进一步研究。
从植物中提取的皂苷可以增强植物来源的Ⅰ型RIP的对其他真核细胞的毒性[14-15, 19]。目前为止,尚未有报道研究皂苷是否可以增强来源于细菌的RIP对肿瘤细胞活性。为进一步提高微生物来源的BLF1重组蛋白抑制肿瘤细胞生长增殖的能力,我们在前期筛选的基础上尝试了将药用植物商陆来源的EsA与BLF1重组蛋白联用来考察是否可提升抗肿瘤效果。考虑到大多数皂苷具有溶血活性[20],选择了低溶血性EsA来进行试验。EsA在50 μmol/L浓度下不表现出溶血活性,也对细胞无生长抑制作用。实验结果显示,低浓度的EsA可显著提高BLF1或融合了穿膜肽的BLF1对所测试的4种肿瘤细胞的毒性。上述实验显示了穿膜肽HBP的引入和皂苷EsA联用对提升BLF1重组蛋白在肿瘤细胞中活性均发挥了重要作用。
皂苷作为一种两性化合物其可通过与膜脂的相互作用改变膜的通透性[21-22],使得细胞膜渗透率发生变化[23-24],由此推测EsA可能改变了细胞膜的通透性从而提高了重组蛋白进入细胞效率使其有效发挥生物学活性,因此用FITC标记BLF1和BLF1-HBP重组蛋白,通过激光共聚焦显微镜观察EsA的存在是否促进了重组蛋白进入细胞数量,结果显示EsA存在下BLF1和BLF1-HBP在HeLa细胞中的荧光强度均有显著提高,表明EsA确实有利于促进重组蛋白进入细胞的效率。
此外,观察到EsA存在下BLF1和BLF1-HBP对4种肿瘤细胞IC50值降低均非常显著,如EsA存在下BLF1-HBP对HeLa的IC50值从无EsA时的2 180 nmol/L下降到0.52 nmol/L,药效提高达4 192倍。但两种重组蛋白在EsA存在下细胞中荧光强度增强倍数十分有限,如EsA存在下BLF1-HBP在HeLa细胞中的荧光强度比无EsA时仅增强1.4倍,表明EsA促进重组蛋白对肿瘤细胞提高药效并非仅仅由于促进药物蛋白进入细胞的数量所致。文献报道大多数药物蛋白一般通过受体介导的内吞作用形成的内吞体囊泡进入细胞,随后被递送到溶酶体中,大部分在溶酶体酶作用下被降解,只有少量被释放到细胞质到达其作用部位,因此严重限制蛋白药物发挥药理活性及其在临床上的应用[25]。由于皂苷可以与细胞膜上脂质相互作用,从而在细胞膜上形成孔样结构,因此我们推测EsA不仅改变了细胞外周膜的通透性,提高重组蛋白进入细胞效率,同时可能也作用于胞内内吞体和溶酶体的单层膜,破坏其完整性,使进入内吞体/溶酶体的药物蛋白有效释放进入细胞质发挥药理活性。BLF1必须与细胞质中的核糖体蛋白结合后才能发挥抑制细胞蛋白质合成、诱导细胞凋亡的作用。因此,本研究中穿膜肽的应用和皂苷的联用都有效提高了蛋白药物在细胞质中浓度,从而显著提高了药物蛋白对肿瘤细胞生长增殖的抑制效应。
4 结论通过将穿膜肽HBP与BLF1融合表达,增强了BLF1对多种肿瘤细胞尤其是抑制肝癌细胞HepG2细胞生长的活性。植物皂苷EsA联用更使得BLF1重组蛋白对肿瘤细胞的增殖的抑制作用得到进一步显著提高。流式凋亡实验分析表明EsA通过强化BLF1-HBP诱导HeLa细胞的凋亡途径而显著提高其对肿瘤细胞的毒性。
| [1] |
Walsh MJ, Dodd JE, Haubergue GM, et al. Ribosome-inactivating proteins:potent poisons and molecular tools[J]. Virulence, 2013, 4: 774-784. DOI:10.4161/viru.26399 |
| [2] |
Puri M, Kaur I, Kanwar RK, et al. Ribosome inactivating proteins (RIPs) from Momordica charantia for anti viral therapy[J]. Current Molecular Medicine, 2009, 9: 1080-1094. DOI:10.2174/156652409789839071 |
| [3] |
Rust A, Shah S, Hautbergue GM, et al. Burkholderia lethal factor 1, a novel anti-cancer toxin, demonstrates selective cytotoxicity in MYCN-amplified neuroblastoma cells[J]. Toxins (Basel), 2018, 10(7): pii E261. DOI:10.3390/toxins10070261 |
| [4] |
Cruz-Migoni A, Hautbergue GM, Artymiuk PJ, et al. A Burkholderia pseudomallei toxin inhibits helicase activity of translation factor eIF4A[J]. Science, 2011, 334: 821-824. DOI:10.1126/science.1211915 |
| [5] |
Hautbergue GM, Wilson SA. BLF1, the first Burkholderia pseudomallei toxin, connects inhibition of host protein synthesis with melioidosis[J]. Biochemical Society Transactions, 2012, 40: 842-845. DOI:10.1042/BST20120057 |
| [6] |
任春艳, 方瑶, 等. 类鼻疽杆菌毒素分子BLF1的重组表达及生物学活性[J]. 第三军医大学学报, 2016, 38: 1215-1219. |
| [7] |
Huang Y, Yang VC, Li F, et al. Improved protein toxin delivery based on ATTEMPTS systems[J]. Current Drug Targets, 2017, 18: 380-392. |
| [8] |
Koren E, Torchilin VP. Cell-penetrating peptides:breaking through to the other side[J]. Trends Mol Med, 2012, 18: 385-393. DOI:10.1016/j.molmed.2012.04.012 |
| [9] |
Raucher D, Ryu JS. Cell-penetrating peptides:strategies for anticancer treatment[J]. Trends Mol Med, 2015, 21: 560-570. DOI:10.1016/j.molmed.2015.06.005 |
| [10] |
Zhang D, Wang J and Xu D. Cell-penetrating peptides as noninvasive transmembrane vectors for the development of novel multifunctional drug-delivery systems[J]. J Control Release, 2016, 229: 130-139. DOI:10.1016/j.jconrel.2016.03.020 |
| [11] |
宫春爱, 胡楚玲, 顾芬芬, 等. 细胞穿膜肽在抗肿瘤靶向治疗中的研究进展[J]. 第二军医大学学报, 2017, 38: 774-779. |
| [12] |
Luo Z, Cao XW, Li C, et al. The heparin-binding domain of HB-EGF as an efficient cell-penetrating peptide for drug delivery[J]. J Pept Sci, 2016, 22: 689-699. DOI:10.1002/psc.2932 |
| [13] |
Tan MJ, Cao XW, et al. Effectively enhancing cytotoxic and apopto-tic effects of alpha-momorcharin by integrating a heparin-binding peptide[J]. Biotechnol Appl Biochem, 2017, 64: 918-926. DOI:10.1002/bab.1553 |
| [14] |
Weng A, Thakur M, Beceren-Braun F, et al. The toxin component of targeted anti-tumor toxins determines their efficacy increase by saponins[J]. Mol Oncol, 2012, 6: 323-332. DOI:10.1016/j.molonc.2012.01.004 |
| [15] |
Hebestreit P, Weng A, et al. Enhancement of cytotoxicity of lectins by Saponinum album[J]. Toxicon Official Journal of the Interna-tional Society on Toxinology, 2006, 47: 330-335. DOI:10.1016/j.toxicon.2005.11.011 |
| [16] |
Hu ZL, Qiu L, Xiao ZY, et al. Effects of esculentoside A on autoimmune syndrome induced by Campylobacter jejuni in mice and its modulation on T-lymphocyte proliferation and apoptosis[J]. Int Immunopharmacol, 2010, 10: 65-71. DOI:10.1016/j.intimp.2009.09.022 |
| [17] |
Lv Q, Yang XZ, Fu LY, et al. Recombinant expression and purification of a MAP30-cell penetrating peptide fusion protein with higher anti-tumor bioactivity[J]. Protein Expr Purif, 2015, 111: 9-17. DOI:10.1016/j.pep.2015.03.008 |
| [18] |
翟逸舟, 卢美雅, 赵健, 等. 白树毒素融合蛋白的筛选及其抗肿瘤作用和凋亡途径研究[J]. 生物技术通报, 2018, 34(6): 204-212. |
| [19] |
Böttger S, Westhof E, Siems K, et al. Structure-activity relationships of saponins enhancing the cytotoxicity of ribosome-inactivating proteins type Ⅰ (RIP-Ⅰ)[J]. Toxicon, 2013, 73: 144-150. DOI:10.1016/j.toxicon.2013.07.011 |
| [20] |
Lorent JH, Joëlle QL, Marie-Paule ML. The amphiphilic nature of saponins and their effects on artificial and biological membranes and potential consequences for red blood and cancer cells[J]. Cheminform, 2015, 45: 8803-8822. |
| [21] |
Plock A, Sokolowska-Köhler W, Presber W. Application of flow cytometry and microscopical methods to characterize the effect of herbal drugs on Leishmania spp[J]. Experimental Parasitology, 2001, 97: 141-153. DOI:10.1006/expr.2001.4598 |
| [22] |
Menin L, Panchichkina M, Keriel C, et al. Macrocompartmentation of total creatine in cardiomyocytes revisited[J]. Molecular & Cellular Biochemistry, 2001, 220: 149-159. |
| [23] |
Bachran C, Sutherland MI, Hebestreit P, et al. The saponin-mediated enhanced uptake of targeted saporin-based drugs is strongly dependent on the saponin structure[J]. Experimental Biology & Medicine, 2006, 231: 412-420. |
| [24] |
Melzig MF, Bader G, Loose R. Investigations of the mechanism of membrane activity of selected triterpenoid saponins[J]. Planta Med, 2001, 67: 43-48. DOI:10.1055/s-2001-10632 |
| [25] |
Shete HK, Prabhu RH, Patravale VB. Endosomal escape:a bottleneck in intracellular delivery[J]. Journal of Nanoscience & Nanotechnology, 2014, 14: 460-474. |