围产期是奶牛最重要的时期,同时也是奶牛能量代谢病的高发时期[1]。围产期奶牛动员脂肪组织,导致神经内分泌因子增加和免疫状态发生改变。神经内分泌因子增加促进非酯化脂酸(Non-esterified fatty acids,NEFA)和甘油进入血液及肝脏,从而引起由脂肪代谢产生一系列变化,导致能量代谢障碍性疾病[2]。而免疫力降低,奶牛抵御外来入侵能力减弱,影响围产期奶牛健康状况,易发各种产科疾病发生,造成巨大的经济损失。
黄芪味甘性温,归脾、肺经,属补气药物,具有保护心肌细胞、强心肌、降低血脂、提高免疫功能等药理作用[3-4]。黄芪含有多糖类、皂苷类、黄酮类和氨基酸类等多种活性成分。其中黄芪多糖具有免疫调节、抗肿瘤、抗动脉粥样硬化、降血糖及抗衰老等功效[5-6]。据报道,黄芪多糖粉可提高奶牛机体的免疫功能[7],被作为免疫增强剂应用于奶牛养殖[8]。有研究发现发酵黄芪粉可以显著提高奶牛乳蛋白率,提高奶牛血清总抗氧化能力[9-10]。黄芪茎叶生物发酵物可以提高奶牛产奶量和降低乳房炎发病率[11]。刘超等[12]发现黄芪具有调节小鼠高脂血症脂代谢和增强抗脂质过氧化的作用。山楂为蔷薇科植物的干燥成熟果实。现代药理学研究已证实山楂中降血脂的主要活性成分为山楂黄酮和三萜类物质[13],也有研究发现山楂活性成分果胶五糖有降血脂作用[14]。朱光等[15]研究发现山楂善消肉食油腻之积,对降脂具有很好疗效。目前应用山楂对大小鼠研究较为深入,用于反刍动物研究较少。吴志嵩等[16]以山楂山药汤对高脂血症小鼠血脂水平的影响进行研究,发现山楂可降低脂类及胆固醇的浓度。林秋实等[17]发现山楂及山楂黄酮能显著降低大鼠血清总胆固醇,降低低密度脂蛋白-胆固醇,显著升高高密度脂蛋白-胆固醇。在免疫方面,高东雁等[18]以山楂煎剂对大鼠细胞免疫功能有促进作用,减少炎性细胞浸润和肾组织的炎症反应[19]。
为此,本研究通过对产前奶牛日粮中添加山楂和黄芪混合物,探究对奶牛血浆代谢物的变化情况,探讨山楂、黄芪对围产期奶牛的影响因素,为了解山楂、黄芪维持围产期奶牛健康状况提供参考。
1 材料与方法 1.1 材料 1.1.1 试验仪器设备1290 UHPLC超高效液相(美国Agilent公司)、Triple TOF 6 600高分辨质谱(AB Sciex)、QTOF 6550高分辨质谱(美国Agilent公司)、Heraeus Fresco17离心机(Thermo Fisher Scientific)、BSA124S-CW天平(Sartorius)、JXFSTPRP-24研磨仪(上海净信科技有限公司)、明澈D24 UV纯水仪(Merck Millipore)、PS-60AL超声仪(深圳市雷德邦电子有限公司)、ACQUITY UPLC BEH Amide 1.7 μm 2.1×100 mm色谱柱(Waters)。
1.1.2 试验材料与试剂67-56-1甲醇Methanol(CNW Technologies)、75-05-8乙腈Acetonitrile(CNW Technologies)、631-61-8醋酸铵Ammonium acetate(CNW Technologies)、1336-21-6氨水Ammonium hydroxide(CNW Technol-ogies)、103616-89-3 L-2-氯苯丙氨酸2-Chloro-L-phenylalanine(上海恒柏生物科技有限公司)。
1.2 方法 1.2.1 试验动物和分组在宁夏某大型奶牛场,选择20头2-4胎、预产期相近、年龄和体况相近(体况评分BCS3.0-3.5)和上一个产奶周期产奶量相近的健康荷斯坦奶牛。根据预产期(妊娠天数280 d)计算围产期,于产前21±3 d进入围产圈,开始试验。随机分为2组,对照组A组(n=10):对照组饲喂基础日粮,日粮配方见表 1。试验组B组(n=10):试验组在基础日粮的基础上添加山楂和黄芪各150 g,每日投料3次(每日6:00、12:00和19:00投料),全混合日粮(Total mixed ration,TMR)饲喂,自由饮水,连续饲喂14 d(试验期间奶牛未产犊牛)。
于试验第14天晨饲前(5:00-6:00)尾静脉采集血液10 mL,肝素钠抗凝,迅速3 000 r/min离心10 min,收集上层血浆,置于-80℃冰箱冷冻保存,以备后续分析。
1.2.3 检测方法(1)代谢物提取取100 μL样本,加入400 μL含有内标的提取液(甲醇乙腈体积比=1:1,内标浓度5 μg/mL),涡旋混匀30 s;超声5 min(冰水浴);零下20℃静置1 h;将样本4℃,12 000 r/min离心15 min;小心地取出425 μL上清于EP管中;在真空浓缩器中干燥提取物;向干燥后的代谢物加入100 μL提取液(乙腈水体积比:1:1)复溶;涡旋30秒,冰水浴超声10 min;将样本4℃,12 000 r/min离心15 min;小心地取出60 μL上清于2 mL进样瓶,每个样本各取10 μL混合成QC样本,再取60 μL上机检测。
(2)上机检测安捷伦1290超高效液相控制下按照表 2中的流动相参数进行分析。所使用的色谱柱为购自Waters的UPLC BEH Amide色谱柱(1.7 μm×2.1×100 mm)。进样体积为2 μL。
AB 6600 Triple TOF & Agilent 6550 QTOF质谱仪能够在控制软件(Analyst TF 1.7,AB Sciex)控制下基于IDA功能进行一级、二级质谱数据采集。在每个数据采集循环中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV,15张二级谱图每50 ms。ESI离子源参数设置如下:雾化气压(GS1):60 Psi,辅助气压:60 Psi,气帘气压:35 Psi,温度:650℃,喷雾电压:5 000 V(正离子模式)或-4 000 V(负离子模式)。
1.2.4 数据处理和统计学分析使用ProteoWizard软件将质谱原始转成mzXmL各式。再使用XCMS做保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作,minfrac设为0.5,cutoff设为0.6。同时使用自撰写R程序包和自建二级质谱数据库对峰进行物质鉴定。
对数据的完整性进行检查,对缺失值进行删除或者补充,删除极值,并对数据进行样本间和代谢物间的归一化处理,以确保各样本之间和代谢物之间可平行比较。对XCMS提取得到的数据,进行删除组内缺失值> 50%的离子峰,不参与后续分析。
对数据进行总峰面积归一化后,使用SIMCA-P软件中对数据进行pareto-scaling处理后,进行多元统计分析:包括主成分分析(Principal component analysis,PCA),正交偏最小二乘判别分析(Orthogonal partial least squares-discriminant analysis,OPLS-DA);同时在建模过程中对模型数据进行置换检验并计算变量投影重要度(Variable importance in the projection,VIP)。在此基础上对数据进行单变量统计分析包括:Students t-test和变异倍数(Fold change,FC)分析,利用R软件根据各代谢物P值和FC值绘制火山图。
1.2.5 差异代谢物鉴定和生物学信息学分析以VIP > 1、P < 0.05和FC > 1.3或FC < 0.77作为标准筛选显著性差异代谢物,以VIP > 1和0.05 < P < 0.1作为差异趋势性代谢物,采用质荷比精确匹配(误差 < 25 ppm)和二级质谱图检索比对本地数据库的方法鉴定差异代谢物。代谢物数据使用MetaboAnalyst平台进行数据auto-scaling(以均值为中心,除以每个变量的标准差)标准化后,进行聚类和KEGG通路分析。
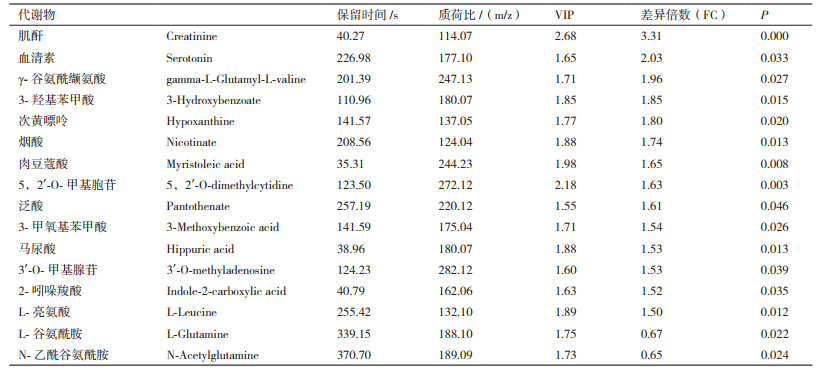
2 结果 2.1 代谢谱分析由图 1可以看到,QC样本TIC出峰保留时间和峰面积都重叠很好,说明仪器稳定性很好。从图 2和图 3可以看到QC样本密集分布,说明本次实验数据质量很高,并且在正负离子PCA-X一维分布图,可以看出所有QC样本分布于3STD之内,说明数据质量较高。

|
| 图 1 QC样本TIC图 |

|
| 图 2 正离子和负离子PCA得分图 |

|
| 图 3 正离子模式和负离子模式下QC样本PCA-X一维分布图 |
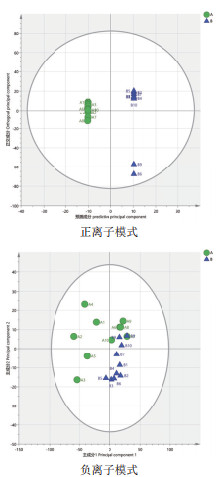
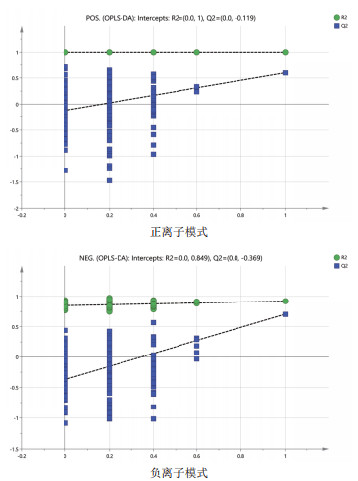
经pareto-scaling处理后,进行模式识别。分析A组和B组用以筛选饲喂山楂、黄芪后两组奶牛的差异代谢物。由图 4可知,A与B组数据在负离子模式下有一定分离趋势,正离子模式下R2X=0.554,负离子模式下R2X=0.722。为了进一判定两组是否有着差异,构建有监督模型OPLS-DA。对数据进行滤除和修正得到OPLS-DA模型,模型得分图如图 5所示。OPLS-DA模型参数正离子模式下R2Y=1和Q2=0.6,负离子模式下R2Y=0.937和Q2=0.625,R2Y和Q2均大于0.5,说明模型解释率和预测能力高,模型稳定可靠。由图 6可知,正离子模式数据置换检验Q2截距=-0.119(Q2intercept < 0),负离子模式Q2截距=-0.369(Q2intercept < 0),说明模型未过度拟合。

|
| 图 4 A组和B组在正负离子模式下的PCA得分图 |
|
| 图 5 A组和B组两组OPLS-DA得分图 |
|
| R2intercept和Q2intercept:R2和Q2回归直线与Y轴的截距,Q2intercept < 0,表明OPLS-DA模型未过度拟合 图 6 A组和B组两组置换检验图 |
对预处理后的两组数据进行单变量统计分析,根据t检验中的P值和变异倍数分析中FC值绘制火山图。由图 7可知,在正负离子模式下检测的代谢谱呈正态分布,可进行进一步的筛选和鉴定。根据t检验中的P值和OPLS-DA模型获得的VIP值。以OPLS-DA模型获得VIP > 1、P < 0.05和FC > 1.3或FC < 0.77作为显著性差异代谢物筛选条件,以VIP > 1和0.05 < P < 0.1作为差异趋势代谢物。筛选A组和B组的差异代谢物共有60种代谢物,其中正离子模式和负离子模式显著性差异代谢物分别有16和15个,差异趋势代谢物分别有19和10个。正离子模式下显著性差异代谢物2个显著低于对照组,14个显著高于对照组(P < 0.05);负离子模式下显著性差异代谢物15个显著低于对照组(P < 0.05)。显著性差异代谢物如表 3和表 4所示。

|
| 图 7 A组和B组代谢物谱火山图表 |
使用MetaboAnalyst分析平台分别A组和B组筛选出的显著性差异代谢物进行聚类分析和KEGG代谢通路分析。由图 8可知,A组和B组中数据有明显的聚集趋势,没能完全聚集在一起可能试验样本组内有个别样本存在差异;由图 9中KEGG通路分析结果可知A组和B组显著性差异代谢物参与20种不同代谢通路,其中通路影响力大于0.2为主要代谢通路,包括D-谷氨酰胺和D-谷氨酸代谢、亚油酸代谢、牛磺酸和亚牛磺酸代谢、丙氨酸,天冬氨酸和谷氨酸代谢、缬氨酸,亮氨酸和异亮氨酸的生物合成。对显著性差异代谢物进行单变量ROC曲线分析,进一步考察这些显著性差异代谢物对分类的识别能力,ROC曲线下的面积(AUC)大于0.5时,说明具有较好的识别能力,AUC越接近于1,即ROC曲线越靠近左上角,识别效果越好。本试验结果显示,A组和B组有9个代谢物AUC面积在0.8以上。如图 10。这9个代谢物为:Creatinine:肌酐、5,2' -O-dimethylcytidine:5,2' -O-甲基胞苷、Myristoleic acid:肉豆蔻酸、L-Leucine:亮氨酸、Nicotinate:烟酸、3-Hydroxybenzoate:3-羟基苯甲酸、Hypoxanthine:次黄嘌呤、gamma-L-GlutamNicotinateyl-L-valine:γ-谷氨酰缬氨酸、Hippuric acid:马尿酸。试验组和对照组相比,9个差异代谢物显著性上调。

|
| 红色表示上调,绿色表示下调。A:正离子模式,B:负离子模式。 图 8 A组和B组差异代谢物聚类热图 |

|
| 图中x轴为通路影响力,y轴为-log(P值),圆圈表示代谢通路,圆圈颜色深浅表示代谢物通路中代谢物显著性变化,圆圈大小与通路影响得分相对应 图 9 A组和B组差异代谢物的代谢通路分析 |

|
| 横坐标为假阳性概率(特异性),纵坐标真阳性率(灵敏度) 图 10 十个显著性差异代谢物的ROC曲线 |
牛磺酸和亚牛磺酸代谢通路反映了机体的能量代谢水平[20]。牛磺酸具有维护细胞膜结构的稳定[21],可以促进肌肉组织对葡萄糖和必需氨基酸的摄取和利用,加速糖酵解,增加糖异生[22]。张瑞等[23]在研究黄芪的抗疲劳作用时,发现大鼠腓肠肌中代谢物牛磺酸水平降低。这和本研究中围产前期日粮添加山楂、黄芪后饲喂14 d试验组奶牛血浆代谢物牛磺酸显著下调试验结果一致。说明日粮添加山楂、黄芪可能通过加速奶牛血浆代谢物牛磺酸的代谢,用于调控葡萄糖和氨基酸的代谢。
3.2 D-谷氨酰胺和D-谷氨酸代谢及丙氨酸,天冬氨酸和谷氨酸代谢谷氨酰胺属于生糖氨基酸被作为生糖物质,是肝糖原发生异生作用的重要底物,维持和调节生物机体的总氨基酸稳态[24]。谷氨酰胺参与调控葡萄糖代谢过程[25],增强免疫效应[26]。谷氨酰胺和谷氨酸同时参与D-谷氨酰胺和D-谷氨酸代谢,丙氨酸、天冬氨酸和谷氨酸代谢两个代谢通路。D-谷氨酰胺和D-谷氨酸代谢通路中谷氨酰胺转化为谷氨酸,丙氨酸、天冬氨酸和谷氨酸代谢通路中谷氨酸在谷氨酰胺合成酶的作用下合成谷氨酰胺,谷氨酰胺被谷氨酰胺磷酸酶水解成谷氨酸,继续参与循环[27-28]。谷氨酸参与D-谷氨酰胺和D-谷氨酸代谢通路时,在谷氨酸脱氢酶的作用下被代谢为α-酮戊二酸。参与丙氨酸、天冬氨酸和谷氨酸代谢通路时,谷氨酸可生成琥珀酸[29]。琥珀酸是三羧酸循环的中间产物,在三羧酸循环中为机体提供能量[30]。有研究表明谷氨酸是中枢神经系统中主要的兴奋性神经递质[31],可以作为中间代谢产物将氨基酸代谢和蛋白质代谢连接起来[32]。本研究中在围产前期日粮添加山楂、黄芪试验组围产期奶牛血浆代谢物谷氨酰胺和谷氨酸分别显著上调和下调。造成这种结果可能是因为谷氨酸转化成谷氨酰胺增加或谷氨酰胺转化为谷氨酸减少,增多谷氨酰胺可能用于调控葡萄糖代谢过程,提高机体蛋白质的合成和葡萄糖能量的补充。
3.3 缬氨酸,亮氨酸和异亮氨酸的生物合成亮氨酸是机体必需氨基酸中的支链氨基酸,也是重要的生酮氨基酸[33-34]。Arakawa和Pleck等[35-36]研究发现亮氨酸在调控糖脂代谢和免疫功能方面有重要作用。曲婷丽等和王二兵等[37-38]研究发现黄芪乙酸乙酯萃取物治疗小鼠白细胞减少症时血清代谢物亮氨酸显著上调。这和本研究血浆代谢物亮氨酸显著上调的结果一致。在围产前期奶牛连续饲喂14 d山楂、黄芪血浆代谢物亮氨酸上调,说明日粮添加山楂、黄芪有利于增强产前期奶牛免疫力,维持免疫系统稳定。
3.4 亚油酸代谢亚油酸是组成游离脂肪酸的重要成分[39]。有研究发现亚油酸能诱导机体产生大量活性氧物质,引起机体红细胞的急性损伤[40]。李秋红等[41]发现荷叶黄酮具有良好的清除自由基能力,能有效抑制亚油酸的氧化。有研究认为,部分黄酮类化合物具有抗氧化作用[42],胡博路等[43]研究发现黄芪具有很强的抗氧化活性。由此推测黄芪中黄酮类化合物可能是抑制亚油酸氧化的物质,减少亚油酸氧化导致奶牛机体细胞损伤。有研究表明亚油酸对奶牛乳腺上皮细胞的生长有抑制作用,并且对奶牛乳腺上皮细胞液中脂质小滴的合成有促进作用[44]。本研究中在围产前期奶牛连续饲喂14 d山楂、黄芪血浆代谢物亚油酸显著下调,说明产前奶牛日粮中添加山楂、黄芪有利于乳腺上皮细胞生长及促进脂质小滴合成的作用。
4 结论本研究中在围产前期奶牛连续饲喂14 d山楂、黄芪血浆代谢物中谷氨酰胺和亮氨酸显著上调,琥珀酸、牛磺酸、谷氨酸和亚油酸显著下调,这些物质调节围产期奶牛葡萄糖代谢和氨基酸代谢通路中牛磺酸和亚牛磺酸代谢、D-谷氨酰胺和D-谷氨酸代谢及丙氨酸、天冬氨酸和谷氨酸代谢和缬氨酸,亮氨酸和异亮氨酸的生物合成,及脂肪酸代谢通路中亚油酸代谢。
| [1] |
靳军阳, 闫磊, 薛永康, 等. 围产期奶牛的能量负平衡及能量代谢障碍病防治[J]. 湖北畜牧兽医, 2018, 39(12): 22-27. DOI:10.3969/j.issn.1007-273X.2018.12.009 |
| [2] |
王吉峰, 王加启. 奶牛营养代谢对乳脂合成调控机制的研究进展[J]. 中国畜牧兽医, 2003, 30(2): 6-10. DOI:10.3969/j.issn.1671-7236.2003.02.002 |
| [3] |
刘艳霞, 刘在萍, 焦建杰, 等. 黄芪苷Ⅳ对正常和心功能受抑制大鼠左心室心肌力学的影响[J]. 中草药, 2001, 32(4): 332-334. DOI:10.3321/j.issn:0253-2670.2001.04.023 |
| [4] |
Lee YS, Han OK, Park CW, et al. Pro-inflammatory cytokine gene expression and nitric oxide regulation of aqueous extracted Astragali radix in RAW 264.7 macrophage cells[J]. Journal of Ethnopharmacology, 2005, 100(3): 289-294. DOI:10.1016/j.jep.2005.03.009 |
| [5] |
张莹, 王蕾, 杜梦楠. 注射用黄芪多糖治疗肿瘤的临床研究进展[J]. 药物评价研究, 2016, 39(6): 1092-1094. |
| [6] |
杨庆珍, 刘德旺, 田义新. 黄芪多糖化学结构与药理作用研究进展[J]. 北方园艺, 2015(7): 168-175. |
| [7] |
杜继红, 韩志帅, 王海良, 等. 黄芪多糖粉对奶牛口蹄疫疫苗免疫效果的影响[J]. 中国畜牧杂志, 2013, 49(24): 64-66. DOI:10.3969/j.issn.0258-7033.2013.24.017 |
| [8] |
文月玲, 申义君, 周金伟, 等. 黄芪多糖对泌乳期奶牛血清生化指标的影响[J]. 中国畜牧兽医, 2014(8): 131-135. |
| [9] |
连慧香. 发酵黄芪粉对奶牛产奶量及乳成分的影响研究[J]. 粮食与饲料工业, 2015, 12(1): 46-48. |
| [10] |
连慧香. 发酵黄芪粉对奶牛抗氧化性能及血液代谢的影响[J]. 粮食与饲料工业, 2015, 12(5): 59-61. |
| [11] |
周庆民, 张艳, 徐馨, 等. 黄芪茎叶生物发酵物对奶牛应用效果的试验研究[J]. 中国乳业, 2016(9): 32-35. DOI:10.3969/j.issn.1671-4393.2016.09.008 |
| [12] |
刘超, 张学武. 黄芪对高脂血症小鼠血脂及脂质过氧化的影响[J]. 时珍国医国药, 2007, 18(7): 1648-1649. DOI:10.3969/j.issn.1008-0805.2007.07.055 |
| [13] |
王代明. 山楂提取物调节血脂作用的实验研究[J]. 中医药临床杂志, 2012, 24(12): 1147-1148. |
| [14] |
高志强, 谢美娟, 陈立波. 山楂果叶对脂肪肝大鼠脂质代谢及氧化应激的影响[J]. 四川中医, 2016(5): 50-53. |
| [15] |
朱光. 高脂血症证治之我见[J]. 实用中医内科杂志, 2001, 15(2): 7. |
| [16] |
吴志嵩, 路新国. 山楂山药汤对高脂血症小鼠体质量和血脂水平的影响[J]. 西部中医药, 2012, 25(2): 15-17. DOI:10.3969/j.issn.1004-6852.2012.02.006 |
| [17] |
林秋实, 陈吉棣. 山楂及山楂黄酮预防大鼠脂质代谢紊乱的分子机制研究[J]. 营养学报, 2000, 22(2): 131-136. DOI:10.3321/j.issn:0512-7955.2000.02.009 |
| [18] |
高东雁, 刘健, 李卫平, 等. 山楂叶总黄酮对大鼠心肌缺血性损伤的保护作用及机制研究[J]. 中药药理与临床, 2012(5): 64-66. |
| [19] |
陈雄, 程学文, 徐美荣. 山楂叶总黄酮对大鼠肾缺血/再灌注损伤的保护作用[J]. 实用儿科临床杂志, 2007, 22(5): 359-360. DOI:10.3969/j.issn.1003-515X.2007.05.018 |
| [20] |
袁子文, 钟立甲, 纪鹏, 等. 当归干预血瘀证大鼠血浆代谢组学研究[J]. 天然产物研究与开发, 2018, 30(4): 559-567. |
| [21] |
Jiang L, Huang J, Wang Y, et al. Metabonomic analysis reveals the CCl4-Induced systems alterations for multiple rat organs[J]. Physical Review A, 2012, 11(4): 1354-1362. |
| [22] |
Ito T, Yoshikawa N, Inui T, et al. Tissue depletion of taurine accelerates skeletal muscle senescence and leads to early death in mice[J]. PLoS One, 2014, 9(9): e107409. DOI:10.1371/journal.pone.0107409 |
| [23] |
张瑞, 李科, 李爱平, 等. 基于1H NMR技术黄芪抗疲劳作用的肌肉代谢组学研究[J]. 药学学报, 2018, 53(5): 129-137. |
| [24] |
吴洪涛, 刘紫庭, 杨罗艳. 川参通对大鼠前列腺组织影响的实验研究[J]. 中国临床康复, 2005, 9(2): 188-190. DOI:10.3321/j.issn:1673-8225.2005.02.094 |
| [25] |
Lapierre H, Lobley GE, Doepel L, et al. Triennial lactation symposium:mammary metabolism of amino acids in dairy cows[J]. Journal of Animal Science, 2012, 90(5): 1708-1721. DOI:10.2527/jas.2011-4645 |
| [26] |
黄英, 谢燕斌. 谷氨酰胺对免疫调节的影响[J]. 福建医药杂志, 2005, 27(2): 133-133. DOI:10.3969/j.issn.1002-2600.2005.02.099 |
| [27] |
Exner R, Tamandl D, Goetzinger P, et al. Perioperative GLY-GLN infusion diminishes the surgery-induced period of immunosuppres-sion[J]. Annals of Surgery, 2003, 237(1): 110-115. DOI:10.1097/00000658-200301000-00015 |
| [28] |
杨晓运, 李智, 秦绿叶, 等. 星形胶质细胞和神经元之间谷氨酸-谷氨酰胺的代谢偶联[J]. 生理科学进展, 2003, 34(4): 350-352. DOI:10.3321/j.issn:0559-7765.2003.04.015 |
| [29] |
Hongbo Y, Wei W, Lingdi L, et al. Research progress of the arginine biosynthetic pathway in prokaryotic cells[J]. Biotechnology Bulletin, 2015, 31(1): 21-28. |
| [30] |
Du C, Lin SKC, Koutinas A, et al. Succinic acid production from wheat using a biorefining strategy[J]. Applied Microbiology and Biotechnology, 2007, 76(6): 1263-1270. DOI:10.1007/s00253-007-1113-7 |
| [31] |
Heath PR, ShawPJ. Update on the glutamatergic neurotransmitter system and the role of excitotoxicity in amyotrophic lateral sclerosis[J]. Muscle & Nerve, 2002, 26(4): 438-458. |
| [32] |
Bergen WG, Wu G. Intestinal nitrogen recycling and utilization in health and disease[J]. Journal of Nutrition, 2009, 139(5): 821-825. DOI:10.3945/jn.109.104497 |
| [33] |
Campos-Ferraz PL, Bozza T, Nicastro H, et al. Distinct effects of leucine or a mixture of the branched-chain amino acids (leucine, isoleucine, and valine) supplementation on resistance to fatigue, and muscle and liver-glycogen degradation, in trained rats[J]. Nutrition, 2013, 29(11-12): 1388-1394. DOI:10.1016/j.nut.2013.05.003 |
| [34] |
Shi X, Xiao C, Wang Y, et al. Gallic acid intake induces alterations to systems metabolism in rats[J]. Journal of Proteome Research, 2013, 12(2): 991-1006. DOI:10.1021/pr301041k |
| [35] |
Arakawa M, Masaki T, Nishimura J, et al. The effects of branched-chain amino acid granules on the accumulation of tissue triglycerides and uncoupling proteins in diet-induced obese mice[J]. Endocrine Journal, 2011, 58(3): 161-170. DOI:10.1507/endocrj.K10E-221 |
| [36] |
Plecko B, Stoeckler-ipsiroglu S, Schober E, et al. Oral β-hydroxybutyrate supplementation in two patients with hyperinsu-linemic hypoglycemia:Monitoring of β-hydroxybutyrate levels in blood and cerebrospinal fluid, and in the brain by in vivo mag-netic resonance spectroscopy[J]. Pediatr Res, 2002, 52(2): 301-306. |
| [37] |
曲婷丽, 王二兵, 李震宇, 等. 黄芪注射液乙酸乙酯萃取物对小鼠白细胞减少症作用的代谢组学[J]. 中成药, 2017, 39(3): 455-461. |
| [38] |
王二兵, 郝津芳, 刘锐玲, 等. 基于代谢组学技术的黄芪根与地上部分醋酸乙酯部位的药效比较[J]. 中草药, 2018, 49(10): 2240-2247. DOI:10.7501/j.issn.0253-2670.2018.10.003 |
| [39] |
范建高, 曾民德, 洪健, 等. 不饱和脂肪酸对L-02和HLF细胞增殖及合成细胞外基质的影响[J]. 华人消化杂志, 1998(6): 502-504. DOI:10.3969/j.issn.1009-3079.1998.06.014 |
| [40] |
纪鹏.生当归及其不同炮制品干预小鼠血虚模型的代谢组学研究[D].兰州: 甘肃农业大学, 2015.
|
| [41] |
李秋红, 李廷利, 黄莉莉, 等. 中药抗氧化的作用机理及评价方法研究进展[J]. 时珍国医国药, 2008, 19(5): 1257-1258. DOI:10.3969/j.issn.1008-0805.2008.05.133 |
| [42] |
Groneberg DA, Grosse-siestrup C, Fischer A. In vitro models to study hepatotoxicity[J]. Toxicologic Pathology, 2002, 30(3): 394-399. DOI:10.1080/01926230252929972 |
| [43] |
胡博路, 孟洁, 胡迎芬, 等. 30种中草药清除自由基的研究[J]. 青岛大学学报:自然科学版, 2000(2): 38-40. |
| [44] |
王治国.奶牛乳腺上皮细胞的体外培养及应用[D].北京: 中国农业科学院, 2007.
|