早期卵泡的发育在家禽繁殖性状有着至关重要的作用,它主要受下丘脑-垂体-卵巢轴分泌的激素调控[1]。促卵泡素受体(Follicle stimulating hormone,FSHR)和雌激素受体(Estrogen alpha,ESR1)是卵泡发育的重要激素受体,其表达量高低与家禽产蛋量显著相关[2]。近些年,针对FSHR在家禽的研究主要集中在鸡,研究发现FSHR在鸡的表达主要在性腺且初次表达也是在性腺,它是通过介导FSH激活cAMP信号通路促进颗粒细胞分泌促黄体生成素、生长转化因子(Transforming growth factor,TGF)、雌激素(Estrogen,ES)等激素和生长因子,同时通过信号分子激活TGF-β、ERK以及AKT等信号通路共同作用促进颗粒细胞的增殖,从而促进卵泡的发育和成熟[3]。Xu等[4]发现FSHR的单核苷酸多态性(Single nucleotide polymorphism,SNP)与番鸭的产蛋量显著相关,且发现番鸭FSHR与鸡(93.2%)、绿头鸭(95.7%)具有高度同源性。ESR1则是一个多功能基因,它表达在动物体内绝大多数组织,且在不同组织中功能也不同。ESR1既可以通过介导ES激活ERK信号通路,调节磷酸化作用增强或抑制功能基因的转录,又可以介导Caspase信号通路使细胞分泌肿瘤坏死因子和白细胞介素调控颗粒细胞凋亡或癌变[5-6]。但大量研究表明ESR1在动物卵巢的主要作用是控制动物产仔数和促进性成熟[7-8]。此外,ESR的PvuⅡ多态性与动物的繁殖性状密切相关[8]。
雷州黑鸭是分布于雷州半岛海滩的优质滩涂鸭种,其主要以虾蟹贝类为食,且具有开产期早(120 d)、产蛋期长(2年)、产蛋量高(280/500 d)、绿壳率高(80%)等特性[9]。通过对其解剖发现其卵巢具有丰富的卵泡(图 1),在繁殖性能具有巨大的开发价值。综上所述,FSHR和ESR对雷州黑鸭的繁殖性能可能有密切的关系。因此,本研究通过对雷州黑鸭FSHR和ESR1基因在性腺轴的表达规律研究和产蛋关联分析,旨在揭示2个基因对雷州黑鸭早期性腺的调控机制以及对繁殖性能的影响,为雷州黑鸭分子育种提供靶位点以及为优质种质资源的开发提供理论依据。

|
| 图 1 180日龄雷州黑鸭和卵巢组织 |
试验用雷州黑鸭由湛江市坡头区恒成种养合作社提供,所有鸭单笼饲养,饲养水平、大小、体型、世代均一致。随机挑选25只雷州黑鸭用于采集下丘脑、垂体、卵巢组织测量FSHR和ESR1表达量(0、30、60、90和120 d,每个时期5只),117只饲喂至300 d用于FSHR和ESR1的繁殖性状关联分析,统计开产期(FEA)、开产蛋重(FEW)、开产体重(FIW)、120 d产蛋数(120E)、180 d产蛋数(180E)、240 d产蛋数(240E)、300 d产蛋数(300E)及300 d蛋品质测试,指标包括蛋重、蛋形指数、蛋壳强度、哈夫单位、蛋黄重、蛋白重和蛋白高度。在300 d,每个个体采血1 mL用于提取DNA,筛选SNP。
1.2 方法 1.2.1 总RNA的提取和cDNA的合成根据TransZol Up Plus Kit(Trans,广州)试剂盒分别对0 d、30 d、60 d、90 d和120 d的下丘脑、垂体、卵巢组织进行总RNA提取。提取的总RNA通过1%的琼脂糖凝胶电泳检测合格后,根据TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix(Trans,广州)试剂盒说明书进行cDNA合成,并将cDNA于-20℃冰箱保存。
1.2.2 引物设计与荧光定量根据GenBank上的绿头野鸭的基因序列,用Primer 3.0分别对FSHR(Gene ID:XM_005012095.2)、ESR1(Gene ID:101802318)和β-actin(Gene ID:NM_001310421.1)设计引物(表 1)。按照ChamQTM SYBR qPCR Master Mix 7750(Trans,广州)荧光定量试剂盒,在Applied Biosystems StepOnePlus(美国)荧光定量PCR上对0 d、30 d、60 d、90 d和120 d的下丘脑、垂体和卵巢组织进行荧光定量。PCR反应体系:10 μL ChamQTM SYBR qPCR Master Mix(1×),0.4 μL PCR Forward Primer(0.4 μmol/L),0.4 μL PCR Reverse Primer(0.4 μmol/L),0.4 μL ROX Reference Dye(1×),2.0 μL cDNA,6.8 μL ddH2O,总体积20 μL。反应程序:94℃,35 s;(94℃,20 s;57℃,35 s;采光;72℃,25 s)40个循环;95℃,15 s;60℃,1 min;95℃,15 s。
根据HiPure Blood DNA Mini Kit(Megen,广州)试剂盒对117只雷州黑鸭血液DNA进行提取,对提取的DNA通过1%琼脂糖凝胶电泳检测合格后,以117个雷州黑鸭的DNA作为构建DNA池的样品。随机挑选30个样品进行用于筛选SNP。根据NCBI公布的绿头野鸭FSHR(Gene ID:XM_101800482)和ESR1(ENSAPLG00000004585)的外显子和内含子序列设计PCR引物(表 1)。用FSHR和ESR1作为模板,进行PCR反应。反应体系:2 μL cDNA,1 μL正向引物,1 μL反向引物,25 μL Premix Taq(TaKaRa,大连)和21 μL dd H2O。反应程序:(98℃,10 s;55℃,30 s;72℃,1 min)30个循环。最终的PCR产物通过1%琼脂糖凝胶电泳并测序。
1.2.4 SNP筛选和基因分型利用DNAMAN对PCR产物测序的序列进行分析比对并筛选SNP位点。根据筛选到的FSHR的两个突变位点和ESR1的一个位点进行引物设计(表 1),然后用PCR-SSCP[10]方法对筛选到的3个SNP位点进行基因分型。在聚丙烯酰胺凝胶上挑选不同类型的条带进行测序。
1.2.5 数据处理根据2-ΔΔCT方法处理荧光定量数据。利用一般线性模型对FSHR和ESR1突变基因型进行分析:Yij = μ+Gi +eij(Yij:不同性状观测值;μ:总群体平均值;Gi:每个基因型的影响;e ij:随机误差)。
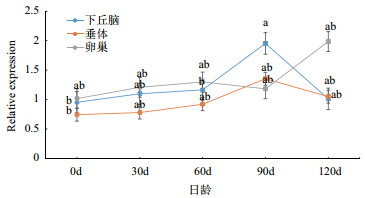
2 结果 2.1 FSHR和ESR1的表达规律本研究对雷州黑鸭0 d、30 d、60 d、90 d和120 d的下丘脑、垂体、卵巢组织的FSHR和ESR1进行荧光定量。如图 2所示,FSHR在下丘脑和垂体的表达量在0-90 d呈稳定上升趋势,在90-120 d下降,90 d表达量最高,且在下丘脑90 d表达量与0 d表达量差异显著(P > 0.05);在卵巢0-120 d的表达量总体呈上升趋势,在120 d表达量达到最高,但与其他时期无显著差异(P > 0.05)。如图 3所示,ESR1在0-120 d所测组织的表达量存在波动,除90-120 d垂体表达量下降,其总体表达呈上升趋势。ESR1在下丘脑和卵巢120 d表达量最高,而在垂体90 d表达量最高,在3个组织的最高表达量都与0 d表达量差异显著(P > 0.05)。
|
| 不同字母表示差异显著(P < 0.05)或差异极显著(P < 0.01) 图 2 雷州黑鸭FSHR表达规律 |

|
| 不同字母表示差异显著(P < 0.05)或差异极显著(P < 0.01) 图 3 雷州黑鸭ESR1表达规律 |
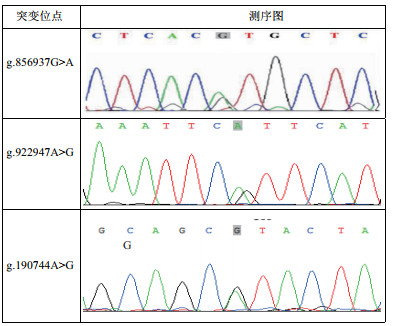
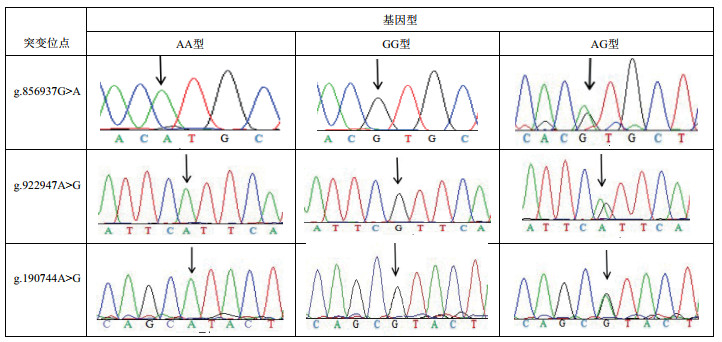
如图 4所示,FSHR的136 bp(intro1)和66 146 bp(exon6)分别有1个突变位点,分别命名为g.856937G > A和g.922947A > G;ESR1的190 744 bp有1个突变位点,命名为g.190744A > G。g.856937G > A位点的突变导致原始编码氨基酸缬氨酸突变为甲硫氨酸,并且g.922947A > G位点是沉默突变。此外,g.190744A > G位点的突变导致原始编码氨基酸脯氨酸突变为异亮氨酸。PCR-SSCP和测序结果显示,以上3个SNP位点都有3种基因型,分别是AA、AG和GG型,如图 4和图 5。
|
| 灰色方框:突变位点的位置 图 4 雷州黑鸭FSHR和ESR1突变位点测序图 |

|
| A:g.856937G > A;B:g.922947A > G;C:g.190744A > G;P1:AG型;P2:AA型;P3:GG型 图 5 雷州黑鸭FSHR和ESR1的PCR-SSCP产物图 |
如表 2所示,FSHR和ESR的多态性分析显示3个SNP位点都呈中度多态性(0.25 < PIC < 0.5),g.856937G > A和g.190744A > G处于Hardy-Weinberg平衡状态(P > 0.05),而g.922947A > G处于Hardy-Weinberg非平衡状态(P > 0.05)。此外,3个SNP都具有较高遗传多态性。
如表 3所示,关联分析显示,FSHR的2个SNP位点都与雷州黑鸭FEA,FEW和300E显著相关(P > 0.05),且g.922947A > G位点还与FIW显著相关(P > 0.05)。ESR1的g.190744A > G位点与雷州黑鸭FEW、FIW和300E显著相关(P > 0.05),而与FEA相关性不显著(P > 0.05)。然而,FSHR和ESR1的3个SNP位点与蛋品质相关性不显著(P > 0.05)。
FSH和ES在卵巢早期发育中起关键作用,其作用强度受其相应受体FSHR和ESR1调节。近年来,研究者对FSHR和ESR1进行了广泛的研究,结果显示两种基因几乎都表达在下丘脑-垂体-性腺轴上,它们早期的表达量对动物的性成熟起决定性作用[5, 11]。FSHR在卵巢通过介导FSH加强cAMP-PAK信号通路,并激活ERK等相关通路调节卵巢雌激素、孕酮等激素共同作用卵泡,当FSHR表达量较低时,颗粒细胞与膜细胞之间的营养物质以及信号交换减弱,颗粒细胞自主激活Caspase信号通路,导致卵泡闭锁[12-14]。本研究表明FSHR在下丘脑-垂体-卵巢轴的表达量随着雷州黑鸭日龄的增长呈稳定上升趋势,与王亚男[11]和Akazome等[12]在鸡的研究基本一致,说明FSHR对雷州黑鸭早期发育有重要作用,同时表明雷州黑鸭早期发育较稳定。研究发现FSHR在优势卵泡表达量显著高于从属卵泡[15]。随着雷州黑鸭发育成熟,其优势卵泡数量迅速增加,而FSHR在卵巢的表达量并未出现显著增长,且在下丘脑和垂体的表达出现略微下降,说明雷州黑鸭发育成熟后卵泡细胞自分泌和旁分泌调节机制较完善,从侧面反映出雷州黑鸭在产蛋性能抗逆性较强,具有良好的开发应用价值。
ESR1在雷州黑鸭下丘脑-垂体-卵巢轴的表达量也随着日龄的增长呈上升趋势,但可能由于作用时间阶段不同,其波动趋势较大,这与Porto[16]在仔鹅中的研究基本一致。据报道,原始卵泡的启动主要受颗粒细胞分泌细胞因子与卵母细胞上的c-kit受体结合发挥作用,不依赖雌激素的调节[17]。因此,ESR1在0-30 d的表达量较低。30 d后,ESR1的表达量迅速上升。研究发现,30 d后卵泡颗粒细胞层由单层变厚,标志着次级卵泡发育。ESR1可通过介导ES直接激活ERK/MAPK信号通路,也可活化cAMP-PKA途径使颗粒细胞和膜细胞表面周期蛋白表达量上调,颗粒细胞快速增殖从而促进卵泡的快速发育和成熟[18-19]。因此,雷州黑鸭ESR1表达量在30 d后迅速增长且在120 d卵巢表达量达到最高,说明ESR1对次级卵泡的发育和性成熟具有重要作用。
通过比较FSHR和ESR1的表达规律发现,两者表达趋势基本一致,说明2个基因对雷州黑鸭早期性腺发育具有类似作用。在90 d时,FSHR和ESR1在卵巢的表达量出现下调,推测雷州黑鸭在90 d时可能存在一个等级卵泡选择过程,但其具体机制仍有待进一步研究。
|
| 图 6 雷州黑鸭FSHR和ESR1的PCR-SSCP产物测序图 |
FSHR和ESR1基因是家禽繁殖性状的关键候选基因,其SNP可能对繁殖性状产生影响。据报道,番鸭FSHR的编码区中鉴定出4个SNP,并且C320T和A227G位点与产蛋量显著相关(P > 0.05)[4]。本研究发现雷州黑鸭FSHR存在2个SNP位点,g.856937G > A与FEA、FEW、300E显著相关(P > 0.05),g.922947A > G与FEA、FEW、FIW、300E显著相关(P > 0.05)。g.856937G > A位点导致原始编码氨基酸缬氨酸突变为甲硫氨酸,g.922947A > G位点是沉默突变。研究发现,FSHR突变可能通过作用其顺式元件影响cFSHR转录,其编码氨基酸突变可影响FSH与FSHR的特异性结合率调节特异性信号通路,从而影响卵泡发育[20-21]。因此,FSHR的SNP对雷州黑鸭繁殖性状的具有重要作用,且g.856937G > A和g.922947A > G位点作为雷州黑鸭产蛋标记基因具有巨大的经济价值。此外,FSHR在颗粒细胞通常与IGFR结合形成复合受体,其突变可能通过控制胰岛素样生长因子的分泌影响机体生长发育[22-23],g.922947A > G与雷州黑鸭FIW显著相关表明该位点突变可能作用IGF信号通路,但其具体机制有待进一步实验研究。
Niu等[24]发现鸡ESR1的外显子4内的T1101C与30、43、57和66周的产蛋量显著相关,而与30周的蛋重相关性不显著(P > 0.05)。Terman等[7]发现,ESR的多态性与生产母猪的数量之间存在极大差异(P > 0.01)。本研究发现ESR1的g.190744A > G位点与雷州黑鸭FEA、FEW、300E显著相关(P > 0.05),且该位点的突变导致脯氨酸突变为异亮氨酸。以上表明雷州黑鸭ESR1的g.190744A > G位点可用于产蛋性状分子标记位点。研究发现,ESR1和ESRβ结构具有高度相似性,二者与雌激素配体结合后发挥不同作用,ESR1在卵巢颗粒细胞膜上可发挥G蛋白偶联ESR1作用,G蛋白偶联ESR1可快速介导GDF9和CYP21等非固醇类物质,促进卵泡发育成熟[25]。当ESR1氨基酸突变,可能使其作用途径发生改变,但其具体结构有待进一步研究。
4 结论本研究首次对雷州黑鸭早期下丘脑-垂体-卵巢轴的FSHR和ESR1的表达规律进行研究,结果发现,FSHR在雷州黑鸭整个早期性腺发育具有重要作用,ESR1主要作用于雷州黑鸭次级卵泡发育和性成熟,90d时雷州黑鸭可能存在一个等级卵泡选择的过程。关联分析发现,本研究鉴定的FSHR和ESR1的3个SNP位点都可作为雷州黑鸭产蛋标记基因,g.922947A > G可能通过FSHR和IGFR复合受体调节IGF信号通路调节机体生长发育。
| [1] |
Kumar TR, Wang Y, Lu N, et al. Follicle stimulating hormone is required for ovarian follicle maturation but not male fertility[J]. Nature Genetics, 1997, 15(2): 201-204. DOI:10.1038/ng0297-201 |
| [2] |
秦玉梅, 任嵩, 李佳玉, 等. 鸡FSHβ、ESRα基因多态性及其合并基因型与产蛋性能的关联性分析[J]. 江苏农业学报, 2017, 33(4): 854-862. DOI:10.3969/j.issn.1000-4440.2017.04.020 |
| [3] |
Sirotkin AV, Benčo A, Tandlmajerová A, et al. cAMP response element-binding protein 1 controls porcine ovarian cell proliferation, apoptosis, and FSH and insulin-like growth factor 1 response[J]. Reprod Fertil Dev, 2018, 30(7): 1145-1153. |
| [4] |
Xu J, Gao X, Li X, et al. Molecular characterization, expression profile of the FSHRgene and its association with egg production traits in muscovy duck[J]. Journal of Genetics, 2017, 96(2): 341-351. DOI:10.1007/s12041-017-0783-x |
| [5] |
Kumar D, Myers MR, Homsi UA, et al. Role of ESR pathway genes in breast cancer:A review[J]. Advances in Breast Cancer Research, 2018, 7(2): 134-186. |
| [6] |
李婷, 马爱团, 刘月琴, 等. 抑制素对绵羊颗粒细胞雌激素和孕酮分泌及相关基因表达的影响[J]. 畜牧兽医学报, 2017, 48(9): 1648-1653. |
| [7] |
Terman A, Kumalska M. The effect of a SNP in ESR gene on the reproductive performance traits in polish sows[J]. Russian Journal of Genetics, 2012, 48(12): 1260-1263. DOI:10.1134/S1022795412120137 |
| [8] |
Goliášová E, Wolf J. Impact of the ESR gene on litter size and production traits in Czech Large White pigs[J]. Animal Genetics, 2015, 35(4): 293-297. |
| [9] |
张少伟, 崔红艳, 苏瑛. 雷州黑鸭FSHβ基因多态性与产蛋性能的关联分析[J]. 南方农业学报, 2018, 49(1): 142-147. DOI:10.3969/j.issn.2095-1191.2018.01.23 |
| [10] |
Hayashi K. PCR-SSCP:a simple and sensitive method for detection of mutations in the genomic DNA[J]. PCR Methods Appl, 1991, 1(1): 34-38. |
| [11] |
王亚男.京海黄鸡FSHβ和FSHR基因的遗传效应及其表达规律研究[D].扬州: 扬州大学, 2015.
|
| [12] |
Akazome Y, Abe T, Mori T. Differentiation of chicken gonad as an endocrine organ:expression of LH receptor, FSH receptor, cytochrome P450c17 and aromatase genes[J]. Reproduction, 2002, 123(5): 721-728. DOI:10.1530/rep.0.1230721 |
| [13] |
滕云.小鼠排卵前卵泡闭锁过程中FSH对FOXO1基因的表达调控[D].南京: 南京农业大学, 2013.
|
| [14] |
Xiao YQ, Huang YB, Jing WU, et al. Effect and mechanism of kisspeptin-10 on progesterone secretion in granulosa cells of chicken F1 follicles cultured in serum-free medium[J]. Scientia Agricultura Sinica, 2012, 32(10): 2091-2097. |
| [15] |
吴阳升, 林嘉鹏, 蒋香菊, 等. 绵羊FSHR基因可变剪接体的克隆、鉴定及表达分析[J]. 江苏农业学报, 2017, 33(3): 630-637. DOI:10.3969/j.issn.1000-4440.2017.03.021 |
| [16] |
Porto CS. Estrogen receptor beta (ESR2) increases the expression of beta-catenin in PC3 prostate cancer cells[J]. Folia Biologica, 2013, 59(3): 135-140. |
| [17] |
Gan X, Chen D, Deng Y, et al. Establishment of an in vitro culture model of theca cells from hierarchical follicles in ducks[J]. Bioscience Reports, 2017, 37(3). |
| [18] |
王洪才, 宋天玉, 袁晓春. 大骨鸡ESR基因多态性及其与产蛋性能关联的分析研究[J]. 中国农学通报, 2012, 28(20): 43-46. |
| [19] |
王虹, 樊官伟, 王少峡, 等. 雌激素受体介导的快速信号通路的研究进展[J]. 现代生物医学进展, 2008, 8(3): 555-557. |
| [20] |
Yang WC, Li SJ, Tang KQ, et al. Polymorphisms in the 5' upstream region of the FSH receptor gene, and their association with superovulation traits in Chinese Holstein cows[J]. Animal Reproduction Science, 2010, 119(3): 172-177. |
| [21] |
Kang L, Zhang N, Zhang Y, et al. Molecular characterization and identification of a novel polymorphism of 200 bp indel associated with age at first egg of the promoter region in chicken follicle-stimulating hormone receptor (FSHR) gene[J]. Molecular Biology Reports, 2012, 39(3): 2967-2973. DOI:10.1007/s11033-011-1058-x |
| [22] |
Ye Q, Xu J, Gao X, et al. Associations of IGF2 and DRD2 polymorphisms with laying traits in Muscovy duck[J]. Peerj, 2017, 5(Suppl 1): e4083. |
| [23] |
Brito IR, Saraiva MVA, Araújo VR, et al. The effect of IGF-1 and FSH on the in vitro development of caprine secondary follicles and on the IGF-1, IGFR-Ⅰ and FSHR mRNA levels[J]. Research in Veterinary Science, 2012, 93(2): 729-732. DOI:10.1016/j.rvsc.2011.09.008 |
| [24] |
Niu X, Tyasi TL, Qin N, et al. Sequence variations in estrogen receptor 1 and 2 genes and their association with egg production traits in Chinese Dagu chickens[J]. Journal of Veterinary Medical Science, 2017, 79(5): 927-934. DOI:10.1292/jvms.17-0014 |
| [25] |
Gonzalez DVE, Broselid S, Kahn R, et al. G protein-coupled estrogen receptor 1(GPER1)/GPR30 Increases ERK1/2 activity through PDZ-dependent and-independent mechanisms[J]. Journal of Biological Chemistry, 2017, 292(24): 9932-9943. DOI:10.1074/jbc.M116.765875 |







