2. 江苏省有害生物入侵预防与控制重点实验室, 南京 210007
2. Jiangsu Key Laboratory for Prevention and Management of Invasive Species, Nanjing 210007
松材线虫病又称为松树萎蔫病(Pine wilt disease), 是由松材线虫(Bursaphelenchus xylophilus)引起的一种松树上的毁灭性病害, 对我国生态和经济造成了重大损失, 已引起了社会的广泛关注[1]。目前关于松材线虫病的防治主要包括化学防治和生物防治。其中, 化学防治不仅易在植物体内形成药物残留, 使环境受到污染, 生态失去平衡, 还易使松材线虫对药物产生抗性[2], 导致其防治效果降低。因此对松材线虫病的生物防治逐渐成为新的研究热点。
目前, 已报道的对松材线虫有杀线活性的微生物包括真菌[3-5]、放线菌[6]和细菌[7-9]等。由于细菌培养简单, 生长繁殖速度快等特点, 使生防细菌在生防微生物中占有重要的研究地位。现今对松材线虫的生物防治以细菌为主, 其中对芽孢杆菌属细菌研究较多, 如解淀粉芽孢杆菌(B. amyloliquefaciens)[10]、短小芽孢杆菌(B. pumilus)[11]、苏云金芽孢杆菌(B. thuringiensis)[12]和蜡状芽孢杆菌(B. cereus)[13]等, 其在松材线虫生物防治中有着巨大的开发潜力。
在自然条件下, 林间环境与实验条件差异较大, 可能会影响生防细菌的防治效果, 因而研究生防细菌的培养条件和杀线物质稳定性显得十分重要。有研究表明, 芽孢杆菌对松材线虫具有杀线虫活性[10-11, 13]。本实验室前期从樱花根际土壤和枝干上分别获得蜡样芽孢杆菌(B. cereus)JK-XZ3和瓦雷兹芽孢杆菌(B. velezensis)YH-20, 从黑松根际土壤分离出一株短小芽孢杆菌(B. pumilus)HR10, 初步研究表明这3株细菌对部分林木病原菌具有较好的拮抗作用, 但它们对松材线虫是否有拮抗作用尚未见报道。本研究拟采用浸测法对以上3株细菌进行杀线活性的测定, 并对筛选出的高效杀线菌株培养条件及杀线物质的稳定性进行测定, 旨在获得高效杀线菌株, 为今后继续开展杀线活性物质的分离纯化, 开发应用防治松材线虫的生物制剂提供参考依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株与松材线虫虫株供试蜡样芽孢杆菌(B. cereus)JK-XZ3分离自徐州樱花根际土壤; 短小芽孢杆菌(B. pumilus)HR10分离自黑松和黄色须腹菌菌根际土壤; 瓦雷兹芽孢杆菌(B. velezensis)YH-20分离自上海樱花枝干上。供试松材线虫虫株为AMA3, 分离于安徽省马鞍山市自然感染松材线虫病死亡的马尾松(Pinus massoniana), 线虫用灰葡萄孢(Botrytis cinerca)培养繁殖备用。以上菌株和线虫虫株均保存于南京林业大学森林病理实验室。
1.1.2 供试培养基马铃薯葡萄糖琼脂培养基(PDA)、牛肉膏蛋白胨固体培养基(NA)和牛肉膏蛋白胨液体培养基(NB)。
1.2 方法 1.2.1 松材线虫的培养将供试松材线虫接种于长满灰葡萄孢的PDA培养基平板中, 置于25℃恒温培养箱中培养至灰葡萄孢菌丝完全被取食。采用Berman漏斗法收集线虫[16], 将收集到的线虫用无菌水洗3次, 配制成浓度约为5 000条/mL的线虫悬液, 备用。
1.2.2 细菌发酵滤液的制备将保存的3株细菌菌株接种到含50 mL NB培养液的150 mL锥形瓶中, 于28℃, 200 r/min摇床摇培4 d, 8000 r/min离心10 min, 上清液用0.22 μm细菌过滤器过滤, 即得细菌发酵滤液, 备用。
1.2.3 细菌对松材线虫杀线活性测定及线虫虫体形态观察取3株细菌的发酵滤液各100 μL分别加入1.5 mL的离心管中, 接着加入100 μL线虫悬液(约500条), 混匀。分别处理线虫24 h和48 h后吸取混合液20 μL(约50条线虫)在显微镜下观察松材线虫的死亡数目(线虫虫体僵直, 虫体呈“J”形或“C”形, 虫体体表无光泽, 视为死亡[17])及松材线虫总数, 计算死亡率和校正死亡率[18], 以无菌NB培养液处理为对照, 每个处理重复3次。
死亡率(%)=线虫死亡数/线虫总数×100;
校正死亡率(%)=(处理死亡率-空白对照死亡率)/(100-空白对照死亡率)×100。
进一步将3株细菌发酵滤液稀释2倍、4倍和10倍分别与线虫悬液以1:1体积混合处理松材线虫48 h后, 比较3株细菌的杀线活性, 并用显微镜观察高效拮抗细菌在不同稀释倍数下松材线虫虫体形态变化, 每个处理重复3次。
1.2.4 不同培养温度下高效拮抗细菌发酵滤液杀线活性测定将筛出的高效拮抗细菌接种到NB培养液中, 分别置于20、25、30、35和40℃摇床摇培4 d, 收集菌株发酵滤液, 分别测定其4倍、8倍和20倍稀释液处理松材线虫48 h后的杀线活性。以无菌NB培养液处理为对照, 每个处理重复3次。
1.2.5 不同培养时间下高效拮抗细菌发酵滤液杀线活性测定将筛出的高效拮抗细菌接种到NB培养液中, 置于30℃、200 r/min摇床, 分别摇培1 d、3 d、4 d、5 d和7 d, 收集菌株发酵滤液, 分别测定其4倍、8倍和20倍稀释液处理松材线虫48 h后的杀线活性。以无菌NB培养液处理为对照, 每个处理重复3次。
1.2.6 高效拮抗细菌发酵滤液杀线活性的热稳定性测定取高效拮抗细菌发酵滤液分别在40、60、80、100℃处理1 h和121℃处理20 min, 测定处理后的发酵滤液8倍稀释液处理松材线虫48 h后的杀线活性。以未经处理的发酵滤液8倍稀释液和NB培养液分别作为阳性对照和空白对照, 每个处理重复3次。
1.2.7 高效拮抗细菌发酵滤液杀线活性的酸碱稳定性测定用1 mol/L HCl和1 mol/L NaOH将高效拮抗细菌发酵滤液pH分别调至4、5、6、7、8、9和10, 静置12 h后离心取上清, 测定经不同pH处理的发酵滤液8倍稀释液处理松材线虫48 h后的杀线活性, 分别以上述相同pH下的NB培养液和未经酸碱处理的发酵滤液(原pH为8.8)8倍稀释液作为空白对照和阳性对照, 每个处理重复3次。
1.2.8 数据处理采用Origin 8.6和WPS软件进行数据图表处理, 用SPSS 19软件进行数据分析。
2 结果 2.1 松材线虫拮抗细菌的筛选及杀线活性的比较测定结果(表 1)表明, 蜡样芽孢杆菌JK-XZ3、短小芽孢杆菌HR10和瓦雷兹芽孢杆菌YH-20对松材线虫均有杀线活性。处理24 h后, 松材线虫的校正死亡率均在40%以上; 处理48 h后, 松材线虫的校正死亡率均达100%。进一步将3株细菌发酵滤液分别稀释后处理松材线虫48 h测定发现, 4倍稀释液下, 3株菌株的杀线活性没有显著差异(P < 0.05), 松材线虫的校正死亡率分别达99.55%、99.29%和83.82%。8倍和20倍稀释液下, 蜡样芽孢杆菌JK-XZ3的杀线活性显著高于其他2株菌株(P < 0.05), 松材线虫的校正死亡率分别为88.32%和22.52%。综合这3株细菌发酵滤液及其不同稀释倍数下的杀线活性, 选取蜡样芽孢杆菌JK-XZ3进行后续试验。
蜡样芽孢杆菌JK-XZ3发酵滤液稀释不同倍数后处理松材线虫, 发现虫体形态发生明显变化, 如虫体内含物消解; 虫体出现膨大后体液外渗; 虫体断裂(图 1)。观察发现随着稀释倍数的增加, 松材线虫的消解率逐渐降低。同一稀释倍数下随着处理时间的延长, 松材线虫的消解率逐渐升高。在不同稀释倍数下处理松材线虫24 h后, 发酵滤液4倍和8倍稀释液中线虫的消解率分别为46.94%和23.32%, 20倍稀释液无消解现象。处理48 h后, 发酵滤液4倍、8倍和20倍稀释液中线虫的消解率分别为75.86%、56.62%和1.22%。

|
| a:CK(NB培养液); b:线虫体腔内容物消解; c:虫体膨大, 体液外渗; d:虫体断裂 图 1 蜡样芽孢杆菌JK-XZ3发酵滤液处理松材线虫后的虫体形态观察 |
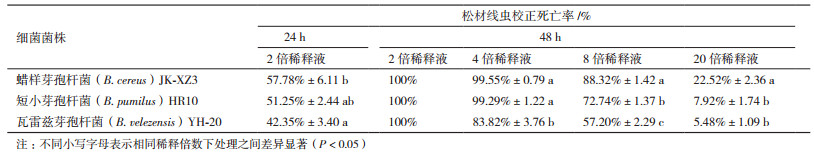
不同培养温度下蜡样芽孢杆菌JK-XZ3发酵滤液处理松材线虫48 h后的杀线活性表明(图 2), 相同温度下, 随着稀释倍数的增加, 其杀线活性显著降低(P < 0.05), 随着温度的升高, 相同稀释倍数下发酵滤液杀线活性先升高后降低。4倍稀释液在30℃和35℃时表现出较高的杀线活性, 松材线虫的校正死亡率均为100%;8倍和20倍稀释液在30℃时杀线活性均高于其他培养温度下的杀线活性, 松材线虫的校正死亡率分别为100%和33.68%;说明蜡样芽孢杆菌JK-XZ3在30℃培养更有助于杀线物质的分泌。
|
| 不同小写字母表示相同稀释倍数下处理之间差异显著(P < 0.05), 不同大写字母表示相同温度下处理之间差异显著(P < 0.05), 下同 图 2 不同培养温度下蜡样芽孢杆菌JK-XZ3发酵滤液对松材线虫的校正死亡率 |
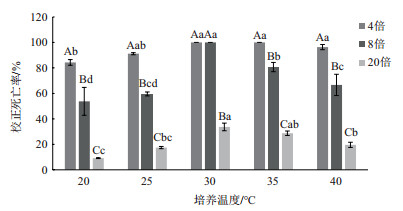
不同培养时间下蜡样芽孢杆菌JK-XZ3发酵滤液处理松材线虫48 h的杀线活性测定表明(图 3), 相同培养时间下, 随着稀释倍数的增加, 其杀线活性逐渐降低。在不同培养时间下, 相同稀释倍数的杀线活性差异显著(P < 0.05), 在4倍和8倍稀释液下, 培养4 d的杀线活性最高, 松材线虫的校正死亡率均为100%;在20倍稀释液下, 培养4 d的杀线活性明显高于其他培养时间下的杀线活性, 松材线虫的校正死亡率为39.99%。说明蜡样芽孢杆菌JK-XZ3分泌杀线物质的最佳培养时间为4 d。
|
| 图 3 不同培养时间下蜡样芽孢杆菌JK-XZ3发酵滤液对松材线虫的校正死亡率 |
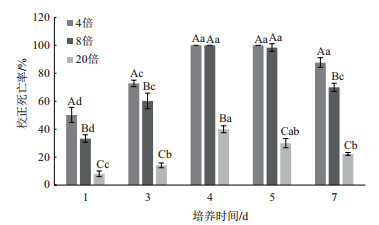
蜡样芽孢杆菌JK-XZ3发酵滤液经不同温度(40、60、80、100和121℃)处理后的杀线活性表明(图 4), 松材线虫在40、60、80和100℃下处理后的发酵滤液8倍稀释液中处理48 h后, 其校正死亡率达84%以上, 在121℃下处理后的发酵滤液8倍稀释液中杀线活性迅速下降, 其校正死亡率为33.19%, 显著低于未经处理的发酵滤液8倍稀释液(100%)(P < 0.05), 说明蜡样芽孢杆菌JK-XZ3发酵滤液中的杀线物质具有较好的热稳定性。
|
| 图 4 不同温度处理蜡样芽孢杆菌JK-XZ3发酵滤液对松材线虫的校正死亡率 |
蜡样芽孢杆菌JK-XZ3发酵滤液经不同pH处理后的杀线活性表明(图 5), 松材线虫在pH为8-10的发酵滤液8倍稀释液中处理48 h后, 其校正死亡率达88%以上, 与未经酸碱度处理的发酵滤液8倍稀释液(原pH为8.8)(100%)无显著差异(P < 0.05), 说明发酵滤液中具有杀线活性的物质受碱性条件影响较小; 在pH为4-6的发酵滤液8倍稀释液中处理48 h后, 其校正死亡率达8%-25%, 显著低于未经酸碱度处理的发酵滤液8倍稀释液(100%), 说明在酸性条件下发酵滤液中具有杀线活性的物质易失活。因此表明, 蜡样芽孢杆菌JK-XZ3发酵滤液中具有杀线活性的物质在碱性条件下是比较稳定的。
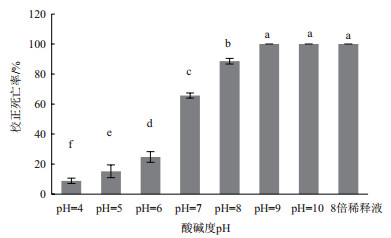
|
| 图 5 不同pH处理蜡样芽孢杆菌JK-XZ3发酵滤液对松材线虫的校正死亡率 |
由松材线虫引起的松树萎蔫病对森林的危害日益加重, 研究者们尝试采用化学药剂进行松材线虫病防治, 但化学药剂的使用对生态环境及人类安全造成隐患, 因此生物防治逐渐成为新的研究热点。据报道, 至今已发现多种对松材线虫具有杀线虫活性的芽孢杆菌[10-11, 13]。本研究从3株供试芽孢杆菌中筛选出1株蜡样芽孢杆菌JK-XZ3, 其发酵滤液具有高效杀线活性, 发酵滤液4倍、8倍和20倍稀释液处理48 h后松材线虫的校正死亡率分别为99.55%、88.32%和22.52%, 均高于短小芽孢杆菌HR10和瓦雷兹芽孢杆菌YH-20处理的松材线虫。李亮亮等[14]选出一株蜡样芽孢杆菌(B. cereus)NJSZ-13, 其菌悬液(105 CFU/mL)对松材线虫有较高的杀线活性, 处理48 h后杀线活性达81.5%, 但该菌株的发酵滤液杀线活性较弱, 而本文研究的蜡样芽孢杆菌JK-XZ3发酵滤液稀释8倍后仍有较高的杀线活性, 有利于今后的大规模发酵生产。一些研究发现微生物会使线虫组织消解或形成空泡现象, 如Geng等[19]以秀丽隐杆线虫作为模型, 研究坚强芽孢杆菌(B. firmus)DS-1的肽酶S8超家族蛋白Sep1的杀线机制, 结果表明Sep1可以降解线虫肠和角质层相关蛋白并破坏宿主物理屏障。Liu等[20]研究发现链霉菌属(Streptomyces sp.)AN091965发酵滤液中的spectinabilin物质处理松材线虫在光学显微镜下观察到死亡线虫的组织解体和空泡形成。朱丽梅等[21]筛选的解淀粉芽孢杆菌(B. amyloliquefaciens)JK-JS3处理松材线虫24 h后部分僵直虫体, 身体局部膨大并从膨大部位出现体液外渗, 进而导致虫体断裂并消解的现象。而本研究在显微镜下也观察到蜡样芽孢杆菌JK-XZ3发酵滤液处理后死亡线虫体腔内内容物消解、虫体局部膨大并出现体液外渗、虫体断裂现象, 推测该菌株发酵滤液中可能存在一些可破坏线虫体壁组织的物质。
由于细菌在发酵的过程中会受到培养条件, 环境等多方面的影响, 而难以发挥其潜在的生物学功能。为使细菌在发酵过程中能分泌更多的杀线活性成分, 因此对其发酵培养条件进行优化。本研究通过比较蜡样芽孢杆菌JK-XZ3在不同培养温度和不同培养时间下发酵滤液对松材线虫杀线活性, 表明蜡样芽孢杆菌JK-XZ3在30℃下培养4 d的发酵滤液杀线活性最强, 其4倍和8倍稀释液处理48 h后松材线虫的校正死亡率均达100%;20倍稀释液处理48 h后松材线虫的校正死亡率达39.99%, 比未优化之前(22.52%)提高了17.47%, 为今后规模化生产应用提供了参考依据。
由于发酵液中的物质成分复杂, 了解发酵液中杀线活性物质的理化性质, 有益于后续研究中利用特定的方法将其分离纯化。Li等[22]研究发现短小芽孢杆菌(B. pumilus)LYMC-3培养滤液经过高温处理后对松材线虫的杀线活性无降低, 表明杀线成分可能是非蛋白类物质, 经分离提纯后发现是一种胍类化合物。本研究蜡样芽孢杆菌JK-XZ3发酵滤液在40、60、80和100℃处理后, 8倍稀释液处理48 h后松材线虫的校正死亡率均达84%以上, 表明发酵滤液中具杀线活性的物质具有耐高温特性, 推测可能也属于非蛋白类物质; 进一步研究发现蜡样芽孢杆菌JK-XZ3发酵滤液经碱(pH为8-10)处理后, 其8倍稀释液对松材线虫的杀线活性与未处理的发酵滤液8倍稀释液无显著差异, 这与李恩杰等[15]研究发现菌株D发酵滤液具有耐碱特性一致。而经酸(pH 4-6)处理后, 8倍稀释液的杀线活性明显低于未处理的发酵滤液8倍稀释液, 可能因酸处理后具有杀线活性的物质留在了酸沉淀中。Li等[22]研究发现短小芽孢杆菌LYMC-3培养滤液在碱性条件下较稳定, 经强酸处理后, 培养滤液上清液对松材线虫的杀线活性显著降低, 培养滤液酸沉淀物经碱溶解后处理线虫的死亡率分别达100%和86.4%, 说明菌株培养滤液在酸性条件下不稳定, 具有杀线活性的物质存在于酸沉淀中。由此推测本试验中具有杀线活性的物质在酸性条件下是否也存在酸沉淀中而导致发酵滤液的杀线活性降低, 还需进一步验证。该研究结果为今后杀线菌株物质的分离纯化具有指导意义。
4 结论本研究对蜡样芽孢杆菌JK-XZ3, 瓦雷兹芽孢杆菌YH-20和短小芽孢杆菌HR10的发酵滤液进行杀线活性的测定, 发现蜡样芽孢杆菌JK-XZ3发酵滤液在不同稀释倍数下对松材线虫的杀线活性均高于其他两株芽孢杆菌, 对线虫虫体有明显的消解作用; 该菌株在30℃下培养4 d的发酵滤液4倍和8倍稀释液处理48 h后松材线虫的校正死亡率均达100%;其发酵滤液具有耐热和耐碱性的特性。该研究结果为今后蜡样芽孢杆菌JK-XZ3的开发和应用提供参考依据。
| [1] |
Zhang L, Fu Q, Li W, et al. Identification and characterization of a novel β-glucosidase via metagenomic analysis of Bursaphelenchus xylophilus and its microbial flora[J]. Sci Rep, 2017, 7(1): 14850. DOI:10.1038/s41598-017-14073-w |
| [2] |
Ryss AY, Kulinich OA, Sutherland J R. Pine wilt disease:a short review of world wide research[J]. Forestry Studies in China, 2011, 13(2): 132-138. DOI:10.1007/s11632-011-0205-8 |
| [3] |
Wang CY, Fang ZM, Wang Z, et al. Biological control of the pinewood nematode Bursaphelenchus xylophilus by application of the endoparasitic fungus Esteya vermicola[J]. Biocontrol, 2011, 56(1): 91-100. DOI:10.1007/s10526-010-9302-1 |
| [4] |
Yang Z, Yu Z, Lei L, et al. Nematicidal effect of volatiles produced by Trichoderma sp[J]. Journal of Asia-Pacific Entomology, 2012, 15(4): 647-650. DOI:10.1016/j.aspen.2012.08.002 |
| [5] |
Song HC, Shen WY, Dong JY, et al. Nematicidal metabolites from Gliocladium roseum YMF1. 00133[J]. Applied Biochemistry And Microbiology, 2016, 52(3): 324-330. DOI:10.1134/S0003683816030169 |
| [6] |
陈聪聪.杀松材线虫海洋放线菌HT-8的分离鉴定、培养条件及其活性物质分析[D].青岛: 青岛大学, 2016.
|
| [7] |
Jeong MH, Yang SY, Lee YS, et al. Selection and characterization of Bacillus licheniformis MH48 for the biocontrol of pine wood nematode(Bursaphelenchus xylophilus)[J]. Journal of Korean Forestry Society, 2015, 104(3): 512-518. DOI:10.14578/jkfs.2015.104.3.512 |
| [8] |
Zeng L, Jin H, Lu D, et al. Isolation and identification of chemical constituents from the bacterium Bacillus sp. and their nematicidal activities[J]. Journal of Basic Microbiology, 2015, 55(10): 1239-1244. DOI:10.1002/jobm.v55.10 |
| [9] |
Yu J, Du GC, Li RG, et al. Nematicidal activities of bacterial volatiles and components from two marine bacteria, Pseudoalteromonas marina strain H-42 and Vibrio atlanticus strain S-16, against the pine wood nematode, Bursaphelenchus xylophilus[J]. Nematology, 2015, 17: 1011-1025. DOI:10.1163/15685411-00002920 |
| [10] |
朱丽梅, 吴小芹, 陈江天, 等. 一株毒杀松材线虫的解淀粉芽孢杆菌活性物质的基本性质[J]. 中国生物防治学报, 2009, 25(4): 359-363. DOI:10.3321/j.issn:1005-9261.2009.04.014 |
| [11] |
曾丽琼, 何学友, 蔡守平, 等. 具杀松材线虫活性细菌的筛选和鉴定[J]. 江苏林业科技, 2018, 45(2): 6-9. DOI:10.3969/j.issn.1001-7380.2018.02.002 |
| [12] |
Huang T, Lin Q, Qian X, et al. Nematicidal activity of Cry1Ea11 from Bacillus thuringiensis BRC-XQ12 against the pine wood nematode(Bursaphelenchus xylophilus)[J]. Phytopathology, 2018, 108(1): 44-51. DOI:10.1094/PHYTO-05-17-0179-R |
| [13] |
谈家金, 李亮亮, 陈凤毛.一株蜡样芽孢杆菌NJSZ-13及其应用: 中国, CN106520635A[P]. 2017-03-22.
|
| [14] |
李亮亮, 谈家金, 陈凤毛. 两株松材线虫拮抗细菌的筛选和鉴定[J]. 南京林业大学学报:自然科学版, 2017, 41(4): 37-41. |
| [15] |
李恩杰, 李娜, 王青华, 等. 具杀松材线虫活性的苏云金芽孢杆菌筛选及其毒力测定[J]. 中国生物防治学报, 2018, 34(4): 539-545. |
| [16] |
Wu XQ, Yuan WM, Tian XJ, et al. Specific and functional diversity of endophytic bacteria from pine wood nematode Bursaphelenchus xylophilus with different virulence[J]. International Journal of Biological Sciences, 2013, 9(1): 34-44. DOI:10.7150/ijbs.5071 |
| [17] |
Guo Q, Du G, Qi H, et al. A nematicidal tannin from Punica granatum L. rind and its physiological effect on pine wood nematode(Bursaphelenchus xylophilus)[J]. Pesticide Biochemistry & Physiology, 2016, 135: 64-68. |
| [18] |
Rajasekharan SK, Lee JH, Ravichandran V, et al. Assessments of iodoindoles and abamectin as inducers of methuosis in pine wood nematode, Bursaphelenchus xylophilus[J]. Sci Rep, 2017, 7(1): 1-13. DOI:10.1038/s41598-016-0028-x |
| [19] |
Geng C, Nie X, Tang Z, et al. A novel serine protease, Sep1, from Bacillus firmus DS-1 has nematicidal activity and degrades multiple intestinal-associated nematode proteins[J]. Sci Rep, 2016, 6: 25012. DOI:10.1038/srep25012 |
| [20] |
Liu MJ, Hwang BS, Jin CZ, et al. Screening, isolation and evaluation of a nematicidal compound from actinomycetes against the pine wood nematode, Bursaphelenchus xylophilus[J]. Pest management science, 2018. |
| [21] |
朱丽梅, 吴小芹, 蒋萍. 细菌XS-JS3对松材线虫杀线活性的测定[J]. 南京林业大学学报:自然科学版, 2008, 32(1): 79-82. |
| [22] |
Li LL, Tan JJ, Chen FM. Bacillus pumilus strain LYMC-3 shows nematicidal activity against Bursaphelenchus xylophilus via the production of a guanidine compound[J]. Biocontrol Science and Technology, 2018, 28(12): 1128-1139. |