2. 中国水产科学研究院生物技术研究中心 农业农村部水生动物基因组学重点实验室,北京 100141
2. Key Laboratory of Aquatic Genomes, Ministry of Agriculture and Rural Affairs, CAFS Key Laboratory of Aquatic Genomics, Chinese Academy of Fishery Sciences, Beijing 100141
孕激素调控硬骨鱼类性腺发育、配子成熟和细胞增殖等重要生物过程[1-5]。目前研究认为在硬骨鱼类中类固醇激素调控作用可通过快速、非基因作用的膜受体介导,也可通过缓慢、经基因作用的核激素受体介导[6]。孕激素受体(Progesterone receptor,Pgr)属于后者,是一类以孕激素为配体的转录因子[7],介导孕激素通过基因作用。硬骨鱼类Pgr包括核激素受体域超家族和锌指结构域2个功能域。核激素受体域特异性识别并结合类固醇激素,是Pgr结合类固醇激素的功能域。锌指结构域具有DNA结合功能和转录因子活性,以识别靶基因启动子区域的孕激素响应位点并激活靶基因表达[8],是Pgr发挥转录因子作用的功能域。核激素受体域结合类固醇激素后,改变Pgr蛋白构象,使得Pgr锌指结构域能结合到靶基因序列上。
Pgr介导孕激素调控鱼类性腺发育和生殖细胞成熟[3, 9-10]。半滑舌鳎(Cynoglossus semilaevis)Pgr可诱导卵母细胞成熟[11]。雄性罗非鱼(Oreochromis niloticus)Pgr敲除后导致不育[12]。鉴于Pgr在孕激素调节鱼类生殖发育的重要作用,已有研究通过调控Pgr表达以影响鱼类生殖发育。用拮抗剂米非司酮抑制Pgr表达可阻碍罗非鱼精子发生[13]。
Pgr在大多数二倍体鱼类中仅以一个拷贝存在。在多倍体鱼类中Pgr存在多个拷贝。Lien等[14]通过全基因组测序发现大西洋鲑(Salmon salar)中存在复制Pgr基因。相比二倍体硬骨鱼类,鲤(Cyprinus carpio)具有特异的全基因组复制事件[15],导致鲤染色体数目(100条)比其他二倍体鱼类多一倍,被认为是四倍体鱼类。因此,鲤基因比其他鱼类多一份拷贝[16]。目前关于二倍体硬骨鱼Pgr的作用机制研究广泛[17-19]。但关于多倍体鱼类中复制Pgr基因的表达及功能研究尚未见报道。多拷贝Pgr基因间是否发生功能或者表达分化,彼此间在作用机制上是否存在竞争或者协同关系,这些问题尚未阐明。对多倍体鱼类Pgr开展深入研究,有助于我们进一步了解其作用机理。关于养殖鱼类生殖发育遗传调控机制研究一直是重要研究热点[20-21]。本实验克隆得到鲤两种Pgr基因,研究它们的时空表达模式和表达分化趋势,旨为研究多倍体鱼类Pgr调控生殖发育提供基础资料。
1 材料与方法 1.1 材料所用10尾鲤的14个组织样品(脑、肌肉、鳃、脾、肾、肠、胰腺、皮肤、精巢、卵巢、血液、心、眼和肝)不同时期胚胎,出膜后2 d幼苗和催产素刺激后的鲤均取自中国水产科学研究院房山基地松浦镜鲤。14个不同时期胚胎包括受精后0、0.5、1.5、2、2.5、3、4、5、7、9、11、24、36和72 h。每个发育时期收集50-60颗胚胎。采集20尾出膜后2 d幼苗。
1.2 方法 1.2.1 材料处理对亲鱼注射促黄体素释放激素2号和马来酸地欧酮(宁波第二激素厂,浙江)进行人工催产[22]。雌鱼注射剂量分别为2 mg/kg和5 μg/kg,雄鱼使用剂量为雌鱼的一半。注射上述催产素7-9 h后收集卵细胞和精液。
1.2.2 总RNA提取和cDNA合成在加有液氮的研钵中将样品研磨至粉末状后,使用Trizol(Invitrogen,美国)提取RNA。用分光光度法和琼脂糖凝胶电泳分别检测RNA的纯度、浓度和完整性。按照RevertAid First Strand cDNA Synthesis Kit试剂盒(Thermo,美国)反转cDNA第一链。
1.2.3 全长cDNA扩增和序列分析用Blastx将斑马鱼(Danio rerio)Pgr蛋白(GenBank号:NP_001159807.1)比对到鲤基因组和预测基因集(GenBank号:GCA_000951615.2)上,获得2种Pgr mRNA(GenBank号:XM_019123336.1和XM_019122667.1)。这两种基因分别位于鲤36号染色体和35号染色体。以这两条mRNA为参考,分别设计5'RACE引物和3'RACE引物(表 1)。以卵巢总RNA为模板,按照SMARTer RACE 5'/3'Kit试剂盒(Clontech,日本)方法分别获得2种基因5'RACE产物。按照3'Full RACE Core Set with PrimeScriptTM RTase试剂盒(TaKaRa,日本)获得3'RACE产物。将产物连接到pEASY-T3载体,转染到Trans1-T1,在LB培养基中筛选阳性克隆。对单克隆进行菌落PCR,产物送至上海生工测序。测序产物与上述mRNA拼接,获得cDNA全长序列。
用Blastn将Pgr1和Pgr2序列比对到对应的染色体序列上,用GSDS[23]绘制2个基因的结构图。用DNAstar 5.0.1预测Pgr1和Pgr2蛋白。用Interproscan[24]识别Pgr1和Pgr2结构功能域和预测Gene Ontology(GO)功能。
1.2.4 保守性和进化分析用Blastp分别将鲤Pgr1、Pgr2和斑马鱼Pgr两两比对,比较三者间一致性。利用ClustalW[25]构建3种蛋白间的多重序列比对,鉴定高保守区域。除鲤和斑马鱼外,选择如下物种Pgr构建进化树,包括罗非鱼、半滑舌鳎、鲫(Carassius auratus)、红鳍东方鲀(Takifugu rubripes)、亚马逊花鳉(Poecilia formosa)、青鳉(Oryzias latipes)、大西洋鳕(Gadus morhua)、三刺鱼(Gasterosteus aculeatus)、牙鲆(Paralichthys olivaceus)、人(Homo sapiens)、牛(Bos taurus)、小鼠(Mus musculus)和鸡(Gallus gallus)。用Clustal W构建多重序列比对后,用MEGA[26]构建进化树,选择Neighbor-Joining法进行1 000次bootstrap。利用PAL2NAL[27]分别计算鲤Pgr1和斑马鱼Pgr、鲤Pgr2和斑马鱼Pgr、鲤Pgr1和Pgr2间的非同义替换率与同义替换率比值,以进行种间和种内的适应性进化分析。
1.2.5 表达模式分析用实时荧光定量PCR检测Pgr1和Pgr2在组织、胚胎和催产素处理后的表达量。反应体系如下:cDNA模板(200 ng/μL)1 μL,正向引物/反向引物(10 μmol/L)各0.2 μL(表 1),SYBR®Green Real-time PCR Master Mix(Toyobo,日本)7.5 μL,加ddH2O至15 μL。每个样品设置4个技术重复。以β-actin为内参基因[28],用2-∆∆Ct法[29]相对定量基因表达,表达量用平均值±标准误(Mean±SD)来表示,用Student's t-test比较两种基因在样本的表达量。
2 结果 2.1 Pgr1、Pgr2克隆和序列分析Pgr1全长cDNA序列为2 713 bp(GenBank:MH778546),编码628个氨基酸(GenBank:BAQ02892.1)。Pgr2全长cDNA序列为2 730 bp(GenBank:MH778547),编码628个氨基酸(GenBank:BAQ02893.1)。两种基因cDNA一致性为91%,蛋白一致性为90%。Pgr1由9个外显子和8个内含子组成,长度为7 124 bp。Pgr2由8个外显子与7个内含子组成,长度为8 376 bp。蛋白结构功能域结果显示,与其他鱼类Pgr相似,Pgr1和Pgr2都有锌指结构域和核激素受体域超家族2个功能域(图 1)。Pgr1锌指结构域分布于251-340位氨基酸,核激素受体域超家族分布于381-627位氨基酸。Pgr2锌指结构域分布于251-339位氨基酸,核激素受体域超家族位于380-627位氨基酸。这两个功能域在Pgr1和Pgr2的分布位置一致。GO功能信息结果显示Pgr1和Pgr2具有转录调控功能(GO:0006355),并参与转录因子活性(GO:0003700)、类固醇激素受体活性(GO:0003707)、DNA结合(GO:0003677)和锌离子结合(GO:0008270)等生物学过程。

|
| 绿色区块为锌指结构域,蓝色区域为核激素受体域超家族 图 1 多种鱼Pgr蛋白功能域 |
进化树显示鲤Pgr1和鲫Pgr1聚为一簇,鲤Pgr2与鲫Pgr2聚为一簇。这两支再与斑马鱼Pgr聚为一大支。而其他鱼类Pgr聚为另外一大支(图 2)。这些结果表明,表明Pgr1和Pgr2出现在鲤与鲫的共同祖先种中,且晚于该祖先种和斑马鱼分化后;推测该祖先种发生全基因组复制事件。
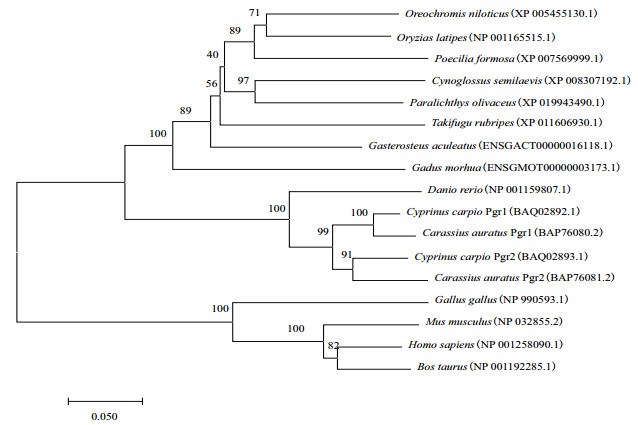
|
| 图 2 Pgr系统进化分析 |
同源序列比对显示鲤Pgr1和斑马鱼Pgr蛋白一致性为84%,Pgr2和斑马鱼Pgr蛋白一致性为82%。比对结果显示这3个基因在锌指结构域和核激素受体域区域高度保守,而非功能域的保守性较低(图 3)。适应性进化结果显示,鲤Pgr1与斑马鱼Pgr的非同义替换率与同义替换率比值为0.189,鲤Pgr2与斑马鱼Pgr的非同义替换率与同义替换率比值为0.190,鲤Pgr1与Pgr2的非同义替换率与同义替换率比值为0.360,表明Pgr1和Pgr2在种间和种内受负选择压力。

|
| 黑色表示高度保守碱基 图 3 鲤、鲫Pgr1、Pgr2与斑马鱼Pgr蛋白序列比对 |
基因组共线性结果显示(图 4),斑马鱼Pgr邻近区域和鲤Pgr1邻近区域有高保守的共线性。斑马鱼Pgr邻近区域有7个基因,包括Yap1(Yes-associated protein 1)、Cep126(Centrosomal protein of 126)、Trpc6(Transient receptor potential channel 6-like)、Arhgap42(Rho GTPase-activating protein 42-like)、Cntn5(Contactin 5-like,)、Fbxo40(F box only protein 40)和Ttc36(Tetratricopeptide repeat domain 36)。除Fbxo40外,7个基因在斑马鱼Pgr邻近区域和鲤Pgr1邻近区域呈现一致性排列。而斑马鱼Pgr基因邻近区域和鲤Pgr2基因邻近区域仅有3个基因(Trpc6、Pgr和Arhgap42)呈现一致性排列。
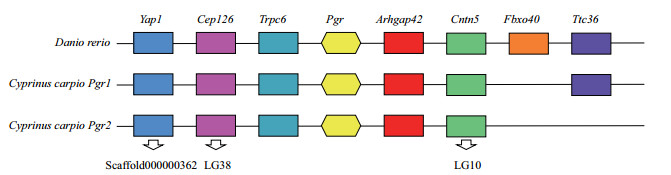
|
| Scaffold000000362、LG38和LG10表示鲤基因组序列Scaffold000000362、38号和10号染色体 图 4 鲤Pgr1、Pgr2与斑马鱼Pgr的基因组共线性 |
在14个组织的实时荧光定量PCR结果表明(图 5),Pgr1在精巢表达量最高;其次是卵巢,在鳃、肾脏和皮肤的表达量极低。Pgr2在精巢表达量最高;其次是卵巢,在眼、血液和心的表达量极低。Pgr1在精巢、卵巢、眼、血液和肠中显著高于Pgr2(P < 0.05),在脾、肌肉、肝和心的表达量略高于Pgr2。而胰腺、脑、鳃、肾和皮肤中Pgr2的表达量显著高于Pgr1(P < 0.05)。
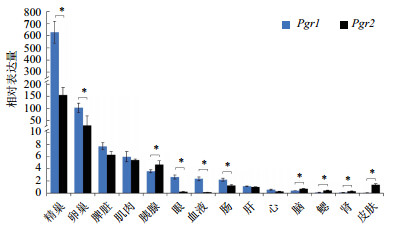
|
| *表示在同一组织下两个基因显著差异表达(P < 0.05) 图 5 不同组织中Pgr1和Pgr2的表达 |
在15个发育时期的实时荧光定量PCR结果表明(图 6),Pgr1在受精后36 h的表达量最高,其次是1.5 h和4 h的表达量。Pgr2在受精后1.5 h的表达量最高。二者的表达模式各异。Pgr1在12个时期的表达量显著高于Pgr2(P < 0.05),其余3个时期(0.5、2和24 h)也略高于Pgr2,表明在发育时期中Pgr1是主要表达基因。

|
| *表示在同一发育时期下两个基因显著差异表达(P < 0.05) 图 6 在不同发育时期Pgr1和Pgr2的表达 |
催产素诱导后的实时荧光定量PCR结果表明(图 7),Pgr1在精液的表达量最高,在卵细胞中次之,在受精卵的表达量最低。Pgr2的表达模式与Pgr1相同,在精液表达量最高,其次是卵细胞和受精卵。尽管二者在催产素诱导后表达趋势相同,但是在精液和卵细胞中Pgr1的表达量显著高于Pgr2(P < 0.05)。综合这些表达结果,推测主要是Pgr1参与催产素促进鱼类排精和产卵反应。
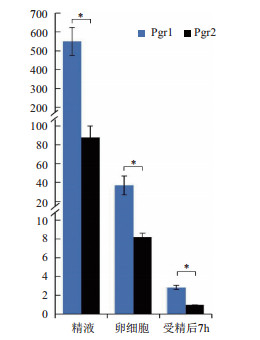
|
| *表示在同一状态下两个基因显著差异表达(P < 0.05) 图 7 在催产素诱导后Pgr1和Pgr2的表达 |
Pgr是介导孕激素调控鱼类性腺发育和生殖细胞成熟的重要转录因子[30]。它通过核激素受体域超家族结合孕激素后,使得锌指结构域构象变化,结合到目标基因启动子区域上以激活目标基因。这2个功能域是Pgr结合孕激素和发挥转录因子作用的重要结构[31]。目前对二倍体鱼Pgr的克隆、表达和功能研究比较详实[32-33],但关于多倍体鱼类Pgr表达功能研究未见报道。目前仅Lien等[14]在大西洋鲑基因组预测到两种Pgr基因。本研究克隆得到鲤两种Pgr基因,cDNA序列长度相近,蛋白序列长度相同。cDNA相似性为91%,蛋白相似性为90%,表明多倍体鱼类可能存在Pgr多个拷贝基因,而且序列一致性很高。鲤Pgr1和Pgr2包含核激素受体域超家族和锌指蛋白域。这与其他鱼类Pgr包含的功能结构域相同[33-34]。鲤Pgr1和Pgr2与斑马鱼Pgr一致性分别为84%和82%。多重比较分析结果显示,物种间Pgr的两个功能结构域高度保守,这可能与该基因在不同物种间的相似性功能有关。GO注释信息也支持这两种基因都具有类固醇激素受体活性。综合序列保守性、结构域分析和GO功能,提示这2种Pgr基因都可能介导孕激素调控鱼类性腺发育和生殖细胞成熟的反应。
为确定鲤Pgr1和Pgr2的组织表达特性,本研究采用实时荧光定量PCR技术检测它们在组织中的表达情况。结果显示Pgr1和Pgr2在精巢表达量最高,其次是卵巢。这两个组织的表达量显著高于其他组织,呈现组织特异性。这与Pgr调控性腺发育的功能相符合。该结果与目前已报道的鱼类Pgr在精巢和卵巢高表达情况一致[5, 9]。催产素刺激后Pgr1和Pgr2在精液表达量最高,其次是卵细胞,受精后表达量下降,暗示这2个基因参与催产素促进鱼类排精和产卵反应。尽管鲤Pgr1和Pgr2在序列同源性、蛋白结构域和组织表达特异性存在相似性,但是二者在基因结构、基因组共线性和表达量存在差异。Pgr1和Pgr2基因长度、外显子数量和内含子长度有较大差异。鲤Pgr1与斑马鱼Pgr的一致性更高(84%)。Pgr1邻近基因与斑马鱼Pgr基因的一致性排列更保守。这些结果暗示相比Pgr2,Pgr1的功能更接近斑马鱼Pgr。组织分布结果、发育时期表达结果以及催产素诱导表达变化显示,Pgr1在大多数状态下的表达量显著高于Pgr2,表明Pgr1是介导鱼类性腺发育和产卵排精的主表达基因。本研究发现Pgr1和Pgr2在性腺和配子中差异表达,暗示它们在调控鲤性腺发育和配子成熟的作用已经分化。这2种基因的转录调控元件是否存在变异,以及表达水平为何有差异,将是下一步研究内容。
4 结论克隆获得鲤2种Pgr基因,Pgr1和Pgr2。二者cDNA序列长度相近,核酸和蛋白质序列相似性高,均具有核激素受体域超家族和锌指蛋白域。这2个基因在进化过程中保守,与斑马鱼Pgr高度同源。组织表达谱显示,二者在性腺的表达显著高于其他组织。催产素诱导后二者在生殖细胞的表达量显著高于受精卵。这2个基因可能参与调控鲤性腺和生殖细胞成熟。但Pgr1与斑马鱼的同源性高于Pgr2,Pgr1基因组共线性比Pgr2更保守,在大部分组织、发育时期和催产素刺激后Pgr1表达量高于Pgr2,表明Pgr1是介导孕激素作用的主要基因。
| [1] |
Tsai MJ, O'Malley BW. Molecular mechanisms of action of steroid/thyroid receptor superfamily members[J]. Annu Rev Biochem, 1994, 63(1): 451-486. DOI:10.1146/annurev.bi.63.070194.002315 |
| [2] |
Wang C, Croll RP. Effects of sex steroids on gonadal development and gender determination in the sea scallop, Placopecten magellanicus[J]. Aquaculture, 2004, 238(1-4): 483-498. DOI:10.1016/j.aquaculture.2004.05.024 |
| [3] |
Chen SX, et al. Cloning, pharmacological characterization, and expression analysis of Atlantic salmon(Salmo salar L.)nuclear progesterone receptor[J]. Reproduction, 2011, 11: 491-500. |
| [4] |
Dequattro ZA, et al. Effects of progesterone on reproduction and embryonic development in the fathead minnow(Pimephales promelas)[J]. Environ Toxicol Chem, 2012, 4: 851-856. |
| [5] |
Wang CL, Liu DT, Chen WT, et al. Progestin increases the expression of gonadotropins in pituitaries of male zebrafish[J]. J Endocrinol, 2016, 230(1): 143-156. DOI:10.1530/JOE-16-0073 |
| [6] |
赖晓健, 洪万树. 介导鱼类孕激素快速、非基因作用的受体研究进展[J]. 中国水产科学, 2010, 17(1): 182-191. |
| [7] |
Aranda A, Pascual A. Nuclear hormone receptors and gene expression[J]. Physiol Rev, 2001, 81(3): 1269-1304. DOI:10.1152/physrev.2001.81.3.1269 |
| [8] |
Hill KK, Roemer SC, Churchill MEA, et al. Structural and functional analysis of domains of the progesterone receptor[J]. Mol Cell Endocrinol, 2012, 348(2): 418-429. DOI:10.1016/j.mce.2011.07.017 |
| [9] |
Hanna RN, Zhu Y. Controls of meiotic signaling by membrane or nuclear progestin receptor in zebrafish follicle-enclosed oocytes[J]. Mol Cell Endocrinol, 2011, 337(1): 80-88. |
| [10] |
Feng C, Xu S, Liu Y, et al. Progestin is important for testicular development of male turbot(Scophthalmus maximus)during the annual reproductive cycle through functionally distinct progestin receptors[J]. Fish Physiol Biochem, 2018, 44(1): 35-48. DOI:10.1007/s10695-017-0411-y |
| [11] |
史宝, 李晓晓, 柳学周, 等. 半滑舌鳎膜孕激素受体基因克隆与组织表达分析[J]. 渔业科学进展, 2014, 34(3): 61-67. |
| [12] |
Fang XL, Wu LM, Yang LY, et al. Nuclear progestin receptor(Pgr)knockouts resulted in subfertility in male tilapia(Oreochromis niloticus)[J]. J Steroid Biochem Mol Biol, 2018, 182: 62-71. DOI:10.1016/j.jsbmb.2018.04.011 |
| [13] |
Liu G, Luo F, Song Q, et al. Blocking of progestin action disrupts spermatogenesis in Nile tilapia(Oreochromis niloticus)[J]. J Mol Endocrinol, 2014, 53(1): 57-70. DOI:10.1530/JME-13-0300 |
| [14] |
Lien S, et al. The atlantic salmon genome provides insights into rediploidization[J]. Nature, 2016, 533: 200-205. DOI:10.1038/nature17164 |
| [15] |
Wang JT, Li JT, Zhang XF, et al. Transcriptome analysis reveals the time of the fourth round of genome duplication in common carp(Cyprinus carpio)[J]. BMC Genomics, 2012, 13(1): 96. DOI:10.1186/1471-2164-13-96 |
| [16] |
Larhammar D, Risinger C. Molecular genetic aspects of tetraploidy in the common carp Cyprinus carpio[J]. Mol Phylogenet Evol, 1994, 3(1): 59-68. DOI:10.1006/mpev.1994.1007 |
| [17] |
Ma Z, Yu Y, Tang S, et al. Differential modulation of expression of nuclear receptor mediated genes by tris(2-butoxyethyl)phosphate(TBOEP)on early life stages of zebrafish(Danio rerio)[J]. Aquatic Toxicology, 2015, 169: 196-203. DOI:10.1016/j.aquatox.2015.10.017 |
| [18] |
Ogiwara K, Takahashi T. Involvement of the nuclear progestin receptor in LH-induced expression of membrane type 2-matrix metalloproteinase required for follicle rupture during ovulation in the medaka, Oryzias latipes[J]. Mol Cell Endocrinol, 2017, 450: 54-63. DOI:10.1016/j.mce.2017.04.016 |
| [19] |
Chauvigne F, Parhi J, Olle J, et al. Dual estrogenic regulation of the nuclear progestin receptor and spermatogonial renewal during gilthead seabream(Sparus aurata)spermatogenesis[J]. Comp Biochem Physiol A Mol Integr Physiol, 2017, 206: 36-46. DOI:10.1016/j.cbpa.2017.01.008 |
| [20] |
Li M, Sun Y, Zhao J, et al. A tandem duplicate of anti-mullerian hormone with a missense SNP on the Y chromosome is essential for male sex determination in nile tilapia, Oreochromis niloticus[J]. PLoS Genetics, 2015, 11(11): e1005678. DOI:10.1371/journal.pgen.1005678 |
| [21] |
Chen S, et al. Whole-genome sequence of a flatfish provides insights into ZW sex chromosome evolution and adaptation to a benthic lifestyle[J]. Nat Genet, 2014, 46(3): 253-260. DOI:10.1038/ng.2890 |
| [22] |
张哲, 卢毅, 詹俊阁, 等. 红白锦鲤的人工催产及胚胎发育研究[J]. 经济动物学报, 2018, 22(1): 24-29. |
| [23] |
Hu B, Jin J, et al. GSDS 2. 0:an upgraded gene feature visualiza-tion server[J]. Bioinformatics, 2015, 31(8): 1296-1297. DOI:10.1093/bioinformatics/btu817 |
| [24] |
Finn RD, et al. InterPro in 2017-beyond protein family and domain annotations[J]. Nucleic Acids Res, 2016, 45: D190-D199. |
| [25] |
Larkin MA, Blackshields G, Brown NP, et al. Clustal W and Clustal X version 2.0[J]. Bioinformatics, 2007, 23(21): 2947-2948. DOI:10.1093/bioinformatics/btm404 |
| [26] |
Kumar S, Stecher G, Tamura K. MEGA7:Molecular evolutionary genetics analysis version 7. 0 for bigger datasets[J]. Mol Biol Evol, 2016, 33(7): 1870-1874. DOI:10.1093/molbev/msw054 |
| [27] |
Suyama M, Torrents D, Bork P. PAL2NAL:robust conversion of protein sequence alignments into the corresponding codon alignments[J]. Nucleic Acids Res, 2006, 34: W609-612. DOI:10.1093/nar/gkl315 |
| [28] |
Li XM, Song YN, Xiao GB, et al. Gene expression variations of red-white skin coloration in common carp(Cyprinus carpio)[J]. Int J Mol Sci, 2015, 16(9): 21310-21329. DOI:10.3390/ijms160921310 |
| [29] |
Schmittgen TD. Analyzing real-time PCR data by the comparative CT method[J]. Nat Protoc, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [30] |
Chen SX, Bogerd J, García-López Á, et al. Molecular cloning and functional characterization of a zebrafish nuclear progesterone receptor[J]. Biology of Reproduction, 2010, 82(1): 171-181. DOI:10.1095/biolreprod.109.077644 |
| [31] |
Zapater C, et al. Alternative splicing of the nuclear progestin receptor in a perciform teleost generates novel mechanisms of dominant-negative transcriptional regulation[J]. Gen Comp Endocrinol, 2013, 182: 24-40. DOI:10.1016/j.ygcen.2012.11.015 |
| [32] |
Zhang YT, Liu DT, Zhu Y, et al. Cloning and olfactory expression of progestin receptors in the Chinese black sleeper Bostrichthys sinensis[J]. Gen Comp Endocrinol, 2016, 230-231: 87-102. DOI:10.1016/j.ygcen.2016.03.029 |
| [33] |
Morini M, Penaranda DS, Vilchez MC, et al. Nuclear and membrane progestin receptors in the European eel:Characterization and expression in vivo through spermatogenesis[J]. Comp Biochem Physiol A Mol Integr Physiol, 2017, 207: 79-92. DOI:10.1016/j.cbpa.2017.02.009 |
| [34] |
Hanna RN, Daly SCJ, Pang Y, et al. Characterization and expression of the nuclear progestin receptor in zebrafish gonads and brain[J]. Biology of Reproduction, 2010, 82(1): 112-122. DOI:10.1095/biolreprod.109.078527 |





