间充质干细胞是一种具有自我更新和多向分化潜能的成体干细胞,可从多种组织器官(骨髓、脂肪、胎盘和脐带)中分离获得。因其缺乏独特的细胞膜表面标记,所以国际干细胞协会认为可以通过以下3个标准来辨别MSC,其中包括其生长贴壁性能、表达的一组细胞表面标志物与多向分化的潜能[1]。
目前,对人、鼠和狗等的MSC生物学特性研究较多,而关于猫MSC的生物学特性的信息较少。2002年,Martin等[2]首次从猫骨髓中分离获得MSC,通过对细胞的形态学、细胞分化能力和细胞表面标记物的研究,发现猫骨髓间充质干细胞(Bone marrow mesenchymal stem cells,BM-MSC)与啮齿类或人类来源的BM-MSC非常相似。随后不断有人从不同来源的组织中分离获得MSC。Jin等[3]研究表明猫脐带来源的间充质干细胞(Umbilical cord mesenchymal stem cells,UC-MSC)和骨髓来源的BM-MSC对神经损伤治疗是有效的。Quimby等[4]的研究发现,猫自体BM-MSC和脂肪间充质干细胞(Adipose-derived mesenchymal stem cells,AD-MSC)移植可治疗猫慢性肾脏疾病。骨髓来源的MSC的生长活性和产量受到猫年龄的影响,而AD-MSC的活性更好和细胞产量更多。由此可见,不同来源的猫MSC对疾病的治疗有一定的效果,但其机制仍需进一步的研究。本研究从猫脂肪、骨髓、脐带和胎盘等4种不同组织中提取MSC,系统地比较它们的生物学特性,为后续的临床应用筛选种子细胞。
1 材料与方法 1.1 材料 1.1.1 试验动物本实验所取得的脂肪、骨髓、羊膜、脐带均来自于一只1岁的健康母猫(家猫),体重约7 kg。取样地点于佛山科学技术学院兽医院二楼。
1.1.2 主要试剂0.25%胰蛋白酶、Ⅰ型胶原酶、磷酸缓冲液(Phosphate-buffered saline,PBS)和青霉素-链霉素双抗溶液均购自Hyclon(美国);胎牛血清购于BioInd(以色列),DMEM/LOW培养液、间充质干细胞成骨、成脂诱导液购于Cyagen(中国);CD44购自ThermoFisher(美国)、CD34和CD90购自BDPharmingenTM(美国)、CD105购自GeneTex(美国)。
1.1.3 主要仪器设备流式细胞仪购自Beckman Coulter(美国),超净工作台购自苏州净化设备有限公司(中国),HHS型电热恒温水浴锅购自上海博讯实业有限公司医疗设备厂(中国),离心机Eppendorf(德国),倒置显微镜购自OLYMPUS公司(日本),CO2培养箱购自Shel Lab公司(美国)。
1.2 方法 1.2.1 细胞的分离、培养 1.2.1.1 BM-MSC的分离、培养通过无菌术,抽取猫骨髓液0.5 mL于抗凝管中,加入2.5 mL含双抗的PBS缓冲液稀释,制成3 mL骨髓稀释液。1 500 r/min冷冻离心10 min,然后小心吸取下层血细胞,加入含1%L-谷氨酰胺、1%双抗和10%胎牛血清的DMEM中,混匀制成细胞悬液,接种至60 mm2细胞培养皿中。将细胞置于37℃、5% CO2培养箱中培养48 h后换液,以后每3 d换一次液,直到细胞长满80%-90%,进行传代。
1.2.1.2 AD-MSC的分离及培养通过无菌术,取猫皮下脂肪约拇指指甲盖大小,放于含有双抗PBS的15 mL离心管内。取到的脂肪在无菌操净台内依次用75%酒精浸泡3次,每次3 s,PBS洗2次,最后使用含双抗的PBS洗涤两次。然后剪碎约为1 mm2大小的组织块,剪碎后转移至15 mL离心管中,加入两倍体积的浓度为1 mg/mL的Ⅰ型胶原酶溶液,于37℃水浴锅中消化30 min,终止消化。消化液用200目细胞筛过滤,滤液以1 200 r/min离心5min,弃去上清液。加入含1% L-谷氨酰胺、1%双抗和10%胎牛血清的DMEM中,混匀制成细胞悬液,接种至60 mm2细胞培养皿中。将细胞置于37℃、5% CO2培养箱中培养48 h后换液,以后每3 d换一次液,直到细胞长满80%-90%,进行传代。
1.2.1.3 UC-MSC的分离及培养取刚生产的母猫产后胎盘,在无菌操净台内小心剥离脐带组织,用75%酒精浸泡3次每次3 s,再用PBS洗2次,最后使用含双抗的PBS洗涤2次。剪碎后转移至15 mL离心管中,加入5倍体积的浓度为1 mg/mL的Ⅰ型胶原酶溶液,于37℃培养箱中消化6 h,消化液用200目细胞筛过滤,滤液1 200 r/min离心5 min,弃上清,加入含1%L-谷氨酰胺、1%双抗和10%胎牛血清的DMEM中,混匀制成细胞悬液,接种至60 mm2细胞培养皿中。将细胞置于37℃、5% CO2培养箱中培养48 h后换液,以后每3 d换一次液,直到细胞长满80%-90%,进行传代。
1.2.1.4 AM-MSC的分离培养取刚生产的母猫产后,在无菌操净台内小心剥离羊膜组织,用75%酒精浸泡3次每次3 s,再用PBS洗2次,最后使用含双抗的PBS洗涤2次。剪碎后转移至15 mL离心管中,加入5倍体积的浓度为1 mg/mL的Ⅰ型胶原酶溶液,于37℃培养箱中消化1 h,消化液用200目细胞筛过滤,滤液1 200 r/min离心5min,弃上清,加入含1%L-谷氨酰胺、1%双抗和10%胎牛血清的DMEM,混匀制成细胞悬液,接种至60 mm2细胞培养皿中。将细胞置于37℃,5% CO2培养箱中培养48 h后换液,以后每3 d换一次液,直到细胞长满80%-90%,进行传代。
1.2.2 细胞生长曲线及计算倍增时间取生长良好的P3、P6和P9代数的细胞,用胰酶消化后,制成细胞悬液,以2×104个/mL的细胞密度接种0.5 mL于24孔培养板中,放置在37℃、5%CO2培养箱中培养。以后每间隔2-3 d换一次液。24 h后开始进行细胞计数,以后每间隔24 h计数一次,每次随机抽取3个孔进行计数,结果取3个孔的平均值,连续计数8 d。根据细胞计数统计的结果,以单位细胞密度作为纵坐标(个/mL),时间为横坐标来绘制生长曲线。根据公式1,计算细胞生长的倍增时间。
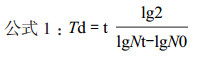
其中:t为细胞培养的时间(h),Nt是培养t时间后细胞的数量,N0是初始接种的细胞数量。
1.2.3 流式细胞仪检测细胞表面标记取P3代的4种细胞,待细胞长至80%时,用0.25%的胰酶消化、用含10%FBS的培养基终止,调整细胞数为1×106个,1 200 r/min离心5 min,弃上清,加PBS缓冲液清洗2次、1 200 r/min离心5 min。分别加入抗体CD34、CD44、CD90和CD105,室温孵育20 min,1 h内上机检测。
1.2.4 成脂成骨诱导分化 1.2.4.1 成脂诱导分化分别取P3代的4种细胞,接种到24孔板,置于38.5℃、5%CO2培养箱培养。每3 d进行换液,等到细胞融合达到80%-90%时,用吸管吸取、弃掉旧培养液,每孔加入0.5 mL的成脂诱导分化A液开始进行诱导,连续培养2 d,2 d后更换为成脂诱导分化B液,继续培养1 d,1 d后再更换为成脂诱导分化A液进行诱导,2 d后更换一次为成脂诱导分化B液,如此重复几个循环。2周后可看到脂滴,当脂滴出现较多、脂滴增大时进行油红O染色。
1.2.4.2 成骨诱导分化分别取P3代的4种细胞,接种到24孔板,置于38.5℃、5%CO2培养箱培养。每3 d进行换液,等到细胞融合达到80%-90%时,用吸管吸取、弃掉旧培养液,每孔加入0.5 mL的成骨分化液进行培养。以后每隔3 d换液一次,诱导细胞分化持续1-2周。经过1-2周的诱导后,在显微镜下观察到有钙结节形成,再进行茜素红染色。
1.3 数据分析本实验数据采用SPSS 19.0软件进行分析,两独立样本比较采用独立样本t检验,不同组间采用单因素方差分析,数据用均数±标准差表示,P < 0.05表示有显著性差异。
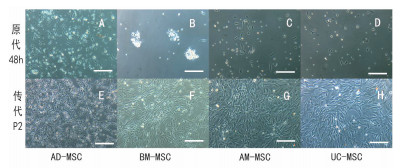
2 结果 2.1 细胞形态学观察在倒置显微镜下观察,原代细胞培养在48 h换液后,4种细胞均可以看到有细胞贴壁,大部分细胞形态呈圆形、多边形梭形,少数细胞呈不规则形状,折光性弱。
AD-MSC在第7天时,细胞融合达到90%,细胞生长时呈圆形、短梭形增殖,增殖速度较快。BM-MSC细胞在培养的前5 d可见少量的细胞死亡,在第7天时细胞融合达到90%,细胞呈长梭形、多棱形、旋涡状生长。
AM-MSC和UC-MSC的细胞,可见部分不规则胞质散大、折光性弱的细胞,在培养的过程中死细胞较多,在第12天时细胞才融合90%,且细胞胞质较大,折光性较BM-MSC和AD-MSC差(图 1)。
|
| 图 1 四种不同来源的MSC细胞生长形态(标尺=100 μm) |
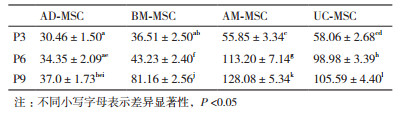
根据绘制的4种MSC的生长曲线(图 2)可知,4种细胞在接种的前2 d增殖比较缓慢。AD-MSCC和BM-MSC在第3天开始进入对数生长期,AD-MSC到P9代依然保持良好活性;P6和P9代BM-MSC在第7天进入平台期,第8天开始衰退;AM-MSC和UC-MSC的增殖速度慢,不出现对数生长期,细胞增殖呈线性生长,P6和P9代细胞在第5天开始进入平台期,第7天开始衰退。根据细胞计数结果,计算AD-MSCC、BM-MSC、AM-MSC和UC-MSC的群体平均倍增时间(表 1)。
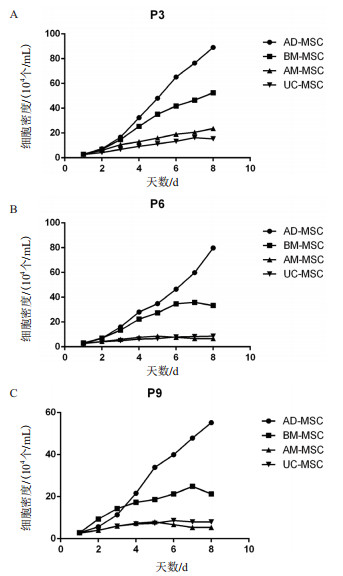
|
| 图 2 四种不同来源MSC的P3、P6和P9的生长曲线 |
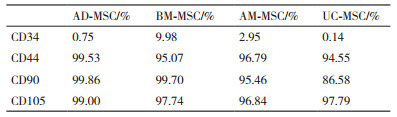
流式细胞检测结果(图 3,表 2)显示,4种细胞表面CD44、CD90和CD105均是强阳性表达,而CD34低表达。
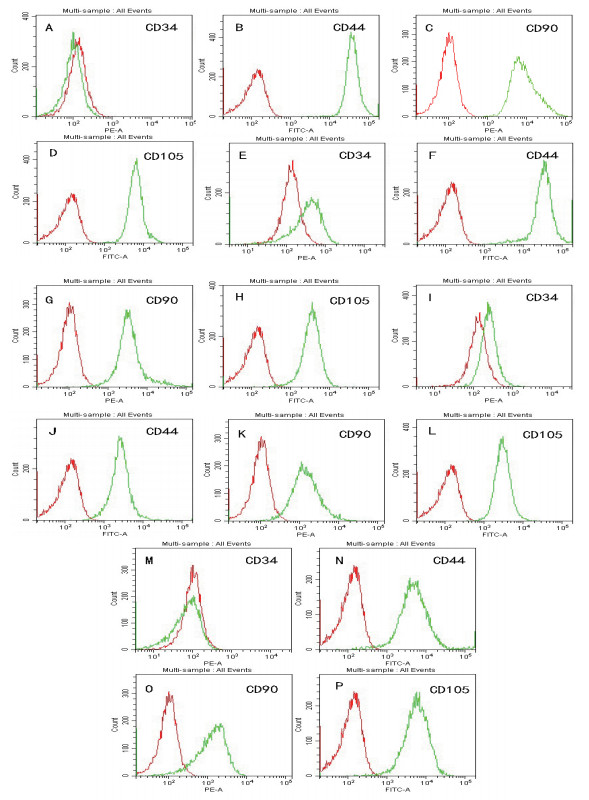
|
| A-D:AD-MSC鉴定结果;E-G:BM-MSC鉴定结果;I-L:AM-MSC鉴定结果;M-P:UC-MSC鉴定结果 图 3 四种不同来源MSC表面标记鉴定结果 |
在成骨诱导分化液的作用后,细胞形态发生变化。培养7 d后,显微镜下观察,4种细胞均能看到钙结节生成。经茜素红染色后,呈红色。BM-MSC第5天出现钙结节,出现最早,其他3种细胞出现的时间一样。
在成脂诱导分化液分化后,细胞形态发生变化。AD-MSC在分化第11天出现脂滴;BM-MSC第15天出现脂滴;UC-MSC和AM-MSC第23天出现脂滴,但脂滴较小,成脂率不高。经油红O染色液染色后,可以看到细胞中的脂滴被染成深鲜红色(图 4)。
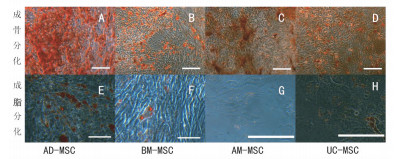
|
| A-D:成骨诱导7 d茜素红染色;E、F:成脂诱导15 d油红O染色;G、H:成脂诱导23 d油红O染色 图 4 四种不同来源MSC的成骨、成脂分化结果(标尺=100 μm) |
MSC是来自胚胎早期发育的中胚层,存在于许多组织器官,具有很强自我更新和分化能力,既有向骨、软骨、脂肪和肌肉等中胚层组织细胞分化的潜能,也有分化为外胚层的细胞和内胚层细胞的能力[5-6]。研究表明,MSC除了具有自我更新和分化的能力,还具有抗炎、免疫调节、分泌多种细胞因子、抗凋亡及促增殖等作用,在修复损伤、调节免疫、减缓器官衰老、治疗退行性疾病及支持造血系统等方面发挥重要作用,在各种疾病的预防和治疗中具有较广阔的应用前景[7-9]。随着组织工程的发展,MSC移植治疗也逐渐成为治疗疾病的一种新方式、新手段。但MSC的体外分离培养及大量扩增是临床应用的前提。因此,本文就猫不同来源的MSC的分离培养方法、细胞生长特性、多向分化性和细胞表型进行了研究。
MSC拥有诸多优点,可以成为细胞治疗的种子,但是如何获得更多、更纯、活性更好的细胞依然是研究的热点。目前,MSC的分离方法有:免疫磁珠分选法、密度梯度分选法、全骨髓贴壁法、组织消化法等[10]。本研究中,骨髓的分离采用了全血培养法,可以减少分离液等因素对细胞的伤害;其他3种细胞均采用Ⅰ型胶原酶消化法,胶原酶消化比较温和,可减少对细胞的伤害,为后续细胞的培养和生物学特性研究提供保障。对细胞生长特性分析,几种细胞的生长形态相近,以多边形、梭形等不规则图形贴壁生长,与报道的结果一致[11-13]。通过绘制生长曲线发现,AD-MSC的活性最好,增长速度最快,群体倍增时间最短,但随着传代次数的增加,细胞数和细胞的增长速度有所下降;BM-MSC的活性和增长速度次之;通过原代、传代培养及细胞生长曲线比较,我们发现AM-MSC和UC-MSC的细胞活性较差,细胞胞质相对较大,折光性差。同AD-MSC和BM-MSC相比,这些可能就是这两种细胞数较少,倍增时间较长的原因。本研究发现AD-MSC的增长活性在P3代时最好,细胞传至P9的时候仍保持良好增殖活性。有研究表明,体外培养MSC细胞可传至P20代以上,因此MSC可以在体外大量的扩增培养,可以为临床研究应用提供足量的细胞[14]。
MSC是一种分化潜能较高的中胚层细胞,对MSC的分化潜能研究主要是成骨、成脂和成软骨分化能力[15]。我们研究发现,不同组织来源的MSC的分化潜能也存在一定差异,AD-MSC和BM-MSC的成骨成脂出现时间较短;AM-MSC和UC-MSC成脂分化时间较长而且成脂率不高。这些结果提示,AD-MSC和BM-MSC的成骨成脂分化能力较强。除此之外,根据报道,不同来源的MSC表型存在很高的相似性,如表达CD29、CD44、CD 73、CD 90和CD 105等,不表达或弱表达CD 14、CD 34和CD 45[16-18]。本研究对细胞表面分子CD44、CD90、CD105和CD34进行分析,结果发现分离的4种MSC均能表达CD44、CD90、CD105,低表达CD34,该结果与报道的研究结果相一致[3-4, 11, 17]。尽管猫AD-MSC在生长能力和分化潜能上有着比其他组织来源的强,但其临床应用的优势怎样,还有待进一步研究。
4 结论本实验建立猫的脐带、羊膜、骨髓和脂肪来源的MSC的分离培养体系,并获得了具有有贴壁生长特性以及分化为成脂成骨的能力和细胞表面高表达CD105、CD90、CD44 3种细胞表面标志物,低表达CD34的MSC。4种细胞中,AD-MSC的增长活性最好,细胞传至第9代的时候依然保持良好的增殖活性,提示AD-MSC的临床应用可能比较好。
| [1] |
Dominici M, Le Blanc K, Mueller I, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The international society for cellular therapy position statement[J]. Cytotherapy, 2006, 8(4): 315-317. DOI:10.1080/14653240600855905 |
| [2] |
Martin DR, Cox NR, Hathcock TL, et al. Isolation and characterization of multipotential mesenchymal stem cells from feline bone marrow[J]. Exp Hematol, 2002, 30(8): 879-886. DOI:10.1016/S0301-472X(02)00864-0 |
| [3] |
Jin GZ, Yin XJ, Yu XF, et al. Generation of neuronal-like cells from umbilical cord blood-derived mesenchymal stem cells of a RFP-transgenic cloned cat[J]. J Vet Med Sci, 2008, 70(7): 723-726. DOI:10.1292/jvms.70.723 |
| [4] |
Quimby JM, Webb TL, Randall E, et al. Assessment of intravenous adipose-derived allogeneic mesenchymal stem cells for the treatment of feline chronic kidney disease:a randomized, placebo-controlled clinical trial in eight cats[J]. J Feline Med Surg, 2016, 18(2): 165-171. DOI:10.1177/1098612X15576980 |
| [5] |
Yang Y, Lin S, Wang B, et al. Stem cell therapy for enhancement of bone consolidation in distraction osteogenesis:A contemporary review of experimental studies[J]. Bone Joint Res, 2017, 6(6): 385-390. DOI:10.1302/2046-3758.66.BJR-2017-0023 |
| [6] |
Corradetti B, Taraballi F, Martinez JO, et al. Hyaluronic acid coatings as a simple and efficient approach to improve MSC homing toward the site of inflammation[J]. Sci Rep, 2017, 7(1): 7991-8002. DOI:10.1038/s41598-017-08687-3 |
| [7] |
Lee SH, Setyawan E, Choi YB, et al. Clinical assessment after human adipose stem cell transplantation into dogs[J]. J Vet Sci, 2018, 19(3): 452-461. DOI:10.4142/jvs.2018.19.3.452 |
| [8] |
方佳, 魏于栋, 张仕强, 等. 间充质干细胞疗法应用于宠物临床的现状及问题(英文)[J]. 农业生物技术学报, 2016, 24(9): 1398-1410. |
| [9] |
Zou X, Jiang K, Puranik AS, et al. Targeting murine mesenchymal stem cells to kidney injury molecule-1 improves their therapeutic efficacy in chronic ischemic kidney injury[J]. Stem Cells Transl Med, 2018, 7(5): 394-403. DOI:10.1002/sctm.17-0186 |
| [10] |
刘洋.犬脐带和大熊猫骨髓来源间充质干细胞的分离培养和分化潜能的初步研究[D].雅安: 四川农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10626-1013157410.htm
|
| [11] |
Parys M, Kruger JM, Yuzbasiyan-Gurkan V. Evaluation of immunomodulatory properties of feline mesenchymal stem cells[J]. Stem Cells Dev, 2017, 26(10): 776-785. DOI:10.1089/scd.2016.0041 |
| [12] |
Rutigliano L, Corradetti B, Valentini L, et al. Molecular characterization and in vitro differentiation of feline progenitor-like amniotic epithelial cells[J]. Stem Cell Res Ther, 2013, 4(5): 133-147. DOI:10.1186/scrt344 |
| [13] |
Iacono E, Cunto M, Zambelli D, et al. Could fetal fluid and membranes be an alternative source for mesenchymal stem cells(MSCs)in the feline species? A preliminary study[J]. Vet Res Commun, 2012, 36(2): 107-118. DOI:10.1007/s11259-012-9520-3 |
| [14] |
张权, 张亚奇, 饶巍, 等. 长期传代培养对人脐带间充质干细胞生物学特性的影响[J]. 中国细胞生物学学报, 2019, 41(1): 42-52. |
| [15] |
Isakson M, de Blacam C, Whelan D, et al. Mesenchymal stem cells and cutaneous wound healing:current evidence and future potential[J]. Stem Cells Int, 2015, 2015: 831095-831107. |
| [16] |
Wexler SA, Donaldson C, Denning-Kendall P, et al. Adult bone marrow is a rich source of human mesenchymal 'stem' cells but umbilical cord and mobilized adult blood are not[J]. Br J Haematol, 2003, 121(2): 368-374. DOI:10.1046/j.1365-2141.2003.04284.x |
| [17] |
Gomez MC, Qin Q, Biancardi MN, et al. Characterization and multilineage differentiation of domestic and black-footed cat mesenchymal stromal/stem cells from abdominal and subcutaneous adipose tissue[J]. Cell Reprogram, 2015, 17(5): 376-392. DOI:10.1089/cell.2015.0040 |
| [18] |
Wu M, Zhang R, Zou Q, et al. Comparison of the biological characteristics of mesenchymal stem cells derived from the human placenta and umbilical cord[J]. Sci Rep, 2018, 8(1): 5014-5022. DOI:10.1038/s41598-018-23396-1 |