2. 农业部农业转基因生物安全评价(食用)重点实验室,北京 100083
2. Key Laboratory of Safety Assessment of Genetically Modified Organism(Food Safety), the Ministry of Agriculture of the P.R. China, Beijing 100083
目前待检物质种类繁多,样品复杂,针对不同待检物质的定量检测方法不一。检测重金属离子采用的主要方法是原子吸收法[1]、电感耦合等离子体原子发射光谱法[2]及电感耦合等离子体质谱[3]等;针对农药、生物毒素、食品添加剂等污染物的检测主要是采用液相色谱[4]、气相色谱-质谱联用等方法[5]、液相色谱-质谱联法,各种传统定量检测方法可以准确测定目标检测物的含量,但无法对不同种类的待检物质进行统一的检测,而功能核酸的出现与其相关技术的发展可有效地解决这一问题。功能核酸作为一类具有特定空间构象、执行特异生物功能的天然或者人工核酸序列,可以将各种待检物质统一转化为核酸信号再结合功能核酸相关检测方法进行检测。另外,还具有易于修饰、价格低廉、稳定性高及特异性强等优势。功能核酸检测技术分为靶标识别、信号转换输出两部分。信号输出的方式包括比色信号、荧光信号、电化学信号、化学发光信号、热信号及动力学信号等。
其中,荧光传感具有灵敏度高、特异性强以及可进行实时原位检测的优势,而标记型荧光传感又是荧光传感中最重要的一部分,结合功能核酸后,更扩大和增强了其检测灵敏度、检测范围与检测效率[6-7],逐渐被广泛应用于食品安全、环境污染、疾病诊断相关多种靶标物质的检测[8]。功能核酸在功能核酸荧光标记型定量统一化检测技术中起到的重要作用主要体现在两个方面,一是可将多种靶物质统一转为较为稳定的核酸信号,使现有的荧光检测的可检靶物质种类增多,扩大检测范围;二是由于功能核酸本身可扩增的性质,可以在定量检测中加入信号扩增,使得检测灵敏度以及检测效率大大增强。
不同的荧光标记型材料与功能核酸结合后具有不同的发光、猝灭性质,其发光机制也不尽相同,本文针对不同荧光物质与功能核酸结合的特点将功能核酸荧光标记型定量统一化检测技术分为荧光标记型线性功能核酸探针介导的荧光定量检测技术,荧光标记型非线性功能核酸探针介导的荧光定量检测技术,荧光标记型功能核酸双探针介导的荧光定量检测技术,并从这几个角度对功能核酸荧光标记型定量统一化检测技术与其实际应用进行了分类介绍与评价对比,最后讨论了该技术在多种风险因子分析中的研究意义以及存在的问题,并为其未来的发展方向与应用前景作出展望。
1 功能核酸荧光标记型定量统一化检测技术概述及其分类荧光定量检测技术是以紫外或可见光作为激发光源,照射处于基态的分子,使其吸收能量,跃迁至激发态,进而由于激发态不稳定激发态物质分子返回基态过程会散失部分能量,这部分能量转化光能,这种光被称为荧光,即可利用与检测的荧光信号[9-10]。荧光定量检测技术广义上是由识别部分、转化部分以及荧光物质部分构成,其检测原理是待检测物被识别部分与转化部分特异性识别、结合、相互作用并转化为可引起荧光物质敏感的信号[11],进而导致其光物理性质发生变化,主要包括荧光的增强、淬灭和光谱位移等。
通常,在荧光标记型功能核酸介导的荧光定量检测系统的构建过程中,需要在核酸分子上面标记荧光物质,这些用于标记的荧光物质可分为荧光素类[12-13]、罗丹明类[14-15]、氟硼类染料(BODIPY)[16]、香豆素类[17]、萘酰亚胺、芘类[18-19]、萘类[20]、蒽类及新型荧光物质等,根据检测对象的特点选择不同的荧光报告基团以共价键形式标记在核酸上,这些被荧光标记后的核酸分子作为核酸分子荧光探针在生物传感过程中起到分子识别以及荧光信号报告等功能,根据其荧光发光特点可以将荧光标记型功能核酸介导的荧光生物传感技术分为Light-up(点亮型)探针介导的荧光定量检测技术、Scorpions primer(蝎子型)探针介导的荧光定量检测技术等。
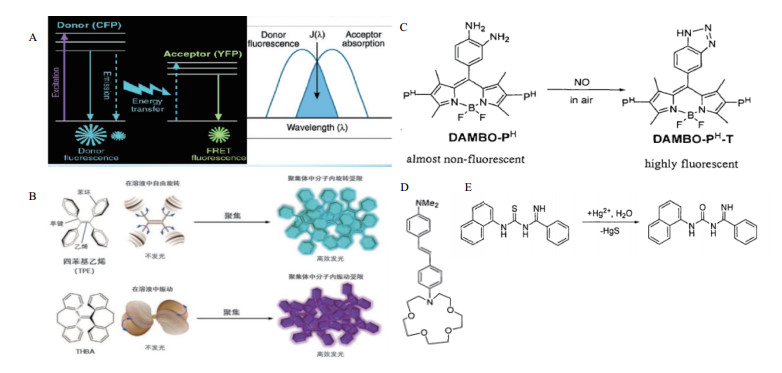
2 标记型荧光定量检测技术几种重要发光机制以及与核酸结合的典型应用 2.1 荧光共振能量转移荧光共振能量转移(Fluorescence resonance energy transfer,FRET)是指一个体系含有能量供体与能量受体两个荧光团,在供体被激发后可以向受体发生能量转移,进而受体发出荧光[21]。该机理对供体和受体的激发和发射光谱、两者间的距离和排列方式皆有一定要求[22-23],可应用于多种形式的荧光探针中。例如,Shamsipur等[24]基于荧光与猝灭基团的荧光共振能量转移现象,开发了一种荧光探针介导的针对目标靶序列检测的生物传感器(图 1-A)。
|
| 图 1 荧光共振能量转移(A)聚集诱导发光(B)光诱导电子转移(C)分子内电荷转移(D)化学发光(E)机理图 |
激发态缔合物(Excimer,简称Er)和激发态复合物(Exicplex,简称Ex)分别指激发态荧光基团与相同的和不同的基态荧光基团复合。激发态复合物与缔合物的发射光谱与基态相比,会产生红移,同时其发射峰呈现强而宽且无精细结构的状态。蒽(anthracene)[25-26]和芘(pyrene)[27]等多环芳烃荧光团常用于此类探针的设计。例如,末端标有芘分子核酸发卡探针常被设计到高灵敏检测靶标物质的荧光定量检测技术中[28-29]。
2.3 聚集诱导发光基于聚集诱导发光(Aggregation-Induced emis-sion,AIE)的荧光分子是一类具有螺旋结构的分子,具有游离状态不发荧光,聚集状态发生较强荧光的性质[30]。具体机理是当这类分子以单体游离态被激发光激发后,被激发电子以分子内振动旋转形式回到基态,不产生荧光;聚集时,被激发的电子无法通过分子内振动旋转释放能量回到基态,而通过辐射方式释放多余能量,产生荧光。该类荧光分子可以很巧妙的结合分子溶解性来进行荧光传感策略的设计,具有信噪比高、抗漂白能力强的特点[31](图 1-B)。
2.4 上转换发光上转换纳米材料(Upconversion luminescence,UCL)具有优异的光学性能,它能克服传统发光材料的多种不足,尤其是其激发波长位于近红外区,可以将低频率激发光转换成高频率发射光,即吸收多个低能光子使其到达高的激发态并最终发射出一个高能光子的现象,也称为多光子发光。以UCNPs作为标记材料可有效避免生物样品的自体荧光和光散射,大大提高了检测的灵敏度,UCNPs与DNA分子相结合可构建DNA荧光纳米探针,在生物领域具有巨大的应用潜力[33]。2006年,Wang等[34]利用Yb3+/Er3+离子对共掺NaYF4纳米晶体,并结合磁场力分离技术对靶标DNA进行检测。
2.5 光诱导电子转移光诱导电子转移(Photo-induced electron tran-sfer,PET)[35]是指电子给体或电子受体的电荷在激发光的作用下发生电子给予或者电子接收的过程,该过程会阻碍荧光基团的电子从激发态返回基态的过程,引起荧光淬灭,若结合待检测物质时,荧光团被氧化或还原,可以阻止光诱导电子转移过程,使得荧光团恢复荧光,常用于荧光增强型传感器设计,Nagano课题组就基于PET过程构建了可以识别一氧化氮及单线态氧的荧光探针(图 1-C)。
2.6 分子内电荷转移分子内电荷转移,也称作光致电荷转移(Photo-induced charge transfer,PCT)指分子在激发光的激发下,电子在分子内部发生转移,形成正负电荷分离的状态[36]。荧光物质以耦合形式连接着给电子和吸电子集团,π键可作为电子转移通道,其中电子所受的力越强,分子内电荷转移效益就越强,荧光强度越强,光谱波长越长,当待检测物分别与吸电子基团和给电子基团结合时,分别会使分子内电荷转移效应增强和减弱,光谱波长红移和蓝移。例如,图 1-D分子探针的识别基团是其电子受体,分子中的氮杂冠醚与二甲氨基都是电子给体,冠醚和钙离子络合后,冠醚吸电子能力显著变强,荧光随之红移。
2.7 化学发光化学发光(Chemical emission)是指物质在进行化学反应过程中发生的一种光辐射现象。两种可发生自发反应的物质反应后所释放的能量激发另一类物质从基态跃迁至激发态,部分能量以辐射形式释放出来,形成荧光。例如,图 1-E反应型汞离子分子荧光探针在溶液中与汞离子结合后其荧光强度增至34倍之多,并伴随有光谱红移,经检测发现反应后可得到脱硫化合物。
3 荧光标记型线性功能核酸探针介导的荧光定量检测技术这类核酸链标记型功能核酸荧光定量检测技术是基于标记荧光基团或猝灭基团的线性单链核酸探针。其原理是在靶标物质的介导下,核酸探针结构发生变化,引起荧光基团与核酸探针或者荧光基团与猝灭基团间距离、状态的变化,再导致荧光信号的变化,通过检测这种荧光信号的变化定量检测靶标物质,该类荧光定量检测技术可分为Light-up(点亮型)探针介导型、线性单标记探针介导型与线性双标记探针介导型等典型类型。
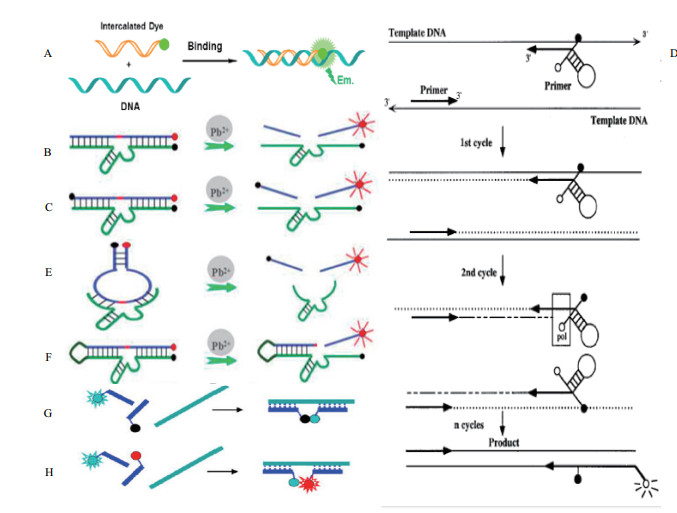
3.1 Light-up(点亮型)探针介导的荧光定量检测技术Light-up探针是一种单标记型核酸探针,可应用于定量PCR中,其特性是,游离状态时,该类探针中不对称花青染料噻唑橙,其中,两个芳香族体系可以围绕相互连接的亚甲基旋转,物质从激发态回到基态以旋转动能释放多余能量,荧光微弱;芳香族部分被外力如结合另一条核酸链时,变为几何平面结构,分子内无法旋转,多余能量会以辐射能的形式释放,转为光能,荧光增强,该类荧光分子可以很巧妙的结合分子溶解性来进行荧光传感策略。Svanvik等[32]报道了一种以标记有噻唑橙染料的7-9个碱基的肽核酸Light-up探针在实时定量PCR检测中的应用,其选用的电中性核酸模拟物肽核酸比普通探针与靶DNA结合的更快更稳定,在检测时,将体系加入到实时普通PCR体系中,每轮扩增过程后,在靶物质存在时,荧光探针可与再次退火的热变性模版竞争结合,每次退火过程后在波长是470 nm的激发光和波长为530 nm的发射光的条件下进行荧光强度的读数,达到实时定量监测PCR过程中产生的特定扩增产物的目标(图 2-A)。
|
| 图 2 荧光标记型功能核酸介导的荧光定量检测技术原理图 |
这类核酸链标记型功能核酸荧光定量检测技术的检测原理是基于单荧光基团与单猝灭基团的荧光共振转移原理,通过所标记的核酸结构改变或通过核酸扩增而改变淬灭基团与荧光基团的距离引起两者间的荧光共振转移现象的发生或停止,进而引起荧光信号的变化。Li和Lu等[37]于2000年报道了一种用于检测铅离子的TAMRA单标记功能核酸荧光定量检测技术。该传感器设计了一条5' 端以共价键形式标有TAMRA荧光基团的20个碱基的8-17DNAzyme底物链(其中切割部位为一个RNA碱基)与一条3' 端标有Dabcyl猝灭基团的含有34个碱基的8-17DNAzyme酶链,在没有铅离子存在以及解链温度高于室温的情况下,该条底物链会通过Waston-Crick键碱基对与其酶链相连,呈惰性。另外,在猝灭基团的猝灭作用下体系成低荧光状态。环境pH为6,当铅离子存在时,8-17DNAzyme被激活,催化切割底物链,使其接连温度变低在室温下呈不稳定状态,进而标有荧光基团的底物链从酶链脱离,同时与标有猝灭基团的序列分离,荧光基团重新发出荧光,荧光倍数为猝灭时的3-4倍,该种荧光的激发光波长为560 nm,发射波长为580 nm。测试结果表明该种DNA传感器的检出限为10-8 mol/L。此后,另一种铅离子GR-5 DNAzyme也被应用于荧光定量检测技术并显示出更好的选择性(图 2-B)。
3.3 线性双标记探针介导的荧光定量检测技术为了提高线性标记探针介导的荧光定量生物传感器的相关性能,研究者引入一个以上的淬灭基团建立了线性双标记探针介导的荧光定量检测系统,以增加传感器的猝灭效率,降低检测系统的荧光背景值。Lan等[38]针对铅离子检测,设计了一种双标记功能核酸FAM荧光传感器,其设计了一条5' 端以共价键形式标有FAM荧光基团的含20个碱基的8-17DNAzyme底物链与一条3' 端标有Dabcyl猝灭基团的含有34个碱基的8-17 DNAzyme酶链,并且在底物链的3' 端加标了一个猝灭基团,以降低底物链未切割时的荧光背景值。该实验的实验条件为pH为7.2的50 mmol/L HEPES的缓冲液,其原理与线性单标记探针介导的荧光定量检测技术相似,最适检测温度为15-25℃,检出限为10-8 mol/L(图 2-C)。
4 荧光标记型非线性功能核酸探针介导的荧光定量检测技术这类核酸链标记型功能核酸荧光定量检测技术是基于标记荧光基团或猝灭基团的非线性单链核酸探针,与荧光标记型线性功能核酸介导的技术的主要区别在于体系内核酸结构的不同,呈发卡型、蝎子型等非线性形状。其原理同样是在靶标物质的介导下,核酸探针的结构发生变化,引起荧光基团与核酸探针或者荧光基团与猝灭基团间距离、状态的变化,再导致荧光信号的改变,通过检测这种荧光信号的变化定量检测靶标物质。该类荧光定量检测技术包括Scorpions primer探针介导型、Amplifluor primer(引物特异型)探针介导型与Hairpin Probe(发卡探针型)介导型等典型类型。
4.1 Scorpions primer(蝎子引物型)探针介导的荧光定量检测技术Scorpions primer是一种在5' 端标记有一段防止5' 端延伸的核酸尾链的引物探针,这种探针可以与经过引物探针尾部延伸的同体分子靶序列互补配对,因为探针—靶物质的结合对二次退火和链内二级结构的支持,这种分子内部结合的速度缩短了反应过程中的平衡时间,使得信号技术十分满足快速检测的要求。Whitcombe等[39]利用这种蝎子型自扩增探针检测了PCR产物,同样,这种探针包含了由50个左右碱基,5' 延伸部分,荧光猝灭分子对,以及一段自互补茎序列组成,这种蝎子型探针比普通探针与靶DNA结合的更快更稳定。在检测时,将体系加入到实时普通PCR体系中,每轮扩增过程后,在靶物质存在时,荧光探针可与再次退火的热变性模版竞争结合,每次退火过程后进行荧光强度的读数,达到荧光实时定量检测的目的。
4.2 Amplifluor primer(引物特异型)探针介导的荧光定量检测技术Uehara等[40]介绍了一种基于引物特异型探针的荧光共振能量转移原理针对端粒酶闭管型检测方法。该引物特异型探针包含了3' 端和端粒重复靶序列互补配对的序列,5' 端一个标有荧光基团和猝灭基团的发卡状的41 nt长的核酸序列,发卡结构与端粒酶重复序列没有同源部分,结构稳定。该实验通过检测端粒酶重复序列对端粒酶活性进行检测,检测时,在端粒酶具有活性时,随着端粒酶的加入,底物序列的3' 端开始30℃延伸端粒酶重复序列30 min,接着加入引物特异型序列,进行30轮的94℃热变性30 s和59℃的30 s PCR扩增过程,当其与端粒酶重复序列互补的序列段与端粒酶重复序列结合时,其发卡结构打开,荧光基团与猝灭基团被分离,发射荧光;当端粒酶序列不存在时,引物特异性探针内的发卡结构保持发卡状态,荧光基团与猝灭基团发生荧光共振能量转移,荧光被猝灭,通过对后续PCR扩增循环过程的荧光强度的监测实现对端粒酶实时监测的目标(图 2-D)。
4.3 Hairpin Probe(发卡探针型)介导的荧光定量检测技术为了提高标记探针介导的荧光定量生物传感器的相关性能,研究者将检测系统中用到的功能核酸的结构进行优化,加强底物链与酶链之间的结合率,降低检测时的背景值。Wang和Nagraj等[41-42]将8-17 DNAzyme酶链与底物链设计成一条发卡状核酸链以加强其结合率,Wang等同时将FAM荧光基团与猝灭基团标记于核酸链的两端,该段探针包含60左右个碱基,其中包含10个连续的胸腺嘧啶,检测条件为pH为7.2的50 mmol/L HEPES缓冲液与100 mmol/L NaCl溶液,其原理与线性单标记探针介导的荧光定量检测技术相似,该传感器的检测限可达到2 nmol/L(图 2-E,2-F)。
5 荧光标记型功能核酸双探针介导的荧光定量检测技术这类核酸链标记型功能核酸荧光定量检测技术是基于标记荧光基团或猝灭基团的功能核酸双探针,该种荧光标记型功能核酸双探针介导的荧光定量检测技术最大的特点是在该体系中含有两条荧光基团或者猝灭基团标记的功能核酸探针,其原理是在靶标物质的介导下,两条核酸探针的相对状态、结构发生变化,引起荧光基团与核酸或者荧光基团与猝灭基团间距离、状态的变化,再导致荧光信号的变化,通过检测这种荧光信号的变化定量检测靶标物质,该类荧光定量检测技术包括猝灭型双探针介导型、荧光共振能量转移型双探针介导型等典型类型。
5.1 猝灭型双探针介导的荧光定量检测技术猝灭型双探针(Binary probe)介导的荧光定量检测技术含有两条单标记探针,基于荧光猝灭原理,两条探针设计时可以在特定结合位点与靶序列互补配对或与靶序列进行竞争结合,当靶信号存在时,两探针所标记的荧光信号相关物质可以发生荧光产生,荧光猝灭,荧光波长改变等荧光信号的变化,达到检测目的。Heller等[43]设计了一种双探针介导的荧光定量检测技术,他们利用两条分别在3' 端和5' 端标记荧光基团和猝灭基团的可与靶序列互补配对的探针,当其与扩增后的靶序列结合时,两段探针上的荧光基团和猝灭基团足够靠近,发生荧光猝灭,产生荧光信号。该探针在10个碱基至10 000个碱基的区间都可以实现结合,当碱基数少于10个时,探针结合不稳定,在低于20℃时会发生解离,当碱基数大于10 000个时,结合过程时间过长(图 2-G)。
5.2 荧光共振能量转移型双探针介导的荧光定量检测技术荧光共振能量转移型双探针介导的荧光定量检测技术基于荧光共振能量转移原理,两条探针设计时一条上边进行能量供体标记,一条进行能量受体标记,可以在特定结合位点与靶序列互补配对或与靶序列进行竞争结合,检测机理与上述猝灭型相似。在理想的双探针检测中,供体的激发光仅仅可以在靶标物质不存在时候激发供体发荧光,在靶标物质存在时,供体不发荧光仅受体发荧光,但也由于激发光的直接激发,使得该系统荧光共振能量转移效率降低了信号/背景荧光比例,而这一问题被由Marti等[44]报道的三荧光基团探针系统有效解决,这一系统基于FAM-TAMRA-Cy5荧光共振能量转移原理对mRNA进行检测,这3种荧光物质的发射检测波长分别为518 nm、581 nm和667 nm,该系统中一条探针标记着被4个碱基对隔开的FAM和TAMRA基团,第二条被Cy5所标记,在靶标DNA存在时,FAM能且仅能与TAMRA发生荧光共振能量转移,当探针与靶标DNA结合时,TAMRA可与Cy5发生有效的荧光共振能量转移,结果导致产生Cy5的荧光产生以及TAMRA荧光的减少,这种原理可以有效地提高信号/背景荧光比值(图 2-H)。
6 总结与展望功能核酸荧光标记型定量统一化检测技术是一种具有高灵敏度,高特异性,甚至具有实时特性的分子检测技术,目前在食品、临床、环境多种检测检测领域具有重要的应用意义。但是,现阶段仍存在一些局限性问题,如在荧光物质标记方面,部分标记型荧光物质的标记技术仅局限在特定碱基上,无法进行多种碱基的检测与标记;有一部分具有优良发光、猝灭荧光性质的荧光物质在功能核酸上的标记技术不够成熟,仍停留在实验室研究,未进入产业化阶段。在标记型荧光核酸传感策略的设计方面,部分传感策略对荧光物质和核酸结构变化的要求较为严格,只能实现在特定环境中对特定物质的检测,无法实现通用型检测;传感性能还有待优化和完善,如荧光背景值过高、重复性不够强、检测时间过长等问题。因此,需要针对荧光物质、荧光传感思路、荧光性能优化等方面进一步探索和思考,如通过对相关物质发光机制、结构特性等方面的探究,开发、合成性能更佳的荧光物质。同时,结合物质发光特点更巧妙地设计在标记型荧光传感系统中,并优化荧光物质与功能核酸的标记方式,使其结合程度更符合我们实验的要求;针对功能核酸标记型荧光传感设计时,可以考虑检测靶标物质的通用性,将原来一种荧光传感策略设计成一类或多类的通用型传感策略。另外,开发更高灵敏度,重复性更好的高通量实时传感技术也是功能核酸荧光标记型定量统一化检测技术的重要研究方向。
| [1] |
杨赵伟, 曹秀梅, 闫玉杰, 等. 微波消解-原子吸收法测定貉肉中重金属含量[J]. 现代畜牧兽医, 2016(2): 5-9. DOI:10.3969/j.issn.1672-9692.2016.02.002 |
| [2] |
周西林, 王娇娜, 刘迪, 等. 电感耦合等离子体原子发射光谱法在金属材料分析应用技术方面的进展[J]. 冶金分析, 2017, 37(1): 39-46. |
| [3] |
Beauchemin D. Inductively coupled plasma mass spectrometry[J]. Encyclopedia of Spectroscopy & Spectrometry, 2007, 18(7): 1345-1346. |
| [4] |
Liu W, Smith DI, Rechtzigel KJ, et al. Denaturing high-performance liquid chromatography(DHPLC)used in the detection of germline and somatic mutations[J]. Nucleic Acids Research, 2016, 26(6): 1396-1400. |
| [5] |
Purcaro G, Barp L, Beccaria M, et al. Characterisation of minor components in vegetable oil by comprehensive gas chromatography with dual detection[J]. Food Chemistry, 2016, 212: 730-738. DOI:10.1016/j.foodchem.2016.06.048 |
| [6] |
Alsaafin A, Mckeague M. Functional nucleic acids as in vivo metabolite and ion biosensors[J]. Biosensors & Bioelectronics, 2017, 94: 94-106. |
| [7] |
Du Y, Dong S. Nucleic acid biosensors:Recent advances and perspectives[J]. Analytical Chemistry, 2017, 89(1): 189-215. DOI:10.1021/acs.analchem.6b04190 |
| [8] |
Liu J, Cao Z, Lu Y. Functional nucleic acid sensors[J]. Chemical Reviews, 2009, 109(5): 1948-1998. |
| [9] |
Zhang H, Zhang H, Aldalbahi A, et al. Fluorescent biosensors enabled by graphene and graphene oxide[J]. Biosensors and Bioelectronics, 2017, 89: 96-106. DOI:10.1016/j.bios.2016.07.030 |
| [10] |
Asnaashari M, Kenari RE, Farahmandfar R, et al. Fluorescence quenching biosensor for acrylamide detection in food products based on double-stranded DNA and gold nanoparticles[J]. Sensors & Actuators B Chemical, 2018, 265: 339-345. |
| [11] |
Jeong J, Le TT, Kim HD. Single-molecule fluorescence studies on DNA looping[J]. Methods, 2016, 105: 34-43. DOI:10.1016/j.ymeth.2016.04.005 |
| [12] |
Ali A, Kamra M, Roy S, et al. Enhanced G-Quadruplex DNA stabilization and telomerase inhibition by novel fluorescein derived salen and salphen based Ni(Ⅱ) and Pd(Ⅱ) complexes[J]. Bioconjug Chem, 2017, 28(2): 341. DOI:10.1021/acs.bioconjchem.6b00433 |
| [13] |
Weng H, Yan B. A Eu(Ⅲ) doped metal-organic framework conjugated with fluorescein-labeled single-stranded DNA for detection of Cu(Ⅱ) and sulfide[J]. Analytica Chimica Acta, 2017, 988: 89. DOI:10.1016/j.aca.2017.07.061 |
| [14] |
Fang C, Agarwal A, Buddharaju KD, et al. DNA detection using nanostructured SERS substrates with Rhodamine B as Raman label[J]. Biosensors & Bioelectronics, 2008, 24(2): 216-221. |
| [15] |
Bhowmick R, Islam ASM, Saha U, et al. Rhodamine based turn-on chemosensor for Fe3+ in aqueous medium and interactions of its Fe3+ complex with DNA[J]. New Journal of Chemistry, 2018, 42(20): 3435-3443. |
| [16] |
Gupta G, Das A, Junseong L, et al. Self-assembled BODIPY-based iridium metallarectangles:Cytotoxicity and propensity to bind biomolecules[J]. Chempluschem, 2018, 83(5): 339-347. DOI:10.1002/cplu.201800035 |
| [17] |
Yeap GY, Hrishikesan E, Chan YH, et al. A new emissive chalcone-based chemosensor armed by coumarin and naphthol with fluorescence "turn-on" properties for selective detection of F- ions[J]. Journal of Fluorescence, 2016, 27(1): 1-6. |
| [18] |
Aparin I, Proskurin GV, Golovin AV, et al. Fine tuning of pyrene excimer fluorescence in molecular beacons by alteration of the monomer structure[J]. Journal of Organic Chemistry, 2017, 82(19): 10015. DOI:10.1021/acs.joc.7b01451 |
| [19] |
Kim D, Amos R, Gauthier M, et al. Application of pyrene fluorescence to the characterization of hydrophobically modified starch nanoparticles[J]. Langmuir, 2018, 34(29): 8611-8621. DOI:10.1021/acs.langmuir.8b01591 |
| [20] |
Ren RXF, Chaudhuri NC, Paris PL, et al. Naphthalene, phenanthrene, and pyrene as DNA base analogues:synthesis, structure, and fluorescence in DNA[J]. Journal of the American Chemical Society, 1996, 27(48): 7671-7678. |
| [21] |
Zheng X, Peng R, Jiang X, et al. Fluorescence resonance energy transfer-based DNA nanoprism with a split aptamer for ATP sensing in living cells[J]. Analytical Chemistry, 2017, 89(20): 10941-10947. DOI:10.1021/acs.analchem.7b02763 |
| [22] |
Shigeto H, Nakatsuka K, Ikeda T, et al. Continuous monitoring of specific mRNA expression responses with a fluorescence resonance energy transfer-based DNA nano-tweezer technique that does not require gene recombination[J]. Analytical Chemistry, 2016, 88(16): 7894-7898. DOI:10.1021/acs.analchem.6b02710 |
| [23] |
Chen Y, Chen L, Ou Y, et al. Enzyme-free detection of DNA based on hybridization chain reaction amplification and fluorescence resonance energy transfer[J]. Sensors & Actuators B Chemical, 2016, 233: 691-696. |
| [24] |
Shamsipur M, Nasirian V, Mansouri K, et al. A highly sensitive quantum dots-DNA nanobiosensor based on fluorescence resonance energy transfer for rapid detection of nanomolar amounts of human papillomavirus 18[J]. Journal of Pharmaceutical & Biomedical Analysis, 2017, 136: 140. |
| [25] |
Duprey JH, Bullen GA, Zhao ZY, et al. Single site discrimination of cytosine, 5-methylcytosine and 5-hydroxymethylcytosine in target DNA using anthracene-tagged fluorescent probes[J]. Acs Chemical Biology, 2016, 11(3): 717-721. DOI:10.1021/acschembio.5b00796 |
| [26] |
Mondal S, Pakhira B, Blake AJ, et al. Co(Ⅲ)and Ni(Ⅱ)complexes of an anthracene appended aroyl hydrazone:Synthesis, crystal structures, DNA binding and catecholase activity[J]. Polyhedron, 2016, 117: 327-337. DOI:10.1016/j.poly.2016.05.052 |
| [27] |
Šmidlehner T, Badovinac M, Piantanida I. Pyrene-cyanine conjugates as multipurpose fluorescent probes for non-covalent recognition of ds-DNA, RNA and proteins[J]. New Journal of Chemistry, 2018, 42: 6655-6663. DOI:10.1039/C8NJ00055G |
| [28] |
Huang J, Wu Y, Chen Y, et al. Pyrene-excimer probes based on the hybridization chain reaction for the detection of nucleic acids in complex biological fluids[J]. Angewandte Chemie International Edition, 2011, 50(2): 401-404. DOI:10.1002/anie.201005375 |
| [29] |
Huang J, Zhu Z, Bamrungsap S, et al. Competition-mediated pyrene-switching aptasensor:probing lysozyme in human serum with a monomer-excimer fluorescence switch[J]. Analytical Chemistry, 2010, 82(24): 10158-10163. DOI:10.1021/ac102277p |
| [30] |
Ma H, Yang M, Zhang C, et al. Aggregation-induced emission(AIE)-active fluorescent probes with multisite-binding sites toward ATP sensing and the live cell imaging[J]. Journal of Materials Chemistry B, 2017, 5: 8525-8531. DOI:10.1039/C7TB02399E |
| [31] |
Tyagi A, Chu KL, Abidi IH, et al. Single-probe multistate detection of DNA via aggregation-induced emission on a graphene oxide platform[J]. Acta Biomaterialia, 2017, 50(334): 334-343. |
| [32] |
Svanvik N, Westman G, Wang D, et al. Light-up probes:thiazole orange-conjugated peptide nucleic acid for detection of target nucleic acid in homogeneous solution[J]. Analytical Biochemistry, 2000, 281(1): 26-35. |
| [33] |
Zhao J, Gao J, Xue W, et al. Upconversion luminescence-activated DNA nanodevice for ATP sensing in living cells[J]. Journal of the American Chemical Society, 2018, 140(2): 528-581. |
| [34] |
Wang L, Li Y. Green upconversion nanocrystals for DNA detection[J]. Chem Commun Camb, 2006(24): 2557-2559. DOI:10.1039/b604871d |
| [35] |
Akerele D, Ljolje D, Talundzic E, et al. Molecular diagnosis of Plasmodium ovale by photo-induced electron transfer fluorogenic primers:PET-PCR[J]. PLoS One, 2017, 12(6): e0179178. DOI:10.1371/journal.pone.0179178 |
| [36] |
Chantzis A, Very T, Daniel C, et al. Theoretical evidence of photo-induced charge transfer from DNA to intercalated ruthenium (Ⅱ) organometallic complexes[J]. Chemical Physics Letters, 2013, 578(1): 133-137. |
| [37] |
Li J, Lu Y. A highly sensitive and selective catalytic DNA biosensor for lead ions[J]. Journal of the American Chemical Society, 2000, 122(42): 10466-10467. DOI:10.1021/ja0021316 |
| [38] |
Lan T, Furuya K, Lu Y. A highly selective lead sensor based on a classic lead DNAzyme[J]. Chemical Communications, 2010, 46(22): 3896-3898. DOI:10.1039/b926910j |
| [39] |
Whitcombe D, Theaker J, Guy SP, et al. Detection of PCR products using self-probing amplicons and fluorescence[J]. Nature Biotechnology, 1999, 17(8): 804-807. DOI:10.1038/11751 |
| [40] |
Uehara H, Nardone G, Nazarenko I, et al. Detection of telomerase activity utilizing energy transfer primers:comparison with gel- and ELISA-based detection[J]. Biotechniques, 1999, 26(3): 552-558. DOI:10.2144/99263pf01 |
| [41] |
Wang H, Kim Y, Liu H, et al. Engineering a unimolecular DNA-catalytic probe for single lead ion monitoring[J]. Journal of the American Chemical Society, 2009, 131(23): 8221-8226. DOI:10.1021/ja901132y |
| [42] |
Nagraj N, Liu J, Sterling S, et al. DNAzyme catalytic beacon sensors that resist temperature-dependent variations[J]. Chemical Communications, 2009(27): 4103-4105. DOI:10.1039/b903059j |
| [43] |
Heller MJ, Morrison LE, Prevatt WD, et al. Light-emitting polynuc-leotide hybridization diagnostic method: CA, EP0070687[P]. 1985.
|
| [44] |
Martí AA, Li X, Jockusch S, et al. Design and characterization of two-dye and three-dye binary fluorescent probes for mRNA detection[J]. Tetrahedron, 2007, 63(17): 3591-3600. DOI:10.1016/j.tet.2006.08.109 |




