食源致病微生物是伴随食品、食用农产品整个产供过程的关键潜在生物危害因素,严重威胁食品、食用农产品质量安全,给人类和动物健康造成严重危害。食源致病微生物一方面通过污染食品、食用农产品,使其发生腐败、变质,直接损害产品品质,给产业造成巨大浪费和损失;另一方面以食品、食用农产品为载体或传播媒介,通过病原体直接或者代谢的毒素间接损害机体,引起肠胃疾病、器官衰竭乃至诱发癌症等临床症状[1-2],是人类和动物日常疾病最主要诱因之一。因此,对食源致病微生物的安全有效防控,是保障食品、食用农产品质量安全的必要手段,直接关乎老百姓“舌尖上的安全”和食品、食用农产品产业的优质可持续发展,是广大科研工作者努力探索研究的目标,更是不可推卸的社会责任。
传统抗生素对致病微生物防控发挥着极其重要的作用,特别是发现初期,抗生素在人类和动物疾病治疗乃至食品、农产品防腐保鲜上都发挥了巨大作用;但近几十年来,由于滥用,其带来的副作用及导致的病原菌耐药性问题日益凸显,严重威胁到了人类和动物健康乃至生态安全[3-4]。目前,多数抗生素在食品、食用农产品中都属于禁限用药物。抗菌生物活性肽作为一类具有抗菌功能的生物多肽类蛋白质,被普遍认为是对人类和动物以及生态环境安全的有望替代抗生素用于防控致病微生物的新型安全抗菌类药物,在生物医药和食品、农产品防腐保鲜等领域具有重大挖掘潜力和应用价值,越来越受到科研工作者的关注[5-6]。
近年来,世界各国科研工作者对抗菌生物活性肽的有关研究蓬勃发展,现已从传统的生物体内分离制备天然抗菌肽逐渐向从大容量多肽库中特异性高通量靶向淘筛人工合成抗菌多肽发展的趋势[7-9]。基于此,本文对抗菌生物活性肽在食源致病微生物防控上的研究状况进行系统综述;并结合作者及所在科研团队相关课题成果,探讨了当前抗菌生物活性肽创制存在的主要问题并提出了拟解决对策,旨在为快速高效研发具有可用于食品、食用农产品致病微生物防控的新型安全抗菌生物活性肽提供新思路和可行性建议。
1 食源致病微生物主要类型及其安全风险食源致病微生物可分为食源致病病毒、食源致病细菌、食源致病真菌以及其他较为高等的食源致病病原虫等几大类型,表 1即按类别详细梳理出了当前食品、农产品中较为常见的致病微生物及其主要污染特点与危害风险等相关信息。食源致病病毒中比较典型的有诺如病毒(Norwalk viruses,NV)、甲型肝炎病毒(Hepatitis A virus,HAV)以及轮状病毒(Rotavirus,RV)等,均能引起急性肠胃炎,导致严重腹泻等症状[10-11];食源致病细菌中危害最大、分布最广的是金黄色葡萄球菌(Staphylococcus aureus)和大肠杆菌(Escherichia coli),此外还有产剧毒的肉毒杆菌(Clostridium botulinum)和鼠伤寒沙门氏菌(Salmonella typhimurium)等也是威胁食物质量安全较为严重的致病菌[12-13];食源致病真菌多数具有的共性危害特点是代谢真菌毒素,主要污染粮油等农作物及其产品,最为典型的有麦类作物中的脱氧雪腐镰刀菌烯醇(Deoxynivalenol,DON,又称呕吐毒素)、油料作物中的黄曲霉毒素(Aflatoxins,AFT)以及玉米中的玉米赤霉烯酮(Zearalenone,又称F-2毒素)和伏马菌素(Fumonisin,FB)等,均属剧毒高危致癌或致畸类生物毒素,严重危害人类和动物健康,也给粮油产业造成巨大浪费和损失[14-16]。此外,动物性食品中还有一些寄生性致病微生物如隐孢子虫(Cryptosporidium parvum)、贾第虫(Giardiasis)、旋毛虫(Trichinella spiralis)、痢疾阿米巴虫(Entamoeba histolytica)等,也能引起机体肠道疾病,甚至诱发脏器衰竭导致致命风险[17-20]。
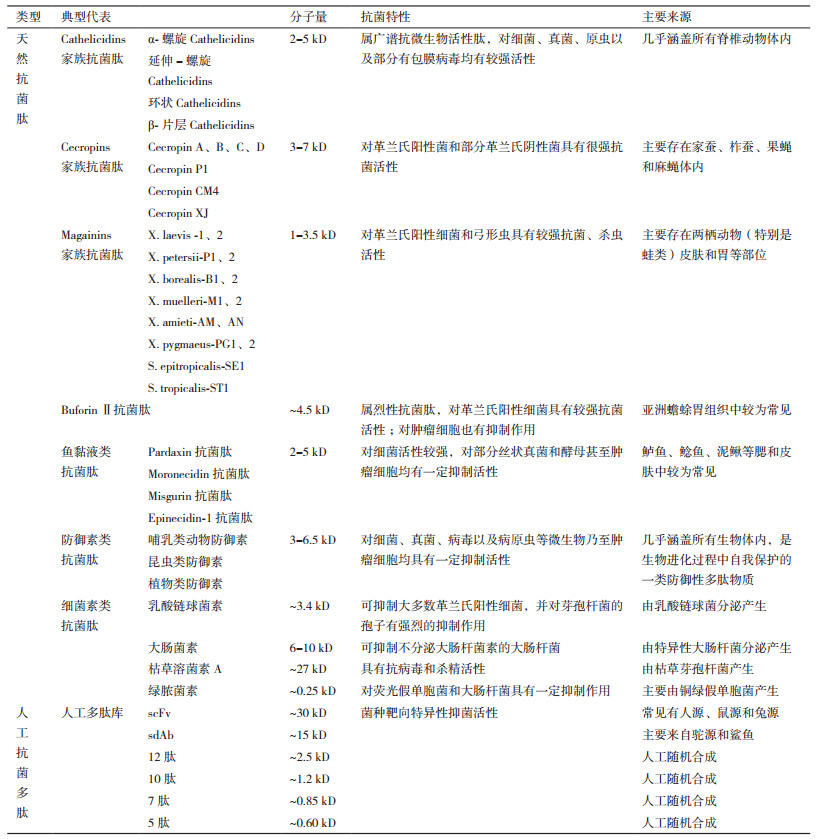
抗菌生物活性肽可以分为天然的抗菌肽(Antimicrobial peptides,AMPs)和人工合成的具有抗菌活性的多肽两大类型。天然抗菌肽种类多、来源广,是几乎存在于所有生物种体内的在机体防御上发挥重要作用的进化保守的特殊多肽,分子量普遍介于2-50 kD之间,其发挥活性的关键功能区域往往富含带正电荷的氨基酸残基和疏水性氨基酸残基,形成α-螺旋β折叠及α-β复合等结构,并通过破坏菌体细胞膜的通透性及渗入胞内后阻碍RNA合成、抑制细胞骨架关键蛋白酶和细胞呼吸酶的活性、阻断蛋白质正确折叠的伴侣蛋白和线粒体正常功能等系列级联反应,最终使得菌体繁殖受到抑制甚至彻底致死[5, 21]。据国际权威抗菌肽数据库(Antimicrobial peptide database,APD;http://aps.unmc.edu/AP/)最新收录信息显示:目前登记收录的各类抗菌肽数量已达3 027种,其中2 236种源于动物,344种源于植物,336种源于微生物,18种源于真菌,8种源于原生生物,4种源于古生菌;其中较为典型并可归类的有Cathelicidins、Cecropins、Magainins和BuforinⅡ等家簇抗菌肽,以及鱼黏液类、防御素类和细菌类抗菌肽等(表 2)。人工合成的具有抗菌活性的多肽则是伴随基因工程抗体创制和特异性抗体高通量筛选技术发展而来的具有模拟传统抗生素功能的新型安全抗菌生物活性肽,来源一般是依附微生物全细胞或特定抗生素在靶标微生物上的受体为包被靶点,然后从各类多肽库中靶向筛选获得(表 2);据公开报道可查的人工抗菌生物活性肽氨基酸序列分析,其发挥抗菌活性区域的关键氨基酸组成也普遍符合天然抗菌肽的特点,抗菌机制也较为类似[22],目前该类研究尚处于探索尝试阶段,文献报道也相对较少。
抗菌生物活性肽创制技术大致可以分为随机筛选和靶向筛选两种方式(表 3),且创制的抗菌生物活性肽材料普遍具有广谱抗菌活性的特点。天然抗菌肽以从生物体特定组织、器官或分泌物中随机筛选较为常见,如Murakami等[23]和Gao等[24]分别从人乳和鸭体内随机筛选到了Cathelicidin家族的抗菌肽材料,Li等25]、Nayak等[26]、Lee等[27]和Meamarpoor-Yazdi等[28]分别从鲶鱼、家蚕、蜈蚣和隐翅虫体内随机筛选到了相应抗菌肽,均对金黄色葡萄球菌和大肠杆菌具有较强抑菌活性;近年也有采用致病微生物特性蛋白或活性脂质体作为靶点进行靶向筛选的报道[29-31]。人工抗菌生物活性多肽创制技术几乎都是通过微生物全细胞或特性蛋白作为包被靶点,从多肽库中靶向筛选获得,其抗菌活性往往具有靶向特异性抗菌谱的特点,如Pini等[32]、Rao等[33]和Bishop-Hurley等[34]以大肠杆菌和空肠弯曲菌全细胞为包被靶点,从噬菌体展示的10肽、12肽和15肽库中分别筛选到了对应人工抗菌多肽;Zoeiby等[35]、Tanaka等[36]、Wang等[37]和Hart等[38]分别以绿脓杆菌MurC酶蛋白、趋磁细菌BacMPs磁性蛋白、乙型肝炎病毒PreS1蛋白和金黄色葡萄球菌lipid Ⅱ蛋白为包被靶点,均从噬菌体展示多肽库中筛选到了对应的人工抗菌多肽。而Tucker等[9]则将天然抗菌肽与细菌表面展示多肽库技术相结合,通过构建的抗菌肽库与微生物互作,实现了靶标微生物靶向抗菌多肽自动筛选与进化的重要突破,为靶向高效创制抗菌活性肽提供了捷径。
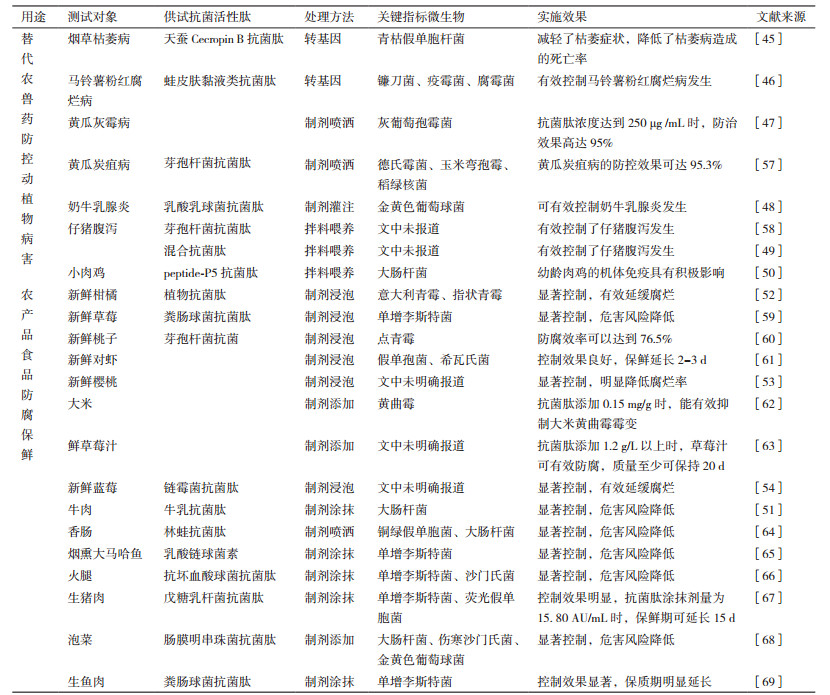
目前抗菌生物活性肽在食源致病微生物防控上的应用研究主要集中在替代农兽药防控动植物病害和食品、农产品防腐保鲜等两大领域;就抗菌生物活性肽类型来看,目前以传统天然抗菌肽为主,而人工抗菌多肽则尚无公开报道的文献(表 4)。在替代农兽药防控动植物病害的应用研究方面,抗菌肽测试对象涉及防控农作物病害、动物疫病以及调节动物免疫机能等方面,使用方法涵盖转基因[45-46]和制剂喷洒[47]、灌注[48]及拌料喂养[49-50]等,对靶标病害均具有一定防控效果;在这类应用当中,天然抗菌肽材料因其对应编码的基因信息明确,理论上完全可用于跨物种克隆表达,因此在转基因抗菌作物改造上具有极大挖掘潜力和广阔的市场应用价值,这在当前已成熟并实现商业化应用的转Bt作物上已有先例可循,有望推进抗菌肽的创新应用。在食品、农产品防腐保鲜的应用研究方面,各种源于动物[51]、植物[52]、微生物[53-54]等生物体的天然抗菌肽在均有应用研究的报道,其中新鲜农产品的防腐保鲜以控制霉菌为主,而食品特别是肉制品的防腐保鲜则以控制细菌为主(如金黄色葡萄球菌、大肠杆菌、李斯特菌和沙门氏菌等),供试抗菌肽对相应测试的食品、农产品防腐保鲜效果均较为显著,其中乳酸链球菌素和别-聚赖氨酸两类抗菌肽已被批准作为食品添加剂用于食品、农产品的防腐保鲜[55]。理论上来说,只要对食源性致病菌有防控效果的抗菌生物活性肽均具有应用于食品防腐保鲜的潜力,但因食品、食用农产品的特殊属性,抗菌生物活性肽作为食品防腐剂的准入要求极为严苛,因此短期内抗菌生物活性肽在食品防腐保鲜中的实际应用仍然任重而道远。此外,近年抗菌生物活性肽还有被用于食品活性包装袋材料辅助防控食品面源致病微生物的报道[56],这是抗菌生物活性肽在食品中食源致病微生物防控应用上的新动态;且抗菌生物活性肽作为包装材料使用,其在食品致病微生物防控领域具有独特的优势,更容易被政府监管部门和广大消费者所认可,有望快速投入使用,市场前景一片大好。
抗菌生物活性肽作为源于生物体或人工合成的具有抗菌功能的蛋白质类物质,其在生物毒性和环境安全性方面明显优于传统抗生素,被普遍认为是有望替代或辅助抗生素用于致病微生物防控的安全抗菌材料,具有极大的挖掘潜力和广阔的应用前景。然而,尽管报道的抗菌肽种类和数量很多,相关探索性应用研究也在不断跟进,但能够实现商品化应用的材料却很少,美国FDA在过去数十年间只批准了十几种抗菌生物活性肽类药品[5],可用于食品、农产品致病微生物防控级别的产品更是少之又少。究其原因,抗菌生物活性肽普遍存在制备困难、活性弱、稳定性差以及生物安全潜在危害风险等问题或争议,是当前制约其在食源致病微生物防控上应用的最主要因素。针对这些问题,以下对策可供参考。
5.1 借鉴基因工程抗体库创制思路,拓展抗菌生物活性肽高通量筛选方法微生物表面展示多肽库技术(如噬菌体表面展示、细菌表面展示、酵母表面展示等)是近年蓬勃发展的人工多肽创制技术,其可以将任何多肽进行展示构成大容量库,然后通过包被靶点从库中高通量靶向筛选具有靶标特异性的多肽及其相应基因材料,这为抗菌生物活性肽人工高通量靶向筛选提供了全新的路径,现已有相关探索研究的报道。
5.2 依托抗独特型抗体创制理论,靶向设计模拟抗生素功能的抗菌生物活性肽1974年,Jerne首次提出“免疫网络学说”,认为在动物免疫系统中,采用抗体免疫后,通过级联反应能刺激免疫系统产生具有抗原独特型的抗体,其中“β”型的抗独特型抗体具有抗原“内影像”效应,即具有与抗原相同的抗原决定簇,从而可以模拟特定抗原决定簇分子构象及乃至其生物活性的功能;随后Nisonoff和Lamoyi进一步证实抗独特型抗体具有能替代抗原诱导特异性免疫应答的作用[70];目前国内外在生物医药和农业昆虫防控领域已有成功的报道[71-75]。其中,作者所在科研团队,借助抗独特型抗体技术路径,从人源噬菌体展示多肽库中成功创制出了具有模拟Bt Cry系列杀虫蛋白抗虫功能的人工抗虫肽材料,现已获得国家发明专利和国际PCT专利授权;这为靶向创制具有模拟抗生素(特别是多肽类抗生素,如万古霉素)抗菌功能的新型安全抗菌生物活性肽材料提供了方向。
5.3 借助抗体体外亲和成熟技术,推进抗菌生物活性肽的定向修饰借助蛋白质分子对接模拟软件,预测抗菌生物活性肽关键活性位点的氨基酸信息,采用多种抗体体外亲和力成熟技术(如定点突变)对多肽进行突变改造,并结合基因工程多肽展示库技术和特异性多肽高通量筛选技术,进一步筛选高活性的突变体。如Zhang等[76]、Schier等[77]和Bardera等[78]均采用分子对接模拟分析然后借助定点突变技术对母体单链抗体基因结合位点关键氨基酸进行突变改造,分别将多肽亲和力提高了4、145和454倍;这为抗菌生物活性肽活性改造提供了思路,有望助推其实用性价值。
| [1] |
Havelaar AH, Kirk MD, Torgerson PR, et al. World health organization global estimates and regional comparisons of the burden of foodborne disease in 2010[J]. PLoS Med, 2015, 12(12): e1001923. DOI:10.1371/journal.pmed.1001923 |
| [2] |
Membré JM, Guillou S. Latest developments in foodborne pathogen risk assessment[J]. Curr Opin Food Sci, 2016(8): 120-126. |
| [3] |
Courvalin P. Why is antibiotic resistance a deadly emerging disease?[J]. Clin Microbiol Infect, 2016, 22(5): 405-407. DOI:10.1016/j.cmi.2016.01.012 |
| [4] |
Yoo SM, Lee SY. Optical biosensors for the detection of pathogenic microorganisms[J]. Trends Biotechnol, 2016, 34(1): 7-25. DOI:10.1016/j.tibtech.2015.09.012 |
| [5] |
Costa JP, Cova M, Ferreira R, et al. Antimicrobial peptides:an alternative for innovative medicines?[J]. Appl Microbiol Biotechnol, 2015, 99(5): 2023-2040. DOI:10.1007/s00253-015-6375-x |
| [6] |
Wang G, Mishra B, Lau K, et al. Antimicrobial peptides in 2014[J]. Pharmaceuticals, 2015, 8(1): 123-150. DOI:10.3390/ph8010123 |
| [7] |
Hilpert K, Hancock RE. Use of luminescent bacteria for rapid screening and characterization of short cationic antimicrobial peptides synthesized on cellulose using peptide array technology[J]. Nat Protoc, 2007, 2(7): 1652-1660. DOI:10.1038/nprot.2007.203 |
| [8] |
Castel G, Chteoui M, Heyd B, et al. Phage display of combinatorial peptide libraries:application to antiviral research[J]. Molecules, 2011, 16(5): 3499-3518. DOI:10.3390/molecules16053499 |
| [9] |
Tucker AT, Leonard SP, DuBois CD, et al. Discovery of next-generation antimicrobials through bacterial self-screening of surface-displayed peptide libraries[J]. Cell, 2018, 172(3): 618-628. DOI:10.1016/j.cell.2017.12.009 |
| [10] |
Li D, Butot S, Zuber S, et al. Monitoring of foodborne viruses in berries and considerations on the use of RT-PCR methods in surveillance[J]. Food Control, 2018, 89: 235-240. DOI:10.1016/j.foodcont.2018.02.024 |
| [11] |
Jones TH, Muehlhauser V. Frequency of hepatitis E virus, rotavirus and porcine enteric calicivirus at various stages of pork carcass processing in two pork processing plants[J]. Int J Food Microbiol, 2017, 259: 29-34. DOI:10.1016/j.ijfoodmicro.2017.07.019 |
| [12] |
Zhang Y, Liu X, Wang Y, et al. Antibacterial activity and mechanism of cinnamon essential oil against Escherichia coli and Staphylococcus aureus[J]. Food Control, 2016, 59: 282-289. DOI:10.1016/j.foodcont.2015.05.032 |
| [13] |
Kirk MD, Pires SM, Black RE, et al. World health organization estimates of the global and regional disease burden of 22 foodborne bacterial, protozoal and viral diseases[J]. PLoS Med, 2015, 12(12): e1001921. DOI:10.1371/journal.pmed.1001921 |
| [14] |
Raiola A, Tenore GC, Manyes L, et al. Risk analysis of main mycotoxins occurring in food for children:an overview[J]. Food Chem Toxicol, 2015, 84: 169-180. DOI:10.1016/j.fct.2015.08.023 |
| [15] |
Frisvad JC. A critical review of producers of small lactone mycotoxins:patulin, penicillic acid and moniliformin[J]. World Mycotoxin J, 2018, 11(1): 73-100. DOI:10.3920/WMJ2017.2294 |
| [16] |
Luo Y, Liu X, Li J. Updating techniques on controlling mycotoxins-a review[J]. Food Control, 2018, 89: 123-132. DOI:10.1016/j.foodcont.2018.01.016 |
| [17] |
Stiff RE, Davies AP, Mason BW, et al. Long-term health effects after resolution of acute cryptosporidium parvum infection:a 1-year follow-up of outbreak-associated cases[J]. J Med Microbiol, 2017, 66(11): 1607-1611. DOI:10.1099/jmm.0.000609 |
| [18] |
Waldram A, Vivancos R, Hartley C, et al. Prevalence of giardia infection in households of giardia cases and risk factors for household transmission[J]. BMC Infect Dis, 2017, 17(1): e486. DOI:10.1186/s12879-017-2586-3 |
| [19] |
Rostami A, Khazan H, Kia EB, et al. Molecular identification of Trichinella spp. in wild boar and serological survey of high-risk populations in Iran[J]. Food Control, 2018, 90: 40-47. DOI:10.1016/j.foodcont.2018.02.016 |
| [20] |
Ssemanda JN, Reij MW, Middendorp G, et al. Foodborne pathogens and their risk exposure factors associated with farm vegetables in Rwanda[J]. Food Control, 2018, 89: 86-96. DOI:10.1016/j.foodcont.2017.12.034 |
| [21] |
Chung PY, Khanum R. Antimicrobial peptides as potential anti-biofilm agents against multidrug-resistant bacteria[J]. J Microbiol Immunol Infect, 2017, 50(4): 405-410. DOI:10.1016/j.jmii.2016.12.005 |
| [22] |
Huang JX, Bishop-Hurley SL, Cooper MA. Development of anti-infectives using phage display:biological agents against bacteria, viruses and parasites[J]. Antimicrob Agents Ch, 2012, 56(9): 4569-4582. DOI:10.1128/AAC.00567-12 |
| [23] |
Murakami M, Dorschner RA, Stern LJ, et al. Expression and secretion of cathelicidin antimicrobial peptides in murine mammary glands and human milk[J]. Pediatr Res, 2005, 57(1): 10-15. DOI:10.1203/01.PDR.0000148068.32201.50 |
| [24] |
Gao W, Xing L, Qu P, et al. Identification of a novel cathelicidin antimicrobial peptide from ducks and determination of its functional activity and antibacterial mechanism[J]. Sci Rep, 2015, 5: e17260. DOI:10.1038/srep17260 |
| [25] |
Li T, Wang X, Wang Y, et al. Characterization of antimicrobial peptides isolated from the processing by products of african catfish clarias gariepinus[J]. Int J Pept Res Ther, 2016, 23(2): 227-233. |
| [26] |
Nayak T, Mandal SM, Neog K, et al. Characterization of a gloverin-like antimicrobial peptide isolated from muga silkworm, antheraea assamensis[J]. Int J Pept Res Ther, 2018, 24(4): 337-346. |
| [27] |
Lee H, Hwang JS, Lee J, et al. Scolopendin 2, a cationic antimicrobial peptide from centipede, and its membrane-active mechanism[J]. Biochim Biophys Acta, 2015, 1848(2): 634-642. DOI:10.1016/j.bbamem.2014.11.016 |
| [28] |
Memarpoor-Yazdi M, Zare-Zardini H, Asoodeh A. A novel antimicrobial peptide derived from the insect paederus dermatitis[J]. Int J Pept Res Ther, 2012, 19(2): 99-108. |
| [29] |
Tang W, Yuan H, Zhang H, et al. An antimicrobial peptide screened from casein hydrolyzate by Saccharomyces cerevisiae cell membrane affinity method[J]. Food Control, 2015, 50: 413-422. DOI:10.1016/j.foodcont.2014.09.030 |
| [30] |
Pei J, Jiang L. Antimicrobial peptide from mucus of Andrias davidianus:screening and purification by magnetic cell membrane separation technique[J]. Int J Antimicrob Agents, 2017, 50(1): 41-46. DOI:10.1016/j.ijantimicag.2017.02.013 |
| [31] |
Tang W, Zhang H, Wang L, et al. Targeted separation of antibacterial peptide from protein hydrolysate of anchovy cooking wastewater by equilibrium dialysis[J]. Food Chem, 2015, 168: 115-123. DOI:10.1016/j.foodchem.2014.07.027 |
| [32] |
Pini A, Giuliani A, Falciani C, et al. Antimicrobial activity of novel dendrimeric peptides obtained by phage display selection and rational modification[J]. Antimicrob. Agents Ch, 2005, 49(7): 2665-2672. DOI:10.1128/AAC.49.7.2665-2672.2005 |
| [33] |
Rao SS, Mohan KV, Atreya CD. A peptide derived from phage display library exhibits antibacterial activity against E. coli and Pseudomonas aeruginosa[J]. PLoS One, 2013, 8(2): e56081. DOI:10.1371/journal.pone.0056081 |
| [34] |
Bishop-Hurley SL, Rea PJ, McSweeney CS. Phage-displayed peptides selected for binding to campylobacter jejuni are antimicrobial[J]. Protein Eng Des Sel, 2010, 23(10): 751-757. DOI:10.1093/protein/gzq050 |
| [35] |
Zoeiby AE. Identification of novel inhibitors of Pseudomonas aeruginosa MurC enzyme derived from phage-displayed peptide libraries[J]. J Antimicrob Chemoth, 2003, 51(3): 531-543. |
| [36] |
Tanaka T, Kokuryu Y, Matsunaga T. Novel method for selection of antimicrobial peptides from a phage display library by use of bacterial magnetic particles[J]. Appl Environ Microbiol, 2008, 74(24): 7600-7606. DOI:10.1128/AEM.00162-08 |
| [37] |
Wang W, Liu Y, Zu X, et al. Blocking peptides against HBV PreS1 protein selected from a phage display library[J]. Biochem Biophys Res Commun, 2011, 412: 633-637. DOI:10.1016/j.bbrc.2011.08.014 |
| [38] |
Hart P, Wood TM, Tehrani K, et al. De novo identification of lipid Ⅱ binding lipopeptides with antibacterial activity against vancomycin-resistant bacteria[J]. Chem Sci, 2017, 8(12): 7991-7997. DOI:10.1039/C7SC03413J |
| [39] |
Imjongjirak C, Amphaiphan P, Charoensapsri W, et al. Characterization and antimicrobial evaluation of SpPR-AMP1, a proline-rich antimicrobial peptide from the mud crab Scylla paramamosain[J]. Dev Comp Immunol, 2017, 74: 209-216. DOI:10.1016/j.dci.2017.05.003 |
| [40] |
Bamdad F, Sun X, Guan LL, et al. Preparation and characterization of antimicrobial cationized peptides from barley (Hordeum vulgare L.) proteins[J]. LWT-Food Sci Technol, 2015, 63(1): 29-36. DOI:10.1016/j.lwt.2015.03.012 |
| [41] |
Regmi S, Choi YH, Choi YS, et al. Antimicrobial peptide isolated from Bacillus amyloliquefaciens K14 revitalizes its use in combinatorial drug therapy[J]. Folia Microbiol, 2017, 62(2): 127-138. DOI:10.1007/s12223-016-0479-2 |
| [42] |
Nakatsuji T, Chen TH, Narala S, et al. Antimicrobials from human skin commensal bacteria protect against Staphylococcus aureus and are deficient in atopic dermatitis[J]. Sci Transl Med, 2017, 9: e4680. DOI:10.1126/scitranslmed.aah4680 |
| [43] |
Flachbartova Z, Pulzova L, Bencurova E, et al. Inhibition of multidrug resistant listeria monocytogenes by peptides isolated from combinatorial phage display libraries[J]. Microbiol Res, 2016, 188: 34-41. |
| [44] |
Zhang Q, Wang Y, Ji Q, et al. Selection of antiviral peptides against mink enteritis virus using a phage display peptide library[J]. Curr Microbiol, 2013, 66(4): 379-384. DOI:10.1007/s00284-012-0284-3 |
| [45] |
Jaynes JM, Nagpala P, Destéfano-Beltrán L, et al. Expression of a cecropin B lytic peptide analog in transgenic tobacco confers enhanced resistance to bacterial wilt caused by Pseudomonas solanacearum[J]. Plant Sci, 1993, 89(1): 43-53. DOI:10.1016/0168-9452(93)90169-Z |
| [46] |
Osusky M, Osuska L, Kay W, et al. Genetic modification of potato against microbial diseases:in vitro and in planta activity of a dermaseptin B1 derivative, MsrA2[J]. Theor Appl Genet, 2005, 111(4): 711-722. DOI:10.1007/s00122-005-2056-y |
| [47] |
范磊, 张道敬, 刘振华, 等. 多粘类芽孢杆菌HY96-2产脂肽类抗真菌物质的研究[J]. 天然产物研究与开发, 2012, 24: 729-735. DOI:10.3969/j.issn.1001-6880.2012.06.004 |
| [48] |
Lee N, Park Y, Kim HW, et al. Purification and characterization of lacticin Nk34 produced by lactococcus lactis Nk34 against bovine mastitis[J]. Korean J Food Sci Ani Res, 2008, 28(4): 457-462. DOI:10.5851/kosfa.2008.28.4.457 |
| [49] |
Xiong X, Yang HS, Li L, et al. Effects of antimicrobial peptides in nursery diets on growth performance of pigs reared on five different farms[J]. Livest Sci, 2014, 167: 206-210. DOI:10.1016/j.livsci.2014.04.024 |
| [50] |
Choi SC, Ingale SL, Kim JS, et al. Effects of dietary supplementation with an antimicrobial peptide-P5 on growth performance, nutrient retention, excreta and intestinal microflora and intestinal morphology of broilers[J]. Ani Feed Sci Technol, 2013, 185(1-2): 78-84. DOI:10.1016/j.anifeedsci.2013.07.005 |
| [51] |
Venkitanarayanan KS, Zhao T, Doyle MP. Antibacterial effect of lactoferricin B on Escherichia coli O157-H7 in ground beef[J]. J Food Protect, 1999, 62(7): 747-750. DOI:10.4315/0362-028X-62.7.747 |
| [52] |
López-García B, Veyrat A, Pérez-Payá E, et al. Comparison of the activity of antifungal hexapeptides and the fungicides thiabendazole and imazalil against postharvest fungal pathogens[J]. Int J Food Microbiol, 2004, 89(2-3): 163-170. |
| [53] |
李蒙, 陆兆新, 周翔, 等. 复合生物源保鲜剂对樱桃番茄绿宝石保鲜效果的影响[J]. 食品科学, 2013, 34(18): 301-306. DOI:10.7506/spkx1002-6630-201318062 |
| [54] |
于继男, 薛璐, 鲁晓翔, 等. 冰温结合聚赖氨酸对贮藏期间蓝莓生理品质的变化影响[J]. 食品工业科技, 2015(1): 334-343. |
| [55] |
薛辉, 涂勇刚, 熊春红, 等.抗菌肽快速筛选方法的研究进展[J/OL].食品科学, 2018, http://kns.cnki.net/kcms/detail/11.2206.TS.20181018.1520.054.html.
|
| [56] |
Luz C, Calpe J, Saladino F, et al. Antimicrobial packaging based on varepsilon-polylysine bioactive film for the control of mycotoxigenic fungi in vitro and in bread[J]. J Food Process Preserv, 2018, 42(1): :e13370. DOI:10.1111/jfpp.2018.42.issue-1 |
| [57] |
顾康博, 张道敬, 罗远婵, 等. Bacillomycin D发酵与纯化工艺优化及其抑菌活性初步研究[J]. 农药学学报, 2017, 19(4): 456-473. |
| [58] |
喻红波, 伍冶, 潘成国. 抗菌脂肽替代抗生素在断奶仔猪生产中的应用效果评价[J]. 饲料与畜牧, 2012(9): 12-14. |
| [59] |
Molinos AC, Abriouel H, Omar NB, et al. Inactivation of listeria monocytogenes in raw fruits by enterocin as-48[J]. J Food Protect, 2008, 71(12): 2460-2467. DOI:10.4315/0362-028X-71.12.2460 |
| [60] |
黄现青, 别小妹, 吕凤霞, 等. 枯草芽孢杆菌fmbJ产脂肽抑制点青霉效果及其桃防腐试验[J]. 农业工程学报, 2008, 24(1): 263-267. DOI:10.3321/j.issn:1002-6819.2008.01.052 |
| [61] |
王东, 孙力军, 王雅玲. 纳豆菌抗菌肽APNT-6对凡纳滨对虾的低温保鲜效果[J]. 水产学报, 2012, 36(7): 1133-1139. |
| [62] |
孟攀攀, 陆兆新, 吕凤霞, 等. Bacillomycin高产菌株的紫外诱变选育及其防治大米黄曲霉霉变的研究[J]. 食品工业科技, 2015, 36(19): 186-201. |
| [63] |
高兆建, 樊陈, 鞠民友. 枯草芽孢杆菌抗菌肽在食品防腐中的应用性研究[J]. 徐州工程学院学报:自然科学版, 2013, 28(2): 67-72. DOI:10.3969/j.issn.1674-358X.2013.02.013 |
| [64] |
李德远, 徐现波, 熊亮. 天然食品保鲜防腐剂林蛙皮抗菌肽[J]. 食品科学, 2002, 23(8): 279-282. DOI:10.3321/j.issn:1002-6630.2002.08.087 |
| [65] |
Neetoo H, Ye M, Chen H. Potential antimicrobials to control Listeria monocytogenes in vacuum-packaged cold-smoked salmon pate and fillets[J]. Int J Food Microbiol, 2008, 123(3): 220-227. DOI:10.1016/j.ijfoodmicro.2008.02.001 |
| [66] |
Santiago-Silva P, Soares NF, Nóbrega JE, et al. Antimicrobial efficiency of film incorporated with pediocin on preservation of sliced ham[J]. Food Control, 2009, 20(1): 85-89. |
| [67] |
Zhang J, Liu G, Li P, et al. Pentocin 31-1, a novel meat-borne bacteriocin and its application as biopreservative in chill-stored tray-packaged pork meat[J]. Food Control, 2010, 21(2): 198-202. DOI:10.1016/j.foodcont.2009.05.010 |
| [68] |
Chang JY, Chang HC. Growth inhibition of foodborne pathogens by kimchi prepared with bacteriocin producing starter culture[J]. J Food Sci, 2011, 76(1): 72-78. |
| [69] |
Baños A, García-López JD, Núñez C, et al. Biocontrol of Listeria monocytogenes in fish by enterocin AS-48 and Listeria lytic bacteriophage P100[J]. LWT-Food Sci Technol, 2016, 66: 672-677. DOI:10.1016/j.lwt.2015.11.025 |
| [70] |
龚非力. 医学免疫学[M]. 北京: 科学出版社, 2003.
|
| [71] |
Hanoux V, Wijkhuisen A, Alexandrenne C, et al. Polyclonal anti-idiotypic antibodies which mimic an epitope of the human prion protein[J]. Mol Immunol, 2009, 46(6): 1076-1083. DOI:10.1016/j.molimm.2008.09.033 |
| [72] |
Xu J, Zhu XJ, Li YH, et al. Expression, characterization and therapeutic efficacy of chimeric Fab of anti-idiotypic antibody NP30 against Schistosoma japonicum[J]. Acta Trop, 2011, 118(2): 159-164. DOI:10.1016/j.actatropica.2011.01.006 |
| [73] |
刘贤金, 徐重新, 张霄, 等.一种人源抗虫基因及其编码的抗Cry1B毒素独特型单链抗体与应用: 中国, 201410037175. X[P]. 2015-11-18.
|
| [74] |
刘贤金, 徐重新, 张霄, 等.一种人源抗虫基因及其编码的抗Cry1C毒素独特型单链抗体与应用: 中国, 201410037240. 9[P]. 2015-11-18.
|
| [75] |
刘贤金, 徐重新, 张霄, 等.一种人源抗虫基因及其编码的抗Cry1Ab毒素独特型单链抗体与应用: 中国, 201410037000. 9[P]. 2015-11-18.
|
| [76] |
Zhang J, Valianou M, Simmons H, et al. Identification of inhibitory scFv antibodies targeting fibroblast activation protein utilizing phage display functional screens[J]. FASEB J, 2013, 27(2): 581-589. DOI:10.1096/fj.12-210377 |
| [77] |
Schier R, Mccall A, Adams GP, et al. Isolation of picomolar affinity anti-c-erbB-2 single-chain Fv by molecular evolution of the complementarity determining regions in the center of the antibody binding site[J]. Mol Bio, 1996, 263(4): 551-567. DOI:10.1006/jmbi.1996.0598 |
| [78] |
Barderas R, Desmet J, Timmerman P, et al. Affinity maturation of antibodies assisted byin silicomodeling[J]. PNAS, 2008, 105(26): 9029-9034. DOI:10.1073/pnas.0801221105 |