2. 湖南省植物保护研究所 园艺作物病虫害治理湖南省重点实验室,长沙 410125;
3. 湖南农业大学植物保护学院,长沙 410128
2. Key Laboratory of Pest Management of Horticultural Crop of Hunan Province, Institute of Hunan Plant Protection, Hunan Academy of Agricultural Science, Changsha 410125;
3. College of Plant Protection, Hunan Agricultural University, Changsha 410128
自1994年美国获准抗草甘膦除草剂转基因大豆商业化种植以来,种植面积逐年增加,2017年全球种植面积达9 410万hm2,占所有转基因作物种植面积的50%[1]。随着转基因作物商业化生产步骤的加快,转基因作物的风险评价备受关注[2-5]。转基因作物对土壤生态环境和微生物群落结构、功能及多样性的影响是其安全性评价的一个重要内容[6],土壤-微生物-作物三者互作的特殊微生态系统组成根际环境,根际环境是作物根系营养成分吸收、新陈代谢和生长的场所,根际微生物广泛存在大豆根际生境中,并对大豆生长产生多方面的影响[7]。转基因作物种植后,其表达的外源基因产物进入到土壤后,可能与土壤微生物发生作用从而影响其活动和功能[8]。由于农田中土壤微生物群落的组成和多样性与作物的根际分泌物有关,转基因与非转基因作物的根际分泌物的变化导致其对土壤微生物群落的影响有所不同[9]。因此,转基因作物对土壤微生物的多样性、结构和功能的影响是作为评价转基因作物安全的重要指标之一[10]。此外,转基因作物残茬对土壤生态系统、土壤特异生物功能团、土壤生物多样性也可能产生一定的影响[11]。
BIOLOG是描述微生物群落功能多样性变化的重要指标,它能代表实际土壤微生物群体对碳源利用的动力学特征[12]。研究发现转基因大豆和转基因玉米根际微生物群落功能多样性与受体的相比无显著性差异[13-15],但转Bt基因水稻SHK601与受体水稻相比对根际微生物群落功能有短暂影响[16]。不同耐草甘膦转基因大豆对根际土壤固氮细菌多样性的影响研究发现,耐草甘膦转基因大豆M88、GTS40-3-2和非转基因大豆中黄13根际土壤固氮细菌多样性指数和均匀度指数无显著差异;抗虫耐草甘膦转基因大豆ZB根际土壤固氮细菌多样性指数显著高于非转基因大豆中黄13,均匀度指数无显著差异[15]。转G10-EPSPS基因抗草甘膦大豆SHZD32-01和配施草甘膦处理后,显著影响结荚期根际土壤细菌和根瘤菌的多样性,但其影响随大豆的生长而逐渐消失[17]。王丽娟等[18]研究发现,转基因大豆PAT和ALS根际土壤微生物活性均高于相应亲本,两种转基因大豆根际土壤微生物群落物种均一度和优势度指数较对应亲本均无显著差异,主成分分析发现,非转基因亲本大豆ALS1以及中黄13土壤微生物群落碳源利用类型相似,仅转基因大豆ALS土壤微生物碳源利用类型表现出差异。
不同转基因作物品种对土壤微生物群落的影响有一定的差异,基于转基因作物安全性评价的个案原则开展相关研究是其安全性评价的必要步骤。本研究以抗草甘膦转基因大豆AG5601、亲本SNK500及常规大豆中黄13为材料,采用BIOLOG-ECO技术,对成熟期和收割60 d后的根际残茬根际微生物群落功能多样性的差异进行比较分析。其结果有助于解析抗草甘膦转基因大豆AG5601对根际微生物群落功能的影响及其对碳源利用的情况,为抗草甘膦转基因大豆安全性评价提供参考。
1 材料与方法 1.1 材料 1.1.1 供试大豆品种抗草甘膦转基因大豆AG5601和亲本非转基因大豆SNK500由美国孟山都公司提供,当地常规品种中黄13由中国农业科学院廊坊科研中试验基地提供。
1.1.2 试验地点和气候条件本试验于2016年在河北省廊坊市安次区炊庄中国农业科学院廊坊科研中试验基地进行,试验期间5-10月的月平均气温为20.6、23.7、27.4、25.0、19.4及14.5℃,平均降雨量为50.0 mm、67.9 mm、75.2 mm、75.2 mm、74.3 mm及68.0 mm。
参照转基因植物及其产品环境安全检测耐除草剂大豆第4部分:“生物多样性影响”(中华人民共和国农业部公告第2031号公告),试验设3个处理分别为抗草甘膦转基因大豆AG5601、亲本大豆SNK500和当地常规品种中黄13,每个处理4次重复,共12个小区。小区采用随机排列,小区间设有1.5 m宽的空白隔离带,小区面积约150 m2(长11.5 m,宽13.0 m)。2016年5月25日播种,试验小区常规管理,未施用化肥和农药,成熟期土壤的部分化学和生物学性状如表 1所示。
于大豆成熟期和收割后60 d残茬根部取样,每小区随机取10株,用小铲子挖出根部,轻轻抖掉根系外围土,用毛刷轻刷黏附在根表面的土壤作为根际土,用无菌的封口袋密封并充分混匀,过50目筛,作为1个土壤样品。
1.2.2 BIOLOG-ECO分析土壤样品在25℃条件下活化24 h,取3 g土放入27 mL的0.85 mol/L NaC1溶液中,振荡30 min后,吸取3 mL上清,加入27 mL NaC1溶液,混匀后再吸取3 mL上清,加入27 mL NaC1溶液;最终的稀释比例为1:1 000。向ECO板的各孔中加入150 μL的稀释液,每个土样3次重复,将接种好的微孔板放在保湿的容器中,并放入25℃的恒温培养箱中。分别于0、12、24、36、48、60、72、84、96、108、120、132、144、156、168、180、192、204、216、228和240 h在ELxS08 Biolog微孔板读数仪(BIO-TEK Instruments INC,USA)上进行读数并记录。
1.2.3 数据分析利用Excel对ECO板结果进行统计分析。单孔的平均颜色变化率(AWCD)计算方法:

式中,C为处理每个碳源孔的光密度值;R为对照孔的光密度值;n为培养基碳源种类数。
土壤微生物功能多样性采用BIOLOG培养72 h的数据进行分析,以Simpson,Shannon和McIntosh3种指数来表征土壤微生物群落功能多样性。
Shannon指数H用来估算群落多样性的高低,计算公式如下:

其中pi为第i孔的相对吸光值(Ci-R)与整个平板相对吸光值总和的比率
Simpson指数D,用于评估某些常见种的优势度,计算公式如下:
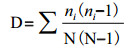
其中ni为第i孔的相对吸光值(Ci-R),N为相对吸光值总和;
Simpson指示用1/D值表示,
McIntosh指数U,反应群落物种均一性,
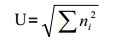
ni同上。
采用SPSS16.0软件进行方差分析和主成分分析,土壤理化性质和微生物多样性指数的显著性分析采用单因素方差分析,对微生物碳源利用进行主成分分析。
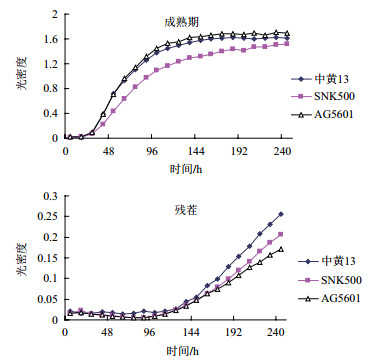
2 结果 2.1 不同处理根际土壤微生物群落平均吸光值的变化由图 1可以看出,AG5601成熟期的根际微生物群落AWCD在整个培养期内均显著高于亲本SNK500,培养72 h后高于常规品种中黄13,但差异不显著;说明AG5601根际微生物的生理活性显著高于亲本SNK500,但与中黄13根际微生物的生理活性相比无显著性差异。残茬期,AG5601、SNK500和中黄13大豆根际微生物群落AWCD随着培养时间的延长,微生物利用碳源量逐渐增加,非转基因大豆SNK500和中黄13大豆根际微生物群落利用碳源量在144 h后略高于AG5601,在整个培养过程中无显著性差异。
|
| 图 1 AG5601,SNK500和中黄13根际微生物在BIOLOG-ECO板上的平均颜色变化率 |
在成熟期,AG5601与亲本SNK500根际土壤微生物群落在McIntosh指数和Simpson指数差异显著,AG5601、SNK500和中黄13根际微生物群落在Shannon指数无显著性差异。AG5601与SNK500残茬的根际土壤微生物群落的Shannon指数、McIntosh指数和Simpson指数均无显著差异,但与中黄13在McIntosh指数上差异显著(表 2)。
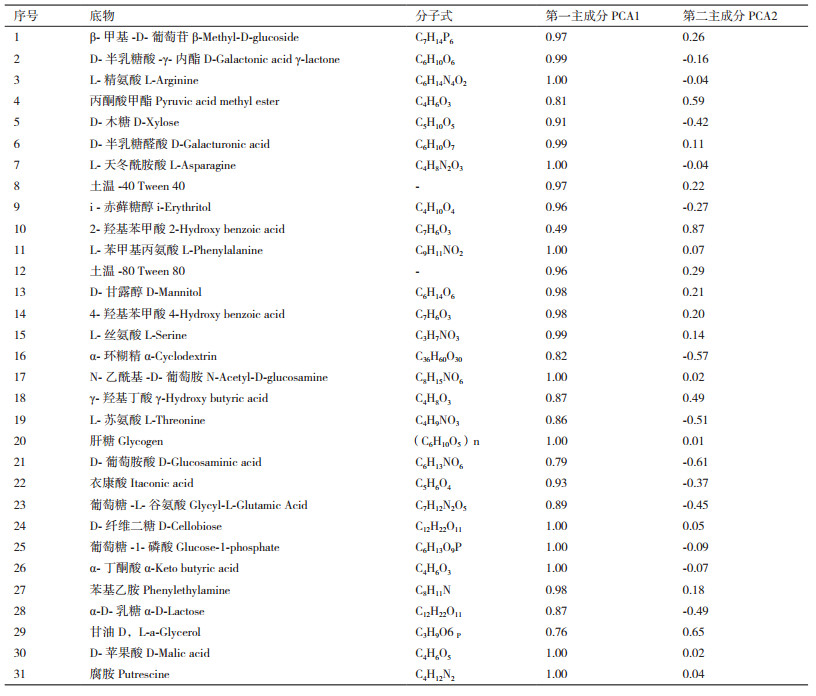
主成分分析发现,AG5601、SNK500和中黄13成熟期的根际微生物群落在第1主成分上的得分没有显著性差异,AG5601在第2主成分上的得分与中黄13差异显著,但与亲本SNK500不显著(图 2)。第1、2主成分贡献率分别为81.88%和10.28%,累积贡献率为92.16%,说明第1主成分是变异的主要来源,起主要参考作用。从31种碳源在2个主成分上的载荷值可知,除2-羟基苯甲酸外,其余30种碳源均集中在第1主成分上,决定了主成分1的分异,而影响主成分2的主要碳源主要是2-羟基苯甲酸、丙酮酸甲酯、α-环糊精、L-苏氨酸、D-葡萄胺酸、甘油(表 3)。综合第1、2主成分分析结果:被AG5601和SNK500根际微生物群落特异利用的碳源有:D-半乳糖酸-γ-内酯、L-精氨酸、D-木糖、L-天冬酰胺酸、I-赤藓糖醇、α-环糊精、L-苏氨酸、D-葡萄胺酸、衣康酸、葡萄糖-L-谷氨酸、葡萄糖- L-磷酸、α-丁酮酸、a-D-乳糖。被中黄13特异利用的碳源有:β-甲基-D-葡萄苷、丙酮酸甲酯、D-半乳糖醛酸、土温-40、2-羟基苯甲酸、L-苯甲基丙氨酸、土温-80、D-甘露醇、4-羟基苯甲酸、L-丝氨酸、N-乙酰基-D-葡萄胺、γ-羟基丁酸、肝糖、D-纤维二糖、苯基乙胺、甘油、D-苹果酸、腐胺。说明在AG5601和SNK500成熟期,根际微生物在碳源的利用上保持一致。
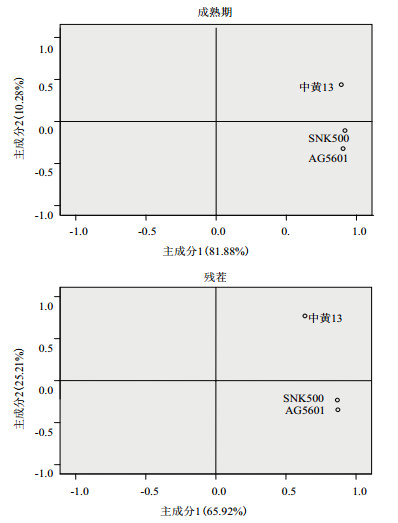
|
| 图 2 土壤微生物碳源利用类型主成分分析(72 h) |
主成分分析发现,AG5601、SNK500和中黄13残茬的根际微生物群落在第1主成分上的得分基本一致,AG5601在第2主成分上的得分与SNK500差异不显著,与中黄13差异显著(图 2)。第1、2主成分贡献率分别为65.92%和25.21%,累积贡献率为91.13%,说明第1主成分是变异的主要来源,起主要参考作用。从31种碳源在2个主成分上的载荷值可见(表 4),除D-半乳糖醛酸、2-羟基苯甲酸、D-甘露醇、4-羟基苯甲酸、N-乙酰基-D-葡萄胺、D-葡萄胺酸不被根际微生物利用外,其他的25种碳源均被根际微生物利用(表 4)。再从25种碳源在2个主成分上的载荷值可以看出,除L-天冬酰胺酸、腐胺外,其余23种碳源均集中在第1主成分上,决定了主成分1的分异,而影响主成分2的主要碳源主要是L-天冬酰胺酸、腐胺、L-精氨酸、葡萄糖-L-谷氨酸、苯基乙胺。综合第1、2主成分结果,被AG5601和SNK500根际微生物群落特异利用的碳源有:L-精氨酸、丙酮酸甲酯、D-木糖、L-天冬酰胺酸、i-赤藓糖醇、L-苯甲基丙氨酸、L-丝氨酸、γ-羟基丁酸、L-苏氨酸、衣康酸、葡萄糖-1-磷酸、α-丁酮酸、苯基乙胺、甘油。被中黄13根际微生物群落特异利用的碳源有:β-甲基-D-葡萄苷、D-半乳糖酸-γ-内酯、土温-40、土温-80、α-环糊精、肝糖、葡萄糖-L-谷氨酸、D-纤维二糖、α-D-乳糖、D-苹果酸、腐胺。其他碳源则可被3种大豆的根际微生物群落共同利用或均不利用。说明AG5601和SNK500残茬的根际微生物群落在碳源的利用上亦保持一致。
土壤根际微生物群落碳源的利用量代表着土壤中可培养微生物群落的数量。土壤微生物的数量是对土壤生态条件的综合反应,土壤微生物中的细菌、真菌、放线菌具有不同的生活习性,它们的数量变化和在土壤微生物中所占的比例对其生活的土壤生态条件具有一定的指示意义[19]。根际是植物与土壤生态系统物质交换的活跃界面,植物同化大气中的CO2,将部分光合产物转运至地下,促进土壤微生物的生长和新陈代谢;土壤中的微生物则将土壤中的有机态养分转化成无机形态,供给植物吸收利用[20]。
近年来随着新转基因作物的出现,转基因作物的种植对根际微生物群落结构和功能的影响受国内外学者的普遍关注[4-6]。土壤微生物作为评价转基因作物安全的重要指标,其群落结构多样性直观地反映转基因作物对土壤生态环境的影响[10]。已有研究结果表明,抗草甘膦转基因大豆与常规大豆根系分泌物相比,表明前者根系分泌物含有的氨基酸和碳水化合物的量更多,进而对根际微生物产生一定影响[21]。本研究结果表明,AG5601与亲本大豆SNK500成熟期的根际微生物群落的光密度差异显著,而与中黄13根际微生物光密度不显著,AG5601、SNK500和中黄13残茬的根际微生物群落的光密度差异无显著性差异。和以往的研究结果相比,不同时期转基因作物根系对土壤微生物的影响有所不同。吕晓波等[21]经过连续3年的大田和盆栽试验,发现转基因大豆与亲本相比,在不同生育期根际土壤细菌和放线菌均表现降低趋势。叶飞等[23]研究发现,在棉花的整个生育期土壤微生物群落的光密度差异不显著,花铃期转基因棉花根际土壤微生物群落的光密度均低于对照。
研究根际微生物群落对不同种类碳源利用率的差异,能够更全面地了解微生物群落代谢功能特征。本研究结果表明,在成熟期AG5601与SNK500根际土壤微生物McIntosh指数、Simpson多样性指数均显著高于中黄13,而AG5601、SNK500和中黄13残茬的根际土壤微生物多样性差异不显著。王丽娟等[18]研究表明,转基因大豆ALS显著提高了根际土壤微生物的物种香农-维纳指数。但并对土壤微生物群落的物种均一度和优势度未产生显著影响。转基因大豆PAT的种植对根际土壤微生物的物种香农-维纳指数、物种均一度和优势度指数均未产生显著影响。梁晋刚等[14]研究表明,转基因高蛋氨酸大豆及其受体大豆在丰富度指数、多样性指数和均匀度指数上均没有显著性差异。转基因抗虫棉SGK321及其亲本棉石远321不同生长时期其根际土壤微生物群落功能多样性的变化研究表明,播种后30 d后,转双价棉根际土壤微生物群落丰富度指数和优势度指数显著高于亲本常规棉,而90 d后,转基因抗虫棉根际土壤微生物群落丰富度指数和优势度指数则显著低于亲本常规棉[24]。以上结果表明,土壤微生物群落丰富度和优势度随转基因作物生长时期的不同而异,但转基因作物的对土壤微生物多样性无显著影响。
Garland等[25]研究结果表明,主成分分析结果中各处理在空间上位置与微生物在碳源的利用能力密切相关。本研究主成分分析结果表明,AG5601、SNK500和中黄13根际微生物群落在第1主成分上的得分基本一致,说明转基因大豆AG5601和非转基因大豆SNK500和中黄13根际在碳源的利用上亦保持一致。王丽娟等[18]研究表明,转基因大豆PAT、亲本PAT1、非转基因亲本大豆ALS1以及中黄13土壤微生物群落碳源利用类型相似,仅转基因大豆ALS土壤微生物碳源利用类型表现出差异。本研究结果表明,转基因大豆AG5601种植后,对于微生物多样性无显著性影响,因此,转基因大豆和常规品种种植后,根际土壤中微生物碳源利用上趋于稳定。
近些年来用新方法分析土壤微生物群落取得了很大的进步,但是这些方法对土壤微生物群落的全面了解具有局限性[26]。而底物碳源的多样性为微生物的生长提供了广泛的选择,从而使大多数可培养微生物均可在有31种碳源的微孔板上进行生命活动,并使微孔板发生颜色变化。土壤生态环境中微生物活性及群落多样性受许多环境因子的影响,如土壤质地结构、土壤肥力、碳源、pH值、水分及植被类别等。而植物根系分泌的有机化合物是影响不同植物根际微生物多样性的关键性因素[27]。由于土壤微生物受到的影响因子太多、太复杂,因此转基因大豆影响土壤微生物的内在机制及多种评价指标有待于进一步的研究。
4 结论本研究发现,虽在成熟期AG5601根际微生物群落利用碳源高于SNK500,但AG5601残茬的根际微生物群落的光密度低于SNK500和中黄13,说明转基因大豆AG5601根系对土壤微生物群落活性的影响是短暂的。主成分分析发现,AG5601与SNK500在成熟期及收获后的残茬根际土壤微生物的碳源利用模式无差别,综上所述,与对照相比,抗草甘膦转基因大豆AG5601对根际微生物群落功能多样性无显著性影响。
| [1] |
国际农业生物技术应用服务组织. 2017年全球生物技术/转基因作物商业化发展态势[J]. 中国生物工程杂志, 2018, 38(6): 1-8. |
| [2] |
Hong B, Du Y, Mukerji P, et al. Safety assessment of food and feed from GM crops in Europe:evaluating EFSA's alternative framework for the rat 90-day feeding study[J]. Journal of Agricultural and Food Chemistry, 2017, 65(27): 5545-5560. DOI:10.1021/acs.jafc.7b01492 |
| [3] |
Lu BR. Challenges of transgenic crop commercialization in China[J]. Nature Plants, 2016, 2(6): 16077. DOI:10.1038/nplants.2016.77 |
| [4] |
刘华清, 李胜清, 陈浩. 转基因作物安全评价及检测技术[J]. 华中农业大学学报:社会科学版, 2010(6): 14-19. |
| [5] |
Pickett JA. The essential need for GM crops[J]. Nature Plants, 2016, 2(6): 16078. DOI:10.1038/nplants.2016.78 |
| [6] |
张艳军, 谢明, 彭德良. 转基因作物对土壤微生物的影响[J]. 应用生态学报, 2013, 24(9): 2685-2690. |
| [7] |
谷岩, 邱强, 王振民, 等. 连作大豆根际微生物群落结构及土壤酶活性[J]. 中国农业科学, 2012, 45(19): 3955-3964. |
| [8] |
梁晋刚, 张秀杰. 转基因作物对土壤微生物多样性影响的研究方法[J]. 生物技术通报, 2017, 33(10): 111-116. |
| [9] |
Liu B, Zeng Q, Yan FM, et al. Effects of transgenic plants on soil microorganisms[J]. Plant & Soil, 2005, 271(1-2): 1-13. |
| [10] |
鄂志国, 陈欣, 职桂叶. 转基因作物对土壤生物的影响[J]. 生态与农村环境学报, 2004, 20(3): 73-76. DOI:10.3969/j.issn.1673-4831.2004.03.018 |
| [11] |
Xue K. Carbon allocation and field residue decomposition dynamics of Mon863 Bt corn and public perceptions of transgenic crops in China[D]. Cornell University, 2009.
|
| [12] |
郑华, 欧阳志云, 方治国, 等. BIOLOG在土壤微生物群落功能多样性研究中的应用[J]. 土壤学报, 2004, 1(3): 456-461. DOI:10.3321/j.issn:0564-3929.2004.03.020 |
| [13] |
陈丰, 彭欣, 华小梅, 等. 富含硫氨基酸转基因大豆对根际土壤有机元素含量和微生物群落多样性的影响[J]. 大豆科学, 2012(2): 259-265. DOI:10.3969/j.issn.1000-9841.2012.02.020 |
| [14] |
梁晋刚, 辛龙涛, 栾颖, 等. 转cry1Ie基因抗虫玉米对根际微生物群落碳代谢的影响[J]. 中国农业科技导报, 2019, 21(2): 104-110. |
| [15] |
章秋艳, 赵建宁, 李刚, 等. 不同耐草甘膦转基因大豆对根际土壤固氮细菌多样性的影响[J]. 农业环境科学学报, 2013, 32(9): 1827-1833. |
| [16] |
Wei M, Tan F, Zhu H, et al. Impact of Bt-transgenic rice(SHK601)on soil ecosystems in the rhizosphere during crop development[J]. Plant Soil & Environment, 2012, 58(5): 217-223. |
| [17] |
沈彬, 洪鑫, 曹越平, 等. 抗草甘膦转基因大豆对根际土壤细菌及根瘤菌的影响[J]. 应用生态学报, 2018, 29(9): 2988-2996. |
| [18] |
王丽娟, 李刚, 赵建宁, 等. 转基因大豆对根际土壤微生物群落功能多样性的影响[J]. 农业环境科学学报, 2013, 32(2): 290-298. |
| [19] |
Lou Y, Davis AS, Yannarell AC. Interactions between allelochemicals and the microbial community affect weed suppression following cover crop residue incorporation into soil[J]. Plant & Soil, 2016, 399(1-2): 357-371. |
| [20] |
Mahnert A, Moissleichinger C, Berg G. Microbiome interplay:plants alter microbial abundance and diversity within the built environment[J]. Frontiers in Microbiology, 2015, 6(887): 887. |
| [21] |
吕晓波, 王宏燕, 刘琦, 等. 抗草甘膦转基因大豆(RRS)在黑土生态系统种植的安全性研究[J]. 大豆科学, 2009, 28(2): 260-265. |
| [22] |
Kremer RJ, Means NE. Glyphosate affects soybean root exudation and rhizosphere microorganisms[J]. International Journal of Environmental Analytical Chemistry, 2005, 85: 1165-1174. DOI:10.1080/03067310500273146 |
| [23] |
叶飞, 宋存江, 陶剑, 等. 转基因棉花种植对根际土壤微生物群落功能多样性的影响[J]. 应用生态学报, 2010(2): 386-390. |
| [24] |
乌兰图雅, 赵建宁, 李刚, 等. 转双价基因抗虫棉对土壤微生物群落多样性的影响[J]. 生态学杂志, 2012, 31(10): 2486-2492. |
| [25] |
Garland JL, Mills AL. Classification and characterization of heterotrophic microbial communities on the basis of patterns of community-level sole-carbon-source utilization[J]. Applied and Environmental Microbiology, 1991, 57(8): 2351-2359. |
| [26] |
Ogram A. Soil molecular microbial ecology at age 20:methodological challenges for the future[J]. Soil Biology and Biochemistry, 2000, 32(11): 1499-1504. |
| [27] |
Liu Y, Li X, Cai K, et al. Identification of benzoic acid and 3-phenylpropanoic acid in tobacco root exudates and their role in the growth of rhizosphere microorganisms[J]. Applied Soil Ecology, 2015, 93: 78-87. DOI:10.1016/j.apsoil.2015.04.009 |