植物糖基转移酶(Glycosyltransferase,GT)是一类与多糖、糖脂、糖蛋白、植物次生产物、核酸等生物分子的代谢密切相关的酶[1-2],在植物细胞中广泛存在,其主要作用方式是通过产生糖苷键将供体糖分子或相关基团转移到特异性受体上[3]。植物中的糖苷键相关受体很多,如甘露糖(Man)类糖蛋白、糖核苷酸等,形成的糖蛋白与相关糖核酸在植物的种子萌发、幼苗生长、生殖和应激等生命过程中均起重要作用[4]。
槲皮素(Quercetin)又名栎精、槲皮黄素,属于黄酮类化合物,分子式为C15H10 O7,难溶于水,可溶于甲醇、冰醋酸、丙酮和碱等。人类日常食物中不仅含有槲皮素自由形态,还存在糖苷的形式,例如芦丁和槲皮苷。近年来国内外研究表明,槲皮素有很多功效,包括抗癌作用[5-6]、抗氧化作用[7]、抗炎作用[8-9]、抗病毒作用[10-11]及心血管保护作用[12]等。但是槲皮素的水溶性较差,在一定程度上影响了它们的开发和利用。因此,需要对这些化合物进行结构改造。而糖基化的主要目的是提高天然产物在水相中的溶解性,从而使一些化合物的理化性质和生理活性发生改变。改变水溶性的方法主要是糖基化,化学合成的方法存在缺乏区域、立体化学选择性,专一性差等缺点,生物转化技术却可以弥补化学合成的不足[13]。
Ko等[14]以来源于蜡状芽胞杆菌的糖基转移酶(BcGT-1)对槲皮素进行糖基化反应,糖基化发生在槲皮素的3位及7位羟基上,该转化体系以UDP(尿苷二磷酸)-葡萄糖为糖基供体,槲皮素为糖基受体,分别得到槲皮素-3-O-葡萄糖苷和槲皮素-7-O-葡萄糖苷。Lim等[15]以来源于拟南芥的7种尿苷二磷酸葡萄糖糖基转移酶(UGT)对槲皮素进行糖基化修饰,该转化反应以UDP-葡萄糖为糖基供体,糖基化位置分别在槲皮素的3、7、3'和4'位羟基,得到6种不同的糖基化产物。Son等[16]以蔗糖合成酶与糖基转移酶的融合蛋白对槲皮素进行糖基化,反应以UDP-葡萄糖为糖基供体,槲皮素为糖基受体时,得到槲皮素-7,3' -2-O-葡萄糖苷。
查阅相关文献发现[14-18],糖基化反应的酶多是来源于微生物体内,且其反应会生成多个产物,这对产物的纯化造成一定的困难,并且天然黄酮类糖基化多发生在植物当中,所以本实验研究的是葡萄柚中的糖基转移酶(FGT),对槲皮素、柚皮苷、柚皮素进行糖基化。以FGT作为糖基转移酶对黄酮类化合物进行糖基化的研究较少,并且所得到的糖苷产物为单一性产物,简化了后续的纯化操作。本研究给未来槲皮素糖基化的工业制备提供了新的思路。
1 材料与方法 1.1 材料 1.1.1 菌种的来源基因工程菌Escherichia coli BL21 / pGEX-4T-1-FGT由本实验室构建、保存。
1.1.2 试剂与仪器槲皮素、柚皮素、柚皮苷购买于成都德锐可生物科技有限公司; AB-8大孔吸附树脂、Sephadex LH-20填料购买于北京英莱克科技发展有限公司; 实验中所涉及的所有试剂均来自于上海生物工程生物科技有限公司,乙腈为HPLC级别; 高效液相色谱(安捷伦公司,规格型号:1260)。
1.2 方法 1.2.1 菌株的表达与纯化将实验室已构建的工程菌培养在含终浓度0.1 g/L氨苄青霉素的100 mL LB培养基中,37℃。培养基的OD600达到0.8后,添加异丙基-1-硫代-β-D-硫代半乳糖苷(IPTG)进行诱导,IPTG的最终浓度为4×10-4 mol/L,20℃下10-12 h。离心收集菌体(10 000 r/min,10 min,4℃),再用1-2 mL buffer(2×10-2 mol/L Tris-HCl,pH7.3)重悬,4℃下5 min,弃上清后-80℃保存菌体。菌体破碎采用反复冻融的方法,用裂解缓冲液(5×10-2 mol/L Tris-HCl,pH 8.0; 1×10-1 mol/L NaCl; 5×10-3 mol/L EDTA; 1 g/L溶菌酶; 1×10-3 mol/L DTT)稀释10倍。目标蛋白用GST标签柱纯化。该纯化的酶用12%聚丙烯酰胺凝胶电泳(SDS-PAGE)检验,并加10%甘油保存于-80℃冰箱中。
1.2.2 酶浓度的测定蛋白浓度的测定采用考马斯亮蓝法(Bradford法)[19]。采用Bradford蛋白浓度试剂盒对所纯化的蛋白进行浓度的测定。
蛋白标准液的制备:把5 mg/L牛血清蛋白,用1×PBS稀释为:10、20、40、60、80、100、120 μg/mL。
分光光度法:分别取不同稀释浓度标准液100 μL,加入到1.5 mL离心管中,再加入1 mL Bradford工作液,迅速混匀。室温下反应5 min后,在分光光度计上测各管的A595值。根据所测的数据得到线性方程,后续纯化得到的蛋白可以根据线性方程得到相应的蛋白浓度。酶液检测的A595值带入下列方程中,可直接得到酶浓度。计算公式如下:
$ 酶浓度 = \frac{{\left( {{{\rm{A}}_{595}}值 - 0.014} \right) \times 稀释倍数}}{{0.0072}} $
1.2.3 酶催化反应将已纯化的FGT酶进行催化反应,反应体系包括:40 μL 2×10-2 mol/L的不同黄酮(槲皮素、柚皮素、柚皮苷)和20 μL 1×10-2 mol/L UDP-糖(UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖),50 μL 5×10-2 mol/L pH 7.0的Tris-HCl缓冲液和25 μL 5×10-2 mol/L MgCl2,85 μL去离子水,混合后,加入150 μL 0.4 g/L FGT酶。相同体系下不加FGT酶为对照组。在35℃下反应16-24 h。产物用高效液相色谱(HPLC)检测。
1.2.4 酶催化反应条件的研究 1.2.4.1 pH对酶活的影响研究pH对酶活性的影响,pH的区间为3.0-9.0,温度35℃,采用的缓冲液分别为:5×10-2 mol/L柠檬酸缓冲液,pH 3.0-5.0; 5×10-2 mol/L Na2HPO4-NaH2PO4缓冲液,pH 6.0-7.0; 5×10-2 mol/L Tris-HCl,pH 8.0-9.0。产物的量用HPLC方法来定量。制作出产物的量与反应pH的曲线图。
1.2.4.2 温度对酶活的影响研究温度对酶活性的影响,温度的测量范围为20-45℃,底物为槲皮素与UDP-葡萄糖,pH 7.0,产物的量用HPLC方法来定量。制作出产物的量与反应温度的曲线图。
1.2.5 槲皮素糖苷分离纯化 1.2.5.1 AB-8大孔吸附树脂分离纯化[20]预处理方法:先用3%的氢氧化钠溶液浸泡24 h,再用蒸馏水清洗至pH值为中性,湿法装柱,用2-3倍柱体积的95%乙醇洗柱,最后用蒸馏水洗去乙醇即可。将反应液浓缩,浓缩后的样品在AB-8大孔吸附树脂中吸附3 h,后用大量的蒸馏水洗脱,再用80%乙醇洗脱,收集洗脱液。
1.2.5.2 Sephadex LH-20柱分离纯化[21]预处理方法:用50%甲醇溶液溶胀填料5 h,湿法装柱,用10倍柱体积的50%甲醇低流速清洗。乙醇样品浓缩后,上样。先用50%甲醇溶液洗脱,收集槲皮素糖苷样品,再用80%甲醇溶液洗脱槲皮素。
1.2.6 产物检测方法 1.2.6.1 HPLC检测得到的反应液经过0.22 μm孔径的滤膜过滤,使用安捷伦TC-C18,150×4.6 mm柱。液相检测方法,槲皮素:缓冲液A为含0.1%磷酸的水溶液,缓冲液B为乙腈,运行程序:0 min 75% B到15 min 60% B,流速1 mL/min,进样量为5 μL,370 nm,温度为30℃。柚皮素、柚皮苷:缓冲液A为含0.1%磷酸的水溶液,缓冲液B为乙腈,运行程序:0 min 75% B到30 min 5% B,流速1 mL/min,进样量5 μL,285 nm,温度30℃。
1.2.6.2 槲皮素糖苷的液相色谱-质谱联用(LC-MS)检测分析WATERS MALDI SYNAPT Q-TOF MS(WATERS,UK)进行MS分析。采用负离子化方式,毛细管电压为3.5 KV,加热温度为100℃。检测槲皮素糖苷分子量。
1.2.6.3 槲皮素糖苷的核磁氢谱(NMR)检测分析冷冻干燥的样品用氘代-二甲基亚砜溶解,在Aduance Ⅲ 400 MHZ质谱仪上检测糖苷产物结构。
2 结果 2.1 FGT纯化及浓度测定结果根据实验室已构建的FGT酶信息可得,目的蛋白的大小为76.7 kD。聚丙烯酰胺凝胶电泳(SDS-PAGE)结果(图 1)显示,所纯化得到的蛋白为目的蛋白FGT酶,图中在26 kD左右的位置出现的条带为在纯化过程中断裂的GST标签。
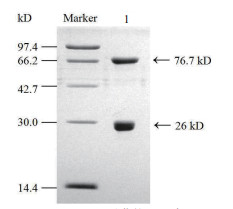
|
| Marker: 1:纯化的FGT酶 图 1 FGT酶纯化SDS-PAGE结果 |
用HPLC分别对9种组合反应液进行检测验证(图 2)。图 2-A-C为槲皮素作为底物的反应,糖基供体依次为UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖,相同反应时间,HPLC检测图谱显示,以UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖为糖基供体时,在4 min左右出现了一个新的吸收峰,表示生成了新的产物。11 min左右的吸收峰为未反应的槲皮素。而UDP-甘露糖却没有生成新的物质,说明FGT酶可以催化槲皮素与UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖发生糖基化反应。图 2-D-F为柚皮苷作为底物的反应,糖基供体依次为UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖,HPLC检测结果显示并没有新的物质生成。图 2-G-I为柚皮素作为底物的反应,糖基供体依次为UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖,HPLC检测结果显示没有新的物质生成。
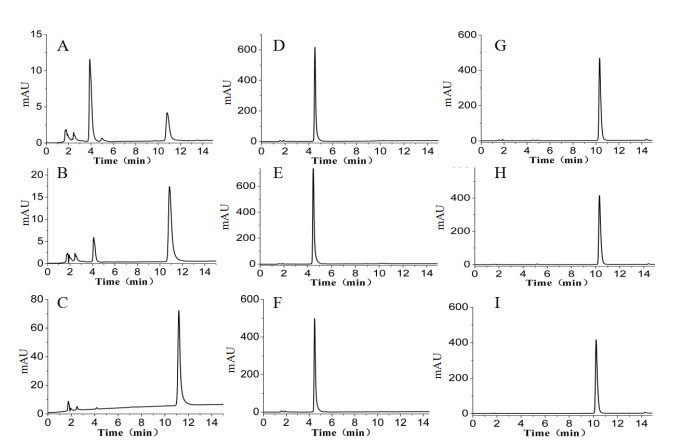
|
| A-C为槲皮素作为底物,D-F为柚皮苷作为底物,G-I为柚皮素作为底物,糖基供体分别为UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖 图 2 FGT催化糖基化反应结果HPLC分析 |
实验以槲皮素和UDP-葡萄糖作为底物,pH设置为3、4、5、6、7、8、9。通过HPLC结果分析,pH 7的产物量最高,所以以pH 7产物量做对照,制作了一个曲线图来探究出其他pH值的相对活性(图 3-A)。pH 3、4相对活性为0,即在这两种pH环境下酶丧失活性,HPLC检测没有生成新的产物。pH 5相对比活为24.87%,pH 6相对比活为46.15%,pH 8相对比活为58.97%,pH 9相对比活为17.44%。
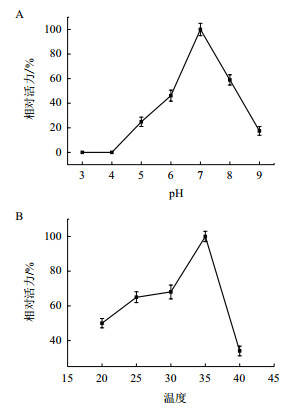
|
| A:研究pH对FGT酶活力的影响; B:研究温度对FGT酶活力的影响 图 3 pH与温度对酶活影响 |
实验以槲皮素和UDP-葡萄糖作为反应底物,温度设置为20℃、25℃、30℃、35℃、40℃(图 3-B)。以35℃为对照,计算其他温度相对活性。20℃相对比活为50%,25℃相对比活为65%,30℃相对比活为68%,40℃相对比活为34%。
2.4 槲皮素糖苷分离纯化结果反应液经过AB-8大孔吸附树脂除去杂质、Sephadex LH-20柱纯化得到槲皮素糖苷,分离的效果用HPLC检测,得到的结果如图 4所示。图 4-A-C为槲皮素与UDP-葡萄糖糖基化反应生成的糖苷纯化HPLC检测图谱,图 4-A为反应后的HPLC图谱,图中4 min左右出现的峰为目标产物槲皮素糖苷,11 min左右出现的峰为槲皮素; 图 4-B为经过AB-8大孔吸附树脂纯化后的HPLC检测图谱,与图A对比,去除了2-3 min之间的杂质; 图 4-C为经过Sephadex LH-20柱得到的糖苷HPLC检测图谱,结果表明,可以得到较纯的槲皮素葡萄糖苷。图 4-D-F为槲皮素与UDP-N-乙酰-D-氨基葡萄糖糖基化反应生成的糖苷纯化HPLC检测图谱,图 4-D为反应后的HPLC图谱,图中4.1 min左右出现的峰为目标产物,11 min左右出现的峰为槲皮素; 图 4-E为经过AB-8大孔吸附树脂纯化后得到的HPLC图谱,与图 4-D比较,去除了1-3 min的杂质; 图 4-F为经过Sephadex LH-20柱纯化后得到的糖苷产物的HPLC图谱,结果表明,可以得到较纯的槲皮素N-乙酰-D-氨基葡萄糖苷产物。HPLC检测结果显示,通过两种柱分离的方法可以得到纯度较高的槲皮素糖苷产物。
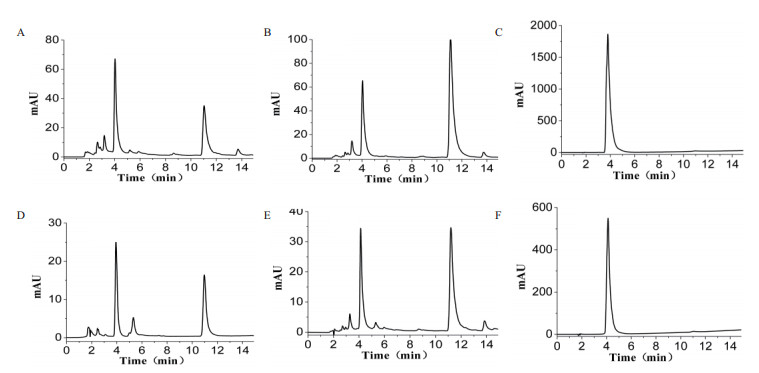
|
| A:催化以UDP-葡萄糖为底物反应16 h后的HPLC图谱; B:以UDP-葡萄糖为底物AB-8大孔吸附树脂纯化HPLC图谱; C:以UDP-葡萄糖为底物Sephadex LH-20纯化HPLC图谱; D:催化以UDP-N-乙酰-D-氨基葡萄糖为底物反应16 h后的HPLC图谱; E:以UDP-N-乙酰-D-氨基葡萄糖为底物AB-8大孔吸附树脂纯化HPLC图谱; F:以UDP-N-乙酰-D-氨基葡萄糖为底物Sephadex LH-20纯化HPLC图谱 图 4 酶催化产物的HPLC检测结果 |
对能够产生新物质的反应体系做进一步MS检测。本实验中,检测使用的是负离子源,槲皮素的分子量为302,葡萄糖分子量为180,当葡萄糖分子结合到槲皮素上时会脱去一分子水,故而产物的分子量为464。所以根据负离子源时会产生失去氢峰,分子量减少1,所以质谱图中显示的是463(图 5-A),证明反应生成的产物为槲皮素-葡萄糖苷。同理,UDP-N-乙酰-D-氨基葡萄糖的分子量为221,与槲皮素结合后脱去一分子水后分子量为505,质谱检测采用的是负离子源,所以显示的分子量为504(图 5-B)。证明反应生成了槲皮素-N-乙酰-D-氨基葡萄糖苷。
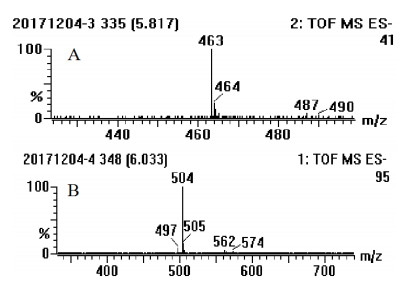
|
| A:槲皮素与UDP-葡萄糖反应生成产物的质谱检测结果; B:槲皮素与UDP-N-乙酰-D-氨基葡萄糖反应生成产物的质谱检测结果 图 5 槲皮素糖苷产物质谱检测 |
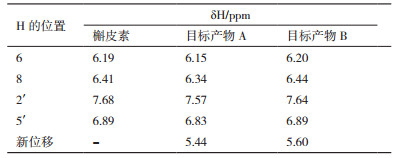
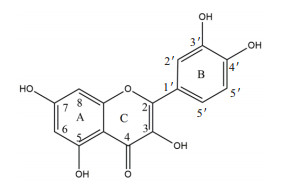
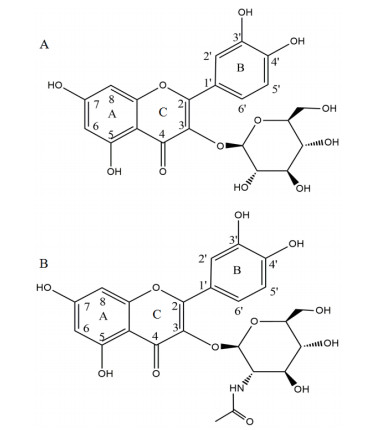
氢原子具有磁性,如电磁波照射氢原子核,它能通过共振吸收电磁波能量,发生跃迁。用核磁共振仪可以记录到有关信号,处在不同环境中的氢原子因产生共振时吸收电磁波的频率不同,在图谱上出现的位置也不同,各种氢原子的这种差异被称为化学位移(ppm)。槲皮素结构如图 6所示。槲皮素葡萄糖苷的核磁共振氢谱分别如图 7所示。将6、8、2'、5'位的氢原子的化学位移分别同槲皮素进行对比,结果如表 1所示。槲皮素6、8、2'、5'化学位移分别为6.19、6.41、7.68、6.89 ppm。目标产物A(槲皮素葡萄糖苷)在6、8、2'、5'化学位移分别为6.15、6.34、7.57、6.83 ppm,且多了一个新的化学位移5.44 ppm,相比较槲皮素,6、8、2'、5'化学位移几乎没有改变,这表明并没有在A、B环出现糖苷信号。出现这种现象表明糖苷分子连接在C环的3号位,且是β连接。同理,目标产物B(槲皮素-N-乙酰-D-氨基葡萄糖苷)在6、8、2'、5'化学位移分别为6.20、6.44、7.64、6.86 ppm,且多了一个新的化学位移5.60 ppm,相比较槲皮素6、8、2'、5'化学位移几乎没有改变,所以根据文献报道[22]得知糖苷分子连接在C环的3号位,且是β连接。推测出来的结构图如图 8所示。
|
| 图 6 槲皮素的结构式 |
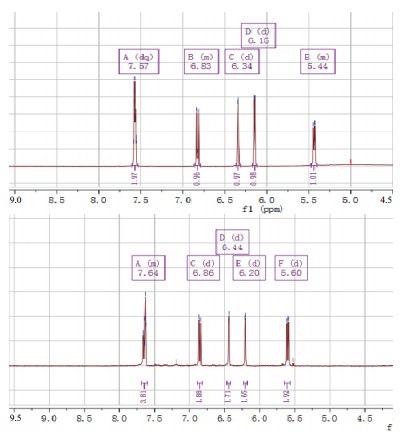
|
| A:槲皮素与UDP-葡萄糖反应生成产物的1H-NMR检测结果; B:槲皮素与UDP-N-乙酰-D-氨基葡萄糖反应生成产物的1H-NMR检测结果 图 7 槲皮素糖苷的1H-NMR谱图 |
|
| A:槲皮素-3-O-β-D-葡萄糖苷,B:槲皮素3-O-β-D-N-乙酰-D-氨基葡萄糖苷 图 8 槲皮素糖苷分子结构图 |
槲皮素大量存在于各种植物以及日常食物和饮料中,如洋葱、苹果、浆果、西兰花、茶和红葡萄酒。并且槲皮素有很多功效,包括抗癌作用[5-6]、抗氧化作用[7]、抗炎作用[8-9]、抗病毒作用[10-11]、心血管保护作用[12]等。尽管槲皮素有如此多的生理活性功能,但槲皮素水溶性低,生物利用度差,而对槲皮素进行糖基化修饰后,可以明显提高水溶性。糖基化方法主要有酶法制备和化学合成,化学合成的方法存在缺乏区域、立体化学选择性及专一性差等缺点,生物转化技术却可以弥补化学合成的不足[13]。
本研究采用葡萄柚中的糖基转移酶FGT对黄酮类化合物进行糖基化修饰,发现FGT酶可以以UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖为糖基供体和槲皮素进行反应,HPLC检测出新物质。根据槲皮素-3-O-葡萄糖标准品,可以确定以UDP-葡萄糖为糖基供体的反应生成了槲皮素糖苷,但是由于没有槲皮素-N-乙酰-D-氨基葡萄糖苷的标准品作为对照,所以只能根据HPLC检测结果和槲皮素-3-O-葡萄糖标准品的出峰位置,推断4.1 min左右出峰位置为槲皮素-N-乙酰-D-氨基葡萄糖苷。根据糖苷性质对两种产物分离纯化,质谱检测后,验证了我们的推断正确,再用核磁共振氢谱检测确定两种糖苷的结构。
本实验所采用的是来源于植物中的糖基转移酶,相比来源于微生物体内的糖基转移酶(如源于蜡状芽孢杆菌的糖基转移酶(BcGT-1)对槲皮素进行糖基化反应,该转化体系以UDP(尿苷二磷酸)-葡萄糖为糖基供体,槲皮素为糖基受体,分别得到槲皮素-3-O-葡萄糖苷和槲皮素-7-O-葡萄糖苷[14]),我们获得的两种糖苷都发生在槲皮素的3号位上,相比较而言,FGT酶的专一性更强,且生成单一产物,有利于简化产物纯化操作过程。
然而,目前我们的研究还不够完善,接下来可以进行体内体外抗氧化活性研究,全方位比较槲皮素与槲皮素糖苷生理活性的差异性。此外还需要对FGT酶转糖基作用机理的研究,因为FGT酶目前没有文献报道过,所以这有利于为后续糖基转移酶的研究奠定重要基础。
4 结论以FGT作为催化酶,对黄酮类物质进行糖基化。参与反应的糖基受体为槲皮素、柚皮素、柚皮苷,糖基供体为:UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖、UDP-甘露糖。经HPLC检测结果显示,FGT仅可以催化槲皮素作为糖基受体,可与其发生反应的糖基供体为UDP-葡萄糖、UDP-N-乙酰-D-氨基葡萄糖。对生成物进行质谱检测,生成产物的分子量分别为463、504。进一步用核磁共振氢谱鉴定结构,初步判定两个糖苷产物分别为槲皮素-3-O-β-D-葡萄糖苷、槲皮素3-O-β-D-乙酰-D-氨基葡萄糖苷。酶的最适温度和pH分别为35℃和7.0。
| [1] |
Charnock SJ, Henrissat B, Davies GJ. Three-dimensional structures of UDP-sugar glycosyltransferases illuminate the biosynthesis of plant polysaccharides[J]. Plant Physiol, 2001, 125(2): 527-531. DOI:10.1104/pp.125.2.527 |
| [2] |
Gachon CMM, Langlois-Meurinne M, Saindrenan P. Plant secondary metabolism glycosyltransferases: the emerging functional analysis[J]. Trends Plant Sci, 2005, 10(11): 542-549. DOI:10.1016/j.tplants.2005.09.007 |
| [3] |
Coutinho PM, Deleury E, Davies GJ, et al. An evolving hierarchical family classification for glycosyltransferases[J]. Mol Biol, 2003, 328(2): 307-317. DOI:10.1016/S0022-2836(03)00307-3 |
| [4] |
尹恒, 王文霞, 赵小明, 等. 植物糖生物学研究进展[J]. 植物学报, 2010, 45(5): 521-529. DOI:10.3969/j.issn.1674-3466.2010.05.001 |
| [5] |
Khorsandi L, Orazizadeh M, Niazvand F, et al. Quercetin induces apoptosis and necroptosis in MCF-7 breast cancer cells[J]. Bratisl Lek Listy, 2017, 118(2): 123-128. |
| [6] |
Yu D, Ye T, Xiang Y, et al. Quercetin inhibits epithelialmesenchymal transition, decreases invasiveness and metastasis, and reverses IL-6 induced epithelial-mesenchymal transition, expression of MMP by inhibiting STAT3 signaling in pancreatic cancer cells[J]. Onco Targets Ther, 2017, 201(10): 4719-4729. |
| [7] |
王中旺, 许梦川, 杨雯茜, 等. 槲皮素对2型糖尿病患者机体铁代谢的影响[J]. 河北师范大学学报:自然科学版, 2017, 41(3): 272-276. |
| [8] |
汤喜兰, 刘建勋, 董伟, 等. 槲皮素对大鼠乳鼠心脏成纤维细胞炎症分泌的干预作用[J]. 中国中药杂志, 2014, 39(12): 2314-2317. |
| [9] |
Byun EB, Yang MS, Choi HG, et al. Quercetin negatively regulates TLR4 signaling induced by lipopolysaccharide through Tollip expression[J]. Biochem Biophys ResCommun, 2013, 431(4): 698-705. DOI:10.1016/j.bbrc.2013.01.056 |
| [10] |
万巧凤, 吴莉, 杨美玲, 等. 槲皮素对甲型H1N1流感病毒诱导的A549细胞凋亡效应酶Caspase-3的影响[J]. 中国中医药信息杂志, 2011, 18(10): 42-44. DOI:10.3969/j.issn.1005-5304.2011.10.016 |
| [11] |
张丹丹, 方建国, 陈娟娟, 等. 连翘及其主要有效成分槲皮素体外抗人巨细胞病毒的实验研究[J]. 中国中药杂志, 2010, 35(8): 1055-1059. |
| [12] |
Hui L, Xiao LG, Yi C, et al. Heart protective effects and mechanism of quercetin preconditioning on anti-myocardial ischemia reperfusion(IR)injuries in rats[J]. Gene, 2014, 4(43): 1-7. |
| [13] |
吴薛明, 许婷婷, 储建林, 等. 黄酮类化合物酶法糖基化修饰的研究进展[J]. 中国天然药物, 2010, 8(5): 389-400. |
| [14] |
Ko JH, Kim BG, Ahn JH. Glycosylation of flavonoids with a glycosyltransferase from Bacillus cereus[J]. FEMS Microbiology Letters, 2006, 258(2): 263-268. DOI:10.1111/fml.2006.258.issue-2 |
| [15] |
Lim EK, Ashford DA, Hou BK, et al. Arabidopsis glycosyltransfe-rases as biocatalysts in fermentation for regioselective synthesis of diverse quercetin glucosides[J]. Biotechnol Bioeng, 2004, 87(5): 623-631. DOI:10.1002/(ISSN)1097-0290 |
| [16] |
Son MH, Kim BG, Kim DH, et al. Production of flavonoid O-glucoside using sucrose synthase and flavonoid O-glucosyltrans-ferase fusion protein[J]. Journal of Microbiology and Biotechnology, 2009, 19(7): 709-712. |
| [17] |
Xu JQ, Fan N, Yu BY, et al. Biotransformation of quercetin by Gliocladium deliquescens NRRL 108[J]. Chinese Journal of Nature Medicines, 2017, 15(8): 615-424. DOI:10.1016/S1875-5364(17)30089-4 |
| [18] |
De Bruyn F, Van Brempt M, Maertens J, et al. Metabolic engineering of Escherichia coli into a versatile glycosylation platform: production of bio-active quercetin glycosides[J]. Microbial Cell Factories, 2015, 14: 1-12. DOI:10.1186/s12934-014-0183-3 |
| [19] |
焦洁. 考马斯亮蓝G-250染色法测定苜蓿中可溶性蛋白含量[J]. 农业工程技术, 2016, 36(17): 33-34. |
| [20] |
李侠, 臧学丽, 徐祎博, 等. AB-8大孔树脂纯化绿豆皮黄酮工艺优化及纯化前后抗氧化能力比较[J]. 食品科学, 2018, 39(10): 283-290. DOI:10.7506/spkx1002-6630-201810043 |
| [21] |
Aramsangtienchai P, Chavasiri W, Ito K, et al. Synthesis of epicatechin glucosides by a cyclodextrin glycosyltransferase[J]. Molecular Catalysis B: Enzymatic, 2011, 73: 27-34. DOI:10.1016/j.molcatb.2011.07.013 |
| [22] |
Chiu HH, Hsieh YC, Chen YH, et al. Three important amino acids control the regioselectivity of flavonoid glucosidation in glycosyltransferase-1 from Bacillus cereus[J]. Applied Microbiology and Biotechnology, 2016, 100(9): 8411-8424. |