FAD依赖的葡萄糖脱氢酶(FAD-dependent glucose dehydrogenase, 简称FAD-GDH, EC 1.1.99.10), 同葡萄糖氧化酶、吡喃糖脱氢酶、胆碱脱氢酶和甲醇氧化酶一样都属于GMC氧化还原酶(Glucose-methanol-choline-oxidoreductase)家族[1]。它是以FAD为辅基能够在NAD(P)+等存在的情况下催化β-D-葡萄糖生成D-葡萄糖酸-δ-内酯, 而D-葡萄糖酸-δ-内酯会自发形成葡萄糖酸。
研究表明, FAD-GDH是一类重要的临床检测和工业用酶, 可应用于血糖试纸或葡萄糖生物传感器的制备、辅酶的再生、新型燃料电池[2]和心脏起搏器[3]的研制等。尤其是可以作为血糖检测用酶, FAD-GDH不以氧气作为酶促反应的电子受体, 检测结果更准确, 且具有转化率高、底物特异性好等优点, 因此有很大的应用前景。
虽然到目前为止已经有不少FAD-GDH被分离和鉴定, 但是针对特定FAD-GDH全面深入的研究很少, 主要原因是FAD-GDH很难实现可溶的重组表达, 在大肠杆菌进行重组表达时形成包涵体, 不易分离纯化。重组表达是克服这一障碍的有效方法。在真核表达系统, 毕赤酵母中有过实现可溶表达, 得到有活性的FAD-GDH的报道[4]。毕赤酵母(P. pastoris)表达系统在进行外源基因表达时, 具有生长周期短、可进行胞外分泌表达、目的蛋白易于纯化和易于高密度发酵培养等优点[5-7]。由于毕赤酵母对密码子的偏爱性, 目的基因的密码子序列对产物的表达量也有很大影响。大量研究表明, 密码子优化对提高产物表达量有明显的作用[8-13]。因此, 如果想提高产物的产量, 不但要优化表达条件, 还需要对密码子进行优化, 以期为FAD依赖的葡萄糖脱氢酶进一步扩大生产提供理论和技术支持, 使其更好的应用于血糖检测及其他相关领域[14]。
本研究以NCBI上登录号为XM_001216916的土曲霉NIH2624基因为基础, 根据毕赤酵母的密码子偏爱性对该基因的密码子进行优化, 然后委托公司进行基因合成。接着将该基因克隆到毕赤酵母中, 并在基因的3′端接上6个组氨酸标签的核苷酸序列, 以便于重组表达蛋白的纯化。经过筛选和优化, 得到了高产该FAD-GDH的重组菌株。采用该菌株摸索发酵条件, 实现了该蛋白的高效表达, 并对其酶学性质进行了研究。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒FAD依赖葡萄糖脱氢酶基因由安徽通用生物公司合成, 合成的基因连接在pUC57T载体上; 大肠杆菌DH5α购自上海生工; 酵母表达菌株X33由中科院微生物研究所提供; 质粒pMD由本实验室前期构建。
1.1.2 酶和主要试剂EcoR I、Not I和Sac I限制性内切酶为NEB公司产品; T4 DNA连接酶为Thermo公司产品; DNA Marker、DNA凝胶回收试剂盒和质粒DNA小提试剂盒为天根生化科技有限公司产品; G418为Sigma公司产品; 2, 6-二氯靛酚钠(DCIP)为BBL Life Sciences公司产品, BeyoGoldTM His-tag Purification Resin为碧云天生物科技有限公司产品; 其他试剂均为国产分析纯试剂。
1.1.3 培养基LB、YPD、YPDS、YPCS、BMGY和基础盐培养基等培养基配方和X33培养条件参照文献[14]。
1.2 方法 1.2.1 葡萄糖脱氢酶密码子优化及人工合成以NCBI上登录号为XM_001216916的土曲霉NIH2624基因为基础, 根据毕赤酵母的密码子偏爱性对该基因的密码子进行优化, 利用密码子优化软件http://www.jcat.de/分析, 发现蛋白酶基因中有多处是毕赤酵母的稀有密码子, 利用密码子优化软件http://www.jcat.de/, 对蛋白酶基因进行密码子优化, 在不改变氨基酸序列的前提下, 获得优化后的蛋白酶的基因序列。利用信号肽预测服务器SignalP, 服务器网址http://www.cbs.dtu.dk/services/SignalP/, 预测信号肽, 然后去除, 在序列的5′端加上EcoR I酶切位点, 3′端加上6个组氨酸标签后再加Not I酶切位点。然后将优化构建的基因序列送安徽通用生物公司合成, 合成的基因连接在pUC57T载体上。
1.2.2 重组表达载体的构建人工合成的pUC57-GDH和载体pMD经EcoR I和Not I双酶切后切胶回收纯化, 然后用T4 DNA连接酶连接, 转化大肠杆菌DH5α感受态细胞中, 在含氨苄的LB平板上筛选阳性克隆, 对阳性克隆提取质粒进一步进行酶切验证, 由安徽通用生物公司进行测序分析。
1.2.3 阳性转化子的获得构建好的重组表达载体pMD-GDH经SacI线性化后电转表达宿主P. pastoris X33感受态细胞, 电转条件:4 Kv, 3 ms, 然后快速加入1 mL预冷YPDS液体培养基, 于30℃培养箱静置培养2-6 h, 涂布在终浓度为250 μg/mL G418的YPD平板上, 3 d后获得阳性转化子。
1.2.4 重组蛋白的诱导表达将重组菌株X33/pMD-GDH挑取单菌落接种于5 mL YPCS试管培养基中, 14-18 h后加1%(V/V)甲醇, 之后24 h和48 h后均各加1%(V/V)甲醇诱导, 72 h收菌, 8 000 r/min离心5 min收集上清, 测定酶活。至少重复3次。
1.2.5 FAD依赖葡萄糖脱氢酶的酶活测定FAD依赖葡萄糖脱氢酶的酶活测定方法参照文献[4], 使用DCIP作为电子受体, 在30℃反应180 s, 测定520 nm的吸光值变化。
1.2.6 FAD依赖葡萄糖脱氢酶酶学性质分析酶的最适作用温度和pH以及热稳定性、pH稳定性测定、金属离子的影响及底物特异性参照文献[14]。所用的缓冲液均为pH 5.2的磷酸盐缓冲液。
1.2.7 10 L发酵罐放大表达FAD-GDH选取试管水平上FAD依赖的葡萄糖脱氢酶活性最高的转化子, 在10 L发酵罐条件下进行FAD-GDH的表达。挑单克隆接种于YPD培养基培养10 h, 按3%接种量转接于100 mL BMGY培养基至OD600≈6接种于10 L发酵罐, 初期装液量为5.6 L BSM培养基, 高压灭菌20 min后, 以10%发酵体积接种。期间每隔24 h加维生素C水溶液(终浓度80 μg/L), 28℃培养, 每12 h取样测定发酵液酶活; 上清液进行10%聚丙烯酰胺凝胶电泳, 观察FAD-GDH蛋白质的表达。具体方法参照文献[15]。
2 结果 2.1 FAD依赖葡萄糖脱氢酶密码子优化主要优化指标为CAI、密码子使用相对分布、GC含量、酶切位点等, 在不改变氨基酸序列的前提下, 在这段优化的密码子序列中, 共替换了416个碱基, 优化后的密码子序列几乎全部是毕赤酵母的偏爱密码子, 为目的基因在毕赤酵母中成功表达提供了保障。基因序列如图 1所示。
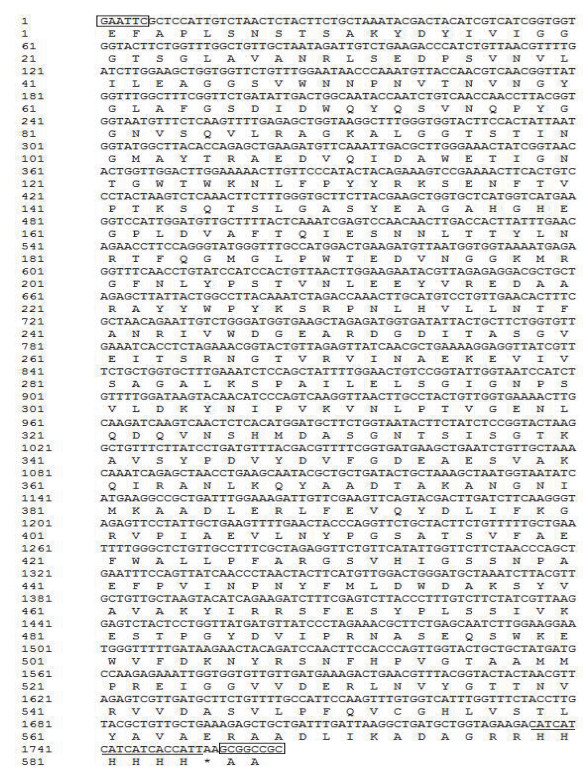
|
| 方框内序列分别为EcoR Ⅰ和Not Ⅰ酶切位点; 划线部分为6个组氨酸标签 图 1 优化后的FAD-GDH基因序列 |
将人工合成包含目的基因的载体和pMD载体分别利用EcoR I和Not I双酶切, 并且利用琼脂糖凝胶回收试剂盒回收目的片段和表达载体片段, 然后利用T4 DNA连接酶将目的片段连接到表达载体上, 并转化大肠杆菌DH5α中, 通过提取质粒, EcoR I/Not I双酶切鉴定质粒的正确性(图 2)。有1.7 kb左右的条带, 说明FAD-GDH基因连接到了pMD载体上, 然后将pMD-GDH质粒送华大基因测序, 测序结果说明目的基因已连接到载体上, 且序列正确。

|
| M:DNA Marker; 1, 2:酶切结果 图 2 pMD-GDH载体双酶切鉴定 |
将酶切正确的重组质粒pMD-GDH进行Sac I线性化后电转表达宿主Pichia pastoris X33, 构建重组菌X33/pMD-GDH, 涂布在终浓度为250 μg/mL G418的YPD平板上, 3 d后获得阳性转化子(图 3)。
|
| 图 3 X33/pMD-GDH单菌落 |
将重组菌株X33/pMD-GDH挑取单菌落接种于5 mL YPCS试管培养基中, 14-18 h后加1%(V/V)甲醇, 之后24 h和48 h后均各加1%(V/V)甲醇诱导, 96 h收菌, 8 000 r/min离心5 min收集上清, 上清液利用DCIP的方法测定FAD依赖葡萄糖脱氢酶的活力, 酶活定义为反应体系中每分钟反应1 μmol电子受体所需的酶量, 并以此来确定重组子是否为阳性。共挑取了18个单菌落诱导培养, 测定酶活, 重复3次, 其中9号酶活较高且稳定(图 4), 试管中酶活为20.85 U/mL, 选其做进一步的研究。

|
| 图 4 高产FAD依赖葡萄糖脱氢酶重组毕赤酵母的试管筛选 |
将在试管中诱导表达收集的酶液经超滤浓缩后进行SDS-PAGE电泳鉴定, 结果如图 5所示, 重组毕赤酵母在60-70 kD之间有一条条带, 与理论分子量相符, 而pMD空载转化的酵母没有类似的条带。并且用DCIP法测定发酵液有活性, 说明FAD依赖的葡萄糖脱氢酶在酵母体内实现了分泌表达。该基因3′端有His-tag序列, 可通过与镍离子的亲和层析进行纯化, 经BeyoGoldTM His-tag Purification Resin纯化后SDS-PAGE分析结果如图 6所示。
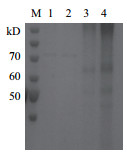
|
| M:蛋白Marker; 1:对照组发酵上清; 2:100×浓缩液; 3:10×浓缩液; 4:浓缩液 图 5 重组蛋白的SDS-PAGE检测结果 |

|
| M:蛋白Marker; 1:纯化蛋白 图 6 重组蛋白纯化结果 |
酶学性质分析结果如图 7-图 9所示, 毕赤酵母表达的FAD-GDH最适反应温度为55℃, 在50℃下处理150 min仍有70%的活性。FAD-GDH的最适pH值为7.0, 在pH 4-7范围内, 37℃保温4 h, FAD-GDH仍能保持50%以上的活性。金属离子Cu2+对酶活抑制作用比较大。FAD-GDH的底物专一性较好, 以葡萄糖为最适底物。当以木糖为底物时, 其相对活性是以葡萄糖为底物的36%;对麦芽糖和海藻糖也有一定活性, 对其他单糖或二糖不显示催化活性。
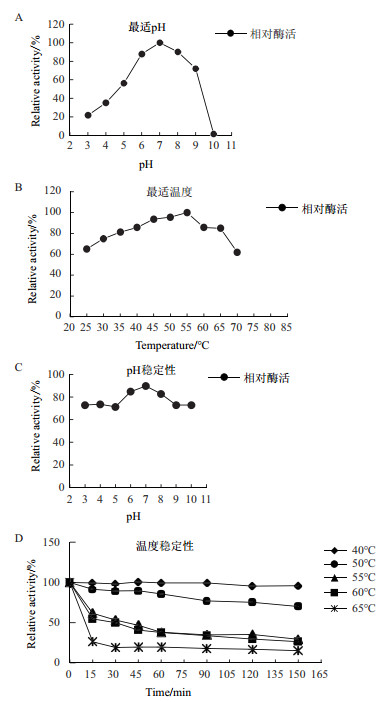
|
| A:最适pH; B:最适温度; C:pH稳定性; D:热稳定性 图 7 FAD-GDH酶学性质 |
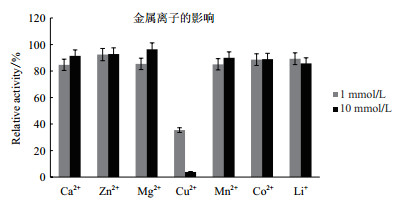
|
| 图 8 不同金属离子对FAD-GDH的影响 |
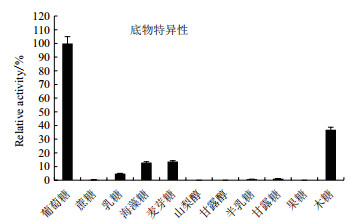
|
| 图 9 FAD-GDH的底物特异性 |
重组菌P. pastoris pMD-GDH在10 L发酵罐的放大培养, 在菌体生长阶段当溶氧DO值在20 h迅速上升(培养基甘油耗尽)时以恒速补加甘油4 h, 饥饿培养0.5 h后开始甲醇诱导。在甲醇诱导阶段, 通过控制DO值来流加甲醇以高效诱导重组毕赤酵母产酶, 同时可避免过高的甲醇对菌体产生毒害作用, 甲醇流加[6 mL/(h·L)]与DO偶联, 即DO值高于0%时补加甲醇, 维持DO 0%左右。随着甲醇添加, FAD依赖葡萄糖脱氢酶酶活不断提升, 甲醇诱导136 h时酶活达到257.6 U/mL(图 10)。此外, 对不同时间点的发酵上清液进行SDS-PAGE电泳分析, 结果显示各上清液在SDS-PAGE图中有一条清晰条带, 该条带随发酵时间增加而变得浓重清晰, 表明发酵上清液中FAD依赖的葡萄糖脱氢酶含量随着发酵时间增加而显著提高, 与酶活增长趋势保持一致。
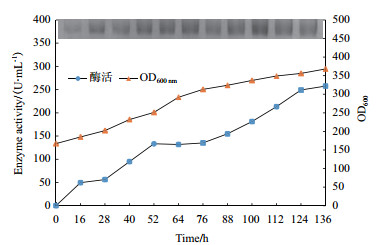
|
| 图 10 上罐发酵实验 |
FAD依赖的葡萄糖脱氢酶作为血糖检测用酶有很大的应用前景, 但是在天然宿主菌中的表达量很低, 在大肠杆菌进行重组表达时形成包涵体, 表达量低, 不易分离[16], 给FAD依赖的葡萄糖脱氢酶的工业应用带来一定的限制, 所以利用基因工程技术实现FAD依赖的葡萄糖脱氢酶的高效表达成了目前研究的重点。酵母表达系统作为一种真核表达系统, 与原核表达系统相比, 具有很多优势, 如生长速度快, 可使用高效的AOX启动子以及可实现异源蛋白的分泌表达等优点, 广泛用于各种具有工业用途的重组蛋白的生产[5-6, 17]。
本实验利用酵母表达系统表达FAD依赖葡萄糖脱氢酶, 通过分析影响表达量的因素, 根据毕赤酵母对密码子的偏爱性对该基因序列进行了优化[18], 提高其表达量。蛋白酶传统分离纯化方法多采用超滤-阳离子柱-超滤-阴离子柱等步骤, 工艺复杂, 收率低。本研究在FAD依赖葡萄糖脱氢酶基因3′端加上了6个组氨酸标签, 可以通过亲和层析的方法进行纯化, 效率高, 适合大规模纯化。
在已有的报道中, 杉木炭疽病菌来源的FAD-GDH在毕赤酵母中得到了较好的表达, 通过采用7 L的发酵罐, 发酵约50.5 h, 产量达到48 000 U/L报道[14]。本实验利用酵母表达系统表达FAD依赖的葡萄糖脱氢酶, 通过优化FAD依赖的葡萄糖脱氢酶密码子序列, 在10 L发酵罐培养时经过136 h诱导培养, 酶活达到257 600 U/L, 是现有技术中报道的酶活的5.3倍。毕赤酵母可通过高密度发酵培养大量生产重组蛋白, 在提高产量的同时有利于简化纯化步骤, 降低生产成本。
酶学性质是表征一个酶的基本参数, 通过酶学性质的测定和评估, 可以了解一个酶的特有性质, 为酶的应用和改造提供一系列必要的初始参数。在血糖检测用酶中, 要求所用的酶有较高的催化效率, 较窄的底物谱, 良好的热稳定性[19]。周利伟等[14]报道的重组FAD-GDH最适温度为40℃, 本研究毕赤酵母重组表达FAD-GDH的最适反应温度为55℃, 且热稳定性良好, 在50℃下处理150 min仍有70%的活性; 其次该酶的最适pH值为7.0, 在pH4-7范围内, 37℃保温4 h, FAD-GDH仍能保持50%以上的活性, 有较高的应用价值。金属离子Cu2+对该酶活抑制作用比较大, 与前人研究结果一致。FAD-GDH的底物专一性较好, 以葡萄糖为最适底物。当以木糖为底物时, 其相对活性是以葡萄糖为底物的36%;对麦芽糖和海藻糖也有一定活性, 与杨愈丰等[20]研究结果相符, 对其他单糖或二糖不显示催化活性。
4 结论本研究以NCBI上登录号为XM_001216916的土曲霉NIH2624基因为基础, 根据毕赤酵母的密码子偏爱性对该基因的密码子进行优化, 将该基因克隆到毕赤酵母中, 经过筛选和优化, 得到了高产FAD-GDH的重组菌株。试管水平酶活达到20 850 U/L; 在10 L发酵罐培养时经过136 h诱导培养, 酶活达到257 600 U/L, 是现有报道中酶活的5.3倍。然后研究了其酶学性质, pH、温度稳定性和底物专一性较好。
| [1] |
Cavener DR. GMC oxidoreductases:A newly defined family of homologous proteins with diverse catalytic activities[J]. Journal of Molecular Biology, 1992, 223(3): 811-814. DOI:10.1016/0022-2836(92)90992-S |
| [2] |
Fapyane D, Lee SJ, Kang SH, et al. High performance enzyme fuel cells using a genetically expressed FAD-dependent glucose dehydrogenase α-subunit of Burkholderia cepacia immobilized in a carbon nanotube electrode for low glucose conditions[J]. Physical Chemistry Chemical Physics, 2013, 15: 9508-9512. DOI:10.1039/c3cp51864g |
| [3] |
Southcott M, Mac Vittie K, Halámek J, et al. A pacemaker powered by an implantable biofuel cell operating under conditions mimicking the human blood circulatory system-battery not included[J]. Physical Chemistry Chemical Physics, 2013, 15: 6278-6283. DOI:10.1039/c3cp50929j |
| [4] |
Sygmund C, Staudigl P, Klausberger M, et al. Heterologous overexpression of Glomerella cingulata FAD-dependent glucose dehydrogenase in Escherichia coli and Pichia pastoris[J]. Microbial cell factories, 2011, 10: 1-9. DOI:10.1186/1475-2859-10-1 |
| [5] |
Gu L, Zhang J, Liu B, et al. High-Level extracellular production of glucose oxidase by recombinant Pichia pastoris using a combined strategy[J]. Applied Biochemistry and Biotechnology, 2015, 175(3): 1429-1447. DOI:10.1007/s12010-014-1387-z |
| [6] |
朱泰承, 李寅. 毕赤酵母表达系统发展概况及趋势[J]. 生物工程学报, 2015, 31(6): 929-938. |
| [7] |
Rosano GL, Ceccarelli EA. Recombinant protein expression in Escherichia coli:advances and challenges[J]. Frontiers in Microbiology, 2014, 5(172): 172-184. |
| [8] |
Yang J, Liu L. Codon optimization through a two-step gene synthesis leads to a high-level expression of Aspergillus niger lip2 gene in Pichia pastoris[J]. Journal of Molecular Catalysis B:Enzymatic, 2010, 63(3): 164-169. |
| [9] |
Al-Hawash AB, Zhang X, Ma F. Strategies of codon optimization for high-level heterologous protein expression in microbial expression systems[J]. Gene Reports, 2017, S2452014417300614. |
| [10] |
Wu AB, Chen HD, Tang ZZ, et al. Synthesis of Drosophila melanogaster acetylcholinesterase gene using yeast preferred codons and its expression in Pichia pastoris[J]. Chemico-Biological Interactions, 2008, 175(1): 403-405. |
| [11] |
陈惠, 赵海霞, 王红宁, 等. 植酸酶基因中稀有密码子的改造提高其在毕赤酵母中的表达量[J]. 中国生物化学与分子生物学报, 2005, 21(2): 171-175. DOI:10.3969/j.issn.1007-7626.2005.02.005 |
| [12] |
孙风敏, 韩焱, 李文利. 基于密码子优化的蛋白酶K在毕赤酵母中的表达及分离纯化[J]. 微生物学通报, 2014, 41(11): 2198-2207. |
| [13] |
Gao Z, Li Z, Zhang Y, et al. High-level expression of the Penicillium notatum glucose oxidase gene in Pichia pastoris using codon optimization[J]. Biotechnology Letters, 2012, 34(3): 507-514. DOI:10.1007/s10529-011-0790-6 |
| [14] |
周利伟.青霉来源葡萄糖脱氢酶的克隆、表达及其酶学性质研究[D].北京: 中国农业科学院, 2012.
|
| [15] |
高庆华, 胡美荣, 吴芳彤, 等. 点青霉葡萄糖氧化酶基因的克隆及其酶学性质研究[J]. 生物技术通报, 2016, 32(7): 152-159. |
| [16] |
Tsuya T, Ferri S, Fujikawa M, et al. Cloning and functional expression of glucose dehydrogenase complex of Burkholderia cepacia in Escherichia coli[J]. Journal of Biotechnology, 2006, 123: 127-136. DOI:10.1016/j.jbiotec.2005.10.017 |
| [17] |
Omura H, Sanada H, Yada T, et al, Coenzyme-linked glucose dehydrogenase and polynucleotide encoding the same[P]. Europe: EP2380980, Oct. 26, 2011.
|
| [18] |
Krainer FW, Dietzsch C, et al. Recombinant protein expression in Pichia pastoris strains with an engineered methanol utilization pathway[J]. Microbial Cell Factories, 2012, 11(1): 22-36. DOI:10.1186/1475-2859-11-22 |
| [19] |
罗超.产葡萄糖脱氢酶工程菌发酵及重组葡萄糖脱氢酶酶学性质研究[D].杭州: 浙江大学, 2015.
|
| [20] |
杨愈丰. FAD依赖的葡萄糖脱氢酶(FAD-GDH)的重组表达、结构与功能研究[D].广州: 华南理工大学, 2014.
|



