巴斯德毕赤酵母(Pichia pastoris, P. pastoris)是甲醇酵母。甲醇为单一碳源时, P. pastoris胞内的醇氧化酶1(Alcohol oxidase 1, Aox1, EC1.1.3.13)能高效催化甲醇氧化成甲醛, 同时Aox1可达到细胞干重的30%[1-2]。利用高效的Aox1启动子(aox1 promoter, Paox1)启动外源蛋白的表达, 成功构建了巴斯德毕赤酵母表达系统, 该表达系统是目前应用最广泛的重组蛋白表达系统之一[3-4]。然而P. pastoris甲醇的代谢存在碳源阻遏现象, 即葡萄糖、甘油等碳源的存在可以阻遏甲醇的代谢, Paox1在甲醇为唯一碳源时被激活, 在甘油存在时被抑制[5]。甘油代谢和甲醇代谢之间调控的分子机理尚不十分清晰, Paox1的激活和抑制是其研究的核心。
目前已发现多个调控Paox1的转录因子[6-7], 其中甲醇表达调控因子1(Methanol expression regμLator 1, Mxr1, GenBank:ABD57365.1)是最重要的Paox1激活因子, Mxr1的缺失会导致P. pastoris无法利用甲醇[8-9]。研究表明, Mxr1是组成型表达, 但是, 在甲醇为唯一碳源的培养基中转录激活活性; 在甘油培养基无活性[3, 10]。同时发现Mxr1上存在磷酸化的Ser215位点, 能够调控Mxr1转录激活活性[8]。说明Mxr1功能的发挥主要受磷酸化修饰调节。但是对Mxr1去磷酸化的酶一直尚未发现, 本文在研究与Mxr1相互作用的蛋白中找到了使Mxr1去磷酸化的酶—蛋白质磷酸酪氨酸磷酸酶(Protein phosphotyrosine phosphatase, Ptp), 并发现该酶对Mxr1的磷酸化水平的调节有明显的调控效果。蛋白质磷酸酪氨酸磷酸酶是一种比较保守的低分子量的磷酸酶[11-12], 而蛋白的磷酸化和去磷酸化对蛋白活性的调节发挥重要作用[13], 推测蛋白质磷酸酪氨酸磷酸酶调控Mxr1磷酸化, 进而调控Mxr1活性。
1 材料和方法 1.1 材料LA Taq DNA聚合酶、内切酶(EcoRI、XhoI、SacI)、T4 DNA连接酶、卡那霉素、博来霉素、四环素, 分光光度计(上海美诺达仪器有限公司), 凝胶成像仪, 蛋白质电泳仪(北京六一仪器), PCR仪(杭州朗基科学仪器有限公司)。
1.1.1 菌株和质粒巴斯德毕赤酵母(P. pastoris)GS115、pGAPZB毕赤酵母表达载体、大肠杆菌E. coli DH5α, E. coli BL21, pSVT7大肠杆菌表达载体(表 1)。
LB培养基(酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 10 g/L、1×105 Pa灭菌20 min, 固体培养基添加2%琼脂粉)、LLB培养基(酵母提取物5 g/L、胰蛋白胨10 g/L、NaCl 5 g/L、1×105 Pa灭菌20 min, 固体培养基添加2%琼脂粉)、BMY培养基(酵母提取物10 g/L、胰蛋白胨20 g/L、100 mmol/L磷酸钾缓冲液, pH6.1, 1×105 Pa灭菌20 min, 无菌酵母无氨基酸氮源YNB 13.4 g/L, 无菌生物素0.4 mg/L, 碳源按照实验要求后续添加)、YPD培养基(酵母提取物10 g/L、胰蛋白胨20 g/L、葡萄糖20 g/L、115℃灭菌30 min, 固体培养基添加2%琼脂粉)。TB/SB培养基酵母提取物13 g/L、胰蛋白胨24 g/L、甘油10 g/L、KH2PO4 23.1 g/L、K2HPO4 12.55 g/L, 1×105 Pa灭菌20 min。
1.1.3 引物本研究所用到的引物(表 2)由苏州金唯智生物科技有限公司合成。
以GS115基因组为模板, PCR扩增ptp片段, 纯化, 用Kpn I, Not I分别双酶切片段和pGAPZB质粒, 分化纯化回收, 用T4连接酶链接片段和载体, 得到ptp高表达载体PGAP-PTP, 转化感受态E.coli DH5α, 然后用含有博来霉素的LLB平板筛选和PCR菌落鉴定, 并送苏州金唯智生物科技有限公司测序, 保存测序正确的菌株。挑选重组子单菌落接种于YPD液体培养基培养24 h, 提取基因组, 用引物zecin-f, zecin-r扩增博来霉素基因。PCR产物用1%琼脂糖凝胶电泳, 检测PGAP-PTP在P.pastoris染色体的整合情况。筛选到的重组子命名为PTP-GS115。
1.2.2 利用CRISPR/Cas9系统敲除磷酸酶ptp及构建Mxr1S215A定点突变菌株利用本实验室构建好的基因编辑系统, 设计3条sgRNA, 电转cas9-GS115感受态, 经过PCR, 测序验证, 在48碱基处成功敲除1个碱基, 命名为ΔPTP-GS115。构建定点突变的上下游500 bp同源臂, 通过融合PCR, 形成上游同源臂定点突变下游同源臂序列, 在突变位点上下200 bp左右设计3条sgRNA, 构建sgRNA质粒, 电转Cas9-GS115通过PCR验证敲掉的碱基数和定点突变。培养P.pastoris细胞、提取基因组及总蛋白质参照Invitrogen公司操作手册。
1.2.3 荧光定量PCR检测Mxr1不同突变体下游基因表达量将保存于YPD平板的突变菌株GS115和野生型GS115接种于YPD液体培养基进行过夜活化, 统一OD600=0.5用无菌PBS洗3次, 接种与含有1%甲醇为碳源的BMMY培养基, 在30℃、230 r/min下培养24 h, 36 h收集菌体, PBS清洗1次, 提取RNA, 反转成cDNA, 荧光定量检测下游基因表达量。
1.2.4 Ptp诱导表达通过NCBI数据库报道的ptp基因序列, 由苏州金唯智生物科技有限公司对ptp序列进行密码子优化, 6His-PTP连到pSVT7载体, 转化感受态E.coliBL21, 保存菌株。接种LB(15 μg/mL四环素)的液体培养基, 37℃, 230 r/min培养过夜(14 h)。测定OD600, 并按照初始0.1接种于TB/SB(含15 μg/mL四环素)培养基中, 30℃, 230 r/min培养5 h, 然后加入不同体积的IPTG进行诱导23℃, 230 r/min培养16 h, 收集菌体。超声波破碎细胞, 提取总蛋白, 磷酸酶的Ptp Western blot检测, 总蛋白SDS-PAGE电泳后, 使用电转仪将蛋白条带转移至PVDF膜上, TBST清洗3次, 每次5 min。使用5%的脱脂奶粉封闭1 h, 加入HRP标记的鼠抗His6抗体(1:10 000), 室温孵育1 h, TBST清洗3次, 每次5 min, 使用化学发光的方法显影, 曝光时间1 s[14-15]。
1.2.5 Ptp蛋白纯化将pSVT7PTP-BL21(DE3)按照最优的发酵条件进行诱导表达, 5 500 r/min收集菌体, 加入与培养基等体积的上样缓冲液(20 mmol/L NaH2PO4·2H2O、50 mmol/L NaCl, pH = 8.0)重悬。冰上预冷后进行超声破碎, 破碎时间25 min, 8 800 r/min离心收集上清。将上清用0.22 μm针头式滤器进行过滤, 作为待纯化的样品。实验采用AKTA-purifier蛋白纯化仪进行纯化, 将滤出液经过Ni agarose蛋白纯化柱进行亲和层析, 使用上样缓冲液平衡5CV以洗去未结合的杂蛋白质, 再用洗脱缓冲液(20 mmol/L NaH2PO4·2H2O, 50 mmol/L NaCl, 250 mmol/L咪唑, pH8.0)洗脱, 收集洗脱峰。将收集的蛋白质进行SDS-PAGE检测。将最优条件下发酵纯化的Ptp分装保存于-80℃[16]。
1.2.6 蛋白磷酸酶Ptp酶活验证磷酸化多肽为底物, 在蛋白金属磷酸酶(PMP)缓冲液。添加1 mmol/L MnCl2, 反应缓冲液, 30℃温育30 min, 反应体系如表 3, ELISA检测反应产物, 反应液包板4℃过夜, 使用1%BSA的PBST室温封闭1 h, PBST洗板5遍, 孵育相对应的磷酸化抗体, 室温2 h, PBST洗板5次, 室温孵育HRP标记的兔抗二抗1 h, PBST洗板5遍, 加入TMB室温20 min, 1 mol/L硫酸终止反应, 多功能酶标仪检测结果。
YPD过夜活化, OD=0.5转接BMMY和BMGY, 24 h, 按照1.2.3的方法取样, 统一OD600=4收集菌体, 提取蛋白, 经过Bradford法蛋白质定量, 之后进行SDS-PAGE电泳后, 使用电转仪将蛋白转移至PVDF膜上, TBST清洗3次, 每次5 min。使用1%的BSA封闭1 h, P215磷酸化抗体(1:2 000), 4℃孵育过夜(14 h), TBST清洗3次, 每次5 min, 室温孵育HRP标记的兔抗二抗1 h使用化学发光的方法显影, 曝光时间1 min。
2 结果 2.1 Ptp与Mxr1相互作用为了寻找与Mxr1相互作用的蛋白, 我们将Mxr1前400氨基酸与GST标签蛋白, 表达纯化, 将靶蛋白- GST融合蛋白亲和固化在谷胱甘肽亲和树脂上, 用分别在甲醇和甘油培养的GS115蛋白溶液过柱, 可从中捕获与之相互作用的“捕获蛋白”(目的蛋白), 洗脱结合物后通过SDS-PAGE电泳, 切胶, 经过质谱分析, 得到其中一个蛋白为Ptp(图 1)。

|
| 经质谱鉴定与Mxr1相互作用的蛋白其中有磷酸酶Ptp 图 1 Mxr1 PULL-DOWN结果及Ptp条带 |
为验证Ptp的去磷酸化功能, 在大肠杆菌表达, 诱导表达纯化脱盐后, 经BCA法测得蛋白浓度是0.98 mg/L, 以不同浓度pNPP为底物, 相同体积酶反应30℃, 10 min, 1 mol/L硫酸钠终止反应, 405 nm测吸光强度, 测得Ptp米氏常数Km= 2.023 mmol/L, 最适酶促反应温度40℃, 最适pH4.5(图 2)。
通过ELISA检测酶促反应结束后底物剩余量, 将酶促反应的底物包板, 每孔包被5 mg磷酸化抗原多肽, 或非磷酸化抗原多肽, 孵育磷酸化抗体(稀释比例是1:2 000;1:4 000;1:8 000), 通过加入纯化的Ptp蛋白和只加入蛋白洗脱液对比(图 2-E), 同样的反应条件, 发现加入Ptp的样品几乎没有磷酸化抗原多肽剩余。说明纯化出的Ptp蛋白有去磷酸化的蛋白活性。
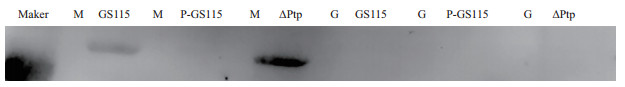
2.3 Mxr1磷酸化情况按照1.2.4的方法取样, 收集菌体, 统一OD600=4收集菌体, 提取蛋白, 经过BCA法蛋白质定量, 之后进行总蛋白SDS-PAGE电泳后, 使用电转仪将蛋白转移至PVDF膜上, 孵育P215磷酸化抗体(1:2000)使用化学发光的方法显影, 如图 3野生型GS115在甘油培养基里没有发生磷酸化, 在甲醇培养基里发生磷酸化, 而Ptp高表达无论在甘油还是甲醇培养基都不发生磷酸化。
|
| G:BMGY培养基M:BMMY培养基 图 3 在分别用甲醇和甘油为唯一碳源培养时, 野生型, 高表达和敲除菌株的磷酸化水平 |
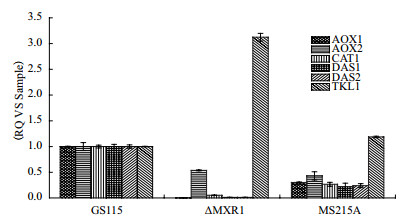
敲除Mxr1后在BMMY培养基中Aox1几乎不转录, 与甲醇代谢相关的酶的转录水平严重下降, 将磷酸化位点定点突变后, 与甲醇代谢相关酶的基因表达量也有所下降, 说明Mxr1的磷酸化修饰调控下游基因的表达, 尤其是与甲醇代谢相关的基因的表达(图 4)。
|
| GS115:野生型; ΔMXR1:ΔMxr1-GS115敲除Mxr1;MS215A:MXR1S215A-GS115 Mxr1第215丝氨突变成丙氨酸; 涉及与甲醇代谢相关的酶, 醇氧化酶(Aox1), 醇氧化酶2(Aox2), 过氧化氢酶(Cat1), 转酮醇酶1(Das1)和转酮醇酶2(Das2)在诱导的(1%甲醇)生长条件下从菌株GS115(Mxr1WT), ΔMxr1-GS115, MXR1S215A-GS115(Mxr1S215A)中提取mRNA。进行定量RT-PCR(qRT-PCR)以确定mRNA水平。将mRNA水平标准化为每个样品中ACT1 mRNA的水平, 纵坐标表示相对表达量 图 4 Mxr1磷酸化修饰对甲醇代谢相关基因表达的影响 |
Aox1启动子受甲醇诱导, 但是其诱导机制到目前为止还没有完全揭示清楚, 而Mxr1是毕赤酵母Aox1启动子的必要转录激活因子, 为了研究甲醇的激活机理, 先研究Mxr1激活机理, 通过PULL-DOWN发现与Mxr1相互作用的磷酸水解酶Ptp, 并对Ptp进行了高表达和敲除, 发现在甲醇培养基中, 高表达菌株Mxr1磷酸化程度远远高于敲除菌株。说明Ptp调控Mxr1磷酸化修饰。
本实验用Mxr1特定位点磷酸化多肽作为底物, 发现Ptp识别Mxr1S215位丝氨酸位点的磷酸化, 并将该位点磷酸基团去除。将Mxr1S215位丝氨酸突变成丙氨酸后, 通过荧光定量PCR检测Mxr1野生型, 敲除, 定点突变菌株的下游基因表达量, 发现与甲醇代谢相关的基因转录水平发生了改变, 其中Aox1、Aox2、Das1、Das2定点突变菌株转录量相对于野生型的下降接近60%。以上说明Mxr1 S215位磷酸化修饰, 影响与甲醇代谢相关基因的转录水平。蛋白的磷酸化修饰与蛋白的结构, 亚细胞定位, 功能息息相关[17-18]。Mxr1磷酸化修饰对其蛋白活性的影有可能是通过影响Mxr1空间结构, 进而影响Mxr1蛋白活性。
在酿酒酵母中, Ptp作为一个高度保守的小分子蛋白磷酸酶, 在AMPK途径发挥重要作用[12], 根据小分子磷酸酶的特性推测其底物有可能不止Mxr1一个, 需要通过PULL-DOWN找与Ptp相互作用的蛋白。寻找在甲醇代谢通路中Ptp底物, 从这些底物磷酸化修饰入手, 揭示甲醇诱导代谢途径所在的细胞信号通路。需要进一步验证Mxr1第215位丝氨酸磷酸化与其亚细胞定位是否相关, Mxr1磷酸化修饰是否控制Mxr1进出细胞核, 还是调控Mxr1的活性, 同时寻找Mxr1其他磷酸化位点, 进而揭示Mxr1激活Aox1转录的分子机理, 以及甲醇诱导Aox1转录机理。最终减少甲醇的用量, 提高利用Aox1启动子表达外源蛋白生产工艺的优化及表达量。
4 结论本研究发现与Mxr1相互作用的磷酸酶Ptp, 验证Ptp的功能是去除Mxr1S215位丝氨酸位点的磷酸基团。将Mxr1S215位丝氨酸突变成丙氨酸后, 发现Aox1、Aox2、Das1、Das2定点突变菌株转录量相对于野生型的下降约60%。以上说明Mxr1 S215位磷酸化修饰, 影响与甲醇代谢相关基因的转录。
| [1] |
Noseda DG, Recúpero MN, Blasco M, et al. Cloning, expression and optimized production in a bioreactor of bovine chymosin B in Pichia(Komagataella)pastoris under AOX1 promoter[J]. Protein Expression & Purification, 2013, 92(2): 235-244. |
| [2] |
Cámara E, Landes N, Albiol J, et al. Increased dosage of AOX1 promoter-regulated expression cassettes leads to transcription attenuation of the methanol metabolism in Pichia pastoris[J]. Scientific Reports, 2017, 15(7): 44302. |
| [3] |
Chen J. Both the AOX1 promoter and the FLD1 promoter work together in a Pichia pastoris expression vector[J]. World Journal of Microbiology & Biotechnology, 2009, 25(10): 1779-1783. |
| [4] |
Xuan Y, Zhou X, Zhang W, et al. An upstream activation sequence controls the expression of AOX1 gene in Pichia pastoris[J]. Fems Yeast Research, 2010, 9(8): 1271-1282. |
| [5] |
Yang J, Cai H, Liu J, et al. Controlling AOX1 promoter strength in Pichia pastoris by manipulating poly(dA:dT)tracts[J]. Scientific Reports, 2018, 8(1): 1401. DOI:10.1038/s41598-018-19831-y |
| [6] |
Cárdenasmonroy CA, Pohlmann T, Piñónzárate G, et al. The mitochondrial alternative oxidase Aox1 is needed to cope with respiratory stress but dispensable for pathogenic development in Ustilago maydis[J]. PLoS One, 2017, 12(3): e0173389. DOI:10.1371/journal.pone.0173389 |
| [7] |
Kim S, Warburton S, Boldogh I, et al. Regulation of alcohol oxidase 1(AOX1)promoter and peroxisome biogenesis in different fermentation processes in Pichia pastoris[J]. J Biotechnol, 2013, 166(4): 174-181. DOI:10.1016/j.jbiotec.2013.05.009 |
| [8] |
Parua PK, Ryan PM, et al. Pichia pastoris 14-3-3 regulates transcri-ptional activity of the methanol inducible transcription factor Mxr1 by direct interaction[J]. Mol Microbiol, 2012, 85(2): 282-298. DOI:10.1111/mmi.2012.85.issue-2 |
| [9] |
亓飞.毕赤酵母AOX1启动子的阻遏因子PpMig1、PpMig2的亚细胞定位及基于RNA-Seq技术的毕赤酵母基因组重注释和比较转录组学初步研究[D].上海: 华东理工大学, 2014.
|
| [10] |
王小龙.毕赤酵母AOX1启动子转录调控机制研究[D].上海: 华东理工大学, 2016.
|
| [11] |
Lindorfflarsen K, Lerche MH, Poulsen FM, et al. Barley lipid transfer protein, LTP1, contains a new type of lipid-like post-translational modification[J]. J Biol Chem, 2001, 276(36): 33547-33553. DOI:10.1074/jbc.M104841200 |
| [12] |
Magherini F, Gamberi T, Paoli P, et al. The in vivo tyrosine phosphorylation level of yeast immunophilin Fpr3 is influenced by the LMW-PTP Ltp1[J]. Biochemical & Biophysical Research Communications, 2004, 321(2): 424-431. |
| [13] |
Paoli P, Modesti A, Magherini F, et al. Site-directed mutagenesis of two aromatic residues lining the active site pocket of the yeast Ltp1[J]. BBA - General Subjects, 2007, 1770(5): 753-762. DOI:10.1016/j.bbagen.2006.12.012 |
| [14] |
刘萌, 孙杨, 杨艳坤, 等. 人-鼠嵌合单链抗体的构建及其在大肠杆菌中的高效可溶性表达和发酵条件优化[J]. 生物学杂志, 2016, 33(6): 1-6. |
| [15] |
杨书豪, 马丽丽, 杨艳艳, 等. 抗人甲胎蛋白单克隆抗体的制备及鉴定[J]. 细胞与分子免疫学杂志, 1997(3): 45-47. |
| [16] |
李诗洁, 杨艳坤, 刘萌, 等. SUMO蛋白酶Ulp1的高效表达纯化并通过His-SUMO标签制备scFv[J]. 中国生物工程杂志, 2018(3): 51-61. |
| [17] |
Gangadhar BH, Sajeesh K, Venkatesh J, et al. Enhanced tolerance of transgenic potato plants over-expressing non-specific lipid transfer protein-1(StnsLTP1)against multiple abiotic stresses[J]. Front Plant Sci, 2016, 7: 1228. |