橡胶延长因子基因(Rubber elongation factor protein,REF)家族包括橡胶延长因子基因(Rubber elongation factor,REF)、小橡胶粒子蛋白(Small rubber particle protein,SRPP)和胁迫相关基因(Stress-related protein,SRP)[1]。其中REF/SRPP有REF结构域,对橡胶的生物合成起决定性作用[2]。拟南芥SRPP在组织生长和发育以及干旱胁迫响应中起重要作用[3],拟南芥中有3种SRPP同源物,分别为SRP1、SRP2和SRP3,SRP在各组织中表达差异。由ABA和非生物胁迫诱导(干旱、高盐度和低温),与野生型相比,过表达SRP的转基因拟南芥植株(35S:SRP1、35S:SRP2和35S:SRP3)具有更好的营养和生殖生长,并且对干旱胁迫具有更好的耐受性[3]。在云杉中通过半干燥处理后,SRP主要涉及渗透、内源激素、抗氧化蛋白、分子伴侣和防御相关蛋白[4]。Sano等[5]研究表明在不同胁迫条件下(脱水胁迫、渗透胁迫、盐胁迫、淹水胁迫、热胁迫和冷胁迫),成熟种子中的SRP被诱导。Hong等[6]研究表明CaSRP1(Capsicum annuum stress-related protein 1)之前被鉴定为SRPPs同源物,在水分胁迫的条件,CaSRP1被诱导,相对于野生型拟南芥,转基因拟南芥植物中CaSRP1过表达导致耐旱性增强[7]。Eun等[8]研究表明SbSRP可能涉及ROS清除活性直接作为非酶抗氧化剂或间接诱导几种编码抗氧化酶的基因的表达。胁迫相关基因的表达导致代谢物的积累和生化和生理途径的改变,这对于植物适应不利胁迫条件是至关重要的。
目前,关于马铃薯StSRP1的表达、功能等相关研究,鲜见报道。有文章表明,水稻种子干燥阶段中,胁迫相关蛋白在水稻种子成熟过程中对耐干性具有重要作用[5],胁迫相关蛋白根据其生理功能分为3大类:分子伴侣(Molecular chaperones)、抗氧化蛋白(Antioxidative proteins)和晚期胚胎发育丰富蛋白(Late embryogenesis abundant proteins,LEA)。分子伴侣通过促进蛋白质的天然折叠和防止变性蛋白质的不可逆聚合,在应答胁迫中发挥重要作用[9]。热休克蛋白(Heat shock protein,HSP)在热休克应答中就是一大类分子伴侣,HSP通过蛋白质之间的相互作用介导调节多种细胞过程,参与热休克胁迫[10];当非生物胁迫破坏细胞的代谢平衡时,有害ROS的水平会增强,抗氧化蛋白参与抑制攻击DNA,蛋白质和膜的活性氧(ROS)的产生引起脂质过氧化和脱酯化[11];LEA蛋白在许多高等植物的种子中很丰富,并且可能普遍存在于植物种子中,LEA蛋白表达可以通过干燥胁迫或通过用ABA处理在植物的其他阶段诱导[12]。
本研究采用电子克隆法,从马铃薯中克隆得到StSRP1序列,利用分子生物学公用数据库,对基因的分子生物学特性、生化特性进行分析,预测蛋白质的结构,并对其进行定量表达分析。为研究该基因的结构和功能以及验证马铃薯StSRP1在抵抗生物胁迫过程中的作用奠定基础。
1 材料与方法 1.1 材料选用中薯3号马铃薯块茎作为试验材料,将其放在高压灭菌的草炭/蛭石土(3:1,V/V)的营养钵中,在光照强度2 000-3 000 lx、光照时间16 h/8 h(昼/夜)、23℃/18℃(昼/夜)的光照培养箱中培养,待其长至7-8叶龄期,进行处理。
选取生理小种3号(race3)、生化变种2号(biovar2)的PO41菌株作为病原菌,在鉴定培养基(TTC培养基)中纯化,在扩繁培养基(牛肉膏蛋白胨培养基)中扩繁。
1.2 方法 1.2.1 激素处理根据Ni等[13]的方法,分别用50 μmol/L茉莉酸甲酯(MJ)、100 μmol/L脱落酸(ABA,Sigma-Aldrich,St. Louis,USA)对马铃薯的7-8叶龄期幼苗进行喷雾处理。用0.1%乙醇喷雾处理作为对照。所有处理后的样品均用透明聚乙烯塑料袋覆盖,以保持湿度,分别于1、2、3、4和5 d时对植物地上部分取样,液氮速冻,-80℃保存备用。
1.2.2 青枯菌处理采用He等[14]的伤根灌菌法,通过分光光度计测量配置菌悬液浓度为108 CFU/mL(A660=0.2)的菌液,取30 mL菌液接种至7-8叶龄期的幼苗,以水作为对照,分别于6、12、24、48和84 h对植株地上部分取样,液氮速冻,-80℃保存备用[15]。
1.2.3 RNA提取及cDNA的合成利用TaKaRa MiniBEST Plant RNA Extraction Kit提取马铃薯地上部分总RNA。使用分光光度计法进行定量检测,用琼脂糖凝胶电泳检测其完整性。样品cDNA合成操作按照PrimeScripTM RT-PCR Kit说明书进行。
1.2.4 StSRP1的电子克隆利用NCBI数据库中的blastn(http:/BLAST.ncbi.nlm.nih.gov/BLAST.cgi)检索前期工作中获得的EST原始序列,找出其同源序列,发现与NCBI数据库中XM_006359330.1相似性最高,为97%。通过bioedit软件拼接序列,直到不能延伸。
1.2.5 StSRP1的生物信息学分析利用BioEdit软件分析基因序列并推导其相应氨基酸序列。用ExPASy-ProtParam(http://web.expasy.org/protparam/)分析氨基酸序列,用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)分析跨膜结构,用SignalP(http://www.cbs.dtu.dk/services/SignalP/)分析信号肽,用NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)分析磷酸位点,利用WOLF PSORT Server(https://wolfpsort.hgc.jp/)分析蛋白质的亚细胞定位,用Pfam(https://pfam.xfam.org/search)分析蛋白结构域。
用PSIPRED(http://bioinf.cs.ucl.ac.uk/psipred/)和PRABI(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_hnn.pl)进行蛋白质二级结构预测,CPHmodels(https://swissmodel.expasy.org/)进行蛋白质三级结构预测。
通过NCBI的BLAST进行同源性分析,按照相似度由高到低的顺序,选择20条序列下载,利用MEGA 5.0软件邻接法(neighbor-joiningmethod,NJ)构建系统发育树,使用1 000 bootstrap replicates。
利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)搜索StSRP1启动子的2 000 bp序列,通过分析目的基因的启动子区域,找出转录基因的结合位点,从而分析目的基因受哪些转录因子的调控,定位潜在的顺式作用元件。
1.2.6 实时荧光定量PCR根据StSRP1序列设计特异性荧光定量引物(F:5'-CGGTGACATATGCGTC-GGAG-3'和R:5'-AACAGTGCCGTCGGTCAAGG-3'),正反引物各0.4 μL、2×TransStart Top Green qPCR SuperMix 10 μL、模板(稀释的cDNA)2 μL,加ddH2O定容到20 μL。用Actin作为内参基因(F:5'-GACTCTGGTGATGGTGTCAG-3'和R:5'-CTCGCTC-AGCTGTGGTGGTG-3'),
2 结果 2.1 StSRP1的生物信息学分析 2.1.1 StSRP1序列前期实验构建了病原诱导的马铃薯茎特异消减cDNA文库,从该文库中筛选出目的基因克隆,通过序列拼接获得全长cDNA序列(Accession:MK224501),经BLAST分析,该基因与Solanum tuberosum stress-related protein(Accession:XM_006359330.1)相似性高达97%,故命名StSRP1。该基因序列包含一个867 bp的开放读码框,编码288个氨基酸(图 1)。

|
| 图 1 StCUL1的核苷酸序列以及推导的氨基酸序列 |
运用ProtParam和ProScal进行分析StSRP1理化性质分析,蛋白的分子量是30.682 kD、等电点是5.22、不稳定指数是38.19,该数值低于阈值40,为稳定蛋白,StSRP1属于不稳定蛋白、半衰期在哺乳动物的网织红细胞中为30 h,在酵母细胞中大于20 h,在大肠杆菌体内大于10 h,脂溶指数是增加球形蛋白的热稳定性的一个积极因素,该蛋白的脂溶指数是86.81、正电荷残基数(Arg + Lys)有26个,负电荷残基数(Asp + Glu)有33个。蛋白质的种类、空间结构及活性、功能都与肽链中氨基酸的种类及顺序有关,该蛋白是由20种氨基酸组成,其中Ala(A)含量最高,为15.3%,其次Pro(P)和Val(V),占9.7%;亲水性平均系数(Grand average of hydropathicity,GRAVY)是-0.152,该数值为负值则说明该蛋白为亲水性蛋白,反之为疏水性蛋白,疏水性氨基酸很明显的少于亲水性的氨基酸,并且亲水性和疏水性都在第100-150个氨基酸区间达到最高值,所以StSRP1属于亲水性蛋白,StSRP1无跨膜结构和信号肽。亚细胞定位分析表明该蛋白位于内质网,并且该蛋白有丝氨酸(Ser)12个、苏氨酸(Thr)16个、络氨酸(Tyr)6个,共34个磷酸位点。该蛋白的保守结构域是REF(52-266)。
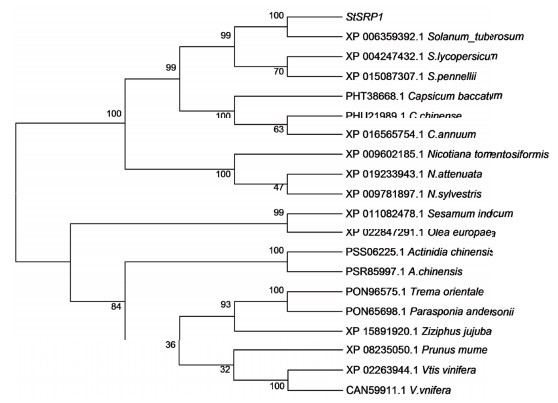
2.1.3 StSRP1系统进化分析通过BLAST搜索比对,StSRP1与Solanum lycopersicum stress-related protein(Accession:XM_004247384.4)相似性达97%,与Solanum pennellii stress-related protein(Accession:XM_015231821.1)相似性达96%,与Capsicum annuum stress-related protein(Accession:XM_016710268.1)相似性达88%。Solanum lycopersicum、Solanum pennellii和Capsicum annuum都属于茄科。因此,马铃薯StSRP1与其他茄科植物SRP具有高度保守的序列结构。
运用MEGA5.0软件中的邻接法构建20个相关氨基酸序列的系统进化树(图 2),从系统发生树上节点位置和分支长度上分析,StSRP1与马铃薯、番茄同属一支,它们可能具有共同的起源,与辣椒、烟草亲缘关系次之。
|
| 数字表示聚类的置信值,Bootstrap值采用1 000次重复 图 2 StSRP1的系统进化树 |
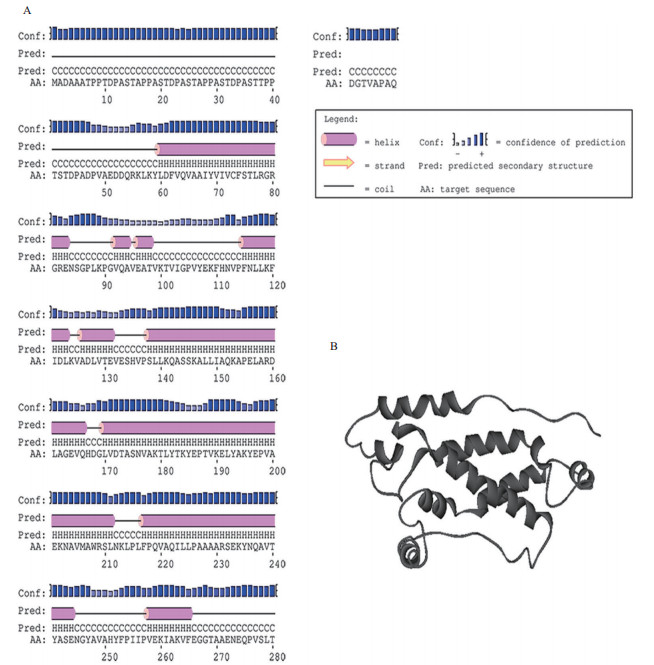
StSRP1蛋白约含49.65%的α-螺旋、5.56%的延伸带和44.79%的无规则卷曲(图 3-A),用CPHmodels建立StSRP1的分子模型(图 3-B),模板Template= 2R6G.G、Id=13.0、Coverage=66.0,StSRP1的二级结构分析证实了StSRP1蛋白的三维模型是合理的。
|
| 图 3 StSRP1蛋白二级结构(A)和三级结构(B) |
基于马铃薯基因组的公开序列,从马铃薯基因组DNA中获得起始密码子ATG上游2 000 bp 5'侧翼序列。利用PlantCare在线软件分析StSRP1启动子序列,在StSRP1启动子1 000 bp区域存在23种潜在的顺式作用元件,并在许多位置发现多个核心顺式作用元件,包括TATA和CAAT box。一系列假定的顺式调控元件能够使StSRP1可诱导或组织特异性表达,如参与脱落酸反应顺式作用元素ABRE、参与光应答的顺式作用调节元件G-box,MYBHv1结合位点CCAAT-box、参与防御和胁迫应答的顺式作用元素TC-rich repeats。
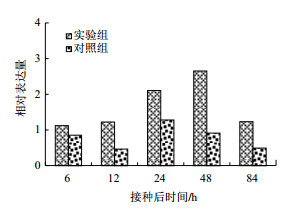
2.2 StSRP1的表达量分析 2.2.1 青枯菌诱导StSRP1的表达模式为了确定在细菌侵染下StSRP1的表达情况,以及StSRP1的表达随时间推移的变化,对接种后马铃薯幼苗在不同时间点的诱导表达进行qRT-PCR分(图 4)。StSRP1受病原菌诱导,能在接种后快速、持续地表达。在接种24 h后,其表达水平开始显著提高,并在接种48 h后表达量至最高水平,接种后84 h表达量迅速下降。相比对照组,StSRP1的表达量无明显变化,一直处于较低水平的表达状态。表明正常情况下,该基因在植物体内维持低水平表达,以调节基本的代谢,当受到病原菌胁迫时,表达量便会被上调,推测它与马铃薯抗青枯病相关免疫应答关系密切。
|
| 图 4 StSRP1在马铃薯与青枯菌互作早期时的表达分析 |
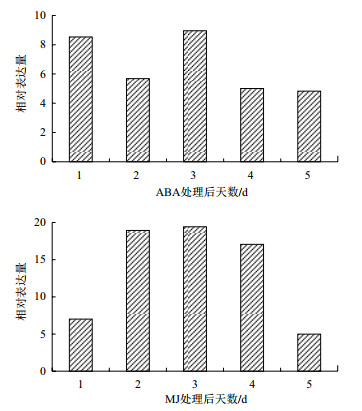
为探讨StSRP1蛋白在植物激素信号转导细胞应答中的作用,通过研究StSRP1在MJ和ABA激素反应中的表达(图 5)发现,MJ和ABA都能够不同程度地诱导StSRP1上调表达,经MJ处理后,StSRP1的表达量在3 d时达到高峰,在5 d时表达量开始明显下降。经ABA处理后,StSRP1的表达量在1 d时增加后,在2 d时立即下降,然后在3 d时达到高峰。结果表明,不同激素处理诱导了StSRP1的表达,因此StSRP1可能在激素信号转导过程中起着重要作用。
|
| 图 5 非生物胁迫下StSRP1的表达分析 |
胁迫相关蛋白在植物响应逆境中至关重要,调节多种真核细胞的生命活动。这已在相关研究中得到支持。Park等[16]研究表明,SRP仅在高等植物中发现,并且对非生物胁迫信号传导非常重要。木豆种子干燥过程中,胁迫相关蛋白在保护酶和脂质大分子中的有着重要作用[17],在大豆中,水胁迫条件下,70 kD HSP蛋白定位于内质网[18];在橡胶树中SRPP和REF定位于内质网[19];在水仙花中,SbSRP在质膜中表达[20],这与通过生物信息学分析SPR蛋白的亚细胞定位一致。Qi等[21]研究表明含有REF结构域的基因参与胁迫应答,在水仙花中,SbSRP转录物在盐,干燥,热和冷胁迫下表现出更高的表达[20],关于StSRP1表达调控的研究很少。StSRP1预测的保守结构域是REF,表明StSRP1可能参与胁迫应答。
为了研究调节StSRP1表达的机制,选取StSRP1蛋白起始密码子上游的2 000 bp碱基,预测其启动子,启动子中含有参与防御和胁迫应答的顺式作用元素TC-rich repeats,进一步表明StSRP1可能参与胁迫应答。植物中的胁迫适应性应答通常涉及ABA激活的信号通路与其他植物激素(例如MeJA,水杨酸和乙烯)之间的协同和拮抗相互作用[22]。StSRP1的侧翼序列中发现了参与脱落酸反应顺式作用元素ABRE,它对StSRP1表达的影响没有报道。StSRP1转录起始位点上游的片段对于在转基因植物的发育中驱动转基因表达可能具有很大的实用性,需要进一步的缺失分析来阐明StSRP1启动子区的顺式作用元件。显然,用ABA、MJ和病原菌处理,StSRP1的表达量上调,为进一步研究StSRP1功能及在青枯菌胁迫下的响应机制提供了依据。
4 结论经青枯菌诱导,克隆获得的马铃薯StSRP1,全长867 bp,编码289个氨基酸,含有REF保守结构域,属于REF家族,与茄科科植物番茄SRP聚为一支。StSRP1可能参与马铃薯激素调控和逆抗逆应答。
| [1] |
Unchera S, Valérie PR, Hervé C, et al. Characterization of polypeptides accumulated in the latex cytosol of rubber trees affected by the tapping panel dryness syndrome[J]. Plant & Cell Physiology, 2002, 43(11): 1323-1333. |
| [2] |
Dennis MS, Light DR. Rubber elongation factor from Hevea brasiliensis. identification, characterization, and role in rubber biosynthesis[J]. J Biol Chem, 1989, 264(31): 18608-18617. |
| [3] |
Kim EY, Park KY, Seo YS, et al. Arabidopsis small rubber particle protein homolog SRPs play dual roles as positive factors for tissue growth and development and in drought stress responses[J]. Plant Physiology, 2016, 170(4): 2494-2510. DOI:10.1104/pp.16.00165 |
| [4] |
Jing D, Zhang J, Xia Y, et al. Proteomic analysis of stress-related proteins and metabolic pathways in Picea asperata somatic embryos during partial desiccation[J]. Plant Biotechnology Journal, 2017, 15(1): 27-38. DOI:10.1111/pbi.2017.15.issue-1 |
| [5] |
Sano N, Masaki S, Tanabata T, et al. Proteomic analysis of stress-related proteins in rice seeds during the desiccation phase of grain filling[J]. Plant Biotechnology, 2013, 30(2): 147-156. DOI:10.5511/plantbiotechnology.13.0207a |
| [6] |
Hong JP, Kim WT. Isolation and functional characterization of the Ca-DREBLP1 gene encoding a dehydration-responsive element binding-factor-like protein 1 in hot pepper(Capsicum annuum L. cv. Pukang)[J]. Planta, 2005, 220(6): 875-888. DOI:10.1007/s00425-004-1412-5 |
| [7] |
Eun Yu K, Young Sam S, Hanna L, et al. Constitutive expression of CaSRP1, a hot pepper small rubber particle protein homolog, resulted in fast growth and improved drought tolerance in transgenic Arabidopsis plants[J]. Planta, 2010, 232(1): 71-83. DOI:10.1007/s00425-010-1149-2 |
| [8] |
Udawat P, Jha RK, Sinha D, et al. Overexpression of a cytosolic abiotic stress responsive universal stress protein(SbUSP)mitigates salt and osmotic stress in transgenic tobacco plants[J]. Front Plant Sci, 2016, 7(14): 518. |
| [9] |
Sarkar NK, Kim YK, Grover A. Rice sHsp genes:genomic organiz-ation and expression profiling under stress and development[J]. BMC Genomics, 2009, 10(1): 393-411. DOI:10.1186/1471-2164-10-393 |
| [10] |
Gary F, Janae W, Williams JJ, et al. Effect of mutation of the tetratricopeptide repeat and asparatate-proline 2 domains of Sti1 on Hsp90 signaling and interaction in Saccharomyces cerevisiae[J]. Genetics, 2006, 172(1): 41-51. DOI:10.1534/genetics.105.045815 |
| [11] |
Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends Plant Sci, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [12] |
Cuming AC. LEA proteins[J]. Seed Proteins, 1999, 753-780. |
| [13] |
Ni XM, Tian ZD, Liu J, et al. StPUB17, a novel potato UND/PUB/ARM repeat type gene, is associated with late blight resistance and NaCl stress[J]. Plant Science, 2010, 178(2): 158-169. DOI:10.1016/j.plantsci.2009.12.002 |
| [14] |
He LY. Characteristics of strains of pseudomonas solanacearum from china[J]. Plant Disease, 1983, 67(12): 1357-1361. DOI:10.1094/PD-67-1357 |
| [15] |
Li Y, Jia F, Yu Y, et al. The SCF E3 ligase AtPP2-B11 plays a negative role in response to drought stress in Arabidopsis[J]. Plant Molecular Biology Reporter, 2014, 32(5): 943-956. DOI:10.1007/s11105-014-0705-5 |
| [16] |
Park KY, Kim WT, Kim EY. The proper localization of RESPONSIVE TO DESICCATION 20 in lipid droplets depends on their biogenesis induced by STRESS-RELATED PROTEINS in vegetative tissues[J]. Biochemical and Biophysical Research Communications, 2017, 495(2): 1885-1889. |
| [17] |
Krishnan HB, Natarajan SS, Oehrle NW, et al. Proteomic analysis of Pigeonpea(Cajanus cajan)seeds reveals the accumulation of numerous stress-related proteins[J]. Journal of Agricultural and Food Chemistry, 2017, 65(23): 4572-4581. DOI:10.1021/acs.jafc.7b00998 |
| [18] |
Cascardo JC, Almeida RS, Buzeli RA, et al. The phosphorylation state and expression of soybean BiP isoforms are differentially regulated following abiotic stresses[J]. J Biol Chem, 2000, 275(19): 14494-14500. DOI:10.1074/jbc.275.19.14494 |
| [19] |
Brown D, Feeney M, Ahmadi M, et al. Subcellular localization and interactions among rubber particle proteins from Hevea brasiliensis[J]. Journal of Experimental Botany, 2017, 68(18): 5045-5055. DOI:10.1093/jxb/erx331 |
| [20] |
Udawat P, Jha RK, Mishra A, et al. Overexpression of a plasma membrane-localized SbSRP-like protein enhances salinity and osmotic stress tolerance in transgenic tobacco[J]. Front Plant Sci, 2017, 8: 582. DOI:10.3389/fpls.2017.00582 |
| [21] |
Qi XT, Cui QH, Luo Y, et al. Zn stress-induced inhibition of bean PvSR2-GUS fusion gene splicing is gene-specific in transgenic tobacco[J]. Journal of Plant Physiology, 2009, 11(166): 1223-1227. |
| [22] |
Takashi H, Kazuo S. Research on plant abiotic stress responses in the post-genome era:past, present and future[J]. Plant J, 2010, 61(6): 1041-1052. DOI:10.1111/tpj.2010.61.issue-6 |




