木质纤维素材料降解产生的糖类可用于微生物发酵,但葡萄糖会对木质纤维素材料中其他糖类的利用产生影响。木质纤维素中约有四成左右的糖类如木糖和阿拉伯糖因为葡萄糖的存在而无法得到彻底的利用[1]。这主要是因为分解代谢产物阻遏效应(Carbon catabolite repression,CCR),即葡萄糖的存在会抑制阻遏其他糖类(如木糖)的代谢,使得大肠杆菌只有优先利用完葡萄糖后,才能再利用其他糖类[2-3]。该阻遏效应与磷酸烯醇式丙酮酸-糖类磷酸转移酶系统(Phosphoenolpyruvate:carbohydrate phosphotransferase system,PTS)密切相关。PTS系统负责特异性地将葡萄糖从细胞外跨膜主动运输进入细胞,同时将葡萄糖磷酸化为葡萄糖-6-磷酸,进入糖酵解途径[4]。在此转运过程中,可溶性蛋白EIIAGlc(由crr基因编码)和结合在质膜上的特异性转运蛋白EIIBGlc(由ptsG基因编码)的去磷酸化状态的积累,与分解代谢产物阻遏直接相关[5-6]。遗传分析也得到相同结论,突变crr基因和ptsG基因,可弱化分解代谢产物阻遏[7-8]。国内外已有许多通过改变PTS系统相关基因表达量的方法来降低分解代谢产物阻遏效应,从而提高木糖利用效率,增强发酵强度,提高发酵产量的研究报道。Nichols等敲除ptsG基因的乙醇工程菌可利用混合糖发酵,产率达理论值的87%-94%[9]。Liang等[10]通过敲除pflB,ldhA,ppc和ptsG基因构建的工程菌混合糖发酵产琥珀酸,产量达到83 g/L。丁小云等[11]敲除ptsG基因的乳酸工程菌可同时利用葡萄糖和木糖发酵产D-乳酸,产量为83.04 g/L。Yao等[12]发现增强crp基因能够使大肠杆菌同时消耗葡萄糖和木糖,而敲除ptsG,或mgsA,或pgi基因都可以导致crp基因转录水平的增加。可以看到,目前对于混合糖利用都侧重于降低分解代谢产物阻遏效应以提高木糖的利用。
葡萄糖的入胞除了依赖PTS系统进行跨膜转运之外,也可依赖于半乳糖转运系统等非PTS系统来完成。目前已知半乳糖转运系统有两种运输载体半乳糖转运蛋白(GalP)和MglBAC复合蛋白(MglA:ATP结合蛋白;MglB:糖结合蛋白;MglC:跨膜运输蛋白),可对葡萄糖进行转运[11-12]。GalP是一种H+共转移载体,在将葡萄糖转运至胞内的同时需要转运H+。MglBAC复合蛋白属于转运蛋白中的ABC(ATP-binding cassette)家族,转运过程中需要额外消耗ATP[13-14]。不同于PTS系统的边转运边磷酸化,这两种运输载体在转运葡萄糖时不改变其构象,之后由葡萄糖激酶(Glk)催化生产葡萄糖-6-磷酸进入糖酵解途径。这些同属于葡萄糖转运系统的基因对木糖的利用是否有影响,目前还鲜有报道。
在前期的工作中,我们以产纤维乙醇的大肠杆菌工程菌SZ470为出发菌,在此基础上构建了ptsG缺陷菌株SZ470P,通过降低分解代谢产物阻遏效应增加混合糖发酵时木糖的利用效率[15]。本文中,我们拟敲除非PTS转运系统且也能转运葡萄糖的基因,即半乳糖转运系统中的mglB基因,得到mglB缺失菌SZ470M和ptsG/mglB双缺陷株SZ470PM。通过发酵验证和转录水平分析,明晰葡萄糖非PTS转运系统相关基因对木糖利用效率的影响,探讨PTS和非PTS转运系统是否对木糖利用存在协同影响,从而为木质纤维素木糖充分利用提供相应的理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株与质粒出发菌株分别为大肠杆菌乙醇工程菌SZ470和SZ470P。SZ470是能够利用五碳糖发酵高产乙醇的工程菌,其来源于野生菌株Escherichia.coli B,并敲除了乙酸激酶(ackA),延胡索酸还原酶(frdABCD),丙酮酸甲酸裂解酶(focA-pflB),D-乳酸脱氢酶(ldhA)等基因,并通过无氧启动子融合表达技术倍增了NADH还原力[16-18];SZ470P则是在SZ470的基础上敲除了参与葡萄糖磷酸转移酶系统中的编码基因ptsG[15]。质粒pKD4(包含FRT-kan-FRT阅读框),同源重组质粒pKD46(温度敏感型复制子,Ampr)。出发菌株与质粒均由本实验室保存。
1.1.2 主要试剂与仪器DNA Marker,PCR Master Mix购自Fermentas公司,细菌基因组DNA抽提试剂盒购于天根生物有限公司。氨苄青霉素和卡那霉素购自Mersco公司,PCR引物合成由上海生工生物工程技术服务有限公司合成。分析纯葡萄糖、蔗糖及其他无机盐等购于国药集团。
Sartorius BB-8846880发酵罐(德国Sartorius Stedim Biotech公司),Waters e 2695型高效液相色谱仪(美国Waters公司),GC-2014/SHIMAD20气相色谱仪(美国GC公司),mycycler PCR仪(美国Bio-Rad公司),MicroPluser电转仪(美国Bio-Rad公司)。
1.1.3 培养基LB培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠5 g/L;种子培养基:LB培养基;发酵培养基:LB培养基加混合糖(3%葡萄糖和2%木糖)或单糖(5%木糖);选择培养基:LB固体培养基加抗生素(50 mg/L氨苄青霉素或卡那霉素)。
1.2 方法 1.2.1mglB基因的敲除PCR引物设计如表 1所示。
根据mglB序列设计敲除引物P1和P2,如表 1所示,该对引物5’端45 bp片段与mglB基因序列同源,另外18-20 bp(表中下划线序列)与质粒pKD4上FRT-kan-FRT阅读框序列同源,以pKD4为模板进行PCR扩增可得到带有卡那霉素抗性基因的PCR片段。扩增条件为:95℃ 3 min;95℃ 30 s,55℃ 30 s,72℃ 2 min,30个循环;72℃ 5 min。用CaCl2法将pKD46转化入SZ470和SZ470P的细胞中,通过氨苄平板筛选得到阳性菌落。将阳性菌落的细胞在添加2%的L-阿拉伯糖的LB培养基中,30℃条件下进行液体培养至OD600 = 0.6。经过无菌去离子水清洗后,得到SZ470/pKD46,SZ470P/pKD46的感受态细胞。再用电转的方法将扩增的PCR片段分别转化到这两种感受态细胞中。30℃复苏培养2 h,涂布于含卡那霉素的LB培养基选择平板。37℃培养24 h,挑选生长良好的阳性单克隆在卡那霉素抗性平板上转接1-2次,并用鉴定引物P3、P4进行PCR验证。将成功敲除mglB基因的SZ470和SZ470P菌株分别命名为SZ470M和SZ470PM。
1.2.2 发酵罐发酵培养挑4-6个在LB平板上生长了24 h的单菌落,接入200 mL种子培养基,200 rpm,37℃培养至OD600为0.8-1.2左右。以10%的接种量将细胞接种至3 L发酵培养基,置于带有自动调节系统7 L发酵罐,200 rpm,37℃培养发酵。定时取样,测定菌体浓度OD600,糖浓度,乙醇及其他代谢产物的浓度等。
1.2.3 发酵产物检测分析菌体浓度测定在可见光分光光度计测定波长600 nm下OD值。葡萄糖、木糖采用高效液相色谱法分析,色谱柱为Bio-Rad HPX 87H,流动相为4 mmol/L H2SO4,流速0.5 mL/min,柱温40℃,检测器为PDA、ELS检测器。乙醇采用气相色谱仪进行测定,测定条件:采用氢离子火焰检测器(FID),毛细管柱,柱温40℃,进样温度200℃,检测器温度200℃,载气为氮气,流速2 mL/min,正丙醇作为内标,进样0.5 μL。乙醇理论产量计算:1 mol葡萄糖产生2 mol乙醇,1 mol木糖产生1 mol乙醇。乙醇转化率为实际产量与理论产量之比。
1.2.4 基因转录水平差异分析收集混合糖发酵24 h的细胞,根据的方法提取总RNA,使用PrimeScriptTM RT reagent Kit进行反转录,并用QTaqTM One-Step qRT-PCR S对YBR® KIT进行目标基因的定量分析。引物序列见表 2。以cysG作为内参基因[19],以SZ470中目标基因的转录水平为对照,计算SZ470M,SZ470P和SZ470PM中各目标基因转录水平的差异倍数。对基因转录水平进行显著性分析,P < 0.05表示有显著性差异。
分别以SZ470和SZ470P为对照,以鉴定引物P3和P4对菌株SZ470M和SZ470PM进行PCR验证,其结果如图 1所示。根据RED同源重组技术的原理,扩增的卡那霉素抗性基因PCR片段具有与mglB基因同源的45 bp序列,该片段通过同源重组整合到菌株基因组上从而将目的基因敲除。因此,SZ470M和SZ470PM经鉴定引物PCR扩增后其产物大小为1550 bp,与卡那霉素抗性基因PCR片段大小一致。而对照菌株SZ470和SZ470P的鉴定引物扩增产物则为mglB基因,片段大小为999 bp。图 1中结果符合预期,说明mglB基因敲除成功。

|
| M:DL2000 Plus DNA marker;1:SZ470;2. SZ470M;3. SZ470P;4. SZ470PM;5:卡那霉素抗性基因片段 图 1 mglB基因敲除验证 |
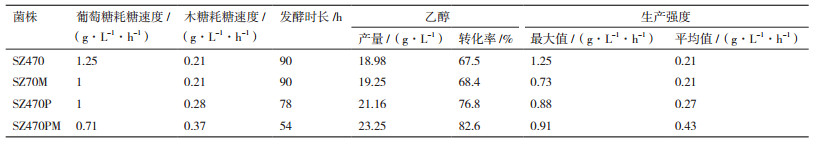
在以水稻秸秆为代表的木质纤维素水解液中,由纤维素以及半纤维素降解得到的葡萄糖约占60%,而由半纤维素降解得到的木糖以及少量阿拉伯糖等糖类占其他40%[20]。因此,本研究中设定3%葡萄糖+2%木糖的混合糖发酵条件,对比SZ470,SZ247M,SZ470P,SZ470PM的菌体生长情况,结果如图 2所示。SZ470发酵24 h时,OD达到最大9.2从而进入稳定期;SZ470M和SZ470P在30 h时OD值分别达到9.8和10.6,SZ470PM则在42 h OD值为11.8。虽然SZ470最先进入稳定期,但其最大OD值为4株菌中最小,而SZ470M,SZ470P和SZ470PM的最大OD值分别为SZ470最大OD值的1.06,1.15和1.28倍。在发酵的前42 h内,相对SZ470而言,SZ470M的菌体生长量与其相差不大;而SZ470P和SZ470PM的菌体增长则更为明显,说明后两者可以摄取更多的碳源,用于菌体生长。
|
| 图 2 大肠杆菌葡萄糖转运基因缺陷菌SZ470M,SZ470P,SZ470PM与出发菌株SZ470混合糖发酵(3%葡萄糖+2%木糖)的菌体生长情况 |
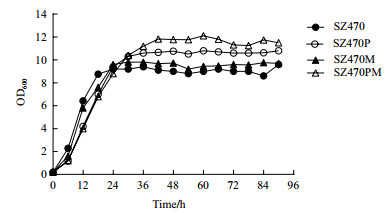
四株菌的葡萄糖的消耗情况如图 3和表 3所示。四株菌在24-48 h内可发酵完葡萄糖。由于mglB基因的敲除,SZ470M和SZ470PM相对于各自的出发菌株而言,葡萄糖消耗速度都有所降低。说明mglB基因可以通过阻断葡萄糖通过MglBAC复合蛋白运输途径来降低葡萄糖入胞速度。而SZ470PM葡萄糖糖耗速度的进一步降低,说明葡萄糖转运系统的阻断对于葡萄糖转运速度的下降有叠加效应。对比SZ470PM和SZ470可知,mglB和ptsG的敲除使葡萄糖的消耗速度下降43%,消耗时长则增加近一倍。
|
| 图 3 大肠杆菌葡萄糖转运基因缺陷菌SZ470M,SZ470P,SZ470PM与出发菌株SZ470混合糖发酵(3%葡萄糖+2%木糖)的葡萄糖消耗曲线 |
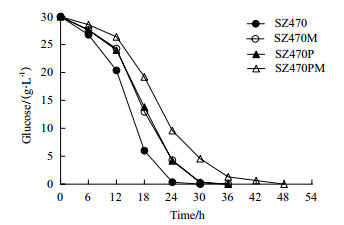
四株菌的木糖消耗情况与如图 4和表 3所示。SZ470和SZ470M的发酵周期最长,并且在前24-30 h时间内,即葡萄糖消耗完毕之前,木糖基本没有消耗,整个发酵周期木糖消耗速度没有明显变化。该结果说明单独敲除mglB基因,并不能降低分解代谢产物阻遏效应,对木糖的利用效率也没有明显影响。而SZ470P和SZ470PM木糖消耗与葡萄糖消耗可同时进行,说明分解代谢产物阻遏效应在这两株菌中程度有所降低。如表 3所示,SZ470P和SZ470PM的木糖消耗速度分别为0.28 g/(L·h)和0.37 g/(L·h),相对于SZ470的木糖消耗速度分别提高了33%和76%。该结果说明ptsG基因的缺失,可以有效降低分解代谢产物阻遏效应,使得木糖与葡萄糖同时利用。而双缺陷菌SZ470PM的木糖消耗速度比ptsG缺陷菌SZ470P提高32%,说明在降低分解代谢产物阻遏效应的基础上,mglB基因的敲除也可提高木糖利用效率。
|
| 图 4 大肠杆菌葡萄糖转运基因缺陷菌SZ470M,SZ470P,SZ470PM与出发菌株SZ470混合糖发酵(3%葡萄糖+2%木糖)的木糖消耗曲线 |
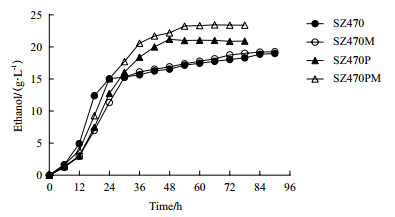
四株菌的乙醇产量如图 5和表 3所示,在发酵的前24 h,SZ470的乙醇产量高于其他3株菌。发酵30 h之后,SZ470PM和SZ470P的乙醇产量超过SZ470。SZ470和SZ470M发酵90 h,乙醇产量分别是18.98 g/L和19.25 g/L。SZ470P的乙醇产量为21.16 g/L,相较于SZ470,产量提高了2.18 g/L,转化率提高9.3%。SZ470PM的乙醇产量为23.25 g/L,相较于SZ470,产量提高了4.27 g/L,转化率提高15.1%;相较于SZ470P,产量提高了2.09 g/L,转化率提高了5.8%。
|
| 图 5 大肠杆菌葡萄糖转运基因缺陷菌SZ470M,SZ470P,SZ470PM与出发菌株SZ470混合糖发酵(3%葡萄糖+2%木糖)的乙醇产量 |
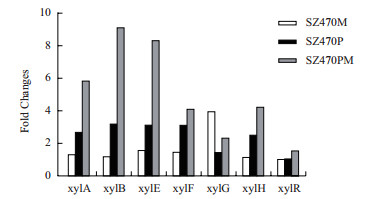
从发酵实验结果来看,ptsG基因的敲除和ptsG/mglB基因的双敲除,都可提高混合糖发酵时木糖的消耗速度,乙醇生产强度及产量。为了进一步探讨葡萄糖转运基因的缺失对混合糖发酵时木糖利用效率的影响,将混合糖发酵24 h的细胞提取RNA,反转录后通过Real-time qPCR对木糖转运及代谢的相关基因进行转录水平分析,结果如图 6所示。以SZ470为对照,SZ470M只有xylG基因有明显差异,其他目标基因差异不显著,说明木糖代谢相关途径没有明显改变,这与SZ470M在混合糖发酵时其发酵能力与SZ470相差不大的结果相符。而SZ470P和SZ470PM中xylA,xylB,xylE,xylF和xylH的基因转录水平有显著性提高,且后者程度更强。说明ptsG基因的敲除和ptsG/mglB基因的双敲除,可提高木糖转运和代谢途径关键基因的转录水平,从而提高混合糖发酵时木糖代谢效率,进而提高乙醇产量和生产强度。
|
| 数值为进行3次独立发酵实验的平均值。以菌株SZ470作为对照,计算SZ470,SZ470P和SZ470PM中目标基因转录水平差异倍数(FC)。FC > 2时,有显著性差异。xylA:xylose isomerase;xylB:xylulokinase;xylE:D-xylose H+ symporter;xylF:xylose ABC trnasporter periplasmic binding protein;xylG:xylose ABC transporter ATP binding subunit;xylH:xylose ABC transporter membrane subunit;xylR:DNA-binding transcriptional dual regulator. 图 6 混合糖发酵(3%葡萄糖+2%木糖)时木糖转运及代谢基因转录水平的变化(发酵24 h) |
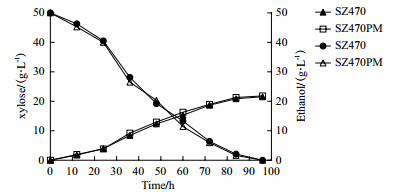
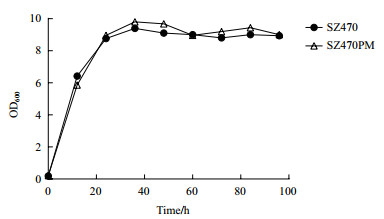
SZ470PM与SZ470混合糖发酵结果对比说明ptsG/mglB基因的双敲除对木糖的利用效率有明显提高。为探讨木糖作为单一碳源发酵时这两个基因对木糖利用效率的影响,以5%木糖为碳源对SZ470PM和SZ470进行发酵,其糖耗曲线和乙醇产量如图 7所示。结果表明,SZ470和SZ470PM在96 h内将木糖完全消耗,最终乙醇产量分别为21.56 g/L和21.87 g/L,且两者的木糖消耗速度和乙醇生产强度没有明显差别。而从两株菌的菌体生长情况来看,也无明显差别(如图 8)。
|
| 图 7 大肠杆菌葡萄糖转运基因缺陷菌SZ470PM与出发菌株SZ470木糖(5%)发酵的糖消耗曲线和乙醇产量 |
|
| 图 8 大肠杆菌葡萄糖转运基因缺陷菌SZ470PM与出发菌株SZ470木糖(5%)发酵的菌体生长情况 |
综合四株菌的混合糖发酵情况来看,mglB基因和ptsG基因的敲除都可以降低葡萄糖的消耗速度,原因是分别阻断葡萄糖通过MglBAC和PTS两种转运途径的运输,造成葡萄糖入胞通量减少。从菌体生长情况来看,SZ470P和SZ470PM的菌体增长则更为明显,说明后两者可以摄取更多的碳源,用于菌体生长。而SZ470PM的菌体生长量高于SZ470P,原因可能为通过阻断能量消耗较高的MglBAC运输途径,使得葡萄糖入胞的能量消耗降低,使更多的能量用于菌体生长,从而导致发酵乙醇总产量增加。从木糖利用效率来看,单独敲除mglB基因并不能提高木糖消耗速度。只有敲除ptsG基因才可通过降低分解代谢产物阻遏效应,达到葡萄糖与木糖同时利用从而提高木糖消耗速度,说明葡萄糖非PTS转运系统不能单独对木糖利用效率产生影响。而ptsG/mglB双缺陷菌SZ470PM木糖消耗速度高于SZ470P,说明在敲除ptsG基因降低分解代谢产物阻遏效应的基础上,mglB基因的敲除对木糖利用效率的提高具有协同效果。因此,SZ470PM在四株菌中木糖消耗速度相对于SZ470,SZ470M,SZ470P分别提高了76%,76%和32%。综合来看,SZ470PM体现出在混合糖发酵条件下木糖利用效率高,发酵周期短,乙醇产量和转化率高的优点。
从混合糖发酵条件下木糖转运与代谢关键基因的转录水平的分析上看,也可得到相同结论。木糖通过H+共运输载体XylE和专一性运输载体XylFGH转运入胞,编码这两种载体的基因xylE和xylFGH受蛋白XylR的调控[21]。木糖入胞后由XylA催化形成木酮糖,再由XylB催化形成木酮糖-5-磷酸。以SZ470为对照,SZ470P和SZ470PM与木糖转运与代谢相关基因的转录水平都有显著上调,且SZ470PM的上调程度要高于SZ470P。说明通过敲除ptsG基因,可以通过阻断与分解代谢产物阻遏效应相偶联的PTS转运系统来降低对木糖代谢途径的抑制,从而提高木糖转运和代谢相关基因的转录水平;而进一步敲除mglB基因,则对木糖木糖转运和代谢相关基因的转录水平的上调有协同影响。和SZ470P相比,SZ470PM木糖H+共运输载体的编码基因xylE的上调趋势要比专一性运输载体XylFGH的编码基因xylF,xylG,xylH的上调趋势更加明显,原因是专一性运输载体XylFGH比木糖H+共运输载体XylE更耗能[22-23],所以从能量的角度来考虑木糖入胞更趋向于通过木糖H+共运输载体XylE来转运。因此,xylE基因的转录水平上调更为显著。
但由菌株SZ470PM与SZ470在木糖单糖发酵情况比对来看,ptsG与mglB双基因的敲除,并没有对木糖利用效率造成显著影响。其原因可能在于,以木糖为单一碳源时,葡萄糖转运代谢相关基因无需大量编码相关蛋白,细胞也不需要消耗能量用于葡萄糖分子的主动转运及代谢。因此,SZ470PM与SZ470的菌体生长,木糖消耗速度以及乙醇产量无明显差异。说明,葡萄糖PTS和非PTS转运系统相关基因只有在混合糖条件下对木糖利用才存在协同效应。
综上,葡萄糖转运基因ptsG和mglB基因的敲除,可降低混合糖发酵时分解代谢产物阻遏效应和葡萄糖入胞速率,提高木糖转运和代谢相关基因的转录水平,从而提高木糖消耗速度及利用效率。
4 结论本研究通过对大肠杆菌葡萄糖转运基因mglB的敲除,构建的ptsG/mglB双缺陷乙醇工程菌SZ470PM,在混合糖发酵时,具有木糖利用效率高,发酵周期短,乙醇转化率高的特点,是具有可利用木质纤维素发酵产乙醇的潜力。通过比较混合糖发酵性能和木糖转运与代谢相关基因的转录水平分析,得出葡萄糖PTS和非PTS转运系统相关基因对木糖利用存在协同影响,为木质纤维素木糖的高效利用提供一定理论依据。
| [1] |
Burin EM. Genomics of cellulosic biofuels[J]. Nature, 2008, 454: 841-845. DOI:10.1038/nature07190 |
| [2] |
Deutscher J. The mechanisms of carbon catabolite repression in bacteria[J]. Current Opinion in Microbiology, 2008, 11(2): 87-93. DOI:10.1016/j.mib.2008.02.007 |
| [3] |
Dien BS, Nichols NN, O'Bryan PJ, et al. Development of new ethanologenic Escherichia coli strains for fermentation of lignocellulosic biomass[J]. Applied Biochemistry and Biotechnology, 2000, 84(1-9): 181-196. |
| [4] |
Saffen DW, Presper KA, Doering TL, et al. Sugar transport by the bacterial phosphotransferase system. Molecular cloning and structural analysis of the Escherichia coli ptsH, ptsI, and ccr genes[J]. Journal of Biological Chemistry, 1987, 262: 16241-16253. |
| [5] |
Meins M, Jeno P, Muller D, et al. Cysteine phosphorylation of the glucose transporter of Escherichia coli[J]. Journal of Biological Chemistry, 1993, 268(16): 11604-11609. |
| [6] |
Deuscher J, Francke C, Postma PW. How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J]. Microbiology and Molecular Biology Reviews, 2006, 70(4): 939-1031. |
| [7] |
Sondej M, Sun JZ, Seok YJ, et al. Deduction of consensus binding sequences on proteins that bind IIAGlc of the phosphoenolpyruvate:sugar phosphotransferase system by cysteine scanning mutagenesis of Escherichia coli lactose permease[J]. Proceedings of the National Academy of Sciences of the USA, 1999, 96(7): 3525-3530. DOI:10.1073/pnas.96.7.3525 |
| [8] |
Zeppenfeld T, Larisch C, Lengeler JW, et al. Glucose transporter mutants of Eshcerichia coli K-12 with changes in substrate recognition of IICBGlc and induction behavior of the ptsG gene[J]. Journal of Bacteriology, 2000, 182(16): 4443-4452. DOI:10.1128/JB.182.16.4443-4452.2000 |
| [9] |
Nichols N, Dien B, Bothast R. Use of catabolite repression mutants for fermentation of sugar mixtures to ethanol[J]. Applied Microbiology and Biotechnology, 2001, 56(1-2): 120-125. DOI:10.1007/s002530100628 |
| [10] |
Liang L, Liu R, Li F, et al. Repetitive succinic acid production from lignocellulose hydrolysates by enhancedment of ATP supply in metaboically engineered Escherichia coli[J]. Bioresource Technology, 2013, 143(6): 405-412. |
| [11] |
丁小云, 顾健健, 王永泽, 等. 产D-乳酸重组大肠杆菌ptsG基因的敲除及其混合糖同步发酵[J]. 生物技术通报, 2015, 31(12): 221-226. |
| [12] |
Yao R, Hirose Y, Sarkar D, et al. Catabolic regulation analysis of Escherichia coli and its crp, mlc, mgsA, pgi and ptsG mutants[J]. Microbial Cell Factories, 2011, 10: 67. DOI:10.1186/1475-2859-10-67 |
| [13] |
Chou CH, Bennett GN, San KY. Effect of modulated glucose uptake on high-level recombinant protein production in a dense Escherichia coli culture[J]. Biotechnology progress, 1994, 10: 644-647. DOI:10.1021/bp00030a009 |
| [14] |
McDonald TP, Walmsley AR, Henderson PJ, et al. Asparagine 394 in putative helix 11 of the galactose-H+ symport protein(GalP)from Escherichia coli is associated with the internal binding site for cytochalasin B and sugar[J]. Journal of Biological Chemistry, 1997, 272: 15189-15199. DOI:10.1074/jbc.272.24.15189 |
| [15] |
严涛, 赵锦芳, 高文慧, 等. 大肠杆菌工程菌ptsG基因敲除及其缺陷株混合糖同型乙醇发酵[J]. 生物工程学报, 2013, 29(7): 937-945. |
| [16] |
Zhou S, Iverson A, Grayburn WS. Engineering a native homoethanol pathway in Escherichia coli B for ethanol production[J]. Biotechnology Letter, 2008, 30(2): 335-342. |
| [17] |
Chen K, Iverson AG, Garza EA, et al. Metabolic evolution of non-transgenic Escherichia coli SZ420 for enhanced homoethanol fermentation from xylose[J]. Biotechnology Letter, 2010, 32(1): 87-96. |
| [18] |
Zhou S, Iverson A, Grayburn WS. Doubling the catabolic reducing power(NADH)output of Escherichia coli fermentation for production of reduced products[J]. Biotechnology Progress, 2010, 26(1): 45-51. |
| [19] |
Zhou K, Zhou L, Lim QE, et al. Novel reference genes for quantifying transcriptional responses of Escherichia coli to protein overexpression by quantitative PCR[J]. BMC Molecular Biology, 2011, 12: 18-26. DOI:10.1186/1471-2199-12-18 |
| [20] |
Wyman C. Potential synergies and challenges in refining cellulosic biomass to fuels, chemicals, and power[J]. Biotechnology Progress, 2003, 19(2): 254-262. |
| [21] |
Khankal R, Chin JW, Cirino PC. Role of xylose transporters in xylitol production from engineered Escherichain coli[J]. Journal of Biotechnology, 2008, 134(3-4): 246-252. DOI:10.1016/j.jbiotec.2008.02.003 |
| [22] |
Gonzalez R, Tao H, Shanmugam KT, et al. Global gene expression differences associated with changes in glycolytic flux and growth rate in Escherichia coli during the fermentation of glucose and xylose[J]. Biotechnology Progress, 2002, 18: 6-20. DOI:10.1021/bp010121i |
| [23] |
Khunnonkwao P, Jantama S. Kanchanatawee S, et al. Re-engineering Escherichia coli KJ122 to enhance the utilization of xylose and xylose/glucose mixture for efficient succinate production in mineral salt medium[J]. Applied Microbiology and Biotechnology, 2018, 102: 127-141. DOI:10.1007/s00253-017-8580-2 |