2. 中国科学院大学,北京 100049;
3. 上海科技大学,上海 201210
2. University of Chinese Academy of Sciences, Beijing 100049;
3. Shanghai Tech University, Shanghai 201210
乙醇酸是一种水溶性α-羟基酸(AHA),通常被添加到乳液聚合物、溶剂、油墨或涂料中改善制剂的流动性并增加其光泽度。因此常用于表面处理,是家用清洁液中常用的活性成分,同时在纺织工业中作为染色剂和鞣剂被广泛使用[1]。乙醇酸也是护肤品工业中最广泛使用的α-羟基酸之一,其分子很小,可以轻易地穿透皮肤、刺激胶原蛋白的再生,且相比于其他AHA,乙醇酸对于加速衰老皮肤脱落的功效更加显著[2-3]。此外,乙醇酸还可在食品加工中作为调味剂和防腐剂[4]。
乙醇酸的工业制备主要是利用甲醛羰基化的合成路径,使用合成气进行催化,这种方式成本较低[5]。也可以通过氯乙酸与氢氧化钠反应后的再次酸化去氯制备乙醇酸[6]。其他方式包括草酸加氢等也可制备[7],但价格较高。此外,包括大肠杆菌等在内的多种微生物存在着氧化木糖获得2-酮-3-脱氧-D-木糖酸,再经过醛缩酶催化后生成乙醇酸的Dahms Pathway(图 1)[8]。
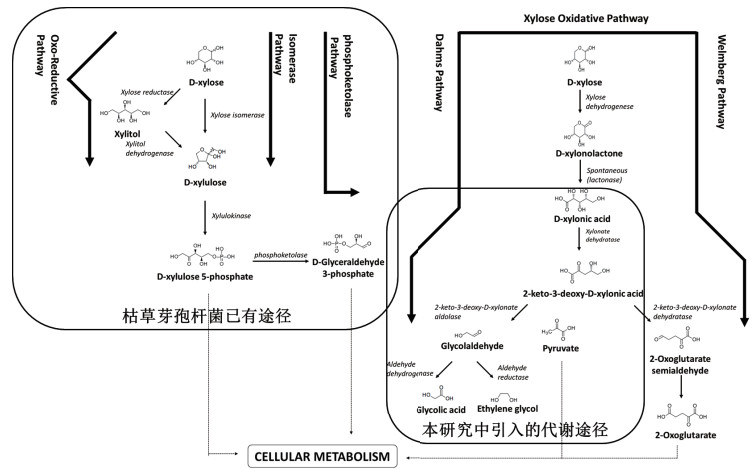
|
| 图 1 枯草芽孢杆菌的木糖及引入的木糖酸代谢途径示意图 |
枯草芽孢杆菌是一种获得了GRAS认证地位的、可用于食品工业的安全生产菌株,具有高分泌胞外蛋白、不含脂多糖等诸多优良特性,被大量用于工业蛋白的生产[9]。此外,这类生产菌株营养代谢谱广,代谢产物较丰富,近年来也被用于多种化学品的生物制造,尤其是用于食品及化妆品市场的有机物的合成[10]。虽然枯草芽孢杆菌可以利用木糖为碳源,却缺少将木糖氧化为木糖酸,再合成乙醇酸的天然途径。为了能够获得一株可以生产乙醇酸的食品安全菌,本研究将来自大肠杆菌的Dahms Pathway引入枯草芽孢杆菌,发现重组菌株可以结合自身的醛缩酶同工酶,仅在过表达YjhG后就可以将木糖酸高效地转化为乙醇酸。
1 材料与方法 1.1 材料菌株、质粒信息以及PCR所用的模板及引物序列等信息如表 1所列,其中枯草芽孢杆菌A164S为实验室改造的实验菌株[11]。
基因组DNA提取试剂盒、PCR清洁试剂盒、质粒小剂量提取试剂盒等,购自杭州爱思进生物技术有限公司;Taq DNA聚合酶,康为世纪生物科技有限公司;限制性内切酶Bam H I,赛默飞世尔科技公司;碱性磷酸酶CIAP,宝日医生物技术(北京)有限公司;Phanta高保真DNA聚合酶、一步克隆试剂盒,南京诺唯赞生物科技有限公司。
S1000TMPCR扩增仪,伯乐生命医学产品(上海)有限责任公司;Tanon EPS30电泳槽及Gel DocTM XR+全自动凝胶成像仪,伯乐生命医学产品(上海)有限责任公司;NANODROP 2000c微量分光光度计,赛默飞世尔科技公司;高效液相色谱仪,日本岛津制作所株式会社;高速冷冻离心机,艾本德生命科学仪器有限公司;恒温培养箱及恒温摇床,上海智城分析仪器制造有限公司。
1.2 方法 1.2.1 培养基的配制大肠杆菌及枯草芽孢杆菌的摇瓶培养均使用LB培养基:10 g/L氯化钠,10 g/L胰蛋白胨,5 g/L酵母浸取物;枯草芽孢杆菌A164S诱导转化培养基为含1%(W/V)木糖的LB培养基;发酵产乙醇酸的培养基为添加了30 g/L木糖酸的LB培养基。在实验需要时,添加的氨苄青霉素(Amp)浓度为100 μg/mL,芽孢杆菌培养时所用的氯霉素(Cm)浓度为7.5 μg/mL。
1.2.2 质粒构建以大肠杆菌E. coli W3110为模板,以引物对YjhGeco-F和YjhGeco-R进行高保真PCR得到目标yjhG基因产物,以引物对YjhHeco-F和YjhGeco-R进行高保真PCR得到目标yjhH-yjhG双基因产物(引物序列见表 1),将得到的PCR产物进行清洁并测定浓度。用BamH I快切酶将质粒pMK4-PxylA-comK线性化并切除comK DNA片段[11],在37℃中反应3 h后加入1 μL碱性磷酸酶,继续反应1 h后进行清洁并测定浓度。将清洁后的质粒和片段通过一步克隆试剂盒进行连接,之后立即进行转化,转化子经colony PCR验证后,提取质粒DNA,通过DNA测序验证了质粒构建的正确性。
1.2.3 大肠杆菌感受态的制备及诱导转化大肠杆菌E. coli DH5α感受态的制作采用氯化钙法,置于-80℃冰柜保存。将转化所需的化学感受态细胞置于冰上解冻,取10 μL重组产物加入到100 μL感受态细胞中,轻弹管壁混匀,冰上放置30 min。放入42℃水浴中热激90 s,立即置于冰上冷却1-2 min。加入700 μL无抗LB液体培养基,37℃摇床200 r/min培养1 h。将Amp抗性的LB固体培养基平板在37℃培养箱中预热。取出转化细胞,500 r/min离心5 min后弃掉400 μL上清,用剩余培养基重悬菌体后用无菌涂布棒在含有正确抗性的平板上轻轻涂匀。37℃培养箱中倒置培养12-16 h。长出单菌落后,挑取菌落进行PCR验证并印章,引物为质粒上的特有片段。
1.2.4 枯草芽孢杆菌感受态的制备及诱导转化将单克隆菌株B. subtilis A164S转接到3 mL液体LB试管中,过夜培养8-12 h。吸取62 μL的木糖溶液0.5 g/mL加入到一支新鲜的3 mL液体LB试管中,37℃预热。加入0.3 mL的过夜培养A164S菌液,在37℃ 200 r/min摇床中培养3 h,即得到枯草芽孢杆菌A164S的转化感受态。用2.0 mL的无菌EP管进行分装,每管加入菌液0.5 mL。每管感受态细胞加入1.0 μg质粒,混匀后在37℃ 200 r/min摇床中培养1.5 h。将氯霉素抗性的LB固体培养基平板在37℃培养箱中预热。取出转化细胞,500 r/min离心5 min后弃掉300 μL上清,用剩余培养基重悬菌体后用无菌涂布棒在含有正确抗性的平板上轻轻涂匀。37℃培养箱中倒置培养12-16 h。当平板上长出阳性转化子后,挑取单克隆,通过colony PCR验证质粒的存在。
1.2.5 摇瓶发酵实验将转入已构建成功质粒的A164S菌株转接入摇瓶进行发酵。在平板上挑取经过验证的单克隆,转接到3 mL带有氯霉素抗性的LB液体培养基中,过夜培养8-12 h。将LB培养基分装到250 mL的三角瓶中,每个瓶子装50 mL。将已灭菌的木糖酸加入LB培养基,使终浓度为20 g/L。将过夜培养的菌液全部转接到三角瓶,在37℃ 200 r/min摇床中进行培养。当OD600约0.4时加入0.5 g/mL的木糖溶液500 mL。
1.2.6 高效液相色谱检测标准样品测定及发酵液组分测定均采用高效液相色谱法,色谱柱为HPX-87H,流动相为0.005 mol /L的稀硫酸溶液,流速为0.8 mL/min,柱温箱温度为60℃,进样体积为20 μL,使用视差检测器和紫外检测器进行检测。
精密称取木糖酸标准品约0.1 g(精确至0.1 mg),用去离子水溶解制成1 mL标准品储备液,浓度为100 g/L,4℃冰箱内保存。取适量木糖酸标准品储备液,稀释成(g/L):1、2、3、4、5、6、7、8、9、10系列浓度的标准样品,按上述色谱条件采集10张色谱图,以木糖酸标准样品的峰面积y对标准样品的质量浓度x(g/L)做标准曲线。
精密称取乙醇酸标准品约0.1 g(精确至0.1 mg),用去离子水溶解制成1 mL标准品储备液,浓度为100 g/L,4℃冰箱内保存。取适量乙醇酸标准品储备液,稀释成(g/L):0.01、0.02、0.03、0.04、0.05、0.06、0.07、0.08、0.09、0.10系列浓度的标准样品,按上述色谱条件采集10张色谱图,以乙醇酸标准样品的峰面积y对标准样品的质量浓度x(g/L)做标准曲线。
每隔一定时间将发酵所用三角瓶从摇床中取出,在超净工作台中吸取1 mL发酵液到1.5 mL EP管中,12 000 r/min离心10 min后将上清收集到干净的1.5 mL EP管。将发酵液稀释10倍,用1 mL针管吸取约300 μL后,通过0.22 μm亲水针式滤器加入衬管中,制成液相样品,按上述色谱条件进行色谱图采集。
2 结果 2.1 代谢途径分析及质粒构建枯草芽孢杆菌可以利用木糖作为碳源,经磷酸化后由5-磷酸核酮糖进入五糖磷酸途径(Pentose Phosphate Pathway),但没有直接氧化木糖产生乙醇酸的代谢途径,如图 1所示。而大肠杆菌中存在这个代谢途径,因此,本研究选取来自大肠杆菌Dahms Pathway的两个酶,在枯草芽孢杆菌中作过表达。
如图 2所示,来自大肠杆菌的yjhH以及yjhG构成一个操纵子,因此可以由一次PCR完成对两个基因的同时克隆。质粒pMK4-comK经BamH I线性化后,通过一步克隆试剂盒与DNA片段连接,得到质粒pMK4-yjhHG。质粒pMK4-yjhG则用来只表达YjhG,两个基因的转录均由可诱导的木糖启动子PxylA完成。质粒构建完成后,经化学转化,转入高转化效率的枯草芽孢杆菌A164S,分别得到转化子A164S-HG和A164S-G。
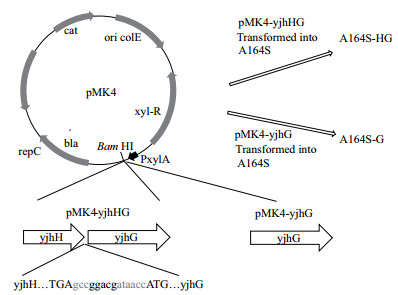
|
| 图 2 质粒构建及转化示意图 |
将重组菌培养后,利用质粒提取试剂盒从重组细胞中提取质粒DNA,再利用BamH I进行酶切,分别得到一条约7 000 bp的质粒条带以及一条约1 000 bp(yjhG)的条带和约2 000 bp(yjhH)的DNA条带,如图 3所示。
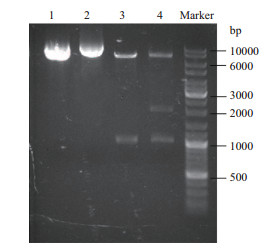
|
| 1. pMK4-yjhG质粒;2. pMK4-yjhHG质粒;3. pMK4-yjhG酶切;4. pMK4-yjhHG酶切 图 3 质粒构建及酶切验证电泳图 |
如图 1所示,yjhG编码的蛋白是木糖酸脱水酶,它的催化产物是2-酮-3-脱氧-D-木酮酸,该化学中间体在醛缩酶(YjhH)的作用下,生成乙醇醛及丙酮酸。为了测定导入了Dahms Pathway的重组枯草芽孢杆菌的生物活性,以未转入质粒的枯草芽孢杆菌A164S作为对照,在发酵预实验中,发现转化子A164S-HG和A164S-G的发酵液中检测到了底物木糖酸的消耗及新产物的产生,通过与乙醇酸及其他可能产物(乙醇醛、乙二醇)标准样品色谱图进行比对,确定产物成分为乙醇酸,如图 4所示。
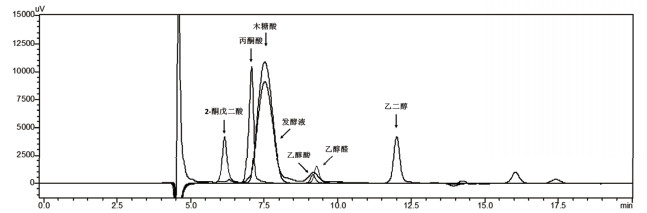
|
| 图 4 代谢产物鉴定色谱图 |
为了检测新产物的浓度,进行了乙醇酸标准浓度的测定(图 5-A),乙醇酸的浓度和形成的紫外吸收峰面积之间的线性相关系数(R2)为0.998(图 5-B)。
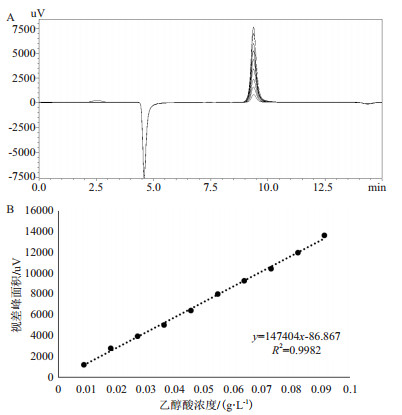
|
| A:乙醇酸标准浓度色谱图叠加图;B:标准浓度曲线图 图 5 乙醇酸标样浓度的确定 |
3个不同的转化子A164S、A164S-HG或A164S-G,被平行接入加入5 g/L木糖和30 g/L的木糖酸的LB培养基中进行摇瓶发酵,发酵过程中每隔一段时间取样进行OD600测定和发酵液组分测定。
OD600测定结果如图 6-A所示,A164S-G转化子的生长情况略优于A164S-HG。通过对色谱图中相应物质的峰面积进行分析后,比较标准曲线可分别得到这两种重组菌木糖酸的消耗量和乙醇酸的产生量,如图 6-B所示。重组枯草芽孢杆菌A164S-G的乙醇酸最高可生成约1.5 g/L的乙醇酸,消耗的木糖酸约为5.3 g/L,摩尔转化率达到42.54%,其乙醇酸的产量反而大大高于同时表达YjhG和YjhH的转化子A164S-HG。
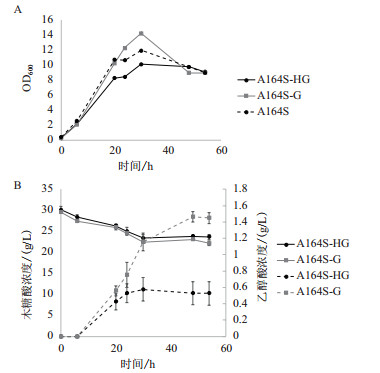
|
| A:OD600变化曲线;B:木糖酸及乙醇酸变化曲线 图 6 重组枯草芽孢杆菌代谢木糖酸的发酵实验结果 |
随着对微生物代谢途径的深入了解,利用来自生物质原料的廉价木糖组分进行发酵生产的研究进展飞速[12]。木糖可以用于酒精生产,或直接被转化为一些重要的化学原料,如木糖醇或木糖酸[13]。而木糖酸不仅是一种重要的水泥工业原料,也是一些微生物进一步代谢利用的底物,但枯草芽孢杆菌并不能代谢木糖酸,让这种食品工业重要微生物获得利用木糖酸进行代谢的能力具有重要意义。通过KEGG代谢网络数据库对多种微生物的代谢途径的分析,发现大肠杆菌、阴沟肠杆菌等微生物均具有水解木糖酸的能力。因此,本文构建了基于木糖酸脱水酶(YjhG)及2-酮3-脱氧-D-木糖酸醛缩酶(YjhH)的代谢支路(图 1),该支路也称为Dahms Pathway[8]。将大肠杆菌YjhH蛋白的氨基酸序列在NCBI数据库中进行比对,发现枯草芽孢杆菌168存在两个同源性较高的蛋白。将这些蛋白进行比对分析后,如图 7所示,原来注释为4-羟基四氢吡啶合酶DapA蛋白与YjhH的同源性为31%;而原来注释为5-脱氢-4-脱氧葡糖二酸脱水酶的KdgD蛋白与YjhH的同源性为27%。因此,为了确定枯草芽孢杆菌是否具有自身的2-酮3-脱氧-D-木糖酸醛缩酶活性,本研究除了共表达YjhG/YjhH之外,还单独表达了YjhG。实验结果表明,与枯草芽孢杆菌168高度同源的菌株A164S在单独表达YjhG后就可以获得来自于2-酮-3-脱氧-D-木糖酸裂解后的终产物-乙醇酸,这说明A164S含有YjhH的同工酶。

|
| 图 7 大肠杆菌YjhH与枯草芽孢杆菌168同源蛋白的比对分析 |
此外,2-酮-3-脱氧-D-木糖酸裂解的直接产物为乙醛酸及丙酮酸,丙酮酸将被代谢利用,而乙醛酸为高活性化合物,微生物通常会利用菌体内非特异的氧化酶或还原酶将其转化为乙醇酸或乙二醇。而在本研究中,无论是过表达了YjhG还是YjhH/YjhG的重组菌的发酵液中均检测不到乙二醇(图 1示意图中的可能产物)。这可能由于枯草芽孢杆菌为好氧型微生物,乙醇醛还原酶的表达量很低所致[14]。同时,实验发现表达双基因YjhHG的重组菌的乙醇酸产率低于单独表达YjhG的重组菌,这可能是由于来自大肠杆菌的原始的核糖体识别位点(RBS)在枯草芽孢杆菌中效率不高所造成的。如图 1中的基因间序列所示,来自大肠杆菌的原始RBS序列(图 1)缺乏枯草芽孢杆菌RBS的典型特征序列(GGAGG)[15]。后续研究若要提高木糖酸的转化效率,除了可以进行RBS的优化,还可以对YjhG和YjhH进行分别表达。此外,双基因表达(YjhHG)的转化效率低于单独表达YjhG的效率,且重组菌的木糖酸的利用率相当低(低于20%),说明微生物自身含YjhH的同工酶,同时也表明YjhG可能是木糖酸氧化过程中的限速酶。因此,未来除了要通过分子生物学手段进一步提高YjhG的表达量,还需要开展YjhG的酶学特征及工程改造研究。此外,还有必要引入来自其他微生物,如新月茎杆菌的Weimberg pathway[16-17],进一步丰富重组枯草芽孢杆菌的代谢途径,并获得直接利用木糖氧化生成木糖酸的能力。综上所述,本研究证实了重组枯草芽孢杆菌生产食品安全级乙醇酸生产的可行性,为进一步开发乙醇酸工业生产菌株奠定了研究基础。
4 结论以枯草芽孢杆菌为研究对象,通过质粒过表达来自大肠杆菌的Dahms Pathway。对获得的转化子进行发酵研究后表明,在枯草芽孢杆菌中单独表达YjhG就可以让宿主细胞获得利用木糖酸的能力,在摇瓶培养时发酵转化生成乙醇酸的产量达到约1.5 g/L,转化率约为42.54%;发酵产物中只发现乙醇酸的生成,没有乙二醇,表明构建的重组枯草芽孢杆菌在好氧培养时有利于乙醇酸的合成及后续的产物纯化。研究发现,木糖酸的利用率还比较低,因此,后续有必要开展Dahms Pathway的过表达优化研究,以提高乙醇酸的产量及转化率。
| [1] |
Kabir SMM, Koh J. Effect of chelating agent in disperse dye dyeing on polyester fabric[J]. Fibers and Polymers, 2017, 18(12): 2315-2321. DOI:10.1007/s12221-017-7481-4 |
| [2] |
Babilas P, Knie U, Abels C. Cosmetic and dermatologic use of alpha hydroxy acids[J]. J Dtsch Dermatol Ges, 2012, 10(7): 488-491. |
| [3] |
Rendon MI, Berson DS, Cohen JL, et al. Evidence and considerations in the application of chemical peels in skin disorders and aesthetic resurfacing[J]. J Clin Aesthet Dermatol, 2010, 3(7): 32. |
| [4] |
Hua X, Cao R, Zhou X, et al. Integrated process for scalable bioproduction of glycolic acid from cell catalysis of ethylene glycol[J]. Bioresource Technology, 2018, 268: 402-407. DOI:10.1016/j.biortech.2018.08.021 |
| [5] |
Cabulong RB, Lee WK, Bañares AB, et al. Engineering Escherichia coli for glycolic acid production from D-xylose through the Dahms pathway and glyoxylate bypass[J]. Applied Microbiology and Biotechnology, 2018, 102(5): 2179-2189. DOI:10.1007/s00253-018-8744-8 |
| [6] |
Alkim C, Trichez D, et al. The synthetic xylulose-1 phosphate pathway increases production of glycolic acid from xylose-rich sugar mixtures[J]. Biotechnology for Biofuels, 2016, 9(1): 201. DOI:10.1186/s13068-016-0610-2 |
| [7] |
李宇展, 刘伟, 顾登平. 草酸电还原研制乙醇酸[J]. 河北师范大学学报, 2003(4): 385-387. DOI:10.3969/j.issn.1000-5854.2003.04.019 |
| [8] |
Dahms AS. 3-Deoxy-D-pentulosonic acid aldolase and its role in a new pathway of D-xylose degradation[J]. Biochemical and biophysical research communications, 1974, 60(4): 1433-1439. DOI:10.1016/0006-291X(74)90358-1 |
| [9] |
van Dijl JM, Hecker M. Bacillus subtilis:from soil bacterium to super-secreting cell factory[J]. Microb Cell Fact, 2013, 12: 3. DOI:10.1186/1475-2859-12-3 |
| [10] |
Tännler S, Zamboni N, Kiraly C, et al. Screening of Bacillus subtilis transposon mutants with altered riboflavin production[J]. Metabolic engineering, 2008, 10(5): 216-226. DOI:10.1016/j.ymben.2008.06.002 |
| [11] |
李思杰, 纪明华, 赵利超, 史吉平, 孙俊松. N-乙酰神经氨酸合成途径在枯草芽孢杆菌的构建[J]. 食品工业科技, 2017, 38(16): 131-135. |
| [12] |
Liu H, Ramos KRM, Valdehuesa KNG, et al. Biosynthesis of ethylene glycol in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2013, 97(8): 3409-3417. DOI:10.1007/s00253-012-4618-7 |
| [13] |
Tai YS, Xiong M, Jambunathan P, et al. Engineering nonphosphorylative metabolism to generate lignocellulose-derived products[J]. Nature Chemical Biology, 2016, 12(4): 247. DOI:10.1038/nchembio.2020 |
| [14] |
Kolodkin-Gal I, Romero D, Cao S, et al. D-amino acids trigger biofilm disassembly[J]. Science, 2010, 328(5978): 627-629. DOI:10.1126/science.1188628 |
| [15] |
Cheng YL, Kalman LV, Kaiser D. The dsg gene of Myxococcus xanthus encodes a protein similar to translation initiation factor IF3[J]. Journal of Bacteriology, 1994, 176(5): 1427-1433. DOI:10.1128/jb.176.5.1427-1433.1994 |
| [16] |
Weimberg R. Pentose oxidation by Pseudomonas fragi[J]. J Biol Chem, 1961, 236(3): 629-635. |
| [17] |
Meijnen JP, de Winde J H, et al. Establishment of oxidative D-xylose metabolism in Pseudomonas putida S12[J]. Applied and Environmental Microbiology, 2009, 75(9): 2784-2791. DOI:10.1128/AEM.02713-08 |





