花粉管是一类研究细胞极性控制和生长的理想模式系统。作为雄配子体,花粉管通过极性生长快速通过雌蕊组织,将精细胞定向输送到胚珠[1-2]。在这一过程中钙离子发挥重要作用,生长中的花粉管顶端区域可以检测到Ca2+浓度梯度(Ca2+浓度从顶端向下逐渐递减)[3]。细胞外Ca2+的流入在很大程度上导致了花粉管生长过程中Ca2+梯度的形成,另外动用内质网中储备的Ca2+,也有助于梯度的形成。人为干扰正常的Ca2+梯度可以导致花粉管生长的中止,去除干扰因素(重建正常的Ca2+梯度)可以恢复正常的花粉管极性生长[4]。利用花粉管模式系统研究钙信号途径,有助于进一步揭示植物细胞极性发育的调控机制,并对提高作物育性具备一定的现实意义。
Ca2+信号的传递有赖于下游的Ca2+传感器,其中包括钙依赖蛋白激酶(Calcium-dependent protein kinase,CPK)。以往的研究在矮牵牛花中鉴定出两种CPK(PiCPK1和PiCPK2)。PiCPK1定位于质膜,其过度表达导致花粉管顶端膨胀,并伴随Ca2+浓度的过量堆积[5]。拟南芥基因组编码34个CPK,其中CPK14与CPK32过量表达可以导致严重的花粉管去极化生长[6-7]。CPK17和CPK34功能缺失突变体的花粉管生长速率显著降低,大多数都无法正确定位胚珠并使其受精[8]。CPK11和CPK24通过激活一个K+通道(SPIK1)来调节花粉管生长中的K+流入[9]。
ROP(Rho-related GTPase from plants)是植物中的信号转导小G蛋白,控制着多种细胞类型的极性生长,包括花粉管、根毛和叶片铺板细胞等[10-12]。ROP存在两种形式:GTP结合的活性形式和GDP结合的非活性形式,两者的转变由多种上游因子严格调控。已发现的ROP上游调控因子包括GTP酶激活蛋白(GAP)、鸟苷解离抑制因子(GDI)和鸟苷交换因子(GEF)。GTP结合的活性ROP在GAP的作用下,可以有效地进行GTP的水解,从而产生GDP结合的无活性ROP。而GEF可以促进GDP与GTP的替换,将ROP恢复成GTP结合的活性态。只有质膜上的ROP才可以被GEF激活,胞质中的ROP与GDI结合,处于无活性状态。因此,GDI和GAP是ROP的负调节因子,而GEF则被认为是ROP的正调节因子[11-13]。
烟草中的GAP1(NtGAP1)定位于亚顶端质膜,其过量表达诱导生长迟缓的花粉管表型,导致尖端狭窄的短小花粉管。这些结果表明NtGAP1可以将ROP的活性限制在花粉管的顶端区域[14]。对于拟南芥中的GAP1(AtGAP1),其过量表达可以抑制花粉管生长中的ROP1活性。然而,敲除AtGAP1不会导致花粉管明显的去极化生长表型,这表明AtGAP1可能在顶端ROP活性的调节机制中发挥次要作用[15]。目前,拟南芥中存在14个GEF,序列分析显示它们都包括一段功能未知的保守结构域(DUF315)。GEF1、GEF8、GEF9、GEF12及GEF14的过量表达可以造成不同程度的花粉管生长缺陷。其中,RopGEF1所诱导的花粉管去极化生长表型最为显著[16]。
尽管花粉管极性发育的相关研究不断深入,但小G蛋白ROP1调控花粉管顶端钙梯度的机理仍需进一步的拓展。本研究通过构建Ca2+传感器CPK家族中CPK14的瞬时表达载体,并转化烟草,统计花粉管的表型及定位分析,确定CPK14的生物学功能及与ROP1信号途径的相互关系。
1 材料与方法 1.1 材料拟南芥(Arabidopsis thaliana L.)生态型为Columbia-0,培养于22℃的温室内(16 h光照/8 h黑暗)。烟草(Nicotiana tabacum)的培养温度为28℃,光周期为12 h/12 h。载体构建相关试剂(RNA提取试剂盒、高保真酶、限制性内切酶及dNTP等)购于Takara。烟草瞬时表达相关试剂(金粉及易裂膜等)购于Bio-Rad公司(Bio-Rad,U.S.A.)。质粒提纯试剂盒(Plasmid Mini Kits)购于QIAGEN的产品。
1.2 方法 1.2.1 表达载体的构建以6周龄的拟南芥花朵为材料,通过总RNA的提取及反转录反应获得cDNA。设计引物(上游引物:5’-GGATCCATGGTAGATTC-TGACCCG-3’,下游引物:5’-GGATCCCCGACGTCG-TATGTACTT-3’,下划线处为BamHⅠ酶切位点)。以cDNA为模板,通过PCR扩增获得CPK14片段,随后连入T-vector并测序。测序正确的目的片段通过酶切连接至瞬时表达载体(pBLAT:GFP)。相对于全长CPK14,组成激活型CPK14(CA-CPK14)只保留了蛋白激酶区域(313个氨基酸残基),缺少C端调控区域及钙调素样区域。CA-CPK14采用相似的载体构建流程,最终连接至瞬时表达载体,用于基因枪的瞬时转化试验。
1.2.2 花粉管瞬时表达试验在每次试验前收集成熟的烟草花粉,每组转化试验大约需要8朵烟草的花粉(悬浮于烟草花粉培养液中备用)。通过质粒提纯试剂盒(Plasmid mini kits)提取用于基因枪瞬时表达的质粒,按照先前描述的粒子轰击试验程序进行相应的操作[17]。轰击完成的花粉粒于28℃培养3 h,然后进行相应的花粉管表型及亚细胞定位观察。
1.2.3 花粉管表型统计与定位分析对于花粉管表型的分析,转化成功的花粉管在荧光显微镜(BX51;Olympus)下进行观察与拍摄(Olympus CCD摄像机,DP70)。获得的试验图片通过蔡司LSM图像浏览器(3.2版)的测量功能,测量花粉管的长度和最宽端部的直径。每组转化试验设3次重复,并进行t检验。对于花粉管的亚细胞定位分析,转化成功的花粉管在共聚焦激光扫描显微镜(蔡司LSM 510 meta,488 nm激发和505-530 nm发射)下进行相应的观察与拍摄。获得的共聚焦图像由蔡司LSM图像浏览器(3.2版)进行分析。
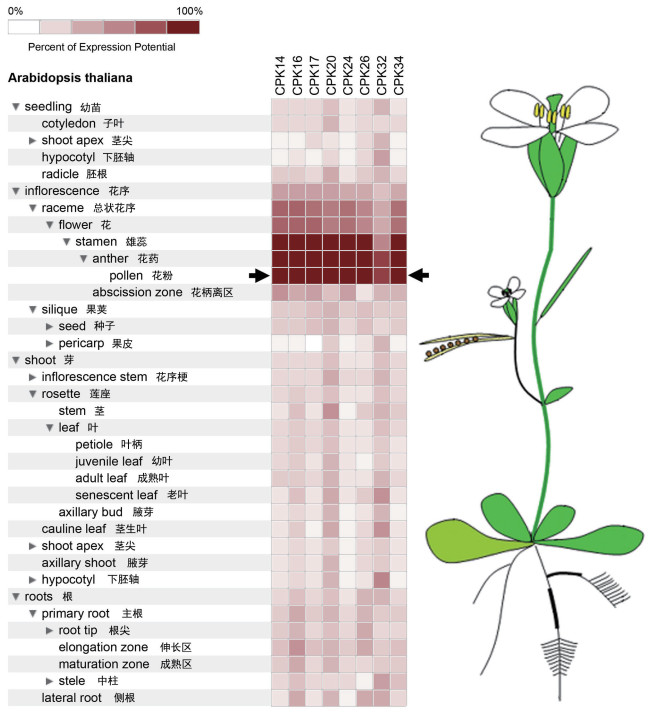
2 结果 2.1 CPK14在花粉中高量表达目前,拟南芥中已证实的钙依赖蛋白激酶(CPK)有34个,本文重点关注那些在成熟花粉中优先表达的CPK(推测其最有可能参与花粉管生长的调控途径)。通过对genevestigator基因芯片数据进行表达图谱分析,发现8个花粉高量表达CPK,分别是CPK14、CPK16、CPK17、CPK20、CPK24、CPK26、CPK32和CPK34(图 1)。这些CPK都是在成熟花粉粒中高度表达,但在其他组织中相对弱表达或完全不表达。通过花粉管瞬时表达体系,对花粉高量表达的CPK进行初步功能筛查。结果显示,过量表达CPK14可以造成严重的花粉管生长缺陷,即长度缩短且宽度增加,形成一个肿大的花粉管顶端(图 2-图 4)。
|
| 图 1 花粉高量表达CPK在各组织中的表达热图 |
|
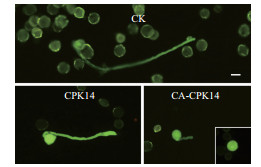
| 图 2 CA-CPK14过量表达所造成的花粉管表型 |
|
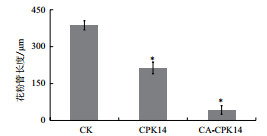
| 注:柱状图数值=平均值±标准差,*代表与GFP单独表达的对照组(CK)存在显著性差异(P < 0.01,t检验),误差线表示标准差。下同 图 3 CA-CPK14过量表达对花粉管长度的影响 |
|
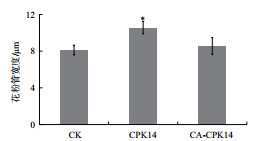
| 图 4 CA-CPK14过量表达对花粉管宽度的影响 |
基于前期的CPK14相关研究成果,为了进一步探究CPK14在花粉管极性生长中的功能,构建了组成激活型(Constitutively active,CA)的CPK14(CA-CPK14)。CA-CPK14缺少C端调控区域(钙调素样区和自抑制区),仅仅保留了蛋白激酶区。因此,CA-CPK14表现出不受Ca2+调控的持续激活特征。带有绿色荧光蛋白(GFP)标签的CA-CPK14通过基因枪技术在烟草花粉中进行瞬时表达,结果(图 2-图 4)显示,CA-CPK14瞬时表达可以全面抑制花粉管的萌发与生长。一方面转化CA-CPK14的花粉萌发率仅为43%,显著低于89%的对照组萌发率;另一方面萌发出的花粉管表现出短小的表型,即花粉管的长度显著缩短(对照组:386.63 μm;试验组:42.64 μm),而顶端宽度与对照没有显著差异。
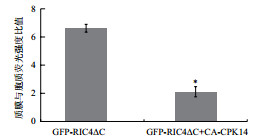
2.3 持续激活的CPK14抑制ROP1的活性通过CA-CPK14与GFP-RIC4ΔC(活性ROP1的标记物)的共同表达试验,从活性ROP1在花粉管顶端质膜(PM)的分布和积累两个方面,分析CA-CPK14的加入是否对ROP1的活性造成一定的影响。如图 5所示,单独表达GFP-RIC4ΔC的花粉管中荧光信号主要集中在顶端的质膜,而CA-CPK14的表达降低了GFP-RIC4ΔC的顶端质膜定位,但增加了GFP-RIC4ΔC在胞质中的积累(图 5-图 6)。

|
| 图 5 CA-CPK14的表达可以抑制GFP-RIC4ΔC在花粉管质膜上的分布与强度 |
|
| 图 6 CA-CPK14对GFP-RIC4ΔC定位强度影响的量化分析 |
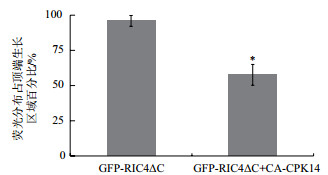
在荧光信号的分布范围方面,将顶端最宽直径以上的花粉管表面定义为顶端生长区域,荧光信号范围与顶端生长区域的比值作为GFP-RIC4ΔC分布的量化指标。量化结果(图 7)显示CA-CPK14对GFP-RIC4ΔC在花粉管的分布存在一定的抑制作用。基于CA-CPK14对GFP-RIC4ΔC荧光强度与分布的抑制作用,说明CPK14可以部分抑制ROP1在花粉管顶端质膜上的活性。
|
| 图 7 CA-CPK14对GFP-RIC4ΔC定位分布影响的量化分析 |
钙依赖蛋白激酶CPK14在成熟花粉中高量表达,而在其他组织中较少表达(图 1),暗示了其在花粉萌发或生长中可能发挥重要作用。基于基因枪瞬时表达体系,单独表达GFP空载的花粉管表现出典型的极性生长特征(细长而均匀的圆柱形花粉管),而CPK14过量表达可以引起花粉管生长极性的部分丧失,产生顶端膨大的花粉管表型(促进细胞膨胀)。另外持续激活型的CPK14(CA-CPK14)在花粉中瞬时表达可以抑制花粉的萌发及后续的极性生长,产生短小的花粉管表型(抑制细胞膨胀)。作为一类蛋白磷酸酶,CPK14过量表达与CA-CPK14瞬时表达都可能导致其下游底物的过度磷酸化,但实验结果却展现出相互对立的花粉管表型。这些结果暗示CPK14可能不是直接作用于花粉管生长相关的关键因子,而是通过中间组分间接调控这些生长因子。
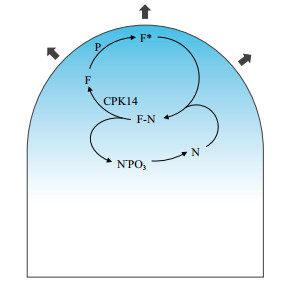
本文提出一个理论模型用于揭示CPK14涉及的花粉管顶端生长机理(图 8)。其中,F代表调控花粉管极性生长的关键因子(Key factor),其活性的高低决定了花粉管极性生长的快慢。N与P分别是调控关键因子F活性的负调节子(Negative regulator)与正调节子(Positive regulator)。N与关键因子F可以在细胞质中结合为复合体(N-F),以维持F的非激活状态,抑制花粉管顶端膨胀。N的磷酸化导致N-F复合体解离,生长关键因子F得以释放。P激活花粉管顶端质膜的生长关键因子F(激活的F表示为F*),促进花粉管顶端膨胀。在这个模型中,N可以结合并抑制关键因子F的活性。当N被CPK14磷酸化会促进关键因子F的释放。因此,过量的CPK14可以导致花粉管极性的部分丧失(花粉管顶端膨大)。
|
| F为花粉管生长关键因子,P为F的正调控子,N为F的负调节子。N可与F结合成复合体F-N,游离的F在顶端质膜可被P激活成为F*。蓝色梯度表示花粉管顶端的Ca2+梯度 图 8 CPK14调控花粉管极性生长的模式图 |
CPK的主要结构区域有激酶区(Kinase domain)、钙调素样区(CaM-like domain)和自抑制区(Auto-inhibitor)。钙调素样区中存在4个Ca2+的结合位点(EF-hand结构),Ca2+的结合可以释放CPK的自抑制作用,发挥丝氨酸/苏氨酸蛋白激酶的活性[18-19]。因此,CPK既是Ca2+感受器(可逆结合Ca2+),也是一个效应因子(激酶活性磷酸化下游靶蛋白)。CA-CPK14缺少自抑制区,仅保留激酶区域,表现出持续激活的激酶活性。CA-CPK14依照上述模型,同样会导致负调节子N的磷酸化,释放关键因子F,造成生长极性的丧失。然而,如图 2-图 4所示,CA-CPK14对花粉管的长度和萌发却产生了显著的抑制作用。正常生长中的花粉管顶端存在一个Ca2+浓度梯度(顶端Ca2+浓度最高),全长CPK14与CA-CPK14的关键区别在于C端Ca2+调控区域的有无,因此,含有Ca2+调控区域的全长CPK14受到顶端Ca2+梯度的严格调控,只有在顶端的生长区域发挥磷酸化作用,释放关键因子F。而缺少Ca2+调控区域的CA-CPK14不受顶端Ca2+梯度的限制,在花粉管的各个区域都可释放关键因子F,F分布到整个花粉管质膜,而不是集中在顶端生长区。P作为F的正调节子,只在花粉管顶端质膜的生长区发挥作用。由于F被稀释到整个质膜,导致顶端生长区(唯一存在P激活F的地方)F的相对减少,从而导致花粉管生长的抑制现象。
ROP类小G蛋白已被证实是花粉管生长的关键因子(相当于模型中的F),调控细胞极性的建立与维持[1-2, 13, 20]。CA-CPK14的表型类似于GAP1(ROP1的负调控因子)的表型。采用一个活性ROP1的标记物(GFP-RIC4ΔC,GFP-RIC4ΔC在花粉管顶端的荧光分布情况可以反映出有活性ROP1的分布情况[21])。结果显示CA-CPK14可以显著抑制活性ROP1在花粉管顶端的分布,暗示CPK14可以通过ROP信号途径发挥负反馈抑制的作用。CPK14可能通过磷酸化鸟苷解离抑制因子GDI(相当于模型中的N)导致ROP-GDI复合体的解离,释放游离的ROP。富集到顶端质膜的ROP进一步被鸟苷交换因子GEF(相当于模型中的P)激活,从而推动花粉管顶端生长。该研究初步揭示了拟南芥CPK14在花粉管极性生长中的功能,CPK14与ROP信号途径的互作研究将进一步阐明CPK14的调控机理。
4 结论本研究发现8个花粉高量表达CPK,其中CPK14在花粉中表达极高,而在其他组织中几乎不表达。CPK14的过量表达可以引起花粉管生长的极性丧失。组成激活型CPK14全面抑制花粉管的萌发与极性生长。
| [1] |
Rounds CM, Bezanilla M. Growth mechanisms in tip-growing plant cells[J]. Annu Rev Plant Biol, 2013, 64(2): 243-265. |
| [2] |
Bloch D, Yalovsky S. Cell polarity signaling[J]. Curr Opin Plant Biol, 2013, 16(6): 734-742. DOI:10.1016/j.pbi.2013.10.009 |
| [3] |
Rathore K, Cork R, Robinson K. A cytoplasmic gradient of Ca2+ is correlated with the growth of lily pollen tubes[J]. Dev Biol, 1991, 148(2): 612-619. DOI:10.1016/0012-1606(91)90278-B |
| [4] |
Steinhorst L, Kudla J. Calcium-a central regulator of pollen germination and tube growth[J]. BBA-Mol Cell Res, 2013, 1833(7): 1573-1581. |
| [5] |
Yoon GM, Dowd PE, Gilroy S, et al. Calcium-dependent protein kinase isoforms in Petunia have distinct functions in pollen tube growth, including regulating polarity[J]. The Plant Cell, 2006, 18(4): 867-878. DOI:10.1105/tpc.105.037135 |
| [6] |
Zhou L, Fu Y, Yang Z. A genome-wide functional characterization of Arabidopsis regulatory calcium sensors in pollen tubes[J]. J Integr Plant Biol, 2009, 51(8): 751-761. DOI:10.1111/jipb.2009.51.issue-8 |
| [7] |
Zhou L, Lan W, Jiang Y, et al. A calcium-dependent protein kinase interacts with and activates a calcium channel to regulate pollen tube growth[J]. Mol Plant, 2014, 7(2): 369-376. |
| [8] |
Myers C, Romanowsky SM, Barron YD, et al. Calcium-dependent protein kinases regulate polarized tip growth in pollen tubes[J]. Plant J, 2009, 59(4): 528-539. DOI:10.1111/tpj.2009.59.issue-4 |
| [9] |
Zhao LN, Shen LK, Zhang WZ, et al. Ca2+-dependent protein kinase11 and 24 modulate the activity of the inward rectifying K+ channels in Arabidopsis pollen tubes[J]. The Plant Cell, 2013, 25(2): 649-661. |
| [10] |
Yang Z. Cell polarity signaling in Arabidopsis[J]. Annu Rev Cell Dev Biol, 2008, 24(2): 551-575. |
| [11] |
Yang Z, Fu Y. ROP/RAC GTPase signaling[J]. Curr Opin Plant Biol, 2007, 10(5): 490-494. DOI:10.1016/j.pbi.2007.07.005 |
| [12] |
Yang Z. Small GTPases versatile signaling switches in plants[J]. The Plant Cell, 2002, 14(suppl 1): S375-S388. DOI:10.1105/tpc.001065 |
| [13] |
Pfeffer SR. Rab GTPase regulation of membrane identity[J]. Curr opin cell Biol, 2013, 25(4): 414-419. |
| [14] |
Klahre U, Kost B. Tobacco RhoGTPase ACTIVATING PROTEIN1 spatially restricts signaling of RAC/Rop to the apex of pollen tubes[J]. The Plant Cell, 2006, 18(11): 3033-3046. DOI:10.1105/tpc.106.045336 |
| [15] |
Hwang JU, Wu G, Yan A, et al. Pollen-tube tip growth requires a balance of lateral propagation and global inhibition of Rho-family GTPase activity[J]. J Cell Sci, 2010, 123(3): 340-350. |
| [16] |
Gu Y, Li S, Lord EM, et al. Members of a novel class of Arabidopsis Rho guanine nucleotide exchange factors control Rho GTPase-dependent polar growth[J]. The Plant Cell, 2006, 18(2): 366-381. |
| [17] |
Fu Y, Wu G, Yang Z. Rop GTPase-dependent dynamics of tip-localized F-actin controls tip growth in pollen tubes[J]. J Cell Biol, 2001, 152(5): 1019-1032. DOI:10.1083/jcb.152.5.1019 |
| [18] |
Boudsocq M, Sheen J. CDPKs in immune and stress signaling[J]. Trends Plant Sci, 2013, 18(1): 30-40. |
| [19] |
Hashimoto K, Kudla J. Calcium decoding mechanisms in plants[J]. Biochimie, 2011, 93(12): 2054-2059. DOI:10.1016/j.biochi.2011.05.019 |
| [20] |
Guan Y, Guo J, Li H, et al. Signaling in pollen tube growth: crosstalk, feedback, and missing links[J]. Mol Plant, 2013, 6(4): 1053-1064. DOI:10.1093/mp/sst070 |
| [21] |
Hwang JU, Gu Y, Lee YJ, et al. Oscillatory ROP GTPase activation leads the oscillatory polarized growth of pollen tubes[J]. Mol Biol Cell, 2005, 16(11): 5385-5399. DOI:10.1091/mbc.e05-05-0409 |




