在自然环境中, 植物需要面对复杂多变的生存条件, 因此, 它们进化出复杂的机制来感知并响应环境的变化, 以便更好地生存和繁殖。为了更方便、快速地传递感知信息, 植物使用Ca2+作为第二信使。在感受到外界刺激后, 细胞质中游离的Ca2+水平增加, 充当携带特定信息的信号, 被下游效应器感受到并产生生理生化反应。许多外源和内源因素(包括光、温度、干旱与盐胁迫病原体衍生的分子和植物激素等)都会引起植物细胞质内不同区域的游离Ca2+水平的升高[1]。
天山雪莲(Sasussured involucrata)生长于天山山脉的陡峭山壁, 是一种新疆特有的名贵中草药[2]。由于生长在高海拔地区, 天山雪莲进化出独特的生理生化机制来适应高寒、低氧、强辐射和昼夜温差巨大等多种极端的生存环境。天山雪莲作为一种抗逆性极强的植物, 但人们对其抗逆机理仍然知之甚少。深入挖掘天山雪莲的抗逆机制可以为研究植物逆境响应机理、提高经济作物的逆境适应力提供新的思路。
CaM是一种典型的Ca2+传感器, 可以与多种蛋白质相互作用并调节其活性。它由2个球状区域组成, 每个区域都有一对EF-hand, 由一个螺旋区域相连接[3]。Ca2+与EF-hand结合诱导蛋白质疏水表面的暴露, 形成结合下游效应因子的高亲和力结合位点。与CaM类似, CMLs主要由EF-hand组成, 缺少其他已知的功能域。大多数CML(拟南芥中的31种, 水稻种的20种)与钙调素一样具有4个EF-hand, 但大部分的类钙调素蛋白与钙调素蛋白的同源性小于50%[4]。CML家族的蛋白质一级结构差异巨大, 这表明它们在结合和识别Ca2+、激活下游目标等方面具有独特的性质。尽管EF-hand结构域的序列差异巨大, 但在Ca2+存在下的电泳迁移率变化表明CMLs是Ca2+传感器。包括激酶和转录因子在内的多种蛋白质已被鉴定为CML结合蛋白, 植物细胞中CML与靶蛋白以及蛋白质间特异性的相互作用已见报道, 这表明CML可以通过调节自己的靶标蛋白发挥其独特的功能[5]。同种植物中存在不同的CaM和CML蛋白, 在感受和鉴别不同环境刺激的Ca2+信号中均起到了重要的作用, 但到目前为止, 其具体的机理机制仍未被阐明。
通过对拟南芥AtCML9的研究显示该蛋白含有151个氨基酸, 与典型的CaM蛋白具有46%的序列同一性。该蛋白作为一种转录因子, 响应盐、低温、水分、干旱等各种刺激, 并贯穿整个发育过程, 作为ABA信号通路中的一种负调控因子调控拟南芥的胁迫应激和生长发育[6]。但在许多非模式植物中, 对类钙调素蛋白功能的研究鲜见报道。
本研究以天山雪莲低温转录组数据库为基础, 采用RT-PCR方法从天山雪莲中克隆CML基因家族SiCML7, 并对其进行生物信息学分析及低温胁迫下的定量表达分析, 以期为开展抗逆基因工程提供有效的基因资源。
1 材料与方法 1.1 材料天山雪莲(S.involucrata Kar.et kir)试管苗由石河子大学农业生物重点实验室提供。
1.2 方法 1.2.1 SiCML7的克隆使用总RNA提取试剂盒(天根)提取天山雪莲RNA, 利用EasyScriptOne-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(全式金)反转录成cDNA。根据石河子大学农业生物重点实验室得到的天山雪莲叶片低温转录组数据设计特异性引物(SikCML7-UP:5′-TTGTCGAAGATGGTTGAAGGA-3′和SikCML7-DOWN:5′-TTGTTTACGAGGCACTCATCA-3′), 扩增SiCML7的开放阅读框(ORF)序列, 1%琼脂糖凝胶电泳检测, 回收、连接, 挑选阳性克隆测序, 测序成功后将其命名为pMD19-T-SikCML7质粒。
1.2.2 SikCML7生物信息学分析利用NCBI在线Blast寻找同源序列; 利用DNAMAN进行序列分析, 搜索开放阅读框ORF; 利用DANMAN和MEGA软件进行多序列比对和进化树分析; 采用ProtParam(https://web.expasy.org/protparam/)预测SikCML7的分子量、氨基酸组成、等电点以及疏水性等理化性质; 利用NCBI CDD以及Interproscan(https://www.ebi.ac.uk/interpro/search/sequence-search)对蛋白质的保守功能结构域进行分析; 使用PSORT Prediction(http://psort1.hgc.jp/form.html)预测蛋白质的亚细胞定位; 使用ProtScale(https://web.expasy.org/)对SikCML7蛋白的亲/疏水性进行分析[7]。
1.2.3 SikCKL7在不同胁迫条件下的表达分析低温处理:将天山雪莲组培苗分别放入4℃和-2℃的低温光照培养箱中培养, 并在1、3、6、9、12和24 h分别取样, -80℃保存备用。干旱处理:将天山雪莲组培苗置于20% PEG6000溶液中, 并置于20℃光照培养箱中培养, 在1、3、6、9、12和24 h分别取样备用。盐胁迫处理:将天山雪莲组培苗放置于含150 mmol/L NaCl的MS固体培养基中置于20℃的光照培养箱中培养, 1、3、6、9、12和24 h分别取样备用。分别提取不同处理雪莲样本的RNA, 并反转录为cDNA, 置于-20℃备用。选择天山雪莲看家基因GADPH作为内参基因, 并设计引物GAPDH-up:5′-TAGCAAGGATGCTCCCATGTTCGT-3′和GAPDH-down:5′-AAAGGAGCAAGGCAGTTGGTTGTG-3′; 根据测序结果, 设计SikCKL7引物SikCKL7-up:5′-GGTACCTTGTCGAAGATGGTTGAAGGA-3′和SikCKL7-down:5′-TCTAGACGAGGCACTCATCATAACC-3′。参考SYBR GreenⅠ Master Mix试剂盒说明书进行qRT-PCR反应, 采用2-ΔΔct法对数据进行分析。
2 结果 2.1 SikCML7的克隆与同源序列比对根据天山雪莲低温转录组数据检索到的SikCML7序列, 并设计PCR引物, 以天山雪莲cDNA为模板, 获得到一条长度约500 bp的条带。经测序, 其长度为450 bp。生物信息学分析表明其编码一条149个氨基酸的蛋白质序列, 蛋白质预测结果表明, 该蛋白的相对分子质量为17.14 kD, 等电点为4.00。NCBI CDD以及interpro保守型分析表明其编码一个属于Penta-EF-hand(PEF)超家族的EF-hand结构域; 含有4个钙离子结合位点, 分别位于第21-33、57-69、93-105和129-141氨基酸。
使用PSORT Prediction对SikCML7蛋白进行亚细胞定位预测分析, 结果显示, 有65%的可能性定位在细胞质内, 有10%的可能性定位在线粒体基质内, 有10%的可能性定位在溶酶体腔内, 说明SikCML7是一种胞内蛋白, 且定位在细胞质基质内。对SikCML7进行Blast检索, 获得16个相似度极高的序列, 使用DANMAN进行多序列比对, 结果(图 1)显示, 其同一性为81.16%, 其中83-98、123-141区域相似度较高, 而其余区域的相似度较低, 可能由于植物CML的功能区域位于N末端。同时也表明, 不同物种间的CML基因在功能上存在一定的差异。

|
| 方块表示功能结构域 图 1 雪莲SikCML7与其他物种氨基酸多序列比对 |
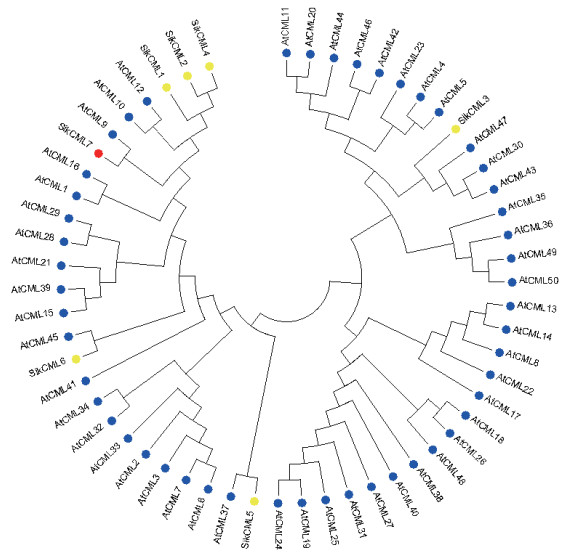
在Tair上搜索并下载AtCMLs氨基酸序列, 使用MEGA7和NJ法进行进化树构建。结果(图 2)显示, 雪莲SikCML7蛋白同AtCML9在同一进化枝上, 表明SikCML7与AtCML9的亲缘性较近。
|
| 图中蛋白标记为红色的是SikCML7, 标记为蓝色的是拟南芥CMLs, 标记为黄色的是雪莲其他CMLs 图 2 SikCML7与拟南芥CMLs的系统进化树 |
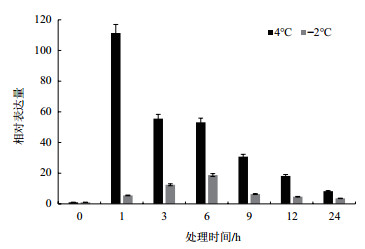
通过对天山雪莲进行不同胁迫处理, 利用荧光定量PCR法检测SikCML7的表达情况。在4℃处理时, SikCML7表达量在胁迫初期急速上升, 约为对照组的116倍, 之后随着时间的推移其表达量逐渐下降, 并在24 h后达到最低。在-2℃处理时, 随着时间的推移, 其表达量在胁迫初期呈上升趋势, 并在6 h时表达量达到最高, 约为对照组的20倍, 之后其表达量随胁迫时间逐渐下降(图 3)。
|
| 图 3 低温胁迫下天山雪莲SikCML7的表达模式 |
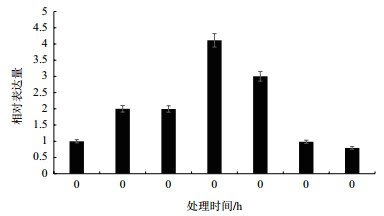
在干旱胁迫下, SikCML7表达量逐渐上升, 在6 h时达到最大值, 之后表达量逐渐下降, 最终回到正常值(图 4)。
|
| 图 4 干旱胁迫下天山雪莲SikCML7的表达模式 |
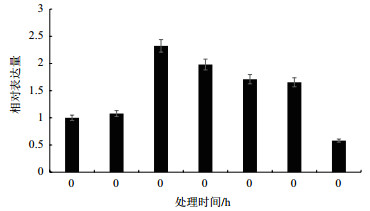
在盐胁迫时, SikCML7表达量在胁迫初期不变, 3 h时表达上调, 且在接下来的9 h内表达量均很高, 24 h后恢复常态(图 5)。
|
| 图 5 盐胁迫下天山雪莲SikCML7的表达模式 |
结果表明, SikCML7面对胁迫时, 可以在短时间内快速作出反应, 并调整自身的生理状态, 以适应逆境环境。
3 讨论CMLs是存在于高等植物中重要的Ca2+结合蛋白, 在细胞Ca2+信号传导途径中扮演着重要的角色。CML含有1-6个不等的EF-hand手型结构域, 除此之外, 没有其他已知的功能结构域[8]。研究表明, 含有EF-hand的CMLs在植物的生长发育和逆境响应中都有着重要的作用, 例如AtCML15和AtCML16参与开花的过程[9]; AtCML36定位在花粉管, 参与植物自身的Ca2+调节[10]; AtCML38是缺氧反应核心钙传感蛋白[11]; AtCML42通过茉莉酸途径充当植物防御的负调节因子[12]; AtCML37通过脱落酸途径参与植物干旱胁迫的响应[13]; AtCML24通过调控NO进而调控植物光周期和开花[14]; AtCML9通过ABA通路调控植物的低温抗性[15]等。此外, 大量研究表明, CMLS对Ca2+与靶蛋白的结合具有选择性。植物中存在着与类钙调素蛋白结合的不同蛋白激酶, 它们在不同的生理条件下被特异性调控, 具有不同的作用机制和生理功能[16]。
拟南芥CML家族有50个成员, 水稻的CML家族有32个成员, 由此可见CML是一个成员众多的基因家族[17-19]。但是, 迄今为止, 对于不同基因的表达模式以及功能分析还未得到深入发掘, 因此, 关于类钙调素蛋白家族的生理和生化功能还有待进行更加深入的研究。
天山雪莲作为一种具有高度抗寒性的植物, 其生理功能及抗寒机制的研究还很浅薄。且多数实验主要集中在功能基因的研究上, 而对于信号分子的研究几乎为空白。作为植物信号通路中极为重要的一环, CMLs在天山雪莲的抗逆过程中扮演着十分重要的角色。在石河子大学农业生物重点实验室先前研究的基础上, 根据天山雪莲的低温转录组数据, 本研究获得到了天山雪莲SikCML7基因, 其编码149个氨基酸, 有4个EF-hand手型结构域。系统进化树分析其与AtCML9亲缘性最近, BLAST分析及多序列比对则显示出其与向日葵拥有最高的相似度, 且均含有EF-hand手型结构域, 因此, 推测两者在功能上可能具有一定的相似性, 此外, SikCML7是一个EF-hand的家族成员。
实时荧光定量PCR结果表明, CMLs能够参与植物的逆境应激响应。天山雪莲经过不同的低温处理之后, 其表达量均有显著的提高, 但是其表达模式却存在明显的差异。在4℃胁迫条件下, SikCML7在胁迫初期表达量瞬时上升, 随着时间的推移, 其表达量逐渐下降。这可能是由于在冷害初期, 外界冷信号迅速激活雪莲的低温应激反应, SikCML7在上游信号分子的调控下, 表达量迅速上升; 之后, 随着雪莲对低温胁迫的适应, 导致SikCML7的表达量逐步趋于正常。在-2℃胁迫条件下, SikCML7表达量逐渐上升, 在6 h时表达量达到峰值, 之后又表达下降。在经过PEG和NaCl处理后, 其表达量均在初期就有上升, 之后随着胁迫的持续基因表达维持一段时间, 之后表达量恢复到正常水平。大量研究表明, ABA作为一种重要的植物激素, 在于植物抵抗逆境的过程中起着重要的作用[20], 而类钙调素蛋白家族积极参与植物ABA通路的响应[21-22]。雪莲SikCML7与拟南芥AtCML9的亲缘性最高, AtCML9通过ABA通路调控植物抗逆。因此, 推测SikCML7通过ABA途径调控雪莲的逆境响应。植物在冷害下, 细胞渗透压上升, 细胞保水性增加, 从而降低低温所带来的损伤[23]。在冻害时, 细胞内水分需要快速外排, 防止胞内水分形成冰晶, 从而降低冰晶形成所引起膜破坏损害[24]。因此, 植物在应对冷害和冻害需通过不同的机制调节达到整个低温状态的适应。有研究表明, 拟南芥中的CML家族成员可以通过调控钠离子泵AtNHXs基因来调节细胞的渗透平衡, 从而调节细胞的含水量以适应不同温度所带来的生理生化反应的变化[25]。据此推测SikCML7可能通过调控NHX来调节细胞的渗透压, 因此造成了SikCML7在不同低温环境下的表达模式差异。同时, AtCML与AtNHX之间的相互作用表明在液泡中存在Ca2+-pH依赖性的信号组分, 可以参与植物对盐胁迫和干旱的响应。研究表明, 甲基乙二醛作为糖酵解的副产物, 是植物暴露于高盐环境下所产生的毒害物质之一, 通过乙二醛酶Ⅰ和乙二醛酶Ⅱ可以有效解毒。乙二醛酶Ⅰ是一种钙依赖性蛋白, 其酶学功能受到Ca2+/CaM的影响[26-27]。此外, 有报道表明CML37、CML38和CML39也对盐、干旱和ABA刺激有反应, 推测可能参与到植物渗透胁迫耐受[28]。
4 结论SikCML7可能参与天山雪莲的胁迫响应过程, 且对低温胁迫响应尤为强烈。
| [1] |
Dodd AN, Kudla J, Sanders D. The language of calcium signaling[J]. Annual Review of Plant Biology, 2010, 61(1): 593-620. DOI:10.1146/annurev-arplant-070109-104628 |
| [2] |
郭新勇, 程晨, 王爱英, 等. 天山雪莲冷调节蛋白基因siCOR转化烟草植株的抗旱性分析[J]. 植物学报, 2012, 47(2): 111-119. |
| [3] |
Ishida H, Vogel HJ. Protein-peptide interaction studies demonstrate the versatility of calmodulin target protein binding[J]. Protein & Peptide Letters, 2006, 13(5): 455-465. |
| [4] |
Ishida H, Huang H, Yamniuk AP, et al. The solution structures of two soybean calmodulin isoforms provide a structural basis for their selective target activation properties[J]. Journal of Biological Chemistry, 2008, 283(21): 14619-14628. DOI:10.1074/jbc.M801398200 |
| [5] |
Perochon A, Dieterle SC, Aldon D, et al. Interaction of a plant pseudo-response regulator with a calmodulin-like protein[J]. Biochemical & Biophysical Research Communications, 2010, 398(4): 747-751. |
| [6] |
Magnan F, Benoît R, Charpenteau M, et al. Mutations in AtCML9, a calmodulin-like protein from Arabidopsis thaliana, alter plant responses to abiotic stress and abscisic acid[J]. The Plant Journal, 2008, 56(4): 575-589. DOI:10.1111/tpj.2008.56.issue-4 |
| [7] |
赵桂红, 张妮妮, 高帅帅, 等. 菘蓝CYP83A1基因的克隆、表达特性及原核表达分析[J]. 基因组学与应用生物学, 2018, 37(1): _302-312. |
| [8] |
Li DF, Li J, Ma L, et al. Calmodulin isoform-specific activation of a rice calmodulin-binding kinase conferred by only three amino-acids of OsCaM61[J]. FEBS Letters, 2006, 580(18): 4325-4331. DOI:10.1016/j.febslet.2006.06.090 |
| [9] |
Ogunrinde A, Munro K, Davidson A, et al. Arabidopsis calmodulin-like proteins, CML15 and CML16 possess biochemical properties distinct from calmodulin and show non-overlapping tissue expression patterns[J]. Front Plant Sci, 2017, 8: 2175. DOI:10.3389/fpls.2017.02175 |
| [10] |
Astegno A, Bonza MC, Vallone R, et al. Arabidopsis calmodulin-like protein CML36 is a calcium(Ca2+)sensor that interacts with the plasma membrane Ca2+-ATPase Isoform ACA8 and stimulates its activity[J]. Journal of Biological Chemistry, 2017, 292: 15049-15061. DOI:10.1074/jbc.M117.787796 |
| [11] |
Lokdarshi A, Conner WC, Mcclintock C, et al. Arabidopsis CML38, a calcium sensor that localizes to ribonucleoprotein complexes under hypoxia stress[J]. Plant Physiology, 2016, 170(2): 1046-1059. DOI:10.1104/pp.15.01407 |
| [12] |
Vadassery J, Reichelt M, Hause B, et al. CML42-mediated calcium signaling coordinates responses to spodoptera herbivory and abiotic stresses in Arabidopsis[J]. Plant Physiology, 2012, 159(3): 1159-1175. DOI:10.1104/pp.112.198150 |
| [13] |
Scholz SS, Reichelt M, Vadassery J, et al. Calmodulin-like protein CML37 is a positive regulator of ABA during drought stress in Arabidopsis[J]. Plant Signaling & Behavior, 2015, 10(6): e1011951. |
| [14] |
Tsai YC, Delk NA, Chowdhury NI, et al. Arabidopsis potential calcium sensors regulate nitric oxide levels and the transition to flowering[J]. Plant Signaling & Behavior, 2007, 2(6): 446-454. |
| [15] |
Köhler C, Neuhaus G. Characterisation of calmodulin binding to cyclic nucleotide-gated ion channels from Arabidopsis thaliana[J]. FEBS Letters, 2000, 471(2): 133-136. |
| [16] |
Hua W, Liang S, Lu YT. A tobacco(Nicotiana tabaccum)calmodulin-binding protein kinase, NtCBK2, is regulated differentially by calmodulin isoforms[J]. Biochemical Journal, 2003, 376(1): 291. DOI:10.1042/bj20030736 |
| [17] |
Mccormack E, Braam J. Calmodulins and related potential calcium sensors of Arabidopsis[J]. New Phytologist, 2003, 159(3): 585-598. DOI:10.1046/j.1469-8137.2003.00845.x |
| [18] |
Boonburapong B, Buaboocha T. Genome-wide identification and analyses of the rice calmodulin and related potential calcium sensor proteins[J]. BMC Plant Biology, 2007, 7(1): 4. DOI:10.1186/1471-2229-7-4 |
| [19] |
Mccormack E, Tsai YC, Braam J. Handling calcium signaling:Arabidopsis CaMs and CMLs[J]. Trends in Plant Science, 2005, 10(8): 383-389. DOI:10.1016/j.tplants.2005.07.001 |
| [20] |
Mantyla E, Lang V, Palva ET. Role of abscisic acid in drought-induced freezing tolerance, cold acclimation, and accumulation of LT178 and RAB18 proteins in Arabidopsis thaliana[J]. Plant Physiology, 1995, 107(1): 141-148. DOI:10.1104/pp.107.1.141 |
| [21] |
Magnan F, Ranty BM, Sotta B, et al. Mutations in AtCML9, a calmodulin-like protein from Arabidopsis thaliana, alter plant responses to abiotic stress and abscisic acid[J]. The Plant Journal, 2010, 56(4): 575-589. |
| [22] |
Delk NA, Johnson KA, Chowdhury NI, et al. CML24, regulated in expression by diverse stimuli, encodes a potential Ca2+ sensor that functions in responses to abscisic acid, daylength, and ion stress[J]. Plant Physiology, 2005, 139(1): 240-253. DOI:10.1104/pp.105.062612 |
| [23] |
Ji CY, Jin R, Xu Z, et al. Overexpression of Arabidopsis P3B increases heat and low temperature stress tolerance in transgenic sweetpotato[J]. BMC Plant Biology, 2017, 17(1): 139. DOI:10.1186/s12870-017-1087-2 |
| [24] |
Storey KB, Storey JM. Molecular biology of freezing tolerance[M]//Comprehensive Physiology. John Wiley & Sons, Inc. 2013: 1283-1308.
|
| [25] |
Yamaguchi T, Aharon GS, Sottosanto JB, et al. Vacuolar Na+/H+ antiporter cation selectivity is regulated by calmodulin from within the vacuole in a Ca2+- and pH-dependent manner[J]. Proc Natl Acad Sci USA, 2005, 102(44): 16107-16112. DOI:10.1073/pnas.0504437102 |
| [26] |
Deswal R, Sopory SK. Glyoxalase I from Brassica juncea is a calmodulin stimulated protein[J]. Biochimica Et Biophysica Acta, 1999, 1450(3): 460. DOI:10.1016/S0167-4889(99)00047-6 |
| [27] |
Veena, Reddy VS, Sopory SK. Glyoxalase I from Brassica juncea:molecular cloning, regulation and its over-expression confer tolerance in transgenic tobacco under stress[J]. The Plant Journal, 2010, 17(4): 385-395. |
| [28] |
Vanderbeld B, Snedden WA. Developmental and stimulus-induced expression patterns of Arabidopsis calmodulin-like genes CML37, CML38 and CML39[J]. Plant Molecular Biology, 2007, 64(6): 683-697. DOI:10.1007/s11103-007-9189-0 |




