腺苷三磷酸(ATP)是生物体内重要的代谢物质,作为代谢中间体、辅酶和能量供体参与生物体内多种生化反应,是生命活动及生化反应所必需的高能化合物。在体外,ATP常作为酶反应的辅底物应用于工业产品如谷胱甘肽的生产[1-2]。目前合成ATP的方法有酶催化法、微生物细胞酶系合成法及基因工程菌合成法等,如Maruyama等[3]报道了以腺嘌呤为底物,在产氨棒杆菌催化下合成ATP,反应28 h积累ATP量达到117 mmol/L,底物转化率达到82%;廖鲜艳等[4]报道了以腺苷为底物,利用面包酵母的糖酵解途径耦联腺苷激酶和腺苷酸激酶合成ATP,ATP最高合成量达到9 mmol/L。美国麻省理工学院Whitesides博士的研究组曾报道了一种以乙酰磷酸在腺苷激酶、腺苷酸激酶和乙酸激酶3种固相酶的共同作用下将腺苷转化为ATP的方法,产率能达98%以上,具有ATP大量生产的潜力。而国内对此法的研究较少,对于乙酸激酶的研究,则常用于以ATP作为辅底物时的ATP再生[5-6]。
S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)是一种广泛存在于生物体细胞中的重要代谢中间体,在体内转甲基、转硫等多种生化反应中发挥着重要作用。目前SAM已经广泛应用于肝病、关节炎、抑郁症等疾病的治疗,疗效好、副作用低[7-8]。在体外采用酶促转化法合成SAM主要是利用腺苷甲硫氨酸合成酶转化ATP和L-甲硫氨酸合成[9-10]。研究过程中发现,由于ATP的价格较高,大大抬高了合成SAM的成本,因此考虑以其他成本低廉的前体物质代替ATP来降低反应的成本。例如,郑计瑞等报道以一株具有转化腺嘌呤生产ATP的毛霉为出发菌株,重组酵母腺苷甲硫氨酸合成酶,以腺嘌呤为前体物质合成腺苷甲硫氨酸,浓度达到1 g/L左右[11]。
本实验首先构建了表达腺苷激酶(Adenosine kinase,AK,EC 2.7.1.20)、腺苷酸激酶(Adenylate kinase,ADK,EC 2.7.4.3)、乙酸激酶(acetate kin-ase,ACK,EC 2.7.2.1)3种酶的ATP转化菌株,以腺苷和乙酰磷酸二锂盐(以下简称ACP)作为起始物料,合成ATP,并对反应体系进行了优化;再与甲硫氨酸在表达SAM合成酶(S-adenosylmethionine synthetase,EC 2.5.1.6)的菌体催化下合成SAM。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒pET24a质粒载体购自NOVAGEN公司;大肠杆菌DH5α、BL21(DE3)购自Invit-rogen公司。酿酒酵母菌株由本实验室保藏。表达腺苷甲硫氨酸合成酶的重组大肠杆菌pET24a-metK,宿主菌为大肠杆菌BL21(DE3)]由本实验室保藏。
腺苷酸激酶基因和乙酸激酶基因来源于大肠杆菌BL21(DE3)基因组序列,腺苷激酶基因来源于酿酒酵母基因组序列,通过PCR获得。PCR引物由苏州金维智生物科技有限公司合成。
1.1.2 培养基及培养方法种子培养基(g/L):酵母膏5,蛋白胨10,氯化钠10。
发酵培养基(g/L):蛋白胨15,酵母粉25,磷酸氢二钾10,甘油5,用6 mol/L氢氧化钠调pH至7.5。
在含50 μg/mL卡那霉素的种子培养基中加入1‰甘油冻存管菌液,37℃、220 r/min培养过夜。将种子培养液按2%移种量接种至发酵培养基中,37℃、220 r/min培养约5 h,降温至25℃后加入终浓度为1%的乳糖作为诱导剂,220 r/min发酵过夜。
1.1.3 试剂及工具酶NdeⅠ、BamHⅠ、BglⅡ限制性内切酶、Pyrobest聚合酶、dNTPs、SolutionⅠ、DNA Marker、基因组提取试剂盒等购自TaKaRa公司;琼脂糖凝胶DNA回收试剂盒、小量质粒提取试剂盒购自AXYGEN公司;蛋白质相对分子质量标准购自Thermo公司;卡那霉素、ATP标准品购自上海生工生物工程股份有限公司;SAM标准品购自Sigma;其他分析纯试剂均购自国药集团化学试剂有限公司。
1.2 方法 1.2.1 重组菌构建使用基因组提取试剂盒分别提取得到大肠杆菌BL21(DE3)和酿酒酵母的基因组序列,并设计下述PCR引物,分别从大肠杆菌BL21(DE3)中扩增得到腺苷酸激酶基因(gene ID:8156163)和乙酸激酶基因序列(gene ID:8156267),从酿酒酵母中提取得到腺苷激酶基因序列(gene ID:853569)。
腺苷激酶PCR所用引物对为:正向引物:AAAAAAAAAACATATGACCGCACCATTGGTAG,反向引物:AAAAAAAAAAGGATCCCTATTTAGAGTAAGAT。腺苷酸激酶PCR所用引物对为:正向引物:AAAAAAAAAACATATGCGTATCATTCTGCTTG,反向引物:AAAAAAAAAAGGATCCTTAGCCGAGGATTTTT。乙酸激酶PCR所用引物对为:正向引物:AAAAAAAAAACATATGTCGAGTAAGTTAGTAC,反向引物:AAAAAAAAAAGGATCCTCAGGCAGTCAGGCGG。
正向引物中下划线部分表示NdeⅠ酶切位点,反向引物中下划线部分表示BamHⅠ酶切位点。
扩增腺苷激酶基因的PCR扩增反应体系(50 μL):ddH2O 37.5 μL,10×Pyrobest缓冲液5 μL,dNTP(各2.5 mmol/L)4 μL,正向引物1 μL,反向引物1 μL,模板1 μL,Pyrobest酶0.5 μL。PCR反应条件为:95℃ 5 min;94℃ 30 s,50℃ 30 s,72℃1 min,30个循环;72℃ 10 min,16℃ 1 min。
扩增腺苷酸激酶基因的PCR反应体系(50 μL):ddH2O 37.5 μL,10×Pyrobest缓冲液5 μL,dNTP(各2.5 mmol/L)4 μL,正向引物1 μL,反向引物1 μL,模板1 μL,Pyrobest酶0.5 μL。PCR反应条件为:95℃ 5 min;94℃ 30 s,50℃ 30 s,72℃ 40 s,30个循环;72℃ 10 min,16℃ 1 min。
扩增乙酸激酶基因的PCR反应体系(50 μL):ddH2O 37.5 μL,10×Pyrobest缓冲液5 μL,dNTP(各2.5 mmol/L)4 μL,正向引物1 μL,反向引物1 μL,模板1 μL,Pyrobest酶0.5 μL。PCR反应条件为:95℃ 5 min;94℃ 30 s,50℃ 30 s,72℃ 75 s,30个循环;72℃ 10 min,16℃ 1 min。
将通过上述方法得到的3种酶的编码序列片段进行琼脂糖凝胶电泳,并回收;将回收的三种酶基因的片段和pET24a质粒载体分别用限制性内切酶Nde I于37℃处理3-4 h,再添加限制性内切酶BamH I于30℃处理3-4 h。将酶切产物进行琼脂糖凝胶电泳,使用AXYGEN公司的胶回收试剂,盒参考供应商提供的操作手册分别回收经酶切的3种酶的基因片段和pET24a质粒。
首先将上一步处理后的pET24a质粒分别与经酶切、回收的腺苷激酶基因片段、腺苷酸激酶基因片段和乙酸激酶基因片段,利用快速连接酶Solution Ⅰ连接3-4 h,后转入大肠杆菌DH5α感受态细胞中,分别获得重组质粒pET24a-AK、pET24a-ADK和pET24a-ACK。将上述重组质粒pET24a-AK用限制性内切酶BamH I酶切,30℃酶切3 h后再用碱性磷酸酶(CAP)处理15 min,电泳回收。用BglⅡ与BamH I双酶切处理pET24a-ADK,电泳并回收腺苷酸激酶基因的酶切片段。将如上得到的经酶切的pET24a-AK和腺苷酸激酶基因的酶切片段利用快速连接酶Solution Ⅰ连接,将连接产物转入大肠杆菌DH5α感受态细胞中,获得重组质粒pET24a-AK-ADK。将得到的重组质粒pET24a-AK-ADK用BamH Ⅰ酶切,30℃酶切3 h后用碱性磷酸酶处理15 min,将酶切产物进行电泳回收。用BglⅡ与BamHⅠ双酶切处理pET24a-ACK,将酶切产物进行琼脂糖凝胶电泳,并回收乙酸激酶基因的酶切片段。将经酶切的pET24a-AK-ADK和ACK的酶切片段利用快速连接酶Solution Ⅰ连接,将连接产物转入大肠杆菌DH5α感受态细胞中,获得重组质粒pET24a-AK-ADK-ACK。构建的重组质粒pET24a-AK-ADK-ACK的图谱如图 1所示。通过测序检测3种酶的表达序列全部正确。

|
| 图 1 重组质粒pET24a-AK-ADK-ACK |
将上述得到的重组质粒pET24a-AK-ADK-ACK用KCM法转入大肠杆菌BL21(DE3)感受态细胞中,涂板培养,挑取阳性克隆在LB液体培养基中培养后用终浓度为10%甘油保种,置于-80℃冰箱中保存。
1.2.2 3种酶的表达及检测在含50 μg/mL卡那霉素的种子培养基中加入1‰重组大肠杆菌甘油冻存管菌液,37℃、220 r/min培养过夜。将种子培养液按2%移种量接种至发酵培养基中,37℃、220 r/min培养约5 h,降温至25℃后加入终浓度为1%的乳糖作为诱导剂,220 r/min发酵过夜。离心收集菌体并破胞,采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析重组菌对3种酶的表达结果。
1.2.3 重组菌全细胞转化生产ATP及反应条件优化发酵结束后采用8 000 r/min离心10 min收集菌体,用pH 7.0、50 mmol/L硼砂缓冲液洗涤菌体2次备用。反应体系中含有30 mmol/L腺苷、50 mmol/L硼砂、一定浓度ACP和硫酸镁,加入一定量湿菌体作为酶源合成ATP,对ACP浓度、硫酸镁浓度、菌体用量、反应液pH、反应温度、反应时间等条件进行了优化。
1.2.4 联合生产S-腺苷甲硫氨酸表达腺苷甲硫氨酸合成酶的菌株(pET24a-metK)由本实验室在前期构建并于-80℃保存,通过以大肠杆菌BL21(DE3)基因组序列为模板PCR扩增得到表达腺苷甲硫氨酸合成酶的基因序列(gene ID:8180558),经Nde Ⅰ和BamH I双酶切后与载体连接得到重组质粒,转化重组质粒至大肠杆菌BL21(DE3)即得到该菌株。
按照1.2.2所述发酵方法发酵该菌株,8 000 r/min离心10 min收集菌体备用。
在发酵罐中进行5 L体系的反应。先投入5 L ATP反应体系,35℃反应,过程中监测腺苷的转化情况,等腺苷完全转化为ATP后再补加D,L-甲硫氨酸、硫酸镁等其他物料,在表达腺苷甲硫氨酸合成酶的菌体催化下合成SAM。
2 结果 2.1 重组大肠杆菌蛋白表达结果重组大肠杆菌pET24a-AK-ADK-ACK表达结果如图 2-A所示,重组大肠杆菌pET24a-metK表达结果如下图 2-B所示,后续将用于考察反应的效果。
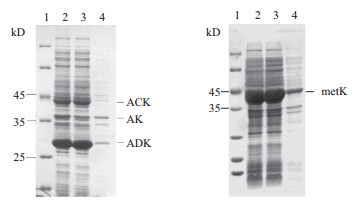
|
| A:重组大肠杆菌pET24a-AK-ADK-ACK表达结果;B:重组大肠杆菌pET24a-metK表达结果;1:蛋白Marker;2:重组大肠杆菌均质液;3:重组大肠杆菌均质液上清;4:重组大肠杆菌均质液沉淀 图 2 重组大肠杆菌蛋白表达结果 |
由于ACP在溶液中易降解,实际使用时需要过量才能使腺苷完全转化,本实验以腺苷浓度为30 mmol/L,分别考察了ACP浓度为90、105、120、135、150 mmol/L时的ATP转化率,其他条件为硫酸镁20 mmol/L、菌体浓度为10 g/L(湿重,下同),反应pH为7.5,反应温度为35℃,反应时间为5 h,结果如下图 3所示。
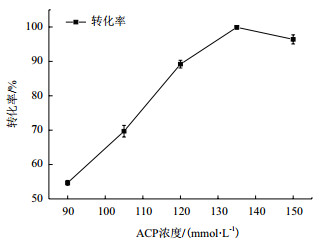
|
| 图 3 ACP浓度对反应转化率的影响 |
从液相分析结果可知,在上述ACP浓度范围内,腺苷均已完全转化,但当ACP浓度低于135 mmol/L时,部分生成ADP,甚至还有少量的AMP存在;当ACP浓度达到135 mmol/L,即腺苷与ACP摩尔比达到1:4.5时,底物腺苷转化为ATP(以下均称转化率)达到99%以上。
2.3 硫酸镁浓度对ATP生成的影响实验中分别考察了硫酸镁浓度为1、5、10、15、20 mmol/L时的ATP的生成率,其他条件同2.2所述,结果如下图 4所示。从上述结果可知,当硫酸镁浓度为5 mmol/L时就已经足够使腺苷完全转化为ATP,因此后续实验硫酸镁浓度就采用5 mmol/L。

|
| 图 4 硫酸镁浓度对反应的影响 |
根据上述实验结果进一步降低菌体用量,分别考察了菌体浓度为1、2、4、6、8、10 g/L时的反应情况。结果如下图 5所示。
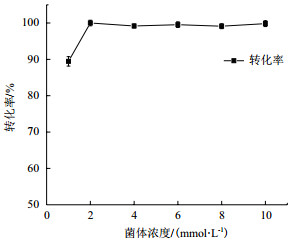
|
| 图 5 菌体用量对反应的影响 |
从上述结果可知菌体的活力较高,在反应体系中用量仅2 g/L就可使底物腺苷完全转化为ATP。
2.5 反应液pH对ATP生成的影响随着反应的进行,反应液pH会出现下降,下降幅度在1.0左右。为操作便利,在实验过程中不对pH进行调节,因此需考察反应液初始pH的最佳值。实验分别考察了pH为6.5、7.0、7.5、8.0、8.5条件下的反应情况,结果如下图 6所示。从上述结果可知反应液pH在7.5时ATP的生成率最高,因此在后续的实验中采用反应液初始pH为7.5。
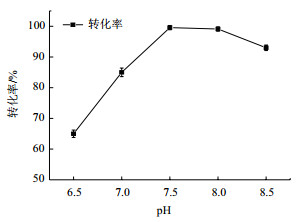
|
| 图 6 pH对反应的影响 |
根据上述优化后的反应条件,进一步考察了反应时间为0.5 h、1 h、2 h、3 h、4 h和5 h的反应情况,结果如图 7所示。反应时间为2 h时,反应转化率已经达到95%以上;继续反应至3 h,转化率达到99%以上。因此后续均反应3 h。
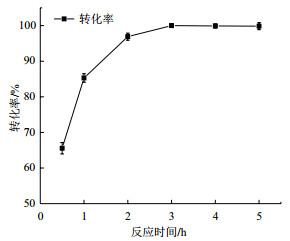
|
| 图 7 反应时间对反应转化率的影响 |
ATP料液转化完成后继续放置会有部分重新降解为ADP和AMP,考虑到实际操作过程中存在无法及时处理ATP反应料液的可能性,因此实验考虑将料液加酸,分别考察了pH为3.0、3.5、4.0、4.5、5.0条件下室温放置ATP反应液的稳定性,结果如下图 8所示。从上述结果可知,在反应结束后放置前6 h,ATP基本都是稳定的;6 h后当料液的pH为3.0、3.5、4.0,ATP基本较稳定,未出现明显的降解;当pH为4.5及5.0时,ATP出现大量的降解,料液中ADP、AMP明显增多,因此后续如需存放ATP料液,可以调节料液的pH为3.0-4.0。

|
| 图 8 反应液放置pH对ATP稳定性的影响 |
根据上述优化结果,反应体系中含腺苷30 mmol/L、ACP 135 mmol/L、MgSO4 5mmol/L、硼砂50 mmol/L,重组ATP转化菌株2g/L(湿重),反应液pH为7.5,35℃反应3 h,即可使腺苷完全转化为ATP。
按照上述反应体系配制5 L反应液,在发酵罐中进行控温反应,反应3 h后采用高效液相分析腺苷已经完全转化为ATP,按50 g/L(湿重)补加表达SAM合成酶的菌体均质液,并加入另一底物D,L-甲硫氨酸65 mmol/L,补加硫酸镁15 mmol/L,控温37℃反应,反应过程中检测SAM的生成情况,结果如图 9所示。

|
| 图 9 SAM生成结果 |
反应最终生成腺苷蛋氨酸浓度达到8.7g/L,ATP转化率达到72.5%。
3 讨论目前用于ATP生产的主要菌株为酵母菌株及产氨棒杆菌,反应所需的时间较长,而采用重组大肠杆菌用于ATP生产的文献相对较少。本实验构建的ATP转化菌株能够在较低的菌体用量下实现30mmol/L腺苷完全转化为ATP,且反应所需的时间仅需3 h。所用的腺苷浓度相对较低,主要是为了将反应液直接用于下一步S-腺苷甲硫氨酸的合成。后续可以考察更高浓度的ATP合成及ATP的分离纯化,用于ATP的生产。另外,由于ATP反应液中含有较高浓度的醋酸盐,以及过量未参与反应的ACP,可能会对下一步生成SAM产生一定的影响,后续可以考虑先对ATP反应液做一定的处理。以价格较低的腺苷作为底物先合成ATP,再与甲硫氨酸反应合成SAM,可以大大降低SAM的生产成本。
4 结论构建了重组菌E.coilBL21(DE3)(pET24a-AK-ADK-ACK),催化以腺苷为底物合成ATP,并对反应体系进行了优化,优化后的体系为:腺苷30 mmol/L,乙酰磷酸二锂盐135 mmol/L,硫酸镁5 mmol/L,硼砂50 mmol/L,菌体2 g/L,反应液初始pH为7.5,反应温度为35℃,反应时间为3 h,反应转化率可以达到99%以上。初步考察了联合腺苷甲硫氨酸合成酶合成S-腺苷甲硫氨酸,生成S-腺苷蛋氨酸浓度能达到8.7 g/L,转化率能达到72.5%。
| [1] |
Xu W, Raetz LB, Wang P, et al. An ATP-dependent ligase catalyzes the fourth ring cyclization in tetracycline biosynthesis[J]. Tetrahedron, 2016, 72(25): 3599-3604. DOI:10.1016/j.tet.2015.09.029 |
| [2] |
刘桂祯, 黄炯威, 周华润, 等.一种酶催化合成谷胱甘肽的方法: 中国, 201610745720. X[P]. 2016-08-29.
|
| [3] |
Maruyama A, Fujio T. ATP production from adeine by a self-coupling enzymatic process: high-level accumulation under ammonium-limited conditions[J]. Biosci Biotechnol Biochem, 2001, 65(3): 644-650. DOI:10.1271/bbb.65.644 |
| [4] |
廖鲜艳, 王芸, 朱至, 等. 面包酵母生物合成ATP的影响因素及机理初探[J]. 食品与生物技术学报, 2007, 26(6): 53-57. |
| [5] |
李寅, 陈坚, 伦世仪. ATP再生系统及其应用[J]. 食品与发酵工业, 1998, 24(3): 60-65. DOI:10.3321/j.issn:0253-990X.1998.03.013 |
| [6] |
颜炳坤.联合葡萄糖激酶与乙酸激酶催化的ATP再生系统酶法合成葡萄糖-6-磷酸[D].上海: 华东理工大学, 2014.
|
| [7] |
徐扬. S-腺苷甲硫氨酸研究进展[J]. 国际生物制品学杂志, 2009, 32(1): 41-44. DOI:10.3760/cma.j.issn.1673-4211.2009.01.010 |
| [8] |
万红贵, 郭一丹, 蔡恒, 等. S-腺苷甲硫氨酸研究进展及市场应用分析[J]. 现代生物医学进展, 2008, 8(10): 1951-1955. |
| [9] |
Yin Chunli, Zheng Tao, Chang Xin. Biosynthesis of S-adenosylmethionine by magnetically immobilized Escherichia coli cells highly expressing a methionine adenosyltransferase variant[J]. Molecules, 2017, 22(8): 1-13. |
| [10] |
牛卫宁, 左晓佳, 顶焰, 等. 重组大肠杆菌全细胞催化合成S-腺苷甲硫氨酸[J]. 精细化工, 2009, 26(3): 288-292. DOI:10.3321/j.issn:1003-5214.2009.03.020 |
| [11] |
郑计瑞, 陈丽芬, 等. 腺嘌呤合成腺苷甲硫氨酸的工程菌构建及其高产株筛选[J]. 食品与发酵工程, 2014, 40(9): 23-28. |




