2. 江苏猎阵生物科技有限公司,南通 226400;
3. 华南农业大学农学院,广州 510642
2. Jiangsu Huntarray Biological Technology Co., Ltd., Nantong 226400;
3. College of Agriculture, South China Agricultural University, Guangzhou 510642
褐腐病(Brown rot)是核果及仁果类水果生产及贮藏期重要的病害,在世界分布较为广泛,为害果树引起枝梢溃疡、花叶枯萎、果实腐烂,导致严重损失[1-4]。褐腐病主要由子囊菌链核盘菌属(Monilinia)中的3个种,即美澳型核果褐腐菌(M. fructicola)、核果褐腐菌(M. laxa)和仁果褐腐菌(M. fructigena)所引起。M. fructicolaS被认为是其中最具有毁灭性的植物病原菌[5],被欧盟、非盟、智利、约旦、以色列和巴林定为检疫性有害生物(EPPO global data base:https://gd.eppo.int/)。该菌也是我国禁止入境的植物检疫性有害生物[6],具有重要的检疫意义。另外两种褐腐病菌,M. fructigena被美国、加拿大、澳大利亚、新西兰和智利列为检疫对象,而M. laxa则是约旦关注的检疫对象。
褐腐病菌既能在果树生长期和果实储藏期造成为害,也可在果实中潜伏侵染随病果远距离传播,加之其环境适应性很强,对我国水果产业造成严重威胁。由于3种褐腐病菌关系相近,传统依靠菌落特征、分生孢子大小、分生孢子萌发产生的芽管、产孢量等形态和生理特征进行区分非常困难[7-9],要求鉴定者必须具备丰富的真菌分类学基础与经验。此外,传统检验方法周期长,难以满足口岸水果快速通关的要求,因此建立快速准确的检测方法以防止该类病原真菌的传播尤为必要。
鉴于褐腐病菌的重大经济意义,许多研究者从多方面寻求更可靠的检测方法,包括普通PCR检测[10-18]、巢式PCR检测[19]、多重PCR检测[20-21]、SYBR green实时荧光PCR检测[22]、TaqMan实时荧光PCR检测[23-26],以及近年发展起来的PCR高分辨率熔解分析技术(High-resolution melting,HRM)[27]和叠氮溴化丙锭(Propidium monoazide,PMA)结合qPCR检测技术[28]。试纸检测技术是一种基于目视判别颜色变化的可视化快速检测技术,具有直观、快速、简便的特点,目前已在食品检测和医学等领域得到广泛应用。迄今为止,国内外尚未见该技术应用于水果褐腐病菌检测的报道。本实验旨在根据水果上3种重要的褐腐病菌的EF-1α基因特异序列,进行引物及探针的筛选,开发出可应用于口岸检疫的水果褐腐病菌快速检测试纸。
1 材料与方法 1.1 材料 1.1.1 主要试剂真菌DNA提取试剂盒、检测试纸试剂盒(含前处理液、探针稀释液、后处理液、不对称扩增预混液、反应液A、反应液B、洗液、显色液及试纸杂交盒)购自江苏猎阵生物科技有限公司;硝酸纤维素膜为德国赛多利斯产品;普通PCR扩增试剂(Ex Taq DNA Polymerase、Ex Taq Buffer、dNTP等)、克隆试剂盒(pMD 19-T Vector Cloning Kit)均购自宝生物工程(大连)有限公司。
1.1.2 供试菌株及DNA供试菌株包括了近年来黄埔口岸和珠海口岸植物检疫实验室截获的来源于国外的7个美澳型核果褐腐病菌菌株,其他褐腐病菌购自中国农业微生物菌种保藏管理中心(Agricultural Culture Collection of China,ACCC)、中国林业微生物菌种保藏管理中心(China Forestry Culture Collection Center,CFCC)和北纳创联生物技术有限公司(BeNa Culture Collection,BNCC)等国内菌种保存机构,阴性对照菌株Botrytis cinerea、Botryotinia fuckeliana、Botryosphaeria dothidea和Pestalotiopsis neglecta为本实验室从进境水果上分离的菌株。供试菌株来源、寄主等相关信息见表 1。将供试菌株在PDA平板上于22℃、黑暗培养7-10 d,收集菌丝,用真菌DNA提取试剂盒按操作说明提取基因组DNA,-20℃保存。
阳性供试质粒共3种,为本课题组前期构建。从菌株M. fructicola(1-42093)、M. laxa(CFCC 80293)和M. fructigena(BNCC 116805)基因组DNA扩增EF-1α基因部分片段,分别将扩增到的目标片段插入pMD19-T载体中,构建pMD19-Mfcl、pMD19-Mlx和pMD19-Mfgn 3种重组阳性克隆。以带有M. fructicola、M. laxa和M. fructigena目标基因EF-1α片段的重组阳性质粒DNA为检测标准品。用Nanodrop ND-2000超微量核酸蛋白测定仪(Thermo Fisher Scientific,USA)测定标准品DNA浓度后稀释至10 ng/µL,-20℃保存。
1.1.4 供试引物和探针根据3种褐腐病菌M. fructicola、M. laxa和M. fructigena的EF-1α序列,设计了一对通用引物Mon F/Mon R、3条种特异性探针Mfcl-P、Mlx-P和Mfgn-P(图 1)。引物和探针具体序列见表 2,由上海生物工程股份有限公司合成,下游引物Mon R的5' 端连接生物素标记。

|
| 图 1 本文设计的引物和探针在Monilinia spp.的EF-1α序列中的位置 |
将硝酸纤维素膜用前处理液处理后,在干燥箱中80℃烘烤10 min。将各探针干粉用纯水溶解稀释到40 μmol/L,然后用探针稀释液稀释到4 μmol/L,用移液器将稀释后的探针点在硝酸纤维素膜上,在干燥箱中60℃烘烤15 min。然后放入后处理液中浸泡10 min,取出用纯水简单冲洗晾干,即为水果褐腐病菌检测试纸(Monilinia dipstick,MON试纸)。
1.2.2 单链检测靶标的扩增以表 1中供试菌株的基因组DNA或标准品质粒DNA为模板,采用引物Mon F/ Mon R进行不对称PCR扩增。反应体系为20 µL:包括13 µL不对称扩增预混液、1.2 µL正向引物Mon F和2 µL反向引物Mon R、2 µL模板DNA,加双蒸水补至20 µL。反应程序为:94℃预变性4 min;然后以94℃ 5 s,43℃ 1 s,68℃ 7 s进行40个循环;最后94℃ 5 s,63℃ 1 s,68℃ 7 s结束反应。扩增产物以1.5%琼脂糖凝胶电泳检测。
1.2.3 试纸检测将扩增产物、600 µL的反应液A、1 µL的反应液B混合后,与MON检测试纸一起加入到杂交盒中,45℃振荡杂交5 min,去杂交液后用2 mL洗液摇洗1 min(重复一次),倒去洗液后加入500 µL显色液,避光显色3 min,肉眼判读结果。MON试纸检测原理如图 2所示。

|
| 图 2 MON试纸检测原理示意图 |
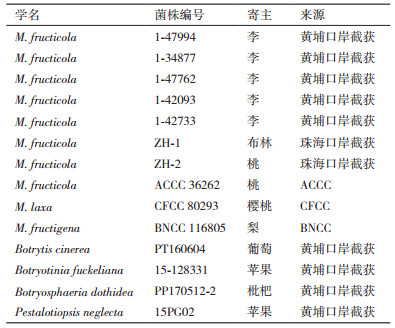
如图 3所示(示意图中显色点为软件绘制),若显色结果为A,则表示试验失败;若显色结果为B,则表示检测结果为阴性,即样品中未含有M. fructicola、M. laxa和M. fructigena中的任一菌株;若显色结果为C,则表示样品中含有M. laxa菌株;若显色结果为D,则表示样品中含有M. fructicola菌株;若显色结果为E,则表示样品中含有M. fructicola菌株。当样品中含有M. fructicola、M. laxa和M. fructigena中的2种或3种菌株,则同一张试纸上会出现2个以上显色点。
|
| 图 3 MON试纸检测结果判读示意图 |
以表 1中M. fructicola、M. laxa和M. fructigena三种褐腐病菌菌株以及从进境水果上分离的阴性参照菌株Botrytis cinereal、Botryotinia fuckeliana、Botryosphaeria dothidea和Pestalotiopsis neglecta的基因组DNA为模板,用上述试纸检测方法进行检测,验证MON检测试纸的特异性。以无菌水为空白对照,平行两次实验。
1.2.6 MON试纸的灵敏度分析分别取M. fructicola、M. laxa和M. fructigena三种褐腐病菌相应的标准品DNA按10倍梯度稀释成系列浓度:100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL,各取1 μL作为模板进行不对称PCR扩增,用上述试纸检测方法进行检测,分析MON试纸的最低检测浓度。以无菌水为空白对照,平行两次实验。
1.2.7 MON试纸的多重检测及灵敏度分析将M. fructicola、M. laxa和M. fructigena三种褐腐病菌的标准品DNA等浓度等量混匀在单管中,按10倍梯度稀释成系列浓度:100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL、1 fg/μL,各取1 μL作为模板进行不对称PCR扩增,用建立的试纸检测方法进行多重检测及灵敏度分析。以无菌水为空白对照,平行两次实验。
1.2.8 MON试纸稳定性测试将MON检测试纸分别在4℃和37℃密封贮存,每隔30 d对不同生产批次、不同贮存温度的试纸进行检测能力测试,评估不同批次试纸间的检测能力有无差异以及不同贮存温度、不同贮存期对试纸检测能力有无影响。
2 结果 2.1 检测靶标DNA电泳验证不对称PCR扩增所得的靶标DNA通过琼脂糖凝胶电泳进行验证。扩增产物的电泳结果如图 4所示,PCR目标产物大约为300 bp,片段长度与预期相符。扩增所用的引物Mon F/Mon R为通用引物,非目标菌株(S11、S12、S14)DNA也可扩增产生条带。未有扩增产物的泳道(S13、S15)或扩增条带较弱的泳道(S2)出现引物二聚体,考虑是不对称PCR体系中加入过量引物进行两轮PCR扩增引起。而目标菌株DNA扩增的产物条带清晰(S1-S10),除此之外没有明显的非目标扩增条带,说明所设计的引物以及设定的PCR反应条件符合反应要求。

|
| S1-S8:M. fructicola(1-47994,1-3S4877,1-47762,1-42093,1-42733,ZH-1,ZH-2,ACCC 36262);S9:M. fructigena(BNCC 116805);S10:M. laxa(CFCC 80293);S11:Botrytis cinerea(PT160604);S12:Botryotinia fuckeliana(15-128331);S13:Botryosphaeria dothidea(PP170512-2);S14:Pestalotiopsis neglecta(15PG02);S15:空白对照(ddH2O);M:50 bp DNA Marker 图 4 检测靶标电泳图 |
MON检测试纸对M. fructicola、M. laxa和M. fructigena三种褐腐病菌特异性验证结果如图 5所示。3种目标褐腐病菌检测信号点明晰,阳性信号明确不交叉,而非目标菌株以及空白对照都没有检测到阳性信号,质控信号正常,不存在假阳性或假阴性结果。表明MON试纸能特异性检出M. fructicola、M. laxa和M. fructigena三种褐腐病菌。

|
| S1-S8:M. fructicola(1-47994,1-34877,1-47762,1-42093,1-42733,ZH-1,ZH-2,ACCC 36262);S9:M. fructigena(BNCC 116805);S10:M. laxa(CFCC 80293);S11:Botrytis cinerea(PT160604);S12:Botryotinia fuckeliana(15-128331);S13:Botryosphaeria dothidea(PP170512-2);S14:Pestalotiopsis neglecta(15PG02);S15:空白对照(ddH2O);1st:第一次实验结果;2nd:第二次实验结果 图 5 水果褐腐病菌检测试纸的特异性验证结果 |
分别用MON检测试纸对菌株M. fructicola(1-42093)、M. laxa(CFCC 80293)和M. fructigena(BNCC 116805)的EF-1α重组阳性质粒DNA不同稀释度模板进行检测。实验结果显示,在100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/µL的DNA浓度下,3种目标褐腐病菌都能被检测到明确的阳性信号,质控信号正常,平行实验结果一致。表明MON试纸分别对3种阳性质粒DNA的检测灵敏度均可达到10 fg/μL。图 6展示了MON检测试纸对最低检测浓度10 fg/μL的标准DNA检测结果。

|
| 1st:第一次实验结果;2nd:第二次实验结果;标准品DNA对应的病菌名称标注于图片上方 图 6 MON试纸对3种褐腐病菌最低检测浓度验证结果 |
MON试纸的多重检测和灵敏度分析结果显示:混合标准品DNA在100 pg/μL、10 pg/μL、1 pg/μL、100 fg/μL、10 fg/μL浓度下均能被检测到明显的三重阳性信号,质控信号正常,平行实验结果一致。表明试纸对阳性标准品DNA的多重检测灵敏度为10 fg/μL,与单重检测灵敏度一致。图 7展示了MON检测试纸对最低检测浓度10 fg/μL的混合标准品DNA检测结果。

|
| 1st:第一次实验结果;2nd:第二次实验结果;混合标准品DNA浓度标注于图片上方 图 7 MON试纸对3种褐腐病菌的多重检测验证结果 |
MON试纸储存温度、储存期和批间检测结果显示,在4℃和37℃贮存条件下,MON试纸检测效果没有明显差异,而当储存时间达到90 d后,在10 fg/µL的标准品DNA浓度条件下,MON试纸依然保持着准确、良好的检测能力,不同批次试纸间的检测能力无明显差异。图 8展示了不同贮存温度、不同贮存时间条件下,MON试纸对10 fg/µL浓度的标准品DNA的检测效果。
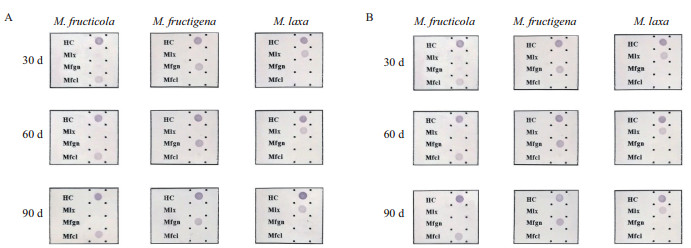
|
| A:4℃贮存MON试纸;B:37℃贮存MON试纸;标准品DNA对应的病菌名称标注于图片上方 图 8 MON检测试纸稳定性测试结果 |
自2005年以来,我国进境口岸检验检疫部门连续每年都从进境水果中多次截获美澳型核果褐腐病菌。2011年的疫情尤为突出,仅从美国进境水果中就检出美澳型核果褐腐病菌50批次。由于水果褐腐病菌寄主范围广、传播途径多、对气候条件的适应性强,其通过水果贸易进行跨国异地传播的风险极高。而随着水果贸易对货物通关速度的要求不断提高,快速、准确、简便的检测技术越来越为口岸植物检疫所需要。
M. fructicola、M. laxa和M. fructigena作为水果褐腐病最重要的3种病原菌,其传统检验方法是根据病菌的形态和培养特性进行分类,首次分离后可能需长达10 d才能完成整个鉴定流程[3, 8]。近年随着分子生物学技术的迅速发展,大量以PCR为基础的技术被应用于水果褐腐病菌的快速检测,大大提高了鉴定的速度和准确性。欧盟将常规PCR[14]和荧光PCR[24]检测方法列入对美澳型核果褐腐病菌的检测标准中[29]。Côté等[20]于2004年开发的多重PCR检测技术也应用较广,但因缺乏验证数据而未被纳入该标准。2015年,Riccioni等对其进行了验证试验并与常规PCR技术[14]进行了比较发现,多重PCR检测灵敏度(25 pg)明显低于常规PCR方法(0.5 pg),但也能满足病害诊断的要求[30]。2016年,Guinet等[25]开发的多重实时荧光PCR检测技术和Papavasileiou等[27]开发的PCR高分辨率熔解分析技术,皆能同时检测多种水果褐腐病菌。同年,Garcia-Benitez等[26]将van Brouwershaven等[24]开发的实时荧光PCR检测技术进行探针荧光基团的改进,应用于潜伏侵染期花、果的检测。2017年,Vilanova等[28]则在van Brouwershaven等的技术基础上,结合叠氮溴化丙锭进行活菌的定量检测研究。每种方法都有各自的优越性,新技术的应用是对PCR等常规检测方法的丰富和发展。
在本研究之前,国内外尚未见检测试纸应用于水果褐腐病菌检测的研究报道。检测试纸技术是将DNA杂交技术与试纸显色技术相结合,将待测的DNA样本经PCR扩增成为带生物素标记的单链DNA,再与试纸上的探针进行杂交,结合了特异DNA样本的探针点即带有生物素类的标记物,经相应的酶促显色反应就能显出杂交信号,从而实现对分子检测结果的直观、可视化处理。本研究首次尝试使用可视化试纸对3种重要的水果褐腐病菌进行快速检测。选择水果褐腐病菌的EF-1α基因作为靶基因。设计通用引物Mon F/ Mon R用于靶标DNA的扩增。通用引物的设计简化了单链靶标扩增体系中的成分,避免了多重PCR扩增过程中引物对之间相互干扰的情况,大大提高了靶标DNA的扩增效率。设计合成特异性探针Mfcl-P、Mlx-P和Mfgn-P,以硝酸纤维素膜为载体制备成MON检测试纸。该试纸利用探针与模板的互补关系来保证检测方法的特异性,这一过程类似荧光定量PCR方法的探针与模板的结合过程,具有高度特异性。在所有供试菌株中,能特异性检测出目标褐腐病菌,检测信号点明晰,阳性信号明确不交叉,而非目标菌株以及空白对照都没有检测到阳性信号,质控信号正常。对3种目标菌的单重检测和多重检测灵敏度一致,检出限均可达10 fg/µL。具有很高的特异性和灵敏度。
水果褐腐病菌存在复合侵染的情况,同一果实上可能同时出现两种褐腐病菌[25, 31]。本研究开发的MON试纸既能对未知样品进行水果褐腐病3种病原菌的特异检测,也够快速诊断样品中是否存在混合感染。整个检测流程包括DNA提取、单链靶标扩增和试纸检测,不超过2 h。通过单张试纸同时实现3种病菌的多重检测,更是节约了检测成本,提高了检测效率,可有效降低口岸检疫监管和货物通关的检测和时间成本。与常规PCR方法相比,本研究所建立的检测试纸方法免除电泳过程,只需根据颜色变化判定即可,具有直观、快速、操作简便等优势。与同样可直接判读结果的荧光PCR方法相比,则无需依赖昂贵的荧光试剂和设备,具有成本低廉的优势,便于向基层口岸推广使用。该试纸实现了口岸水果褐腐病菌可视化核酸检测,在口岸检疫具有很强的可操作性和适用性,为口岸水果病菌检疫提供了一种新的思路和解决方案。
4 结论本研究基于DNA杂交和试纸显色技术,根据水果褐腐病菌的EF-1α基因设计通用扩增引物和特异性探针,研发出水果褐腐病菌的快速检测试纸条,可同时检测3种水果褐腐病菌。对该试纸的特异性、灵敏度和稳定性等参数进行评价,测试结果表明其特异强、灵敏度高、稳定性好,可以作为水果进出口口岸对该类病菌进行检验检疫的高效方法。
| [1] |
Byrde RJW, Willetts HJ. The brown rot fungi of fruit: Their biology and control[M]. Oxford: Pergamon Press, 1977: 1-171.
|
| [2] |
Berrie AM, Holb I. Brown rot diseases// Compendium of apple and pear diseases and pests[M]. St. Paul: APS Press, 1990: 43-45.
|
| [3] |
Batra LR. World species of Monilinia(fungi): Their ecology, biosystematics and control[J]. Mycologia Memoir, 1991, 16: 1-246. |
| [4] |
Ogawa JM, Zehr EI, Bird GW, et al. Brown rot// Compendium of stone fruit diseases[M]. St. Paul: APS Press, 1995: 7-10.
|
| [5] |
Hrustić J, et al. Genus Monilinia on pome and stone fruit species[J]. Pesticidi I Fitomedicina, 2012, 27(4): 283-297. DOI:10.2298/PIF1204283H |
| [6] |
中华人民共和国农业部和国家质量监督检验检疫总局.中华人民共和国进境植物检疫性有害生物名录.农业部第862号公告[S].北京: 2007.
|
| [7] |
Sonoda RM, Ogawa JM, Manji BT. Use of interactions of cultures to distinguish Monilinia laxa from M. fructicola[J]. Plant Dis, 1982, 66(1): 325-326. DOI:10.1094/PD-66-325 |
| [8] |
van Leeuwen GCM, van Kesteren HA. Delineation of the three brown rot fungi of fruit crops(Moniliniaspp.)on the basis of quantitative characteristics[J]. Can J Bot, 1998, 76(12): 2042-2050. |
| [9] |
Lane CR. A synoptic key for differentiation of Monilinia fructicola, M. fructigena and M. laxa, based on examination of cultural characters[J]. EPPO Bulletin, 2002, 32(3): 489-493. |
| [10] |
Fulton CE, Brown AE. Use of SSU rDNA group-Ⅰ intron to distinguish Monilinia fructicola from M. laxa and M. fructigena[J]. FEMS Microbiol Lett, 1997, 157(2): 307-312. DOI:10.1016/S0378-1097(97)00492-8 |
| [11] |
Snyder CL, Jones AL. Genetic variation between strains of Monilinia fructicola and Monilinia laxa isolated from cherries in Michigan[J]. Can J Plant Pathol, 1999, 21(1): 70-77. DOI:10.1080/07060661.1999.10599997 |
| [12] |
Förster H, Adaskaveg JE. Early brown rot infections in sweet cherry fruit are detected by Monilinia-specific DNA primers[J]. Phytopathology, 2000, 90(2): 171-178. DOI:10.1094/PHYTO.2000.90.2.171 |
| [13] |
Hughes KJD, Fulton CE, McReynolds D, et al. Development of new PCR primers for identification of Monilinia species[J]. EPPO Bulletin, 2000, 30(3-4): 507-511. DOI:10.1111/j.1365-2338.2000.tb00938.x |
| [14] |
Ioos R, Frey P. Genomic variation within Monilinia laxa, M. fructigena and M. fructicola, and application to species identification by PCR[J]. Eur J Plant Pathol, 2000, 106(4): 373-378. DOI:10.1023/A:1008798520882 |
| [15] |
Boehm EWA, Ma Z, Michailides TJ. Species-specific detection of Monilinia fructicola from California stone fruits and flowers[J]. Phytopathology, 2001, 91(5): 428-439. DOI:10.1094/PHYTO.2001.91.5.428 |
| [16] |
Gell I, Cubero J, Melgarejo P. Two different PCR approaches for universal diagnosis of brown rot and identification of Monilinia spp. in stone fruit trees[J]. J Appl Microbiol, 2007, 6: 2629-2637. |
| [17] |
Miessner S, Stammler G. Monilinia laxa, M. fructigena and M. frutticola: Risk estimation of resistance to Qol fungicides and identification of species with cytochrome b gene sequence[J]. J Plant Dis Protect, 2010, 117(4): 162-167. DOI:10.1007/BF03356354 |
| [18] |
Hily JM, Singer SD, Villani SM, et al. Characterization of the cytochrome b(cyt b)gene from Monilinia species causing brown rot of stone and pome fruit and its significance in the development of QoI resistance[J]. Pest Manage Sci, 2011, 67(4): 385-396. DOI:10.1002/ps.v67.4 |
| [19] |
Ma Z, Luo Y, Michailides TJ. Nested PCR assays for detection of Monilinia fructicola in stone fruit orchards and Botryosphaeria dothidea from pistachios in California[J]. J Phytopathol, 2003, 151(6): 312-322. DOI:10.1046/j.1439-0434.2003.00725.x |
| [20] |
Côté MJ, Tardif MC, Meldrum AJ. Identification of Monilinia fructigena, M. fructicola, M. laxa, and Monilia polystroma on inoculated and naturally infected fruit using multiplex PCR[J]. Plant Dis, 2004, 88(11): 1219-1225. DOI:10.1094/PDIS.2004.88.11.1219 |
| [21] |
Hu MJ, et al. Monilinia species causing brown rot of peach in China[J]. PLoS One, 2011, 6(9): e24990. DOI:10.1371/journal.pone.0024990 |
| [22] |
Luo Y, Ma Z, Reyes HC, et al. Quantification of airborne spores of Monilinia fructicola in stone fruit orchards of California using real-time PCR[J]. Eur J Plant Pathol, 2007, 118(2): 145-154. DOI:10.1007/s10658-007-9124-x |
| [23] |
程颖慧, 王颖, 章桂明, 等. 应用TaqMan MGB探针检测美澳型核果褐腐病菌[J]. 广东农业科学, 2009(7): 196-198. DOI:10.3969/j.issn.1004-874X.2009.07.066 |
| [24] |
van Brouwershaven IR, et al. A real-time(TaqMan)PCR assay to differentiate Monilinia fructicola from other brown rot fungi of fruit crops[J]. Plant Pathol, 2010, 59(3): 548-555. |
| [25] |
Guinet C, et al. One-step detection of Monilinia fructicola, M. fructigena, and M. laxa on Prunus and Malus by a multiplex real-time PCR assay[J]. Plant Dis, 2016, 12: 2465-2474. |
| [26] |
Garcia-Benitez C, Melgarejo P, de Cal A. Detection of latent Monilinia infections in nectarine flowers and fruit by qPCR[J]. Plant Dis, 2017, 101(6): 1002-1008. DOI:10.1094/PDIS-11-16-1682-RE |
| [27] |
Papavasileiou A, Madesis PB, Karaoglanidis GS. Identification and differentiation of Monilinia species causing brown rot of pome and stone fruit using High-Resolution Melting(HRM)analysis[J]. Phytopathology, 2016, 106(9): 1055-1064. DOI:10.1094/PHYTO-01-16-0016-R |
| [28] |
Vilanova L, Usall J, Teixidó N, et al. Assessment of viable conidia of Monilinia fructicola in flower and stone fruit combining propidium monoazide(PMA)and qPCR[J]. Plant Pathol, 2017, 66(8): 1276-1287. DOI:10.1111/ppa.2017.66.issue-8 |
| [29] |
EP PO. EPPO Standard PM 7/18(2)Diagnostic protocols for regulated pests Monilinia fructicola[J]. EPPO Bulletin, 2009, 39: 337-343. DOI:10.1111/epp.2009.39.issue-3 |
| [30] |
Riccioni L, Valente MT. Comparison of different PCR tests to iden-tify Monilinia fructicola[J]. EPPO Bulletin, 2015, 1: 33-40. |
| [31] |
Ondejková N, Hudecová M, Bacigálová K. First report on Monilinia fructicola in the Slovak Republic[J]. Plant Protection Science, 2010, 46(4): 181-184. DOI:10.17221/PPS |