右旋糖酐是一种聚D-葡萄糖,在自然界中由微生物产生,是一种胞外多糖。右旋糖酐中葡萄糖残基以α-1,6糖苷键连接成主链,α-1,2-、α-1,3-和α-1,4-糖苷键连接成支链,不同微生物产生的右旋糖酐结构上有差异[1]。但分子量一般较大,黏度较高[2]。右旋糖酐与多种生命现象有关。例如,细菌黏附于物体表面时会分泌出多种物质将自身包绕,形成大量细菌聚集膜样物[3]。这种膜样物称为生物被膜,是细菌为适应自然环境以利于生存的生命现象,而某些细菌生物被膜中含有右旋糖酐,这有助于细菌的聚集和黏附[4]。此外,右旋糖酐及其改性物或复合物已被广泛研究,研究方向包括用于糖肽或多糖富集的材料[5]、抗菌生物医学材料[6]、抗氧化剂[7]等。
右旋糖酐酶(EC 3.2.1.11)是一类可以水解右旋糖酐内α-1,6糖苷键的酶。酶解使右旋糖酐分子量降低,导致性质改变。可产生右旋糖酐酶的菌种种类繁多、分布广泛,一直有新的性能优良的右旋糖酐酶被发现。在国外,右旋糖酐酶早已开发成用于制糖行业的商品化酶制剂。随着各种新理论的提出,有关右旋糖酐酶应用机理的研究仍有持续报道。特定分子量的右旋糖酐及其复合物已被用作血浆代用品或抗贫血药在临床使用多年,近年来更发现其在食品、材料等领域有着重要用途,利用右旋糖酐酶生产特定分子量右旋糖酐很可能是今后的发展趋势。右旋糖酐酶还作为一种工具,协助探索各种生物学现象。随着相关研究及糖生物学的发展,对右旋糖酐酶的深入研究具有重要意义。与此前的综述不同,本文将结合本团队的研究成果,对右旋糖酐酶开发的全过程与各领域应用的最新研究成果进行综述,并讨论开发和应用阶段所遇到的问题,旨在以问题为导向,讨论有关右旋糖酐酶的研发方向。
1 右旋糖酐酶开发研究右旋糖酐酶制剂在国外早已产业化和商品化,但在国内鲜见,主要原因是国外制糖业深受葡聚糖问题困扰,该酶制剂能较好解决这一问题。而国内制糖业对葡聚糖问题的认识程度普遍不深,或未能对葡聚糖问题产生足够的重视,所以国内的右旋糖酐酶制剂开发动力不足,开发水平不高。随着国内制糖业对葡聚糖问题认识的加深,右旋糖酐及其水解产物用量的增大,以及右旋糖酐酶在医药领域深层次应用的发展,高效、安全的右旋糖酐酶制剂需求量会越来越大,相应的开发研究亦随之增加。
1.1 基因工程菌构建、生产菌株筛选和诱变育种为得到性能优良、能高效表达产物的工业生产菌株,基因工程菌构建、生产菌筛选及育种等均是有效可行的技术,右旋糖酐酶生产菌的获得自然也离不开上述方法。本团队通过基因工程方法,将朱黄青霉(Penicillium minioluteum)的右旋糖酐酶基因利用毕赤酵母(Pichia pastoris)进行表达[8];在进一步工作中,构建出组成型表达载体(图 1),实现了右旋糖酐酶在毕赤酵母中的组成型表达,使发酵过程无需使用甲醇进行诱导,提高了生产和使用安全性[9];根据毕赤酵母的密码子偏爱对酶基因进行优化与合成,使发酵液酶活进一步提高[10]。
近年来,越来越多右旋糖酐酶产生菌和酶被发现,其中不乏性能优异的右旋糖酐酶(表 1)。相当一部分右旋糖酐酶产生菌是霉菌,但霉菌菌株普遍存在产酶活性低的缺点。右旋糖酐酶常用于食品及药物行业,除了部分霉菌已经通过食药认证,绝大部分霉菌发酵酶液因可能含有抗生素或有害代谢物而存在安全隐患。所以,已经有可观的人力物力在寻找细菌替代霉菌生产右旋糖酐酶。有研究人员把目光转向了海洋细菌,并认为由这些细菌生产的酶制剂具有更高的安全性、更低的最适反应温度,以及更有实际意义的酶活水平[11-14]。有研究显示,由于缺乏相关水解酶,右旋糖酐在小肠中一般不被消化降解;但在大肠中,由于乳酸菌(Lactohacillus sp.)和双歧杆菌(Bifidobacterium sp.)等益生菌的存在而容易被消化[20-21]。而其水解产物——低聚右旋糖酐或低聚异麦芽糖则有促进益生菌生长和增殖的作用[22]。有研究人员在人类粪便分离出多种右旋糖酐酶产生菌[19],这些微生物及所产生的酶可能更适应人体肠道环境,为右旋糖酐酶在人体应用提供一定指导。
发酵生产是得到高活性酶制剂的重要一环。本团队构建了多株产右旋糖酐酶的工程菌,同时对其发酵工艺进行了深入研究。对于甲醇诱导的菌株,先在摇瓶阶段进行多因素发酵工艺优化[23],再放大到5 L发酵罐进行甲醇流加优化[24]。对于组成型表达工程菌,先在6.8 L发酵罐进行多因素的发酵工艺优化[25-26],再逐级放大到5 t发酵罐发酵,完成了规模化的生产试验[27]。
此外,曹研研等[28]优化了棘孢青霉菌(Penicillium aculeatum)F1001产右旋糖酐酶的发酵条件,使酶活力提高了88%。对于个别特殊的微生物,还可以辅以其他手段优化发酵。例如,细丽毛壳(Chaetomium gracile)在发酵过程中会出现菌体絮凝的现象,若辅以一定强度的低频超声作用,可以令絮凝现象显著缓解,提高生理活性和产酶效率[29]。以上研究均只在小规模发酵体系中进行,并未在大规模发酵中进一步研究。
1.3 酶的纯化、稳定性和固定化研究在不同的使用场景下,对右旋糖酐酶的纯度要求是不一样的。本团队在右旋糖酐酶的纯化方面亦做了大量工作,为大规模纯化打下基础。其中,双水相体系纯化法和离子交换色谱法所用仪器简易,所用试剂常见、无毒,整个实验易于放大,并取得了良好的效果[30-31]。
酶的稳定性表征一般包括热稳定性和pH稳定性,提高稳定性的常用方法是添加保护剂。本团队所研究的右旋糖酐酶可用较高浓度的葡萄糖、蔗糖或甘油作保护剂[8, 32]。有研究表明,一定比例的甘油、乙酸钠和柠檬酸钠混合水溶液是良好的右旋糖酐酶稳定剂,同时加以少量对羟基苯甲酸复方醋酸钠、异抗坏血酸钠和山梨酸钾作为防腐剂,可大大延长酶的保存时间[33]。由于该酶制剂会在食品和医药行业中应用,所以后续研究中需关注各种添加剂是否会影响产品的质量。
为了使酶稳定、持久地发挥作用,固定化是一种有效的技术。Bertrand等[34]构建的固定化酶反应器可连续运作90 h和稳定储存78 d;Shahid等[35]将右旋糖酐酶固定化在壳聚糖水凝胶微球上,热稳定性显著提高,连续循环使用14个周期酶活还有42%。固定化右旋糖酐酶常用于制备低分子量右旋糖酐或低聚异麦芽糖,酶活不稳定很可能造成生产不稳定,所以如何进一步提高右旋糖酐酶的稳定性值得继续深入研究。
1.4 酶活性增强研究通过添加金属离子可提高酶活,但不同的酶对于不同浓度金属离子可能有不同的效果。例如,有研究在反应体系中添加10 mmol/L Co2+可令该种右旋糖酐酶酶活提高96%[11],但在另一个研究中,添加2 mmol/L Co2+却令另一来源的酶酶活下降至原来的62%[8]。有研究显示,联合运用超声和高静水压可提高酶活,并发现该条件下的酶分子构象变化,包括分子表面色氨酸残基增多,α-螺旋增加,无规卷曲减少[36]。类似地,联合运用超声和微波辐射亦可提高酶活,原因是酶分子的二级结构重构,该方法可在包括食品加工等工业应用中提高右旋糖酐酶的活性[37]。
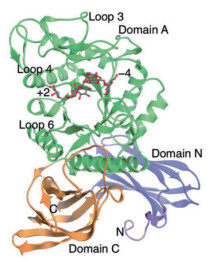
1.5 酶的其他基础研究酶的其他基础研究包括酶的结构、催化活性中心、作用模式、动力学和热力学数据等,这些信息对理解酶的行为模式和改进酶的性能有着极其重要的作用,是当前急需进行的研究。利用超高效液相色谱-四极杆飞行时间质谱联用,可高效、灵敏、直观地分析整个酶解过程[38];Suzuki等[39]对一种耐高温右旋糖酐酶进行了结构分析(图 2),认为环状结构的缺失、盐桥和表面暴露的残留电荷这几个结构特征可能有助于提高热稳定性。Okazawa等[40]则详细分析球形节杆菌(Arthrobacter globiformils)T6分泌的右旋糖酐酶结构及进化关系,为酶的工程改造奠定了基础。Bhatia等[41]对淡紫色拟青霉(Paecilomyces lilacinus)分泌的两种右旋糖酐酶进行研究,推测参与催化的基团可能是天冬氨酸残基或谷氨酸残基的羧基或组氨酸残基的咪唑基;在其他研究中,利用亲和标记试剂改性后,分析其失活动力学,得到了类似的结论[42]。
2 右旋糖酐酶应用研究 2.1 应用于抑制口腔微生物生物被膜的研究早在1969年,Gibbons和Fitzgerald[43]就指出变异链球菌(Streptococcus mutans)产生的右旋糖酐诱导变异链球菌的聚集和牙菌斑的形成。到了1971年,已有用含右旋糖酐酶的漱口水来处理牙菌斑的研究报道[44]。随着生物被膜的深入研究,Flemming和Wingernder详细阐述了生物被膜基质组成和结构,了解到多糖是胞外聚合物的主要成分之一[3]。可见,右旋糖酐在口腔问题中扮演着重要角色。
近年来,口腔医学领域的研究人员利用生物被膜理论研究和解释右旋糖酐酶的作用[11, 14, 45-46],在动物试验[13]中直接利用该酶抑制牙菌斑的形成,在人体试验[47]中利用微生物定植腔产酶方式抑制龋齿形成。Qiu等[48]在体外建立了含有变异链球菌、嗜酸乳杆菌(Lactobacillus acidophilus)和黏放线菌(Actinomyces viscosus)的生物被膜系统,通过分别和同时添加右旋糖酐酶和氟化钠,考察处理后的生物量、内生多糖量和菌体生存量,并用共聚焦激光扫描显微镜观察生物被膜形态,结论是联合利用右旋糖酐酶和氟化钠能有效地破坏了变异链球菌生物被膜,作用机制可能是右旋糖酐酶水解了右旋糖酐,破坏了生物被膜的结构,促进氟化钠渗透,从而提高抗菌效果。Senpuku等[49]证明了当右旋糖酐酶存在时,变异链球菌无法聚集。除了传统地用单一的酶来处理生物被膜,也有采用特殊的嵌合酶来处理的。Otsuka等[50]将来自Paenibacillus humicus NA1123的非水溶性葡聚糖酶(可以水解多糖中的α-1,3糖苷键)基因和变异链球菌ATCC 25175的右旋糖酐酶基因接入到载体中,在大肠杆菌(Escherichia coli)BL21(DE3)中表达并部分纯化,得到一个具有两种功能的嵌合酶,考察处理后的不溶性葡聚糖量、还原糖量,发现该嵌合酶能显著降低不溶性葡聚糖量,其破坏生物被膜的效率比两种酶的混合物高4.1倍。
虽然右旋糖酐酶对于口腔健康有着明确的积极作用,但含右旋糖酐酶的口腔清洁用品的占比仍不高。究其原因,机械力才是清洁牙齿的主要力量,酶作用只是一个辅助手段;其次,成本和公众接受程度也是商家考虑的因素。有趣的是,现在国内市场会把添加右旋糖酐酶作为商品的卖点来提升商品档次,这种商品一般售价更高。
2.2 应用于制糖生产过程研究在制糖生产过程,多个环节都适合微生物滋长。肠膜明串珠菌(Leuconoseol mesenteroides)这种常见的微生物会在制糖过程通过发酵蔗糖产生高分子量右旋糖酐,令其掺杂在所有在制品和产品中,对制糖生产造成多种不利影响[51]。而清除右旋糖酐最有效的方法就是添加右旋糖酐酶。本团队在该方面做了大量的工作。2009/2010年榨季,在广东某糖厂进行模拟生产工艺试验,发现使用右旋糖酐酶后蔗汁澄清的各指标都得到明显改善[8]。2013/14年和2014/15年榨季,本团队在广西农垦的多家糖厂(包括甘蔗糖厂和原糖精炼糖厂)中使用右旋糖酐酶,添加方式为在压榨工段或溶糖箱流加右旋糖酐酶液,均有效地清除了右旋糖酐,并可减少硫熏强度。部分糖厂的右旋糖酐去除率达98%以上,清混汁纯度差达2AP以上,废蜜重力纯度下降0.38,煮炼回收率提高1个百分点以上,混合产糖率提高0.35个百分点[52-53]。在原糖精炼糖厂中显示出了更为明显的效果,在包括过滤效果、糖浆处理量和物料纯度等方面均有一定程度的改善[54]。
在副产物的进一步利用过程中,右旋糖酐酶亦发挥了一定作用。在发酵甘蔗糖蜜生产乙醇过程中添加右旋糖酐酶等酶,能使糖蜜中难以发酵的糖类转化成易于发酵的糖类,从而提高乙醇产率[55]。
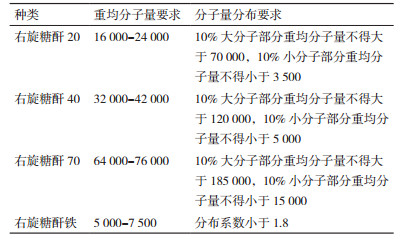
2.3 应用于右旋糖酐分子量可控发酵技术右旋糖酐及其衍生物是常用的药物。中国药典2015年版二部中收载了4种相关药品,其中3种右旋糖酐作为血浆代用品,还有一种右旋糖酐与氢氧化铁的络合物——右旋糖酐铁作为一种抗贫血药[56];在日本药典JP17中,收载了用于降血脂的硫酸葡聚糖钠[57];英国药典BP2017和欧洲药典EP9.5都收载了结痂剂聚糖酐(Dextranomer)[58-59]。不同的右旋糖酐相关药物,其分子量要求是不一样的。以中国药典为例,其收载的4种右旋糖酐相关药物中,其分子量与分子量分布要求如表 2所示。
右旋糖酐的衍生物除了可作为药物外,还可以作为物质分离纯化的工具,例如蓝色葡聚糖、二乙氨乙基葡聚糖等,该类物质的分子量对其分离效果有一定影响。所以,控制右旋糖酐的分子量是制备右旋糖酐类药物和衍生物的重要环节,而右旋糖酐酶恰恰可以达到灵活控制其分子量的效果。本团队创新性地提出并成功开发右旋糖酐分子量可控发酵工艺技术,不仅能提高蔗糖转化效率,更能在结束发酵时,使右旋糖酐分子量落在期望范围[60]。这将免去后续酸解工艺,直接省去大量酸碱的使用,节约因酸解工艺所需高温的能耗,达到优化生产流程,节能减排的目的。
2.4 应用于制备低聚异麦芽糖和低聚右旋糖酐益生元是指能选择性地刺激一种或少数种菌落中细菌的生长与活性,而对寄主产生有益的影响,改善寄主健康的不可被消化的食品成分[61]。低聚异麦芽糖可将右旋糖酐水解制得,已有大量文献报道其益生元作用,从动物试验[62-63]到人体试验[64-65],证实了其具有提高免疫力、改变肠道微生物组成、改善排便和肠道功能等功效。
大量的低聚异麦芽糖需求,促进了右旋糖酐酶的应用研究。Gan等[66]利用右旋糖酐蔗糖酶和右旋糖酐酶协同催化蔗糖产生低聚右旋糖酐,Bertrand等[34]和Chalane等[67]利用环氧树脂固定化右旋糖酐酶,制备出能连续生产分子量可控的低聚异麦芽糖的固定化酶反应器,并具有酶活稳定性高等特点。利用右旋糖酐T-40作为原料,制备出的低聚异麦芽糖的益生元活性与商品化商品无异[34, 67]。由于该方法需要用右旋糖酐作为原料,成本可能会较高。若联合右旋糖酐蔗糖酶使用,在催化蔗糖合成右旋糖酐的同时,用右旋糖酐酶控制分子量,则可以利用蔗糖一步合成低聚异麦芽糖。而Tingirikari等[68]更是将右旋糖酐蔗糖酶和右旋糖酐酶用藻酸盐微球共固定化,然后用于催化橙汁中的蔗糖转化为低聚异麦芽糖,将橙汁制备成功能性健康饮料。
由于不同的微生物或酶在不同条件下所产生的右旋糖酐结构都有一定差异,而不同的右旋糖酐酶酶解后的水解产物的结构和比例亦有所差异,这些差异对益生元活性有何影响,是低聚异麦芽糖的进一步研究方向。
2.5 应用于右旋糖酐基质材料的降解和承载物释放右旋糖酐材料的应用是近期右旋糖酐相关的研究热点。以右旋糖酐为基质可以以纳米颗粒、水凝胶等形式与氨基酸、蛋白质等物质结合,在生物医学医药领域有巨大的应用潜力[69-71]。在部分应用中,通过右旋糖酐酶对右旋糖酐材料进行降解,可达到释放承载物等作用,达到某种预设的目的。Widenbring等[72]研究了右旋糖酐酶对负载着伴刀豆球蛋白A的右旋糖酐微凝胶载体的降解规律,为其在生物医学中的应用提供参考依据。由于消化道上游不存在分泌右旋糖酐酶的微生物,而结肠中却存在,所以利用右旋糖酐作为基质的微球或复合物可携带药物定点输送至结肠,有望用于治疗结肠癌或阿米巴肠病[73-75]等疾病。
2.6 用作研究过程的辅助手段由于不同来源的右旋糖酐的分子量不定,分子量分布可能较宽,若右旋糖酐作为杂质存在于体系中,则对其他物质的分析或纯化造成不利影响。比如要纯化右旋糖酐蔗糖酶时,常伴有大量右旋糖酐存在,而目标酶的分子量亦很可能在右旋糖酐的分子量分布内。此时,右旋糖酐酶就可以发挥它的作用,将右旋糖酐降解为小分子,再用膜技术就可以去除右旋糖酐,提纯右旋糖酐蔗糖酶[76]。在研究多糖时也遇到类似问题:Matsuzaki等[77]发现了肠膜明串珠菌NTM048f分泌的胞外多糖可以作为一种免疫刺激剂来提高黏膜IgA的量,这种胞外多糖的主要成分是右旋糖酐,当使用右旋糖酐酶将右旋糖酐水解后,发现了残余物中存在另外两种果聚糖。如果不使用酶的话,果聚糖的存在将难以发现。右旋糖酐酶对某些结构中的葡萄糖残基间的α-1,6糖苷键有特异性水解作用,所以亦被用于其他多糖的结构辅助分析手段,推测多糖中α-1,6糖苷键的比例[78]或用于寻找结构特殊的多糖[79-80]。
3 总结与展望右旋糖酐酶的研究已超过百年,但一直没有停止。新的右旋糖酐酶不断被发现和开发,探索的范围已从陆地微生物向海洋微生物发展。无论从生物化学和生物物理的基础理论研究角度,还是从右旋糖酐酶的新型应用开发研究角度,关键问题在于右旋糖酐酶催化性能的广泛发掘和催化机理的深入探究。分子生物学的发展令其研究延伸至基因层面。随着人们对酶的三级结构了解的深入,酶的理性设计技术(如定点突变和结构域重组)将越来越普遍。加上计算化学的发展,计算机计算能力的提高,计算机算法的进步,将大大提高酶的改造效率,甚至使酶的从头设计成为可能。更高的酶活、更宽的反应温度和pH、更强的稳定性,这些都是可预期的。但由于应用范围所限,开发动力不足,右旋糖酐酶基础研究力度还不大,导致高性能的酶制剂还是难以开发。右旋糖酐的结构复杂多变,随着对右旋糖酐质量要求的提高,很可能需要一种更精确地控制右旋糖酐的分子量和支链情况的技术,而利用右旋糖酐酶可能是一种很好的选择。右旋糖酐酶的开发、应用,与右旋糖酐的研究这三者之间紧密相连,相互促进,相互制约。
| [1] |
Naessens M, Cerdobbel A, Soetaert W, et al. Leuconostoc dextransu-crase and dextran:production, properties and applications[J]. J Chem Technol Biotechnol, 2005, 80(8): 845-860. DOI:10.1002/(ISSN)1097-4660 |
| [2] |
Wales M, Marshall PA, Weissberg SG. Intrinsic viscosity-molecular weight relationships for dextran[J]. Journal of Polymer Science, 1953, 10(2): 229-240. DOI:10.1002/pol.1953.120100211 |
| [3] |
Flemming HC, Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633. DOI:10.1038/nrmicro2415 |
| [4] |
Li W, Liu H, Xu Q. Extracellular dextran and DNA affect the formation of Enterococcus faecalis biofilms and their susceptibility to 2% chlorhexidine[J]. J Endod, 2012, 38(7): 894-898. DOI:10.1016/j.joen.2012.04.007 |
| [5] |
Chen L, Ding D, et al. Selective enrichment of N-linked glycopept-ides and glycans by using a dextran-modified hydrophilic material[J]. Journal of Separation Science, 2018, 41(9): 2003-2011. DOI:10.1002/jssc.v41.9 |
| [6] |
Wang L, Li X, Sun T, et al. Dual-functional dextran-PEG hydrogel as an antimicrobial biomedical material[J]. Macromolecular Bioscience, 2018, 18(2): 1700325. DOI:10.1002/mabi.v18.2 |
| [7] |
Oliver S, Yee E, Kavallaris M, et al. Water soluble antioxidant dext-ran-quercetin conjugate with potential anticancer properties[J]. Macromolecular Bioscience, 2018, 1700239. |
| [8] |
梁达奉. α-葡聚糖酶的基因工程菌构建、发酵及其应用研究[D]. 广州: 广东工业大学, 2011.
|
| [9] |
梁达奉, 黄曾慰, 曾练强, 等. α-葡聚糖酶在毕赤酵母中的组成型表达[J]. 华南理工大学学报: 自然科学版, 2012, 40(5): 96-100. |
| [10] |
黄曾慰, 梁达奉, 曾练强, 等. 朱黄青霉α-葡聚糖酶在毕赤酵母中的高效表达[J]. 广西科学, 2014(6): 614-618. DOI:10.3969/j.issn.1005-9164.2014.06.010 |
| [11] |
Wang D, Lu M, Wang S, et al. Purification and characterization of a novel marine Arthrobacter oxydans KQ11 dextranase[J]. Carbohydrate Polymers, 2014, 106(1): 71-76. |
| [12] |
Wang X, Lu M, Wang S, et al. The atmospheric and room-temperature plasma(ARTP)method on the dextranase activity and structure[J]. International Journal of Biological Macromolecules, 2014, 70(8): 284-291. |
| [13] |
Jiao YL, Wang SJ, Lv MS, et al. Characterization of a marine-derived dextranase and its application to the prevention of dental caries[J]. J Ind Microbiol Biotechnol, 2014, 41(1): 17-26. |
| [14] |
Cai R, Lu M, Fang Y, et al. Screening, production, and characterization of dextranase from Catenovulum sp[J]. Annals of Microbiology, 2014, 64(1): 147-155. DOI:10.1007/s13213-013-0644-7 |
| [15] |
Kiran T, Asad W, et al. Industrially important hydrolytic enzyme diversity explored in stove ash bacterial isolates[J]. Pakistan Journal of Pharmaceutical Sciences, 2015, 28(6): 2035-2040. |
| [16] |
Zohra RR, Aman A, Ansari A, et al. Purification, characterization and end product analysis of dextran degrading endodextranase from Bacillus licheniformis KIBGE-IB25[J]. International Journal of Biological Macromolecules, 2015, 78: 243-248. DOI:10.1016/j.ijbiomac.2015.04.007 |
| [17] |
Zhang YQ, Li RH, Zhang HB, et al. Purification, characterization, and application of a thermostable dextranase from Talaromyces pin-ophilus[J]. J Ind Microbiol Biotechnol, 2017, 44(2): 317-327. DOI:10.1007/s10295-016-1886-8 |
| [18] |
Picozzi C, Meissner D, Chierici M, et al. Phage-mediated transfer of a dextranase gene in Lactobacillus sanfranciscensis and characterization of the enzyme[J]. International Journal of Food Microbiology, 2015, 202: 48-53. DOI:10.1016/j.ijfoodmicro.2015.02.018 |
| [19] |
Kim JK, Shin SY, Moon JS, et al. Isolation of dextran-hydrolyzing intestinal bacteria and characterization of their dextranolytic activities[J]. Biopolymers, 2015, 103(6): 321-327. DOI:10.1002/bip.v103.6 |
| [20] |
Sarbini SR, Kolida S, Naeye T, et al. In vitro fermentation of linear and α-1, 2-branched dextrans by the human fecal microbiota[J]. Appl Environ Microbiol, 2011, 77(15): 5307-5315. DOI:10.1128/AEM.02568-10 |
| [21] |
Olano-Martin E, Mountzouris KC, Gibson GR, et al. In vitro fermentability of dextran, oligodextran and maltodextrin by human gut bacteria[J]. Br J Nutr, 2000, 83(3): 247-255. DOI:10.1017/S0007114500000325 |
| [22] |
Goffin D, Delzenne N, Blecker C, et al. Will isomalto-oligosaccharides, a well-established functional food in Asia, break through the european and American market?The status of knowledge on these prebiotics[J]. Critical Reviews in Food Science & Nutrition, 2011, 51(5): 394-409. |
| [23] |
吴兆鹏, 梁达奉, 曾练强, 等. 毕赤酵母产α-葡聚糖酶发酵工艺研究[J]. 粮油食品科技, 2010, 18(2): 29-31. DOI:10.3969/j.issn.1007-7561.2010.02.011 |
| [24] |
梁达奉, 吴兆鹏, 曾练强, 等. 重组毕赤酵母产α-葡聚糖酶甲醇流加控制的研究[J]. 甘蔗糖业, 2011(5): 21-27. DOI:10.3969/j.issn.1005-9695.2011.05.005 |
| [25] |
吴兆鹏, 曾练强, 黄曾慰, 等. 重组毕赤酵母发酵甘油制备α-葡聚糖酶的研究[J]. 广西科学, 2014(6): 624-628. DOI:10.3969/j.issn.1005-9164.2014.06.012 |
| [26] |
吴兆鹏, 梁达奉, 黄曾慰, 等. 葡萄糖对组成型毕赤酵母发酵产α-葡聚糖酶的影响[J]. 广西糖业, 2015(6): 16-21. DOI:10.3969/j.issn.1007-4732.2015.06.004 |
| [27] |
黄曾慰, 吴兆鹏, 常国炜, 等. 重组毕赤酵母发酵生产α-葡聚糖酶的放大研究[J]. 甘蔗糖业, 2016(2): 20-26. DOI:10.3969/j.issn.1005-9695.2016.02.005 |
| [28] |
曹研研, 张洪斌, 李若菡, 等. 棘孢青霉菌发酵产右旋糖酐酶的条件优化[J]. 食品科学, 2015, 36(23): 215-220. DOI:10.7506/spkx1002-6630-201523040 |
| [29] |
张泽栋, 刘继栋, 陆海勤, 等. 低频超声场促进细丽毛壳菌发酵生产α葡聚糖酶的研究[J]. 食品工业科技, 2015, 36(5): 161-165. |
| [30] |
黎志德, 常国炜, 黄曾慰, 等. 大孔型离子交换树脂分离纯化右旋糖酐酶[J]. 甘蔗糖业, 2015(4): 58-64. DOI:10.3969/j.issn.1005-9695.2015.04.012 |
| [31] |
黎志德, 蚁细苗, 黄思鸿, 等. 聚乙二醇-硫酸铵双水相体系萃取α-葡聚糖酶[J]. 甘蔗糖业, 2013(1): 38-42. DOI:10.3969/j.issn.1005-9695.2013.01.009 |
| [32] |
黎志德, 曾练强, 蚁细苗, 等. 右旋糖酐酶的保存稳定性研究[J]. 广西蔗糖, 2013(4): 31-34. DOI:10.3969/j.issn.1007-4732.2013.04.007 |
| [33] |
Wang D, Lu M, Wang X, et al. Improving stability of a novel dextran-degrading enzyme from marine Arthrobacter oxydans KQ11[J]. Carbohydrate Polymers, 2014, 103(1): 294-299. |
| [34] |
Bertrand E, Pierre G, Delattre C, et al. Dextranase immobilization on epoxy CIM(®)disk for the production of isomaltooligosaccharides from dextran[J]. Carbohydrate Polymers, 2014, 111(111): 707-713. |
| [35] |
Shahid F, Aman A, Nawaz MA, et al. Chitosan hydrogel microspheres: an effective covalent matrix for crosslinking of soluble dextranase to increase stability and recycling efficiency[J]. Bioprocess Biosyst Eng, 2017, 40(3): 451-461. DOI:10.1007/s00449-016-1713-7 |
| [36] |
Bashari M, Abdelhai MH, Abbas S, et al. Effect of ultrasound and high hydrostatic pressure(US/HHP)on the degradation of dextran catalyzed by dextranase[J]. Ultrasonics Sonochemistry, 2014, 21(1): 76-83. DOI:10.1016/j.ultsonch.2013.04.014 |
| [37] |
Bashari M, Jin Z, Wang J, et al. A novel technique to improve the biodegradation efficiency of dextranase enzyme using the synergistic effects of ultrasound combined with microwave shock[J]. Inno Food Sci Emerg, 2016, 35: 125-132. DOI:10.1016/j.ifset.2016.04.007 |
| [38] |
Yi L, Sun X, Du K, et al. UP-HILIC-MS/MS to Determine the action pattern of Penicillium sp. dextranase[J]. Journal of the American Society for Mass Spectrometry, 2015, 26(7): 1174-1185. DOI:10.1007/s13361-015-1117-y |
| [39] |
Suzuki N, Kishine N, Fujimoto Z, et al. Crystal structure of thermo-philic dextranase fromThermoanaerobacter pseudethanolicus[J]. J Biochem, 2015, 159(3): 331-339. |
| [40] |
Okazawa Y, Miyazaki T, Yokoi G, et al. Crystal structure and mutational analysis of isomalto-dextranase, a member of glycoside hydrolase family 27[J]. Journal of Biological Chemistry, 2015, 290(43): 26339-26349. DOI:10.1074/jbc.M115.680942 |
| [41] |
Bhatia S, Bhakri G, Arora M, et al. Kinetic and thermodynamic properties of partially purified dextranase from Paecilomyces lilacinus and its application in dextran removal from cane juice[J]. Sugar Tech, 2016, 18(2): 1-10. |
| [42] |
Ko JA, Nam SH, Kim D, et al. Identification of catalytic amino acid residues by chemical modification in dextranase[J]. J Microbiol Biotechnol, 2016, 26(5): 837-845. DOI:10.4014/jmb.1601.01014 |
| [43] |
Gibbons RJ, Fitzgerald RJ. Dextran-induced agglutination of Strep-tococcus mutans, and its potential role in the formation of microbial dental plaques[J]. J Bacteriol, 1969, 98(2): 341-346. |
| [44] |
Caldwell RC, Sandham HJ, Jr WVM, et al. 1. The effect of a dextranase mouthwash on dental plaque in young adults and children[J]. J Am Dent Assoc, 1971, 82(1): 124-131. DOI:10.14219/jada.archive.1971.0023 |
| [45] |
Wang X, Cheng H, Lu M, et al. Dextranase from Arthrobacter oxydans KQ11-1 inhibits biofilm formation by polysaccharide hydrolysis[J]. Biofouling, 2016, 32(10): 1223-1233. DOI:10.1080/08927014.2016.1239722 |
| [46] |
Yang YM, Jiang D, Qiu YX, et al. Effects of combined exogenous dextranase and sodium fluoride on Streptococcus mutans 25175 monospecies biofilms[J]. Am J Dent, 2013, 26(5): 239-243. |
| [47] |
Pierro FD, Zanvit A, Nobili P, et al. Cariogram outcome after 90 days of oral treatment with Streptococcus salivarius M18 in children at high risk for dental caries: results of a randomized, controlled study[J]. Clin Cosm Invest Dent, 2015, 7(7): 107-113. |
| [48] |
Qiu YX, Mao MY, Jiang D, et al. Co-operative effect of exogenous dextranase and sodium fluoride on multispecies biofilms[J]. Journal of Dental Sciences, 2016, 11(1): 41-47. DOI:10.1016/j.jds.2015.08.001 |
| [49] |
Senpuku H, Yonezawa H, Yoneda S, et al. SMU. 940 regulates dextran-dependent aggregation and biofilm formation in Streptococ-cus mutans[J]. Mol Oral Microbiol, 2017, 33(1): 47-58. |
| [50] |
Otsuka R, et al. Application of chimeric glucanase comprising mutanase and dextranase for prevention of dental biofilm formation[J]. Microbiol Immunol, 2015, 59(1): 28-36. |
| [51] |
梁达奉, 曾练强, 郭亭, 等. 葡聚糖对制糖工业的影响及对策(上)[J]. 甘蔗糖业, 2008(3): 28-33. DOI:10.3969/j.issn.1005-9695.2008.03.006 |
| [52] |
钟志才, 马步, 徐杰荣, 等. 葡聚糖酶应用于甘蔗制糖过程的试验研究[J]. 甘蔗糖业, 2014(3): 41-46. DOI:10.3969/j.issn.1005-9695.2014.03.009 |
| [53] |
姚满芳, 常国炜, 韦红桥, 等. 葡聚糖酶在甘蔗制糖过程的应用试验研究[J]. 甘蔗糖业, 2015(6): 18-22. DOI:10.3969/j.issn.1005-9695.2015.06.005 |
| [54] |
马步, 常国炜, 蚁细苗, 等. 葡聚糖酶在原糖精炼生产中的应用研究[J]. 广西糖业, 2014(3): 18-21. DOI:10.3969/j.issn.1007-4732.2014.03.005 |
| [55] |
Fadel, Zohri ANA, El-Dean AMK, et al. Enhancing ethanol yield from sugar cane molasses fermentation by addition of depolymerising enzymes[J]. Indian Journal of Applied Research, 2016, 6(8): 291-294. |
| [56] |
国家药典委员会. 中华人民共和国药典[M]. 二部. 北京: 中国医药科技出版社, 2015.
|
| [57] |
Editorial Board of Japanese Pharmaceutical Bureau. The Japanese Pharmacopoeia[M]. 17th ed. Japan: Ministry of Health, Labour and Welfare, 2016.
|
| [58] |
British Pharmacopoeia Commission. British Pharmacopoeia[M]. 2017 ed. England: The Stationery Office, 2017.
|
| [59] |
European Pharmacopoeia Commission. European Pharmacopoeia[M]. 9th ed. France: European Directorate for Quality Medicines, 2018.
|
| [60] |
常国炜, 梁达奉, 张九花, 等. 发酵耦合酶解高效制备右旋糖酐工艺研究[J]. 广西科学, 2014(6): 619-623. DOI:10.3969/j.issn.1005-9164.2014.06.011 |
| [61] |
Gibson GR, Probert HM, Loo JV, et al. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics[J]. Journal of Nutrition, 1995, 125(6): 1401-1412. DOI:10.1093/jn/125.6.1401 |
| [62] |
Li J, Tan B, Mai K. Dietary probiotic Bacillus OJ and isomaltooligosaccharides influence the intestine microbial populations, immune responses and resistance to white spot syndrome virus in shrimp(Litopenaeus vannamei)[J]. Aquaculture, 2009, 291(1-2): 35-40. DOI:10.1016/j.aquaculture.2009.03.005 |
| [63] |
Chung CH, Day DF. Efficacy of Leuconostoc mesenteroides(ATCC 13146)isomaltooligosaccharides as a poultry prebiotic[J]. Poultry Science, 2004, 83(8): 1302-1306. DOI:10.1093/ps/83.8.1302 |
| [64] |
Kaneko T, Kohmoto T, Kikuchi H, et al. Effects of Isomaltooligosaccharides with Different Degrees of Polymerization on Human Fecal Bifidobactcria[J]. Journal of the Agricultural Chemical Society of Japan, 1994, 58(12): 2288-2290. |
| [65] |
Chen HL, Lu YH, Lin JJ, et al. Effects of isomalto-oligosaccharides on bowel functions and indicators of nutritional status in constipated elderly men[J]. J Am Coll Nutr, 2001, 20(1): 44-49. DOI:10.1080/07315724.2001.10719013 |
| [66] |
Gan W, Zhang H, et al. Biosynthesis of oligodextrans with different Mw by synergistic catalysis of dextransucrase and dextranase[J]. Carbohydrate Polymers, 2014, 112(21): 387-395. |
| [67] |
Chalane S, Delattre C, Michaud P, et al. Optimized endodextranase-epoxy CIM® Disk reactor for the continuous production of molecular weight-controlled prebiotic isomalto-oligosaccharides[J]. Process Biochemistry, 2017, 58: 105-113. DOI:10.1016/j.procbio.2017.04.017 |
| [68] |
Tingirikari JMR, Gomes WF, Rodrigues S. efficient production of prebiotic gluco-oligosaccharides in orange juice using immobilized and Co-immobilized dextransucrase[J]. Applied Biochemistry & Biotechnology, 2017, 183(4): 1-17. |
| [69] |
Ferreira MPA, Talman V, Torrieri G, et al. Dual-drug delivery using dextran-functionalized nanoparticles targeting cardiac fibroblasts for cellular reprogramming[J]. Advanced Functional Materials, 2018, 28(15): 1705134. DOI:10.1002/adfm.v28.15 |
| [70] |
Fan Y, Yi J, Zhang Y, et al. Fabrication of curcumin-loaded bovine serum albumin(BSA)-dextran nanoparticles and the cellular antioxidant activity[J]. Food Chemistry, 2018, 239: 1210-1218. DOI:10.1016/j.foodchem.2017.07.075 |
| [71] |
Riahi N, Liberelle B, Henry O, et al. Impact of RGD amount in dextran-based hydrogels for cell delivery[J]. Carbohydrate Polymers, 2017, 161: 219-227. DOI:10.1016/j.carbpol.2017.01.002 |
| [72] |
Widenbring R, Frenning G, Malmsten M. Chain and pore-blocking effects on matrix degradation in protein-loaded microgels[J]. Biomacromolecules, 2014, 15(10): 3671-3678. DOI:10.1021/bm5009525 |
| [73] |
Kim W, Yang Y, Kim D, et al. Conjugation of metronidazole with dextran: a potential pharmaceutical strategy to control colonic distribution of the anti-amebic drug susceptible to metabolism by colonic microbes[J]. Drug Design Development & Therapy, 2017, 11: 419-429. |
| [74] |
Rai G, Yadav AK, Jain NK, et al. Enteric-coated epichlorohydrin crosslinked dextran microspheres for site-specific delivery to colon[J]. Drug Dev Ind Pharm, 2015, 41(12): 2018-2028. DOI:10.3109/03639045.2015.1044901 |
| [75] |
Chu CW, Ryu JH, Jeong YI, et al. Redox-Responsive nanophotosensitizer composed of chlorin e6-conjugated dextran for photodynamic treatment of colon cancer cells[J]. Journal of Nanomaterials, 2016, 2016(20): 1-12. |
| [76] |
Guzman GYF, Hurtado GB, Ospina SA. New dextransucrase purification process of the enzyme produced byLeuconostoc mesenteroides IBUN 91. 2. 98 based on binding product and dextranase hydrolysis[J]. J Biotechnol, 2018, 265: 8-14. DOI:10.1016/j.jbiotec.2017.10.019 |
| [77] |
Matsuzaki C, Takagaki C, Tomabechi Y, et al. Structural characterization of the immunostimulatory exopolysaccharide produced by Leuconostoc mesenteroides strain NTM048[J]. Carbohydr Res, 2017, 448: 95-102. DOI:10.1016/j.carres.2017.06.004 |
| [78] |
Vasileva T, Bivolarski V, Michailova G, et al. Glucansucrases produced by fructophilic lactic acid bacteria Lactobacillus kunkeei H3 and H25 isolated from honeybees[J]. Journal of Basic Microbiology, 2016, 57(1): 68-77. |
| [79] |
Miao M, Bai A, Jiang B, et al. Characterisation of a novel water-soluble polysaccharide from Leuconostoc citreum SK24. 002[J]. Food Hydrocolloids, 2014, 36(5): 265-272. |
| [80] |
Hector S, Willard K, Bauer R, et al. Diverse Exopolysaccharide producing bacteria isolated from milled sugarcane: Implications for cane spoilage and sucrose yield[J]. PLoS One, 2015, 10(12): e0145487. DOI:10.1371/journal.pone.0145487 |