花粉壁是成熟雄性配子体表面的一层致密物质,主要起到保护花粉、抵御外界环境物质入侵及在植物授粉过程中识别雌性配子体等作用。目前,在雄性不育研究中,已克隆了一些与花粉壁发育相关的基因,证实在雄配子形成过程中花粉壁起到重要作用[1]。通过形态学观察雄性不育植株,多数涉及花粉壁的不正常发育。因此,雄性配子体发育过程中花粉壁的研究对不育机理的解析有重要的理论意义。
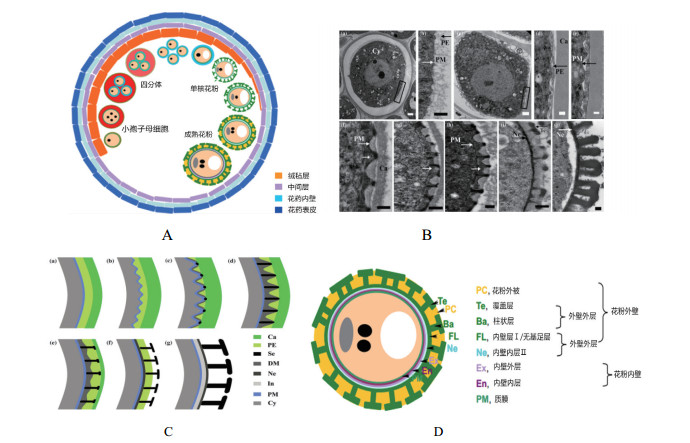
1 花粉壁发育的模式花粉壁主要由花粉外壁和花粉内壁构成,花粉外壁位于最外层,包括含油层或者花粉胞被等结构。花粉外壁又分为外壁外层和外壁内层,外壁外层由网状结构组成,其结构包括覆盖层结构和柱状结构。花粉内壁由内壁外层和内壁内层构成,内壁内层和小孢子质膜紧密接触(图 1-D)。
花粉壁是雄性配子体外层起到保护作用的结构物质,虽然发育过程在不同物种中不尽相同,但有些发育模式非常相似。根据花粉发育过程将其分为12个时期,整个花粉壁的发育模式如图 1所示,在拟南芥的第7时期的早期小孢子呈现为三分体结构,到晚期形成四分体结构。这时质膜开始出现波动,这种结构变化由最开始点状结构转变为波浪形结构。质膜在初生外壁中的顶点接触到最外层的胼胝质后,孢粉素在接触顶点开始累积,形成柱状结构物质的前体,随后胼胝质开始降解,当胼胝质完全降解时小孢子释放,此时初生外壁开始降解,孢粉素继续累积形成柱状结构,空腔结构形成覆盖层。当初生外壁完全降解后,质膜又恢复到起初的状态(图 1-C)。随后由绒毡层降解释放的物质转化成脂肪类物质,填充外壁外层中由柱状结构和覆盖层结构组成的网状结构,即含油层(图 1-A和图 1-B)。到双核花粉时期绒毡层完全降解,此时形成成熟的花粉壁(图 1-C)。
目前,在雄性不育研究中很多涉及花粉壁的发育;获得与雄性不育相关的基因均引起花粉壁的非正常发育。因此,在雄性不育机理解析中,对花粉壁形成过程的研究有着十分重要的作用。
2 初生外壁的发育在一些植物减数分裂后期,已经观察到初生外壁,初生外壁是花粉壁发育起始的信号物质,说明减数分裂后期花粉壁已经开始发育。通过化学染色分析,发现初生外壁由中性/酸性多糖、蛋白质和纤维素组成[4]。当小孢子母细胞发育到第7期时,初生外壁积累到一定程度并在小孢子母细胞的膜上形成点状的突起,电镜下小孢子纵切面显示小孢子母细胞膜上的初生外壁堆积,压迫质膜,使质膜形成波浪状突起,构成花粉壁沉积发育的基础[2]。
初生外壁的缺失会导致花粉壁发育异常从而引起雄性不育,说明初生外壁对于花粉壁的形成是至关重要的。目前发现的与初生外壁形成有关的拟南芥突变体ms1、dex1、nef1、rpg1、npu、efd和arf17都能造成花粉壁缺失。调控初生外壁形成有关的基因包括NPU、RPG1、DEX1、EFD和NEF1等,这些基因主要调控花粉初生外壁的形成。EFD(Exine formation defect)与初生外壁的形成有关[5],突变体efd初生外壁缺失,孢粉素无法沉积,通过关键基因的回补依然不能恢复育性[6]。Hu等[7]证明了EFD主要在初生外壁形成过程中表达,在efd突变体中初生外壁异常降解,花粉外壁缺陷。ARF17(Auxin Response Factor17)是一个生长素的相应因子,Yang等[8]发现在拟南芥中其主要参与初生外壁的形成,突变体arf17中初生外壁缺失,导致花粉壁缺陷和花粉退化,在拟南芥中AFR17通过调控CalS5影响初生外壁的形成,CalS5是与胼胝质合成的相关基因,说明胼胝质和初生外壁的形成之间有直接关联。
花粉发育过程中初生外壁未随质膜形成波浪形结构会导致孢粉素累积异常,影响花粉发育。NPU(No primexine and plasma membrane undulation)编码的膜蛋白具有二次跨膜的结构,在四分体时期的小孢子及绒毡层细胞中检测到其高度表达,该基因参与小孢子质膜波浪形的形成和初生外壁的沉积。Chang等[9]的研究结果显示npu突变体初生外壁完全缺失,质膜未出现波浪形,随后发育过程都受到影响,引起花粉外壁发育异常,最终影响雄配子育性。NEF1(No exine formation 1)基因转运初生外壁所需要的特殊糖类物质[10],在突变体nef1中初生外壁缺陷,质膜没有波浪形起伏同时孢粉素出现异常沉积。RPG1(Ruptured pollen grain-1)作为糖的转运蛋白,与初生外壁的合成有关。相应突变体rpg1中初生外壁合成显著减少,小孢子质膜表面也没有形成波浪形结构,导致孢粉素沉积异常,引起外壁模式缺陷和花粉降解[11]。RPG1和RPG2同属于MtN3/saliva家族,RPG1参与了初生外壁的沉积,rpg2突变体中成熟花粉中花粉外壁的网状结构虽有一些变形,但不影响育性,另外发现rpg1rpg2双突变体表现出更严重的不育性,rpg1突变体可由RPG2恢复育性,表明RPG1和RPG2都参与了花粉外壁的形成,且育性调控方面存在功能重复[12]。DEX1(Defective in exine formation 1)同样作为花粉外壁发育不可缺少的基因,dex1突变体花粉外壁发育异常,初生外壁沉积延缓,DEX1可能通过调节CalS5来参与小孢子的形成[13]。
3 花粉内壁的发育花粉内壁的发育始于花粉外壁形成的后期,通常为小孢子释放后即单核花粉粒时期。一般认为花粉内壁是由纤维素、果胶和内壁蛋白等成分组成[14]。
纤维素是花粉内壁的组成成分,也是小孢子发育成熟的必需物质[15]。纤维素缺失的花粉中内壁形成一个厚度不均匀的结构,会导致花粉内壁发育缺陷,引起花粉壁发育异常。花粉内壁形成过程中纤维素微丝提供细胞壁沉积的骨架,纤维合酶复合体的催化核心由3个CESA亚基组成,即CESA1、CESA3和CESA6,这些亚基缺失都会引起花粉功能缺陷[16]。AtUSP(Arabidopsis udp-sugar pyrophosphorylase)在拟南芥中主要是参与到花粉内壁果胶纤维素的合成,果胶纤维素是一种合成核苷酸糖的底物酶,突变体usp-1的花粉内壁缺失但是可以通过转入AtUSP得到恢复[17];atusp-1突变体中主要通过抑制MIO(Myo-inositol Oxidation)途径来阻遏基质多糖和纤维素的合成,从而导致花粉内壁合成受阻[18]。通过对油菜花药不同发育时期转录组的动态分析,在花药发育的后期检测到许多与糖类代谢有关的基因表达,这些基因主要参与花粉内壁的形成和成熟花粉中的淀粉积累,包括GH(Glycoside hydrolase family)家族、CE(Carbohydrate esterase family)家族和GT(Glycosyl transferase family)家族,它们主要通过调控转化酶和果胶聚合酶来实现对花粉内壁合成的调控[19]。
阿拉伯半乳糖蛋白是花粉壁的组成成分之一,合成受阻会导致花粉内壁发育异常。Yang等[20]在雄雌异株中发现与内壁合成相关的FLA和USP的含量相比于雌雄同株显著降低,同时发现CWI2和ST2参与脂类合成、运输以及内壁的形成。通过抑制FLA3表达来调控花粉内壁的发育,虽然花粉外壁正常但花粉内壁发育缺陷,花药由单核花粉期到双核花粉期转变时内壁出现厚度不均匀的异常现象,推测FLA3参与了阿拉伯半乳糖的合成表达,抑制其表达导致花粉内壁的异常发育和小孢子的败育[21]。通过RNAi技术沉默OsUAM3,发现植株有异常的外壁,并伴随着阿拉伯聚糖水平的降低[22],但基因的遗传调控机制尚不清晰。
在花粉壁形成的研究中,还有一些其他的途径参与了花粉内壁的形成。2个拟南芥ABC转运因子ABCG1和ABCG16在绒毡层中表达,对花粉壁的形成有着重要的作用,在突变体abcg1和abcg16中都表现出花粉内壁的缺失;有趣的是ABCG1和ABCG16的缺失在花粉中同样引起绒毡层功能的失常[23]。MGT基因家族中成员MGT5(Magnesium transporter 5)和MGT9(Magnesium transporter 9)在镁离子的吸收方面起作用,突变体mgt5和mgt9中都出现花粉内壁缺失而花粉外壁正常的现象,说明Mg离子不足雄配子不能正常发育[24]。cap1(Collapsed abnormal pollen1)突变体几乎丧失了所有细胞质内物质,包括花粉内壁,暗示了CAP1在植物中对花药的发育起到至关重要的作用[25-26]。
4 绒毡层的发育绒毡层位于花药室的最内层,主要在小孢子发育过程中提供营养和相关激素。四分体后期催化释放小孢子的胼胝质酶是由绒毡层分泌。在小孢子释放后,绒毡层为小孢子的发育提供营养物质。相关研究也发现了绒毡层的PCD(Program cell death)过程失常导致花粉壁的结构受损[27],在花药发育第8期早期绒毡层是致密的,但到第8时期晚期绒毡层呈现液泡化,第9时期小孢子释放后绒毡层就收缩致密同时颜色也加深。花药发育到单核花粉期时绒毡层几乎完全降解,随后到双核花粉期绒毡层完全降解,最终形成的花粉富含淀粉素,这些淀粉素来自绒毡层[28]。绒毡层的提前或者延后降解都会引起雄性不育[29-30],究其原因是绒毡层非正常降解会导致花粉壁的发育受损,因此,绒毡层适时的降解对于花粉壁的发育至关重要。
绒毡层缺失或过量都会导致花粉壁发育受损,影响最终育性。Zhao等[31]鉴定了一个有过量小孢子的拟南芥突变体ems1(Excess microsporocytes),它缺少绒毡层和绒毡层外的中层结构;虽然减数分裂时期ems1发育正常,但小孢子母细胞没有经过细胞分裂,导致小孢子发生过程异常随后出现雄性不育。通过对雄性不育突变体exs(Extra sporogenous cells)的结构观察,发现exs产生了一个额外性母细胞,但exs缺少绒毡层和中层细胞结构,胚胎的发育延缓导致形成更小的胚胎[32]。
绒毡层非正常降解会造成花粉壁发育异常,从而引起雄性不育。EMS1编码富含亮氨酸受体蛋白激酶(LRR-RPK),其表达与绒毡层的发育有关,表明EMS1控制花粉壁的发育。通过细胞学观察表明EMS1对孢子体早期阶段不是必需的,但对于花粉壁的发育却是必需的。Huang等[33]证明了βCAs(β-carbonic anhydrases)作为EMS1直接的下游位点,与βCAs蛋白结合起作用,当βCA失去功能后会引起绒毡层分泌失常,导致花粉壁发育异常,进而雄性不育。TPD1(Tapetum determinant1)分泌的富含半胱氨酸蛋白的配体和EMS1的LRR受体激酶在第二个位点区域结合,导致绒毡层细胞功能缺失引起小孢子增殖异常不能形成正常的雄性配子体[34]。
尽管绒毡层在花粉管发育的过程中起到重要作用,但其功能机制至今尚不十分清晰,有待进一步解析。
5 胼胝质和孢粉素 5.1 胼胝质的发育目前,前人对花粉壁发育模式中的胼胝质已经有了较深入的研究。胼胝质是一种β-1,3-葡聚糖,广泛存在于植物中。花粉壁的发育过程中,胼胝质包裹着小孢子,随后在四分体时期,胼胝质沉积于小孢子表面起到临时保护小孢子、限制小孢子异常膨大的作用,同时为花粉外壁的发育提供一个结构支撑,胼胝质在花粉发育过程要经历两次降解:第一次在减数分裂后形成四分体胼胝质沉积于四分体表面;第二次是胼胝质在四分体后期降解解释放小孢子。
胼胝质在GSL(Glucan synthase-like)的作用下合成,胼胝质的合成从UDP-葡萄糖开始,UDP-葡萄糖直接与胼胝质合成酶(GSL)催化剂的亚基相结合[35]。过去50年来,胼胝质在花粉发育过程中的作用逐渐被鉴定出来。胼胝质壁是一种临时的细胞结构,来自于初生外壁和质膜之间降解的胼胝质,胼胝质壁维持了小孢子形态以及保护小孢子免于外界环境的影响[36]。
目前发现的12个GSL(AtGSL1-AtGSL12)与胼胝质的合成有关,它们多数被克隆和验证,GSL1和GSL5功能紧密相关,在花粉发育过程中调控胼胝质的形成,GSL2(Cals5)调节四分体时期胼胝质的沉积[37-38],突变体gsl2缺失胼胝质壁,因此不能形成有活性的花粉[36]。突变体cs9(Callose synthase9)携带cs9等位基因,其纯合体致死,杂合体产生一半有缺陷的花粉,同时胼胝质异常沉积,形成早熟花粉[39]。在突变体gsl8和gsl10中,小孢子减数分裂过程出现不对称分裂,导致胼胝质不规则沉积[35]。与敲除GSL6和GSL11相比,敲除GSL5的植株的胼胝质沉积降低显著[40-41]。GSL1和GSL5在四分体时期胼胝质壁沉积和释放小孢子过程中表达,在突变体gsl1和gsl5中,胼胝质在四分体时期不沉积,未形成明显的胼胝质壁。gsl1gsl5双突变体相对于单突变体表现更加严重的不育性[37]。白菜转录组数据分析发现12个GSL,除GSL9外,其余均在花药发育中被检测到,不育花药中GSL2、GSL5和GSL8表达量很高[42]。
胼胝质的提前或者延后凋亡都会使花粉壁发育失常,引起雄性不育。Huang等[43]通过比较2个不育突变体,发现胼胝质的降解出现延后,花粉发育受损,究其原因是CDKG1先和snRNP结合,再通过RSZ33蛋白剪切掉CalS5的第6个内含子从而影响其表达。bnms3突变体中,绒毡层在四分体后期没有转变为分泌类型即胼胝质没有降解,小孢子未能正常释放,推测BnMs3调控绒毡层的分化和胼胝质的降解,同时参与孢粉素的合成调控和转运[44-45]。李可琪等[46]对甘蓝型油菜温敏不育性TE5A的研究中发现该不育系高温不育、低温可育,低温下正常开花的植株转到高温条件下则转变为不育,不育植株没有形成四分体结构,包裹着四分体的胼胝质降解延迟,导致小孢子不能正常释放,花粉发育晚期胼胝质才降解。
除了上述途径外,还有一些其他途径通过参与胼胝质的调控来影响最终的花粉育性。在烟草中,胼胝质的过量表达导致花粉外壁富集胼胝质壁和胼胝质塞,即花粉外壁畸形形成不育花粉[47-48]。
5.2 孢粉素物质的发育孢粉素是花粉外壁的主要成分,是一种由多羟基脂肪族化合物和酚类物质组成的生物聚合物[4]。孢粉素在绒毡层中合成,通过乌氏体转移到质膜表面并在初生外壁上和孢粉素受体结合,是一种难分解的物质,结构稳定,不溶于一般的酸碱、脂溶剂和无机盐,这是花粉壁结构稳定的原因之一,但这一特征使得对其化学分析造成了挑战。虽然孢粉素普遍存在于花粉和小孢子中,但在不同物种中这些器官所含孢粉素的含量是不相同的。与孢粉素有关基因的突变,会在四分体释放小孢子后立即出现花粉壁的缺陷,一般会削弱雄配子育性[57]。
脂肪酸代谢与孢粉素合成密切相关,但鲜有通过脂肪酸代谢调控花粉壁发育的报道[49-50]。成熟的外膜结构中能清晰观测到孢粉素的累积。根据发育模式的分析,孢粉素对于雄性不育中花粉壁的形成有着某些关联,例如初生外壁上孢粉素不能正常累积会造成花粉壁结构缺陷从而引起雄性不育。
目前鉴定到与孢粉素合成相关基因有PKSA、PKSB、TKPR2、CYB703B1和ACOS5等。三重突变体acbp4 acbp5 acbp6拥有不规则花粉壁结构和异常的含油层,其花粉外壁缺失导致花粉不育[51]。孢粉素受体的累积与初生外壁的沉积之间存在某些关联,孢粉素累积缺陷会导致初生外壁变异,引起败育。ACOS5(Acry-coa Synthetase5)参与调控长链脂肪酸的乙酰化,催化合成孢粉素单体,突变体acos5-2中小孢子发育不正常,四分体释放小孢子后退化和败育,初生外壁的沉积显著减少,孢粉素随机无规律的分布于小孢子表面[52-53],与绒毡层有关的调控因子DYT和TDF1参与了ACOS5的表达[54]。水稻OsMS2和拟南芥MS2高度同源,MS2是拟南芥中花粉发育的关键基因,敲除该基因的植株其绒毡层延迟降解,花粉壁结构较薄,且花粉外壁表面光滑,缺乏孢粉素的累积[55]。绒毡层MYB家族转录因子MS188、MYB103、MYB80都参与了孢粉素合成的调控[56]。PKSA(Polyketide synthesis A)和PKSB(Polyketide synthesis B)催化脂肪酰辅酶A酯和丙二酰辅酶A聚合催化产生孢粉素合成的前体物质,随后TKPR1(Tetraketide α-pyronereductase1)和TKPR2通过降低酮羰基的合成来调控孢粉素的合成[57]。CYP703A2和CYP704B1在孢粉素合成过程中主要是编码一个脂肪酸合酶,催化饱和长链脂肪酸向相应单羟基脂肪酸的转变[53, 58]。
6 展望在雄性不育的形成过程中绒毡层的提前、延迟凋亡或者形成空泡状都会导致后期花粉壁发育受限,引起雄性不育。胼胝质代谢研究表明,在小孢子周围胼胝质代谢下降会导致初生外壁缺陷,花粉外壁沉积也受影响,说明胼胝质在花粉壁发育中起到关键的作用。初生外壁形成缺陷会引起小孢子质膜未能形成波浪状结构,引起孢粉素沉积异常,花粉外壁发育异常,导致小孢子降解;孢粉素累积缺陷会导致花粉外壁缺陷,这些都会引起雄性不育。此外,高温胁迫通过影响花粉壁的发育来调控雄性配子体育性,为雄性不育研究开拓了新思路。
由于花粉壁结构和组成较为复杂,虽然通过电镜了解到一些作物花粉壁发育的大致过程,也在不同作物中克隆到一些与花粉壁发育相关的基因[59](图 2),但作为一个复杂的生物学过程,其遗传调控机理还需要进一步的解析。在花粉壁形成过程中,绒毡层与花粉细胞之间存在着大量的物质交换,但它们的物质能量转化过程和调控机理并不十分清晰。雄性不育研究中关于花粉壁发育的相关信号通路报道也较少,花粉壁的发育是如何导致雄性不育还有待进一步的解析。
| [1] |
杨莉芳, 刁现民. 植物细胞核雄性不育基因研究进展[J]. 植物遗传资源学报, 2013(6): 1108-1117. |
| [2] |
Zhou Q, Zhu J, Cui YL, et al. Ultrastructure analysis reveals sporop-ollenin deposition and nexine formation at early stage of pollen wall development in Arabidopsis[J]. Science Bulletin, 2015, 60(2): 273-276. DOI:10.1007/s11434-014-0723-6 |
| [3] |
Jiang J, Zhang Z, Cao J. Pollen wall development: The associated enzymes and metabolic pathways[J]. Plant Biology, 2013, 15(2): 249-263. DOI:10.1111/plb.2013.15.issue-2 |
| [4] |
Shi J, Cui M, Yang L, et al. Genetic and biochemical mechanisms of pollen wall development[J]. Trends in Plant Science, 2015, 20(11): 741-753. DOI:10.1016/j.tplants.2015.07.010 |
| [5] |
Hu J, Wang Z, Zhang L, et al. The Arabidopsis exine formation defect(efd)gene is required for primexine patterning and is critical for pollen fertility[J]. New Phytology, 2014, 203(1): 140-154. DOI:10.1111/nph.12788 |
| [6] |
赵艳云.拟南芥efd基因影响花粉壁模式形成的机理研究[D].上海: 上海师范大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10270-1017154006.htm
|
| [7] |
Hu J, Huang W, Huang Q, et al. Mitochondria and cytoplasmic male sterility in plants[J]. Mitochondrion, 2014, 19: 282-288. DOI:10.1016/j.mito.2014.02.008 |
| [8] |
Yang J, Tian L, Sun MX, et al. Auxin response factor17 is essential for pollen wall pattern formation in Arabidopsis[J]. Plant Physiology, 2013, 162(2): 720-731. DOI:10.1104/pp.113.214940 |
| [9] |
Chang HS, Zhang C, Chang YH, et al. No Primexine and plasma membrane undulation is essential for primexine deposition and plasma membrane undulation during microsporogenesis in Arabidopsis[J]. Plant Physiology, 2012, 158(1): 264-272. DOI:10.1104/pp.111.184853 |
| [10] |
王建林.拟南芥雄性不育基因nef1的初步功能研究[D].上海: 上海师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10270-1013298298.htm
|
| [11] |
Li WL, Liu Y, Douglas CJ. Role of glycosyltransferases in pollen wall primexine formation and exine patterning[J]. Plant Physiology, 2017, 173(1): 167-182. DOI:10.1104/pp.16.00471 |
| [12] |
Sun MX, Huang XY, Yang J, et al. Arabidopsis Rpg1 Is Important for Primexine Deposition and Functions Redundantly with Rpg2 for plant fertility at the late reproductive stage[J]. Plant Reprod, 2013, 26(2): 83-91. DOI:10.1007/s00497-012-0208-1 |
| [13] |
马丽娟.膜定位蛋白dex1是拟南芥小孢子发育所必需的[D].上海: 上海师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10270-1013299034.htm
|
| [14] |
Scott RJ, Spielman M, Dickinson HG. Stamen structure and function[J]. The Plant Cell, 2004, 16. |
| [15] |
Moon S, Kim SR, Zhao G, et al. Rice glycosyltransferase1 encodes a glycosyltransferase essential for pollen wall formation[J]. Plant Physiology, 2013, 161(2): 663-675. DOI:10.1104/pp.112.210948 |
| [16] |
Persson S, Paredez A, Carroll A, et al. Genetic evidence for three unique components in primary cell-wall cellulose synthase complexes in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15566-15571. DOI:10.1073/pnas.0706592104 |
| [17] |
Schnurr JA, Storey KK, Jung HJ, et al. Udp-sugar pyrophosphorylase is essential for pollen development in Arabidopsis[J]. Planta, 2006, 224(3): 520-532. DOI:10.1007/s00425-006-0240-1 |
| [18] |
Kotake T, Hojo S, Yamaguchi D, et al. Properties and physiological functions of Udp-sugar pyrophosphorylase in Arabidopsis[J]. Journal of the Agricultural Chemical Society of Japan, 2007, 71(3): 761-771. |
| [19] |
Li ZJ, Zhang PP, Lv JY, et al. Global dynamic transcriptome programming of rapeseed(Brassica Napus L.)anther at different development stages[J]. PLoS One, 2016, 11(5): e0154039. DOI:10.1371/journal.pone.0154039 |
| [20] |
Yang K, Zhou X, Wang Y, et al. Carbohydrate metabolism and gene regulation during anther development in an androdioecious tree, tapiscia sinensis[J]. Ann Bot, 2017, 120(6): 967-977. DOI:10.1093/aob/mcx094 |
| [21] |
Li J, Yu M, Geng LL, et al. The fasciclin-like arabinogalactan protein gene, Fla3, is involved in microspore development of Arabidopsis[J]. The Plant Journal, 2010, 64(3): 482-497. DOI:10.1111/tpj.2010.64.issue-3 |
| [22] |
Sumiyoshi M, Inamura T, Nakamura A, et al. Udp-arabinopyranose mutase 3 is required for pollen wall morphogenesis in rice(Oryza sativa)[J]. Plant & Cell Physiology, 2015, 56(2): 232-241. |
| [23] |
Yim S, Khare D, Kang J, et al. Postmeiotic development of pollen surface layers requires two Arabidopsis abcg-type transporters[J]. Plant Cell Report, 2016, 35(9): 1863-1873. DOI:10.1007/s00299-016-2001-3 |
| [24] |
Xu XF, Wang B, Lou Y, et al. Magnesium transporter 5 plays an important role in Mg transport for male gametophyte development in Arabidopsis[J]. The Plant Journal, 2015, 84(5): 925-936. DOI:10.1111/tpj.13054 |
| [25] |
Ueda K, Yoshimura F, Miyao A, et al. Collapsed abnormal pollen1 gene encoding the arabinokinase-like protein is involved in pollen development in rice[J]. Plant Physiology, 2013, 162(2): 858-871. DOI:10.1104/pp.113.216523 |
| [26] |
Dong J, Gao K, Wang K, et al. Cell wall disruption of rape bee pollen treated with combination of protamex hydrolysis and ultrasonication[J]. Food Res Int, 2015, 75: 123-130. DOI:10.1016/j.foodres.2015.05.039 |
| [27] |
Yi J, Moon S, Lee YS, et al. Defective Tapetum Cell Death 1(Dtc1)regulates ros levels by binding to metallothionein during tapetum degeneration[J]. Plant Physiology, 2016, 170(3): 1611-1623. DOI:10.1104/pp.15.01561 |
| [28] |
Papini A, Mosti S, Brighigna L. Programmed-cell-death events during tapetum development of angiosperms[J]. Protoplasma, 1999, 207(3/4): 213-221. |
| [29] |
Li H, Yuan Z, Vizcaybarrena G, et al. Persistent tapetal cell1 encodes a phd-finger protein that is required for tapetal cell death and pollen development in rice[J]. Plant Physiology, 2011, 156(2): 615-630. DOI:10.1104/pp.111.175760 |
| [30] |
Li N, Zhang DS, Liu HS, et al. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J]. The Plant Cell, 2006, 18(11): 2999-3014. DOI:10.1105/tpc.106.044107 |
| [31] |
Zhao DZ, Wang GF, Speal B, et al. The excess microsporocytes1 gene encodes a putative leucine-rich repeat receptor protein kinase that controls somatic and reproductive cell fates in the Arabidopsis anther[J]. Genes & Development, 2002, 16(15): 2021-2031. |
| [32] |
Canales C, Bhatt AM, Scott R, et al. A putative lrr receptor kinase, regulates male germline cell number and tapetal identity and promotes seed development in Arabidopsis[J]. Current Biology, 2002, 12(20): 1718-1727. DOI:10.1016/S0960-9822(02)01151-X |
| [33] |
Huang J, Li Z, Biener G, et al. Carbonic anhydrases function in anther cell differentiation downstream of the receptor-like kinase ems1[J]. The Plant Cell, 2017, 29(6): 1335-1356. |
| [34] |
Huang J, Zhang T, Linstroth L, et al. Control of anther cell differentiation by the small protein ligand Tpd1 and its receptor Ems1 in Arabidopsis[J]. PLoS Genetics, 2016, 12(8): e1006147. DOI:10.1371/journal.pgen.1006147 |
| [35] |
Shi X, Han X, Lu TG. Callose Synthesis During Reproductive Development in Monocotyledonous and Dicotyledonous Plants[J]. Plant Signal and Behavor, 2016, 11(2): e1062196. DOI:10.1080/15592324.2015.1062196 |
| [36] |
Dong X, Hong Z, Sivaramakrishnan M, et al. Callose synthase(Cals5)is required for exine formation during microgametogenesis and for pollen viability in Arabidopsis[J]. The Plant Journal, 2005, 42(3): 315-328. DOI:10.1111/tpj.2005.42.issue-3 |
| [37] |
Enns LC, Kanaoka MM, Torii KU, et al. Two callose synthases, Gsl1 and Gsl5, play an essential and redundant role in plant and pollen development and in fertility[J]. Plant Mol Biol, 2005, 58(3): 333-349. DOI:10.1007/s11103-005-4526-7 |
| [38] |
Nishikawa S, Zinkl GM, Swanson RJ, et al. Callose(Β-1, 3 Glucan)is essential for Arabidopsis pollen wall patterning, but not tube growth[J]. BMC Plant Biology, 2005, 5(1): 1-9. |
| [39] |
Xie B, Wang X, Hong Z. Precocious Pollen Germination in Arabidopsis Plants with Altered Callose Deposition During Microsporogenesis[J]. Planta, 2010, 231(4): 809-823. DOI:10.1007/s00425-009-1091-3 |
| [40] |
Jacobs AK, Lipka V, Burton RA, et al. An Arabidopsis callose synthase, Gsl5, is required for wound and papillary callose formation[J]. The Plant Cell, 2003, 15(11): 2503-2513. DOI:10.1105/tpc.016097 |
| [41] |
Huang L, Chen XY, Rim Y, et al. Arabidopsis Glucan Synthase-Like 10 functions in male gametogenesis[J]. Journal of Plant Physiology, 2009, 166(4): 344-352. DOI:10.1016/j.jplph.2008.06.010 |
| [42] |
崔海芳, 张凡, 尹俊龙, 等. 胼胝质沉积与花粉发育[J]. 云南农业大学学报:自然科学版, 2017, 32(3): 551-557. |
| [43] |
Huang XY, Niu J, Sun MX, et al. Cyclin-dependent kinase G1 is associated with the spliceosome to regulate callose synthase5 splicing and pollen wall formation in Arabidopsis[J]. The Plant Cell, 2013, 25(2): 637-648. DOI:10.1105/tpc.112.107896 |
| [44] |
Zhou Z, Dun X, Xia S, et al. Bnms3 is required for tapetal differentiation and degradation, microspore separation, and pollen-wall biosynthesis in Brassica napus[J]. J Exp Bot, 2012, 63(5): 2041-2058. DOI:10.1093/jxb/err405 |
| [45] |
王增增.油菜嵌合基因bnaa7. Hsp70-1-Like在拟南芥中的遗传转化及后代鉴定[D].武汉: 华中农业大学, 2015. http://d.wanfangdata.com.cn/Thesis/Y2802971
|
| [46] |
戚楠楠, 张晓燕, 苏娜娜, 等. 甘蓝型油菜温敏细胞核雄性不育系te5a花药发育的细胞学研究[J]. 中国农业科学, 2016, 49(12): 2408-2417. DOI:10.3864/j.issn.0578-1752.2016.12.016 |
| [47] |
Worrall D, Hird DL, Hodge R, et al. Premature dissolution of the microsporocyte callose wall causes male sterility in transgenic tobacco[J]. The Plant Cell, 1992, 4(7): 759-771. |
| [48] |
Tsuchiya T, Toriyama K, Yoshikawa M, et al. Tapetum-specific expression of the gene for an endo-beta-1, 3-glucanase causes male sterility in transgenic tobacco[J]. Plant & Cell Physiology, 1995, 36(3): 487-494. |
| [49] |
Ding Y, Ma Y, Liu N, et al. Micrornas involved in auxin signalling modulate male sterility under high-temperature stress in cotton(Gossypium hirsutum)[J]. The Plant Journal, 2017, 91(6): 977-994. DOI:10.1111/tpj.2017.91.issue-6 |
| [50] |
Ji J, Huang W, Yin C, et al. Mitochondrial cytochrome c oxidase and F1fo-atpase dysfunction in peppers(Capsicum annuuml)with cytoplasmic male sterility and its association Withorf507andψatp6-2genes[J]. International Journal of Molecular Sciences, 2013, 14(1): 1050-1068. DOI:10.3390/ijms14011050 |
| [51] |
Hsiao AS, Yeung EC, Ye ZW, et al. The Arabidopsis cytosolic acyl-coa-binding proteins play combinatory roles in pollen development[J]. Plant and Cell Physiology, 2015, 56(2): 322-333. |
| [52] |
Azevedo SC, Kim SS, Koch S, et al. A novel fatty Acyl-Coa synthetase is required for pollen development and sporopollenin biosynthesis in Arabidopsis[J]. The Plant Cell Online, 2009, 21(2): 507-525. DOI:10.1105/tpc.108.062513 |
| [53] |
Morant M, Jørgensen K, Schaller H, et al. Cyp703 is an ancient cytochrome P450 in land plants catalyzing in-chain hydroxylation of lauric acid to provide building blocks for sporopollenin synthesis in pollen[J]. The Plant Cell, 2007, 19(5): 1473-1487. DOI:10.1105/tpc.106.045948 |
| [54] |
Xie Hh, Chen L, Xu F, et al. Acos5 is required for primexine formation and exine pattern formation during microsporogenesis in Arabidopsis[J]. Journal of Plant Biology, 2017, 60(4): 404-412. DOI:10.1007/s12374-016-0523-4 |
| [55] |
方子君, 石其龙, 杨仲南, 等. 水稻osms2基因在花药发育中的功能分析[J]. 植物学报, 2008, 25(6): 665-672. DOI:10.3969/j.issn.1674-3466.2008.06.005 |
| [56] |
Wang K, Guo ZL, Zhou WT, et al. The regulation of sporopollenin biosynthesis genes for rapid pollen wall formation[J]. Plant Physiology, 2018, 78: 283-294. |
| [57] |
Quilichini TD, Grienenberger E, Douglas CJ. The biosynthesis, composition and assembly of the outer pollen wall: A tough case to crack[J]. Phytochemistry, 2015, 113(2): 170-182. |
| [58] |
Yang ZN. Regulation of sporopollenin synthesis for pollen wall formation in plant[J]. Science China Life Sciences, 2016, 59(12): 1-3. |
| [59] |
Ariizumi T, Toriyama K. Genetic regulation of sporopollenin synthesis and pollen exine development[J]. Annu Rev Plant Biol, 2011, 62: 437-460. DOI:10.1146/annurev-arplant-042809-112312 |