巴弗洛霉素(Bafliomycins)是一类化学结构上极为特殊的多烯16元环内脂类抗生素,其大部分衍生物的侧链结构中都含有一个六元环的半缩醛结构[1-2]。其中巴弗洛霉素A1(Bafilomycin A1)是一种空泡H+-ATP酶(V-ATPase)的特异性抑制剂,能够抑制自噬体和溶酶体结合而抑制自噬[3]。V-ATPase广泛分布于真核生物的液泡,溶酶体,反式高尔基体,分泌颗粒,核内体等细胞内膜系统中,根据细胞器官的微小酸性差别,各自发挥独立机能,是一种新的药物靶点[4-5]。另外,巴弗洛霉素类化合物还具有抗细菌[6]、抗真菌[7]、杀虫[8]、除草[9]、抗肿瘤[10]以及免疫抑制等多种生物活性[11]。
在大环内酯类抗生素的生物合成中,低级脂肪酸、氨基酸、小分子有机酸/醇等可以作为前体单元构成内酯环,但部分前体物不易被菌体合成,因而成为大环内酯类抗生素生物合成的限制性因素[12]。安丝菌素发酵过程中添加前体物缬氨酸、异丁醇等均能有效提高主组分安丝菌素P-3含量[13-14];红霉素发酵过程中添加甘氨酸、植物油等也可以促进红霉素产量,使主组分红霉素A比例提高,降低红霉素C含量[14, 16];那他霉素生产过程中添加0.6%的丙酸钠,可以使发酵效价提高1.8倍[17]。由此可见,在发酵培养基中加入适量的前体物质,通过发酵代谢调控,就有可能缩短其生物合成周期,提高大环内酯类抗生素发酵产量。根据巴弗洛霉素的化学结构特点和生物合成途径[18-19],本文选取乙酸钠、丙酸钠、异亮氨酸、亮氨酸、缬氨酸、甲硫氨酸、异丁醇、异丁酸等考察外源性前体物对巴弗洛霉素生物合成的影响,以期通过前体物质的添加提高巴弗洛霉素A1的产量。
1 材料与方法 1.1 材料 1.1.1 实验菌株菌种链霉菌FIM-B0711由本研究室筛选保藏。
1.1.2 培养基斜面培养基:ISP2。分离平板培养基:ISP2。种子培养基:麦芽浸粉2.0%;蛋白胨2.0%;CaCO3 1.0%。(pH为7.2)。发酵培养基:可溶性淀粉4.0%、蛋白胨3.0%、酵母粉2.0%、玉米浆1.5%、碳酸钙0.2%(pH为7.0)
1.2 方法 1.2.1 培养方法斜面28℃培养10-12 d待孢子生长成熟以后,刮取新鲜孢子接于种子培养基,置于28℃培养、摇床转速为220 r/min,培养48 h左右;按5%的接种量接种到发酵培养基,后置于28℃、摇床转速220 r/min,振荡培养120 h。
1.2.2 巴弗洛霉素A1的高效液相色谱(HPLC)检测法样品处理:发酵液加入2倍体积乙醇,混匀、超声20 min,10 000 r/min离心10 min,取上清液即为待测液。
HPLC分析方法:Agilent 1200 series高效液相色谱仪,Syncronis C18分析柱(4.6 mm×250 mm,填料粒径5 μm),流动相为甲醇:水=85:15,进样量为10 μL,流速1.0 mL/min,检测波长248 nm,柱温:40℃。根据样品峰面积/标准液峰面积×标准液浓度计算产量。
1.2.3 菌丝浓度测定采用PMV(Packed Mass Volume)法,取发酵液10 mL于10 mL刻度试管中,于5 000 r/min离心15 min,记录沉淀物毫升数。依下列计算菌丝浓度:菌丝浓度=(沉淀物毫升数/10)×100%。
1.2.4 总糖的测定斐林试剂测定法[20]
1.2.5 氨基氮的测定甲醛法[21]
1.2.6 不同前体对巴弗洛霉素A1生物合成的影响在发酵培养24 h后分别向发酵培养基中加入0.1%的醋酸钠、丙酸钠、异亮氨酸、亮氨酸、缬氨酸、甲硫氨酸、异丁醇、异丁酸,继续培养,在发酵120 h时测定发酵液中巴弗洛霉素A1产量及菌丝浓度,确定最佳前体物质。以无添加前体物的基础发酵培养基为对照。
1.2.7 前体添加浓度对巴弗洛霉素A1生物合成的影响在发酵培养24 h后分别向发酵培养基中添加0.025%、0.05%、0.1%、0.2%、0.3%、0.4%、0.5%的最佳前体物,发酵结束后测定巴弗洛霉素A1产量、菌丝浓度及pH值,确定最佳添加浓度。以无添加前体物的基础发酵培养基为对照。
1.2.8 前体加入时间的考察分别在发酵培养的第0、12、24、36、48、60、72 h时,向发酵培养基中加入最佳前体,发酵结束后测定巴弗洛霉素A1产量、菌丝浓度及pH值,确定最佳加入时间,以无添加前体物的基础发酵培养基为对照。
1.2.9 发酵罐上补料实验新鲜斜面接入装量为80 mL/500 mL摇瓶种子培养基中,28℃,220 r/min培养48 h后合并种子液,按5.0%左右的接种量移种到20 L发酵罐中培养。在发酵培养过程中,通过搅拌及通气量控制发酵液DO值在30%-60%之间,一般通气为1:0.8-1.5 vvm,搅拌转速在200-500 r/min之间。在发酵进行到36 h时一次性加入发酵液体积0.2%的缬氨酸溶液。
2 结果 2.1 不同前体对巴弗洛霉素A1生物合成的影响图 1显示,添加0.1%缬氨酸可促进菌体生长及有效提高巴弗洛霉素A1发酵产量,达217.6 mg/mL,比对照组提高约36.0%;添加0.1%甲硫氨酸对菌体生长影响不大,但可提高巴弗洛霉素A1发酵产量,达到184.2 mg/mL,比对照组提高了约15.0%;添加0.1%的乙酸钠和丙酸钠对巴弗洛霉素A1产量和生物量没有明显影响;而添加0.1%的异丁醇和异丁酸可以提高巴弗洛霉素效价,但效果不明显且会抑制菌体生长;而亮氨酸、异亮氨酸可以促进菌体生长,但会降低巴弗洛霉素A1的产量;由此可见缬氨酸为最佳的外源前体物,后续实验选择缬氨酸进行最适添加量及添加时间的研究。

|
| SA: Sodium Acetate; SP: Sodium Propionate; Ile: Isoleucine; Leu: leucine; Val: valine; Met: Methionine; IBA: Isobutanol; IBAA: Isobutyric acid; CK: Control. 图 1 不同前体物对巴弗洛霉素A1生物合成的影响 |
图 2显示,在发酵24 h左右往培养基中添加缬氨酸浓度为0-0.1%时,菌体浓度持续增加,巴弗洛霉素效价也增加;当缬氨酸浓度达到0.2%时,菌体浓度开始下降,但此时巴弗洛霉素A1效价达到最高;继续加大氨基酸添加量后菌体浓度持续下降,巴弗洛霉素A1效价也跟着下降。有可能是因为高浓度缬氨酸对菌体产生抑制作用,导致生物量的减少进而降低发酵效价。因此,确定前体缬氨酸的最佳添加量为0.2%,此条件下巴弗洛霉素A1产量为264.5 mg/mL,比对照提高了65.3%。
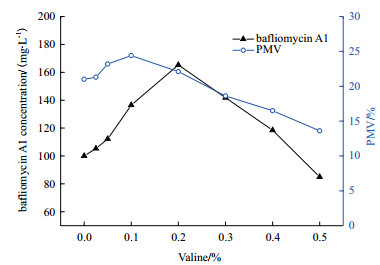
|
| 图 2 缬氨酸添加量对巴弗洛霉素A1生物合成的影响 |
图 3显示,在第36 h添加缬氨酸时,巴弗洛霉素A1产量及菌丝浓度均比对照组有所提高,此时添加缬氨酸效果最好,巴弗洛霉素A1产量高达285.5 mg/mL,比对照组提高了78.4%。
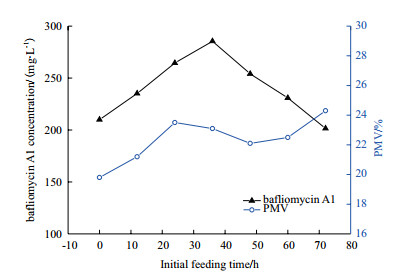
|
| 图 3 缬氨酸添加时间对巴弗洛霉素A1生物合成的影响 |
从图 3上生物量的变化可以看出,在培养0-24 h时加入缬氨酸,菌丝浓度逐渐增加,发酵效价也升高,可能是由于部分缬氨酸作为细胞生长的碳源而促进生长,另外缬氨酸也会诱导次级代谢的酶活从而提高效价;而第36 h是处在链霉菌FIM-B0711开始进入次级代谢产物巴弗洛霉素合成的阶段,此时加入缬氨酸,大部分能作为次级代谢前体物质直接转化为丙酰CoA合成巴弗洛霉素A1,因此发酵效价最高。
在培养48 h之后加入缬氨酸,巴弗洛霉素A1产量下降,而生物量反而有所上升,这可能是由于缬氨酸是初级代谢产物有可能引起菌体二次生长而改变生物合成进程从而降低发酵效价。所以最佳的前体物补料时机为在发酵培养36 h时加入0.2%的缬氨酸。
2.4 发酵过程考察在20 L发酵罐进行发酵试验,在培养36 h左右,往发酵罐加入总量0.2%的缬氨酸溶液,对照组为不添加缬氨酸发酵罐。
由图 4可以看出,添加缬氨酸发酵时总糖消耗速率较快,说明缬氨酸可以提高菌体的代谢合成。氨基氮曲线的变化可以看到,没有添加前体物的发酵过程,前36 h由于菌体细胞的生长和繁殖消耗了大量的氨基氮,导致氨基氮含量下降较快,同时伴随着pH值的下降;之后氨基氮消耗缓慢,此时pH值有所回升;在发酵后期(发酵72 h后),氨基氮缓慢回升,而pH值也在升高,可能是由于发酵后期菌体开始衰老、自溶,释放部分氨基氮。而在36 h时添加缬氨酸可以看到氨基氮在36-48 h恢复到较高水平,然后再下降,在60 h后又开始缓慢上升;这可能是由于添加氨基酸后促进菌体生长和代谢合成,随着发酵的进行氨基酸被大量消耗而导致氨基氮减少,发酵后期产物大量合成,菌体开始自溶,氨基氮又缓慢回升。
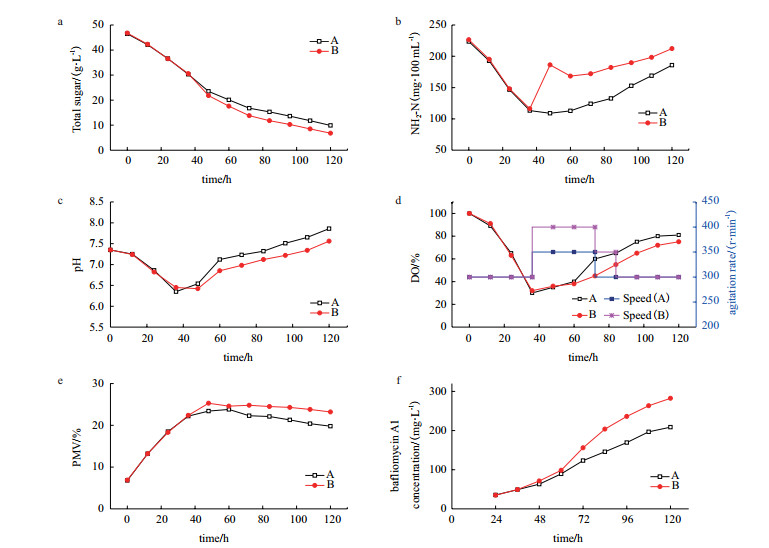
|
| a: Tatal sugar; b: Amino nitrogen(NH2-N); c: pH; d: DO, Agitation rate; e: Packed Mass Volume(PMV); f: bafliomycin A1; A: The process without addition of precursor; B: The process with addition of precursor 图 4 发酵曲线对比 |
由于发酵过程控制发酵罐转速以尽量保证菌体对氧的需求,所以两种发酵方式的溶氧曲线变化基本一致。在发酵0-36 h随着菌体的快速生长,DO值迅速下降到30%左右,此时提高转速增加发酵液中氧气含量,在发酵中后期菌体进入次级代谢合成期对氧的需求开始下降,此时可以适当降低转速,以减少搅拌剪切力对菌丝体的损伤。
从菌丝浓度变化的曲线可以看出,巴弗洛霉素A1发酵过程中存在两个阶段(菌体生长期和产物合成期),发酵前期(0-36 h)菌体生长、繁殖较快,为菌体生长期,36-96 h菌丝浓度增长缓慢,此时开始大量合成次级代谢产物巴弗洛霉素A1;在发酵后期,96-120 h菌体细胞开始衰亡自溶,巴弗洛霉素A1累积速度变慢,发酵120 h时巴弗洛霉素A1产量达到峰值。在发酵36 h时添加缬氨酸可以明显促进菌丝体生长和大大提高巴弗洛霉素A1的生物合成速率和产量,120 h是巴弗洛霉素A1产量达到282.5 mg/L。
3 讨论目前已有公开报道的巴弗洛霉素发酵产量都不高。魏刚等[11]报道从海洋放线菌Y12-26发酵获得bafilomycin A1,效价极低。潘华奇等[22]报道卡伍尔链霉菌经发酵产生的bafilomycin B1和bafilomycin C1含量分别达23.45 mg/L和6.603 mg/L。杨巍民等[23]报道在40 L海洋放线菌Y-0117发酵液中获得bafilomycin D纯品约0117A(14.7 mg)。Werner等[6]报道从100 L灰色链霉菌的发酵液中分离获得bafliomycins A1 45 mg、A2 36 mg、C1 120 mg,Yu等[24]从链霉菌YIM56209的9.6 L发酵液中获得bafliomycins C1 1.8mg。Carr等[25]从海洋放线菌发酵液中分离到bafilomycin F。Lee等[26]报道在发酵过程添加80 mmol/L缬氨酸添加可以使bafilomycin产量达到35 mg/L。由此可见已有报道巴弗洛霉素发酵产量均太低,生产成本高,不足以实现工业化应用。
巴弗洛霉素A1大环内酯核心由I型PKS系统组装,其聚酮延伸前体物为甲基丙二酰辅酶A、丙二酰辅酶A、甲氧基丙二酰辅酶A等[27-28]。这些短链脂肪酸酰基CoA可以通过脂肪酸或支链氨基酸等物质代谢获得[29]。因此在发酵培养过程中加入适量前体物质,通过代谢调控,可能缩短其生物合成周期,提高巴弗洛霉素的产量。但如果外源前体在发酵液中的残留浓度过高,又会使生产菌中毒,而不利于产物的生物合成。因此,研究适当的前体添加策略对有些次级代谢产物的高产稳产有重要意义。
添加缬氨酸可以提高巴弗洛霉素产量的原因可能是缬氨酸在菌体内代谢可得异丁酸,其是巴弗洛霉素生物合成的起始单元[26],外源性地增加巴弗洛霉素生物合成起始单元可以大大地促进其生物合成。而添加亮氨酸或异亮氨酸抑制会乙酰羧酸合成酶(受单个末端产物抑制),使得胞内合成的缬氨酸减少[30],从而降低产量。
4 结论本文研究表明,缬氨酸作为前体物对巴弗洛霉素A1生物合成的促进作用优于甲硫氨酸、异丁醇及异丁酸,是较适宜的前体。在发酵培养36 h时添加0.2%缬氨酸,巴弗洛霉素A1产量高达285.5 mg/L,比对照组提高了78.4%。且这一实验在20 L发酵罐上得以实现,为下一步菌株选育及发酵放大实验提高基础数据。
| [1] |
Werner G, Hagenmaier H, Albert K, et al. The structure of the bafilomycins, a new group of macrolide antibiotics[J]. Tetrahedron Letters, 1983, 24(47): 5193-5196. DOI:10.1016/S0040-4039(00)88394-X |
| [2] |
Bowman EJ, Siebers A, Altendorf K. Bafilomycins: a class of inhibitors of membrane ATPases from microorganisms, animal cells, and plant cells[J]. Proceedings of the National Academy of Sciences of the United States of America, 1988, 85(21): 7972-7976. DOI:10.1073/pnas.85.21.7972 |
| [3] |
Mauyezin C, Nagy P, Juhasz G, et al. Autophagosome-lysosome fusion is independent of V-ATPase-mediated acidification[J]. Nature Communications, 2015, 11(6): 7007-7019. |
| [4] |
Gerber HP, Koehn FE, Abraham RT. The antibody-drug conjugate: an enabling modality for natural product-based cancer therapeutics[J]. Natural Product Reports, 2013, 30(5): 625-39. DOI:10.1039/c3np20113a |
| [5] |
Yuan N, Song L, Zhang S, et al. Bafilomycin A1 targets both autophagy and apoptosis pathways in pediatric B-cell acute lymphoblastic leukemia[J]. Haematologica, 2015, 100(3): 345-56. DOI:10.3324/haematol.2014.113324 |
| [6] |
Werner G, Hagenmaier H, Drautz H, et al. Metabolic products of microorganisms. 224. Bafilomycins, a new group of macrolide antibiotics. Production, isolation, chemical structure and biological activity[J]. The Journal of Antibiotics, 1984, 37(2): 110-7. |
| [7] |
Seto H, Tajima I, Akao H, et al. The isolation and structures of hygrolidin amide and defumarylhygrolidin[J]. J Antibiot, 1984, 37(5): 610-613. DOI:10.7164/antibiotics.37.610 |
| [8] |
Kretschmer A, Dorgerloh M, Deeg M, et al. The structures of novel insecticidal macrolides bafilomycins D and E, and oxohygrolidin[J]. Agric Biol Chem, 1985, 49(8): 2509-2511. |
| [9] |
Kim SD, Ryoo IJ, Kim CJ. Taxonomy, fermentation, isolation and characterization of a herbicidal compound, 3D5[J]. J Microbiolo Biotechnol, 1993, 3(1): 57-60. |
| [10] |
Chu HY, Chen X, Jiang YE, et al. Bafilomycin A1 increases the sensitivity of tongue squamous cell carcinoma cells to cisplatin by inhibiting the lysosomal uptake of platinum ions but not autophagy[J]. Cancer Letters, 2018, 423(3): 105-112. |
| [11] |
魏刚, 苏超, 张道敬, 等. 海洋放线菌Y12-26代谢产物中bafilomycins分离纯化及结构鉴定[J]. 中国抗生素杂志, 2011, 36(8): 571-575. |
| [12] |
孙益, 姚瑜. 大环内酯类抗生素的菌种选育, 发酵和生物合成[J]. 国外医药:抗生素分册, 1997, 18(2): 99-113. |
| [13] |
李婷兰, 韦柳静, 范宇翔, 等. 奇迹束丝放线菌合成安丝菌素过程中支链氨基酸的添加效果分析[J]. 华东理工大学学报, 2013, 39(6): 675-680. DOI:10.3969/j.issn.1006-3080.2013.06.007 |
| [14] |
Lin JX, Bai LQ, Deng ZX, et al. Enhanced production of ansamitocin P-3 by addition of isobutanol in fermentation of Actinosynnema pretiosum[J]. Bioresource Technology, 2011, 102(2): 1863-1868. DOI:10.1016/j.biortech.2010.09.102 |
| [15] |
吕伟, 庄英萍, 储炬, 等. 氨基酸对利用红色糖多孢菌发酵生产红霉素的产量及组分影响研究[J]. 中国抗生素杂志, 2006, 31(10): 595-599. DOI:10.3969/j.issn.1001-8689.2006.10.005 |
| [16] |
杨莲芳, 曹健, 张中州, 等. 不同种类植物油对红霉素发酵的影响[J]. 食品与发酵科技, 2009, 45(4): 46-48. |
| [17] |
刘宁, 金志华, 骆健美, 等. 前体对纳他霉素生物合成的影响[J]. 中国抗生素杂志, 2005, 30(6): 328-331. DOI:10.3969/j.issn.1001-8689.2005.06.003 |
| [18] |
Li Z, Du L, Zhang W, et al. Complete elucidation of the late steps of bafilomycin biosynthesis in Streptomyces lohii[J]. Journal of Biological Chemistry, 2017, 292(17): 7095-7104. DOI:10.1074/jbc.M116.751255 |
| [19] |
Hwang JY, Kim SH, Oh HR, et al. Analysis of a draft genome sequence of Kitasatospora cheerisanensis KCTC 2395 producing bafilomycin antibiotics[J]. Journal of Microbiology, 2015, 53(1): 84-89. |
| [20] |
吴国峰, 李国全, 马永. 工业发酵分析[M]. 北京: 化学工业出版社, 2006: 11-12.
|
| [21] |
陈钧鸣, 徐玲娣. 抗生素工业分析[M]. 北京: 中国医药科技出版社, 1991: 109.
|
| [22] |
潘华奇, 于素亚, 胡江春, 等.一种卡伍尔氏链霉菌及其应用: 中国, 103820351B[P]. 2015-12-23.
|
| [23] |
杨巍民, 斯聪聪, 杨星, 等. 海洋放线菌Y-0117农用活性代谢产物的研究[J]. 化学与生物工程, 2013, 30(1): 24-27. DOI:10.3969/j.issn.1672-5425.2013.01.06 |
| [24] |
Yu Z, Zhao LX, Jiang CL, et al. Bafilomycins produced by an endophytic actinomycete Streptomyces sp. YIM56209[J]. The Journal of Antibiotics, 2011, 64(1): 159-162. |
| [25] |
Carr G, Williams DE, Diaz-Marrero AR, et al. Bafilomycins produced in culture by Streptomyces spp. isolated from marine habitats are potent inhibitors of autophagy[J]. Journal of Natural Products, 2010, 73(3): 422-427. DOI:10.1021/np900632r |
| [26] |
Lee DW, BG NG, Kim BS. Increased valinomycin production in mutants of Streptomyces sp. M10 defective in bafilomycin biosynthesis and branched-chain α-keto acid dehydrogenase complex expression[J]. J Ind Microbiol Biotechnol, 2015, 42(11): 1507-1517. DOI:10.1007/s10295-015-1679-5 |
| [27] |
Zhang W, Jeffrey LF, Carlson JC, et al. Characterization of the bafilomycin biosynthetic gene cluster from Streptomyces lohii[J]. Chembiochem A European Journal of Chemical Biology, 2013, 14(3): 301-306. DOI:10.1002/cbic.v14.3 |
| [28] |
Yoon HJ, Sun KH, Hee KS, et al. Organization and characterization of a biosynthetic gene cluster for bafilomycin from Streptomyces griseus DSM 2608[J]. Amb Express, 2013, 3(1): 24. DOI:10.1186/2191-0855-3-24 |
| [29] |
姚永鹏, 王为善, 杨克迁. 链霉菌中高效生产聚酮化合物的研究方法及进展[J]. 微生物学报, 2016, 56(3): 418-428. |
| [30] |
李婷兰, 韦柳静, 范宇翔, 等. 奇迹束丝放线菌合成安丝菌素过程中支链氨基酸的添加效果分析[J]. 华东理工大学学报:自然科学版, 2013, 39(6): 675-680. |




