2. 东莞市南城医院,东莞 523000;
3. 中国人民大学统计学院,北京 100872
2. Dongguan Nancheng Hospital, Dongguan 523000;
3. School of Statistics, Renmin University of China, Beijing 100872
与细胞传代保存相比,细胞低温冷冻保存可有效避免因细胞传代过程中导致的污染、遗传变异、大量人力财力付出,也可以最大限度保证细胞在长途转移过程中的存活率[1-2]。大部分细胞都可通过程序降温,最终长时间保存于液氮或液氮气相层中[3-4]。在细胞冻存降温,保存及复苏过程中,冻存剂的种类,降温升温速率及冻存细胞密度均是影响细胞冻存效果的因素[5-6]。目前细胞冻存密度对冻存效果影响相关文章及报道较少,CIK细胞是临床肿瘤治疗比较常见的细胞类型[7-8],培养技术亦相当成熟,研究者通过检测复苏后PBMC的活率以及CIK扩增的扩增倍数、淋巴细胞亚群、体外杀伤效率,探讨细胞冻存密度对PBMC的影响。
1 材料与方法 1.1 材料 1.1.1 研究对象分别采集3名健康志愿者外周血100 mL,在2 h内对血液进行处理。所有血液标本收集均征得志愿者同意,并签署知情同意书。
1.1.2 主要试剂无血清培养基(GT-T511)购自日本TaKaRa公司,IFN-γ购自上海普欣生物技术有限公司,IL-1α、IL-2购自PeproTech公司,OKT3购自R & D公司,淋巴细胞分离液购自Nycomed Pharma AS公司,胎牛血清购自美国Gibco公司,FITC标记的CD3,PE标记的CD4,PerCP标记的CD8,APC标记的CD56购自美国BD公司,Calcein-AM购自美国Thermo fisher公司,PI购自美国Sigma公司,DMSO购自美国Origen公司,K562白血病细胞系为本实验室保存。
1.2 方法 1.2.1 PBMC提取采集3名志愿者外周血各100 mL,转移至离心管后离心,离心结束后,用移液器吸取上层淡黄色血浆层,并转移到2个新的50 mL离心管内并配平剩余的液体即为浓缩的血细胞,将装有血浆的两个离心管放入56℃水浴箱内进行补体灭活30 min后离心,离心完毕后,取上清备用,置于冰箱2-8℃保存。用生理盐水稀释浓缩的血细胞,并用Ficoll法离分单个核细胞,离尽管完毕后,取1 mL进行细胞计数及流式检测。计数后,根据细胞密度用移液管从细胞悬液中吸出1.5×107个细胞,加入到另一个50 mL离心管中用作新鲜组PBMC细胞CIK培养,剩下的细胞用作冻存。用作新鲜CIK培养的细胞用10 mL无血清培养基重悬,取200 μL进行细胞计数,活率检测。根据细胞密度用移液管吸取1×107的细胞加入到T75培养瓶中,待用。用作冻存的细胞用3 mL 4℃预冷的自体血浆重悬,取200 μL进行细胞计数,活率检测,待用。
1.2.2 CIK细胞培养在T75培养瓶中补加无血清培养基到10 mL,控制细胞密度为1.0×106/mL,加入1 mL自体灭活血浆,加入1 000 U/mL IFN-γ。培养24 h,培养液中添加0.1 μg/mL OKT3、1.0 ng/mL IL-1α与1 000 IU/mL IL-2,混匀,置于37℃,5% CO2培养箱继续培养;细胞培养每隔2 d补液并计数,补液后细胞密度维持1.2×106/mL[9-10]。
1.2.3 PBMC冻存将每名志愿者3 mL灭活补体血浆细胞悬液均分为3份,根据细胞密度,将细胞用冻存液配制成2.0×107/mL,4.0×107/mL,6.0×107/mL三个密度[9, 11-13],冻存液最终配比为:自体血浆:DMSO=9:1[14],将3个密度的细胞吸入到1.8 mL冻存管中,每支冻存管中装量为1 mL。每管贴上标签,放入程序降温盒,放入-80℃冰箱,隔夜转入-196℃气相罐中。
1.2.4 细胞复苏及再培养细胞冻存180 d后,对3个冻存细胞密度组细胞进行复苏。取出的冻存细胞管迅速放入37℃水浴锅中,水浴至冻存管中留有微小冰块,再用0.9%氯化钠注射液重悬洗涤细胞,用10 mL无血清培养基分别对3个密度的细胞进行重悬,记数后各取出1.0×107个细胞,用无血清培养基定容到10 mL,控制细胞密度为1.0×106/mL,分别吸入到3个T75培养瓶中;重复步骤1.4对复苏后的3组细胞进行CIK培养及计数[15]。
1.2.5 实验分组根据细胞类型分为新鲜组(F组)和冻存组(A组、B组、C组)2大类,如图 1,其中新鲜组(F组)采用未冻存PBMC诱导培养CIK;冻存组采用冻存PBMC诱导培养CIK细胞,按冻存密度共分为2.0×107/mL组(A组)、4.0×107/mL组(B组)和6.0×107/mL组(C组),每组3个样本,种瓶时控制细胞密度为1.0×106/mL,每瓶10 mL。
1.2.6 细胞表型检测收集三名志愿者新鲜PBMC(0 d),扩增7 d及14 d的细胞,调整细胞密度至1.0×105/mL,FITC-CD3标记T细胞亚群,FITC-CD3\PE-CD4标记辅助T细胞亚群,FITC-CD3\PerCP-CD8标记细胞毒性T细胞亚群,FITC-CD3\APC-CD56标记NKT及NK细胞亚群。
1.2.7 肿瘤杀伤活性检测取对数期生长的K562细胞株作为靶细胞,用PBS调整细胞密度为1.0-2.0×106 cell/mL,加入calcein-AM,使终浓度为0.1-0.2 μmol/L,37℃培养箱避光孵育30 min。离心,收集细胞沉淀,用PBS洗涤细胞2次,最后无血清的1640培养基重悬,调整细胞密度为4.0×105 cell/mL,分别取500 μL铺于24孔培养板中。取新鲜PBMC或冻存PBMC制备的CIK细胞(调整细胞密度为8.0×106cell/mL),分别加入到24孔培养板中,每孔加入500 μL,效靶比为20:1,设3个复孔,并设置2个空白对照,放置在37度培养箱中,共同培养16 h。收集细胞,用缓冲液洗涤细胞2次,并用100 μL缓冲液重悬,加入2 μL的PI染色15 min,流式上机检测细胞杀伤效率。
1.2.8 统计学处理采用SPSS22.0统计软件进行分析,计量数据采用x±s表示,组间比较采用独立样本t检验,组内比较采用配对t检验,P < 0.05表示差异具有统计学意义。
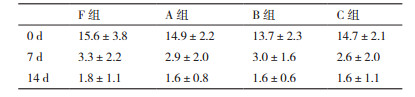
2 结果 2.1 PBMC冻存前后活率比较分别将3个志愿者样品3个冻存密度组PBMC(A组:2.0×107/mL;B组:4.0×107/mL;C组:6.0×107/mL)迅速复苏后缓慢加入生理盐水中,并定容到20 mL,充分混匀后取样计数和检测活率与新鲜PBMC组(F组)对比。结果(表 1)显示,A组活率(95.6±0.4%)相对F组(96.0±0.3%)差异无统计学意义,而B组(94.7±0.2%)、C组(94.9±0.4%)相对F组有显著差异(P < 0.05)。
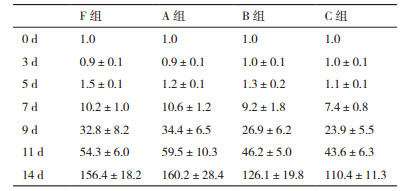
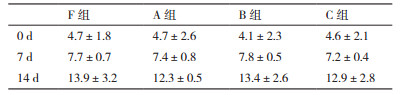
由表 2可以看出,F、A、B、C 4组细胞进行CIK细胞诱导培养后,扩增倍数分别达到156.4±18.2、160.2±28.4、126.1±19.8和110.4±11.3倍,B、C组扩增倍数和F组相比有显著差异(P < 0.05),而A组与F组相比,差异无统计学意义(P > 0.05)。
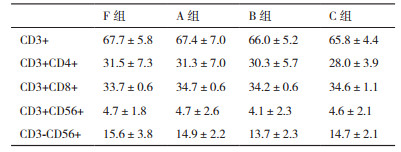
A、B、C组PBMC复苏后,与F组相比,淋巴细胞表型没有明显差异(P > 0.05),见表 3。
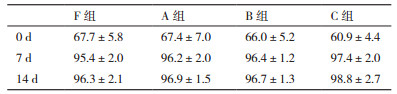
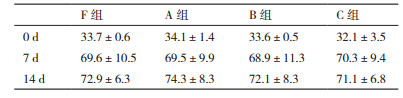
CD3+,CD3+ CD8+,CD3+CD4+,CD3+CD56+,CD3-CD56+细胞比较,4组细胞培养14 d,A/B/C组与F组相比,CD3+,CD3+CD8+,CD3+CD4+,CD3+CD56+,CD3-CD56+的比例均无明显差异,见表 4-8。
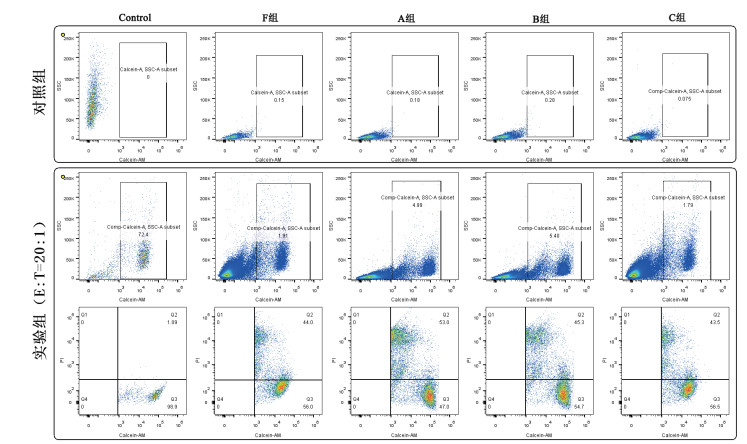
CIK细胞体外杀伤作用比较。4组细胞培养14 d,A/B/C组与F组对比,对K562细胞体外杀伤无明显差异,见表 9,图 1。
|
| 图 1 CIK细胞杀伤作用比较 |
近年来,随着细胞银行及细胞库广泛开展,对细胞冻存技术的要求也越来越严格。细胞冻存的质量直接决定了细胞复苏后的应用。目前尚未见冻存密度对PBMC功能影响的文献报道,偶见细胞系或其他体细胞对冻存密度的敏感性文献[16-18]。通过CIK方式培养PBMC,可在一定程度上验证冻存对PBMC功能的影响[19]。本研究通过设置不同PBMC冻存密度,并通过冻存PBMC与新鲜PBMC CIK培养效果对比,来验证冻存密度对PBMC功能的影响。3个样品(Donor A、Donor B和Donor C)的3个不同冻存密度细胞复苏后再进行CIK培养,其中2.0×107/mL冻存密度组与新鲜组相比,诱导CIK细胞扩增倍数比较无明显差异,甚至高于未冻存细胞;而4.0×107/mL和6.0×107/mL两个密度冻存的细胞复苏后诱导ECIK细胞培养14 d,扩增倍数与未冻存细胞相比扩增倍数有显著差异,具有统计学意义。从活率来看,2.0×107/mL冻存密度组与新鲜组相比,活率无明显差异,而4.0×107/mL和6.0×107/mL两个密度冻存的细胞复苏后活率与新鲜组相比活率有显著差异,具有统计学意义,
3种不同密度冻存的细胞复苏后流式表型检测结果与新鲜PBMC相比,无明显差异,且冻存细胞与新鲜PBMC对比,经过诱导CIK细胞培养后,流式表型也无明显差别,说明冻存对PBMC的表型和功能没有影响。另外,3份样品冻存前后培养CIK细胞14 d后体外杀伤作用检测结果也无明显差异。
Kawai等[20]在1988年的研究中认为,冻存后的PBMC(冻存密度为2.0×107/mL,冻存时间12个月)与新鲜组相比,淋巴细胞亚群比例无明显变化,但诱导为LAK细胞及NK细胞后,对k562、Raji等肿瘤细胞体外杀伤效率较低,可能与其冻存剂的种类影响有关。
过高的PBMC冻存密度会影响其冻存效果而间接影响细胞的复苏应用,而过低的冻存密度因为增加冻存体积而大大提高冻存成本,这两点都是大样本量细胞库或细胞银行要考虑到的问题。本实验通过CIK扩增方法证明了2.0×107/mL、4.0×107/mL、6.0×107/mL三个冻存密度对PBMC的影响,本实验研究人员将在未来的实验中扩大冻存密度验证范围以及用更多的PBMC应用(培养)方法从多角度证明实验观点。
4 结论通过本实验可以看出,3个冻存密度对PBMC的表型及进行CIK培养后对K562的体外杀伤效率无影响,但4.0×107和6.0×107两个冻存密度对PBMC复活的活率及CIK培养的扩增率有显著影响。
由此可见,采用2.0×107密度冻存的细胞冻存后培养效果较好,且与未冻存细胞相比无明显差异,均能达到制备需求,而采用4.0×107和6.0×107密度冻存后细胞扩增倍数均与未冻存细胞有一定差异,因此,选择2.0×107密度进行冻存效果较好。
| [1] |
Masters JR, Stacey GN. Changing medium and passaging cell lines[J]. Nature Protocols, 2007, 2(9): 2276-84. DOI:10.1038/nprot.2007.319 |
| [2] |
张元兴, 易小萍, 张立. 动物细胞培养工程[M]. 北京: 化学工业出版社, 2007.
|
| [3] |
Stacey GN, Masters JR. Cryopreservation and banking of mammalian cell lines[J]. Nature Protocols, 2008, 3(12): 1981-1989. DOI:10.1038/nprot.2008.190 |
| [4] |
Yang J, Diaz N, Adelsberger J, et al. The effects of storage temperature on PBMC gene expression[J]. BMC Immunology, 2016, 17: 6. DOI:10.1186/s12865-016-0144-1 |
| [5] |
李广武, 郑从义, 唐兵. 低温生物学[M]. 长沙: 湖南科学技术出版社, 1998.
|
| [6] |
Angel S, Von Briesen H, Oh YJ, et al. Toward optimal cryopreserva-tion and storage for achievement of high cell recovery and maintena-nce of cell viability and T cell functionality[J]. Biopreserv Bio-bank, 2016, 14(6): 539-547. DOI:10.1089/bio.2016.0046 |
| [7] |
Mesiano G, Todorovic M, Gammaitoni L, et al. Cytokine-induced killer(CIK)cells as feasible and effective adoptive immunotherapy for the treatment of solid tumors[J]. Expert Opinion on Biological Therapy, 2012, 12(6): 673-684. DOI:10.1517/14712598.2012.675323 |
| [8] |
陈复兴, 刘军权, 张南征, 等. 自身细胞因子诱导的杀伤细胞过继性免疫治疗恶性肿瘤的临床观察[J]. 癌症, 2002, 21(7): 797-801. |
| [9] |
Jeurink PV, Vissers YM, Rappard B, et al. T cell responses in fresh and cryopreserved peripheral blood mononuclear cells: kinetics of cell viability, cellular subsets, proliferation, and cytokine production[J]. Cryobiology, 2008, 57(2): 91-103. DOI:10.1016/j.cryobiol.2008.06.002 |
| [10] |
Giancola R, Olioso P, Riti MD, et al. Evaluation of an automated closed fluid management device for processing expanded cytokine-induced killer cells to use in immunotherapy programs for cancer[J]. Transfusion, 2008, 48(4): 629-639. DOI:10.1111/j.1537-2995.2007.01587.x |
| [11] |
Heo YJ, Son CH, Chung JS, et al. The cryopreservation of high concentrated PBMC for dendritic cell(DC)-based cancer immunotherapy[J]. Cryobiology, 2009, 58(2): 203-209. DOI:10.1016/j.cryobiol.2008.12.006 |
| [12] |
Kreher CR, Dittrich MT, Guerkov R, et al. CD4+ and CD8+ cells in cryopreserved human PBMC maintain full functionality in cytokine ELISPOT assays[J]. Journal of Immunological Methods, 2003, 278(1-2): 79-93. DOI:10.1016/S0022-1759(03)00226-6 |
| [13] |
Strong DM, Ortaldo JR, Pandolfi F, et al. Cryopreservation of human mononuclear cells for quality control in clinical immunology. Ⅰ. Correlations in recovery of K- and NK-cell functions, surface markers, and morphology[J]. Journal of Clinical Immunology, 1982, 2(3): 214-221. DOI:10.1007/BF00915224 |
| [14] |
Best A, Hidalgo G, Mircheil K, et al. Issues concerning the large scale cryopreservation of peripheral blood mononuclear cells(PBMC)for immunotherapy trials[J]. Cryobiology, 2007, 54(3): 294-297. DOI:10.1016/j.cryobiol.2007.02.002 |
| [15] |
Sleasman JW, Leon BH, Aleixo LF, et al. Immunomagnetic selection of purified monocyte and lymphocyte populations from peripheral blood mononuclear cells following cryopreservation[J]. Clinical and Diagnostic Laboratory Immunology, 1997, 4(6): 653-658. |
| [16] |
郭海平, 郭冠萍, 郝鹏. BHK21细胞冻存密度与复苏后活力的关系分析[J]. 畜牧与饲料科学, 2010, 31(3): 6-7. DOI:10.3969/j.issn.1672-5190.2010.03.003 |
| [17] |
杨银芬, 考桂兰, 侯先志, 等. 不同细胞密度冻存对奶牛乳腺上皮细胞的影响[J]. 中国细胞生物学学报, 2010, 32(4): 626-629. |
| [18] |
丁伟峰, 冯颖, 张欣, 等. 密度对黑腹果蝇胚细胞系L-2/M delta 2-3冻存效果的影响[J]. 林业科学研究, 2012, 25(1): 6-10. DOI:10.3969/j.issn.1001-1498.2012.01.002 |
| [19] |
黄体龙, 杨跃煌. 外周血单个核细胞冻存后诱导为CIK细胞及其抗肿瘤效应的研究[J]. 中国小儿血液与肿瘤杂志, 2007, 12(5): 204-208. DOI:10.3969/j.issn.1673-5323.2007.05.003 |
| [20] |
Kawai H, Komiyama A, Katoh M, et al. Induction of lymphokine-activated killer and natural killer cell activities from cryopreserved lymphocytes[J]. Transfusion(Bethesda), 1988, 28(6): 531-535. |