党参是我国传统的大宗中药,具有补中益气、健脾益肺等功效。在2015版《中华人民共和国药典》中记载:党参为桔梗科植物党参[Codonopsis pilosula(Franch.)Nannf.]、川党参(Codonopsis tangshen Oliv.)、素花党参[Codonopsis pilosula Nannf.var.modesta(Nannf.)L.T.Shen]等多种同属植物的干燥根[1]。主要有效成分有多糖类、生物碱、皂苷等。其中,党参多糖主要由戊糖、己糖及其衍生物糖醇、糖酸组成,具有抗氧化和抗衰老[2]、调节免疫[3]、促进机体造血[4]的功能,临床可用于降糖降脂等。
目前,针对党参多糖的研究主要集中于提取工艺、含量测定、多糖结构解析以及药理作用方面。在免疫调节方面,已有文献报道了轮叶党参[5]、素花党参[6]、道真洛龙党参[7]等不同品种的党参多糖成分或其制剂对巨噬细胞株释放炎症性因子,以及小鼠[8]、大鼠[9]、肉仔鸡[10]、仔猪[11]等动物的免疫功能的调节活性。本研究以山西省南部道地药材潞党参的多糖为研究对象,分析其对小鼠巨噬细胞Ana-1产生TNF-α和IL-1β的影响,进而通过体内实验,探讨了党参多糖对小鼠免疫器官、血清中炎症性因子等的影响,分析其对免疫功能的调节作用。
1 材料与方法 1.1 材料 1.1.1 试剂RPMI-1640培养基购自北京索来宝生物科技有限公司;胎牛血清购自赛默飞世尔科技(中国)有限公司;胰蛋白酶、四氮甲基唑蓝(Methyl thiazolyl tetrazolium,MTT)、青链霉素、二甲基亚砜(Dimethyl sulfoxide,DMSO)等购自北京依托华茂生物科技有限公司;小鼠IL-1β ELISA试剂盒和小鼠TNF-α ELISA试剂盒均购自武汉博士德生物工程有限公司。
1.1.2 材料党参购自山西省长治市昂生大药房;小鼠巨噬细胞Ana-1购自武汉博士德生物工程有限公司;昆明种小鼠共30只,雌性,每只(20 ± 2)g,由山西康宝生物制品股份有限公司提供。
1.1.3 主要仪器CO2培养箱(美国热电公司);细胞计数仪Cellometer Auto1000(美国Nexcelom公司);多功能酶标仪SpectraMax M2(美谷分子仪器(上海)有限公司);高速冷冻离心机(HITACHI)。
1.2 方法 1.2.1 MTT实验本研究以山西省长治市所产的道地药材潞党参为材料,通过传统的水提醇沉法获得粗多糖,然后通过Sevag法脱蛋白和透析法除去小分子进行精制,即得党参多糖样品。具体方法参照文献[12]。前期研究显示高于0.25 mg/mL的党参多糖会抑制人宫颈癌细胞SiHa细胞生长[13],因此本研究以终浓度为0.01、0.03、0.06、0.12和0.25 mg/mL的党参多糖处理小鼠巨噬细胞Ana-1,并参照该文献中的方法,按照1×104个/孔的浓度,将Ana-1细胞接种到96孔板中,用不同浓度的党参多糖处理,每个浓度设置5个复孔。继续培养48 h后,加入MTT溶液,测定OD570值,然后计算细胞存活率。
1.2.2 Ana-1细胞释放TNF-α和IL-1β含量的测定用不同浓度的党参多糖处理Ana-1细胞48 h后,取上清液,按照ELISA试剂盒说明书进行操作。根据标准曲线来计算小鼠巨噬细胞培养液中TNF-α和IL-1β的含量。
1.2.3 动物分组及处理将小鼠适应性喂养3 d后随机分为5组,每组6只,分别为阴性对照组、阳性对照组及党参多糖高、中、低剂量组。参照文献[7, 14-15],设置阳性对照组灌胃盐酸左旋咪唑(40 mg/kg),高、中、低剂量组分别灌胃0.62、0.31和0.16 mg/g体重的党参多糖,连续灌胃10 d,阴性对照组给予等体积的生理盐水。实验期间各组小鼠自由采食、饮水。
1.2.4 小鼠胸腺指数的测定将小鼠处死后,取出胸腺,用滤纸吸干后,准确称重,然后按公式:胸腺指数=胸腺质量(mg)/体质量(g)计算各组小鼠的胸腺指数。
1.2.5 小鼠淋巴细胞增殖能力的测定在无菌条件下,将小鼠脾脏制成单细胞悬液,计数,调整细胞浓度为2.5×106个/mL,按照每孔200 μL加入到96孔培养板中。再加入终浓度为2 μg/mL的ConA,同时设空白对照(只加细胞悬液),在37℃、5% CO2培养箱中孵育72 h。取出培养板,每孔中加入10%的MTT溶液(储液浓度5 mg/mL),继续培养4 h后,每孔中加入100 μL DMSO,振摇10 min,待紫色结晶完全溶解后,酶标仪读取570 nm波长处OD值。按照公式“淋巴细胞增殖指数=实验组吸光度值/空白对照组吸光度值”计算细胞增殖指数。
1.2.6 小鼠血清中TNF-α和IL-1β含量的测定将取得的小鼠血液在室温下自然凝固15 min,3 000 r/m离心10 min。小心收集上清液,待用。采用ELLSA法测定小鼠血清中TNF-α和IL-1β含量。
1.2.7 统计学分析实验结果以平均值±标准差x±s表示。利用SPSS 10.0软件对所得数据进行处理,并进行t检验。
2 结果 2.1 党参多糖对Ana-1细胞存活的影响分别用终浓度为0.01、0.03、0.06、0.12和0.25 mg/mL的党参多糖处理小鼠巨噬细胞Ana-1 48 h后,利用MTT法检测细胞存活率。结果如图 1所示,上述浓度的党参多糖都不影响Ana-1细胞的生长,存活率均接近100%。
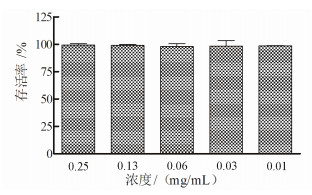
|
| 图 1 党参多糖对Ana-1细胞存活的影响 |
不同浓度的党参多糖处理Ana-1细胞48 h后,取细胞培养上清液,按照试剂盒说明书,分别检测培养液中TNF-α和IL-1β的含量。结果如图 2所示,与未加多糖的空白对照组细胞相比较,党参多糖浓度越高,细胞培养液中TNF-α含量越高,当多糖终浓度达到3.13 mg/mL时,TNF-α的释放量显著增多(P < 0.05),当党参多糖浓度高于6.25 mg/mL后,TNF-α释放量增加极显著(P < 0.01)。党参多糖对Ana-1细胞产生IL-1β的影响结果如图 3所示,当其终浓度高于6.25 mg/mL时,Ana-1细胞IL-1β产生增加极显著(P < 0.01)。因此,党参多糖能够在体外明显增强小鼠巨噬细胞炎症相关因子的释放量。

|
| 与对照组相比,*P < 0.05,**P < 0.01 图 2 党参多糖对Ana-1细胞产生TNF-α的影响 |
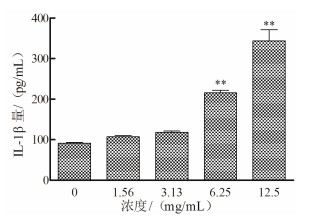
|
| 与对照组相比,**P < 0.01 图 3 党参多糖对Ana-1细胞产生IL-1β的影响 |
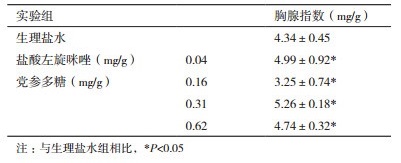
由表 1可知,盐酸左旋咪唑实验组(阳性对照)与生理盐水实验组(阴性对照)相比,胸腺指数明显升高(P < 0.05),表明盐酸左旋咪唑能使小鼠免疫功能增强。与阴性对照组相比,党参多糖中、高剂量组能显著提高小鼠胸腺指数(P < 0.05)。
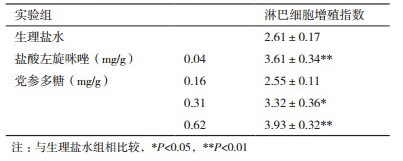
由表 2可知,Con A诱导下,与阴性对照生理盐水组相比,阳性对照盐酸左旋咪唑极显著地增强了淋巴细胞增殖指数(P < 0.01)。与阴性对照组相比,中剂量的党参多糖能显著地(P < 0.05)提高淋巴细胞的增殖;高剂量的党参多糖则极显著地增强了淋巴细胞的增殖能力(P < 0.01)。
由图 4所示,与阴性对照生理盐水组(164.54±26.26 pg/mL)相比,阳性对照盐酸左旋咪唑极显著地提高了小鼠血清红TNF-α的水平(452.25±28.97 pg/mL,P < 0.01)。中剂量和高剂量党参多糖也能极显著提高小鼠血清中TNF-α水平(P < 0.01),分别为264.13±33.56 pg/mL和377.13±31.85 pg/mL。由图 5所示,与生理盐水组(106.60±2.51 pg/mL)相比,中浓度和高浓度的党参多糖极显著增高了小鼠血清中IL-1β的含量(P < 0.01),分别为132.96±7.10 pg/mL和162.36±9.97 pg/mL。但是,低剂量的党参多糖对小鼠血清中TNF-α和IL-1β水平的影响,没有显著性差异。

|
| 与对照组相比,*P < 0.05,**P< 0.01 图 4 党参多糖对小鼠血清中TNF-α水平的影响 |
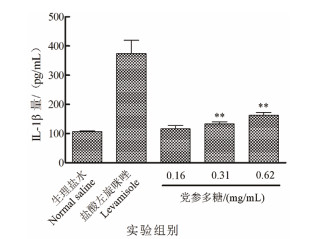
|
| 与对照组相比,**P < 0.01 图 5 党参多糖对小鼠血清中IL-1β水平的影响 |
在免疫应答过程中,巨噬细胞通过吞噬作用清除侵入机体的病原微生物,然后通过抗原加工和提呈,从而发挥抗体依赖的免疫作用[16-17]。此外,当巨噬细胞被激活后,还会产生多种细胞因子。如NO、TNF-α、多种白细胞介素等,参与机体多种生理过程。TNF-α是一种参与天然免疫和获得性免疫反应的多功能细胞因子,能激活其他免疫细胞,同时能诱导白细胞趋化运动及其表明黏附分子的表达,从而选择性抑制某些肿瘤细胞。Qin等[18]发现硒化党参多糖能够增强巨噬细胞RAW264.7的吞噬功能,以及NO、TNF-α和IL-6的释放,而且可提高小鼠腹腔巨噬细胞的吞噬指数,并诱导TNF-α和IL-6的分泌。石轶男等[19]发现党参多糖可能通过NF-κB信号通路增强小鼠巨噬细胞RAW264.7的TNF-α和IL-6产生。本研究发现党参多糖能有效增强小鼠巨噬细胞Ana-1的TNF-α分泌量,并且前期研究显示当党参多糖浓度高于12.5 mg/mL后,TNF-α分泌量无显著改变。进一步的体内实验也表明,党参多糖显著提高了小鼠血清中TNF-α的含量,接近阳性对照盐酸左旋咪唑的效果,与上述结果一致。
IL-1β是介导炎症反应的一种主要促炎因子,有活化的巨噬细胞分泌产生,可促进B淋巴细胞产生抗体,诱导T淋巴细胞分泌IL-2,且体外实验研究显示,IL-1β可直接杀伤多种肿瘤细胞[20-21]。阎海青等[22]发现蓝莓多酚能抑制RAW264.7细胞中IL-1β的表达;张东芳等[23]的研究显示表没食子儿茶素-3-没食子酸酯可抑制LPS诱导的RAW264.7细胞TNF-α和Il-1β的表达,发挥抗炎效应;康峰[24]的研究则显示灵芝多糖能有效促进巨噬细胞分泌IL-1β,增强巨噬细胞活性。本实验发现党参多糖能显著提高巨噬细胞Ana-1的IL-1β分泌量和小鼠血清中IL-1β水平,因此党参多糖可能发挥免疫增强作用。
胸腺和脾脏是人类和动物体内主要的免疫器官,胸腺指数和脾脏指数主要反映了机体非特异免疫能力的强弱。脾脏是机体内最大的淋巴器官和血流通路中的过滤器官,是机体细胞免疫和体液免疫的中心[25]。贾林等[26]研究表明,桔梗多糖能明显增加免疫抑制小鼠的胸腺指数和脾脏指数,显著提高血清中IL-2和TNF-α的含量并呈剂量依赖性。林丹丹等[14]发现党参多糖在硒化后,更能够提高免疫器官指数、淋巴细胞增殖能力和血清免疫球蛋白分泌等作用。本研究发现党参多糖能够显著增强T淋巴细胞的增殖,提高实验小鼠的胸腺指数,并呈剂量依赖关系,高剂量(0.62 mg/g)的党参多糖与阳性对照盐酸左旋咪唑(0.04 mg/g)的效果相当。
4 结论党参多糖在体外不影响小鼠巨噬细胞Ana-1的增殖,却显著增强其TNF-α和IL-1β的分泌;进一步的体内实验表明,在ConA刺激下,党参多糖能明显促进淋巴细胞的增殖,提高小鼠的胸腺指数及其血清中TNF-α和IL-1β的含量,均呈剂量依赖关系。
| [1] |
国家药典委员会.中华人民共和国药典[S].北京: 中国医药科技出版社, 2015.
|
| [2] |
李贵荣, 杨胜圆. 党参多糖的提取及其对活性自由基的清除作用[J]. 化学世界, 2001, 56(8): 421-423. DOI:10.3969/j.issn.0367-6358.2001.08.009 |
| [3] |
张华荣, 姜国辉. 党参药理及临床研究进展[J]. 中医药信息, 1996, 13(5): 17-21. |
| [4] |
郭晓农, 戚欢阳, 王兵, 等. 党参多糖对衰老模型小鼠的抗衰老作用[J]. 中国老年学杂志, 2013, 33(21): 5371-5272. DOI:10.3969/j.issn.1005-9202.2013.21.076 |
| [5] |
张妍, 林昌岫, 邵玉健, 等. 轮叶党参粗多糖对体外培养小鼠脾淋巴细胞及RAW264. 7细胞的免疫活性[J]. 食品工业科技, 2018, 39(12): 311-315. |
| [6] |
李开菊, 陈文倩, 周霞, 等. 素花党参多糖对乌鸡生长性能、免疫功能、血常规及肠道菌群的影响[J]. 四川畜牧兽医, 2017, 326(10): 32-36. |
| [7] |
余兰, 王毅. 道真洛龙党参多糖对小鼠免疫活性的影响[J]. 遵义医学院学报, 2016, 39(1): 10-13. |
| [8] |
晏永新, 张丽, 贾海芳, 等. 党参多糖口服液对小鼠免疫功能的影响[J]. 中国兽药杂志, 2013, 47(3): 18-20. |
| [9] |
王爱青. 党参多糖对肾阴虚大鼠抗氧化活性和免疫调节影响[J]. 中医药临床杂志, 2018, 30(2): 287-290. |
| [10] |
郭艳丽, 钟光柱, 王荣. 红芪、党参复方添加剂对肉仔鸡抗氧化能力和免疫功能的影响[J]. 中国饲料, 2012(19): 26-28. DOI:10.3969/j.issn.1004-3314.2012.19.010 |
| [11] |
李成, 尹莉莉, 朱电锋, 等. 党参多糖对仔猪小肠黏膜免疫功能的影响[J]. 江苏农业学报, 2018, 34(2): 347-355. DOI:10.3969/j.issn.1000-4440.2018.02.018 |
| [12] |
胡建燃, 郭阳, 李平. 潞党参多糖的提取及其抗氧化活性分析[J]. 中国食品添加剂, 2016, 149(7): 93-96. DOI:10.3969/j.issn.1006-2513.2016.07.007 |
| [13] |
胡建燃, 李平, 雷海英, 等. 潞党参多糖对宫颈癌细胞SiHa增殖和迁移的影响[J]. 生物技术通报, 2017(5): 159-163. |
| [14] |
林丹丹, 秦韬, 任喆, 等. 硒化党参多糖对免疫抑制小鼠免疫功能的影响[J]. 中国畜牧兽医, 2016, 43(6): 1544-1549. |
| [15] |
龚其海, 赵万, 余兰, 等. 两种党参多糖对小鼠免疫功能影响的比较[J]. 遵义医学院学报, 2012, 35(14): 267-270. |
| [16] |
Locati M, Mantovani A, Sica A. Macrophage activation and polarization as an adaptive component of innate immunity[J]. Advances in Immunology, 2013, 120: 163-184. DOI:10.1016/B978-0-12-417028-5.00006-5 |
| [17] |
Liu GW, Yang H. Modulation of macrophage activation and programming inimmunity[J]. Journal of Cellular Physiology, 2013, 228(3): 502-512. DOI:10.1002/jcp.v228.3 |
| [18] |
Qin T, Ren Z, Lin D, et al. Effects of Selenizing Codonopsis pilosula polysaccharide on macrophage modulatory activities[J]. Journal of Microbiology and Biotechnology, 2016, 26(8): 1358-1366. DOI:10.4014/jmb.1601.01094 |
| [19] |
石轶男, 孙娜, 孙耀贵, 等. 党参多糖对巨噬细胞的诱导活化作用[J]. 畜牧兽医学报, 2017, 48(4): 777-784. |
| [20] |
Dinaralla DA. Interleukin-1 and its biologically related cytokine[J]. Advances in Immunology, 1989, 44: 153-205. DOI:10.1016/S0065-2776(08)60642-2 |
| [21] |
Ohta K, Pang XP, Berg L, et al. Antitumor actions of cytokines on new human papillary thyroid carcinoma cell lines[J]. Journal of Clinical Endocrinology & Metabolism, 1996, 81(7): 2607-2612. |
| [22] |
阎海青, 等. 蓝莓多酚对巨噬细胞IL-1β、IL-6基因表达的影响[J]. 核农学报, 2014, 28(10): 1828-1833. DOI:10.11869/j.issn.100-8551.2014.10.1828 |
| [23] |
张东芳, 肖鹏, 韩晨露, 等. 表没食子儿茶素-3-没食子酸酯抑制脂多糖诱导的巨噬细胞促炎因子TNF-α和IL-1β基因表达[J]. 中国生物化学与分子生物学报, 2014(4): 402-408. |
| [24] |
康峰. 灵芝多糖对长期运动大鼠巨噬细胞吞噬功能及NO和IL-1β表达的影响[J]. 动物医学进展, 2017, 38(6): 61-65. DOI:10.3969/j.issn.1007-5038.2017.06.014 |
| [25] |
崔治中, 崔保安. 兽医免疫学[M]. 北京: 中国农业大学出版社, 2010.
|
| [26] |
贾林, 陆金健, 周文雅, 等. 桔梗多糖对环磷酰胺诱导的免疫抑制小鼠的免疫调节[J]. 食品与机械, 2012(3): 112-114. DOI:10.3969/j.issn.1003-5788.2012.03.031 |