2. 贵州大学环境工程规划设计研究院,贵阳 550025;
3. 贵州大学科技园发展有限公司,贵阳 550025
2. Institute of Environmental Engineering Planning and Designing, Guizhou University, Guiyang 550025;
3. The Science Park Development Co., Ltd., of Guizhou University, Guiyang 550025
由于工业迅速发展,锑(Antimony,Sb)及其化合物受到越来越多的关注,并在环境中呈现高浓度水平[1-2],尤其富矿区域分布集中且浓度较高[3]。锑作为一种新兴的全球性环境污染物,对生物体存在慢性毒性和潜在致癌性的危险物质,被美国环保署和欧洲多国列为优先防治污染物,在巴塞尔公约中,锑被列为可越境迁移的环境染物之一[4]。中国是产锑大国,全球超过90%的锑来自中国[5]。矿井废水及残留物是锑最大的来源和浓度高的区域[6-7]。因此,伴随着锑矿的开采、冶炼,大量的锑流入到空气、水体及土壤中,通过呼吸,皮肤吸收及食物链进入人体,对人体的心脏、皮肤等器官造成伤害[8-9]。卢莎莎等[10]测定了都柳江干流和支流水体中的锑含量发现,都柳江部分水体中含锑量高达2 223 μg/L,反映出我国面临严峻的锑污染状况。
近年来,研究学者对锑的毒性试验研究进行了报道。王安等[11]以小鼠为受体,发现锑引起小鼠肝损害的机理与其损伤肝线粒体的抗氧化能力,产生脂质过氧化作用有关。王凯[12]研究发现锑能够对蚯蚓金属硫蛋白产生诱导效应,且蚯蚓金属硫蛋白含量与锑暴露浓度呈显著正相关。Yang[13]研究表明三价锑对青虾的半数致死浓度是1.962 6 mg/L。综上研究表明锑对生物体都具有明显的毒性效应。
为了研究锑胁迫下,生物体内各类酶活性的变化,本研究选取斑马鱼为受体进行试验,了解生物对锑胁迫的响应机制。斑马鱼与人的基因相似度高达87%[14],是一种模式生物,其生长周期短、鱼卵体外受精易收集、鱼身通体透明[15],被广泛用于生态毒理学研究。近年来,锑对斑马鱼毒性的研究基本仅限于半数致死浓度及富集系数,而锑胁迫对斑马鱼的酶活性效应研究鲜有报道。过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxisome,POD)和超氧化物歧化酶(Superoxide dismutase,SOD)隶属于生物体内的抗氧化酶系统,该系统可以消除多余自由基,维持体内自由基在一个正常的水平内,保护细胞[16-17]。Na+K+-ATPase酶既是酶又是载体,可以催化ATP水解,同时也是组成Na+-K+泵活性的主要成分[18]。神经冲动的正常传递要靠乙酰胆碱酯酶(Acetylcholinesterase,AchE)来维持[19]。乳酸脱氢酶(Lactate dehydrogenase,LDH)是在细胞内催化乳酸氧化成丙酮酸的重要酶[20]。磷酸酶参与一些营养物质的消化、吸收、运输,还是生物体内重要的解毒体系,在蛋白质去磷酸化过程中也起着十分重要的作用[21]。根据其反应的pH环境分为酸性磷酸酶(Lactate dehydrogenase,ACP)和碱性磷酸酶(Alkaline phosphatase,AKP)。因此,本研究以斑马鱼为受体做毒性试验,研究不同影响因素下斑马鱼体内CAT、POD、SOD、AchE、LDH、Na+K+-ATPase酶、ACP和AKP活性的变化,从而探讨锑胁迫下斑马鱼体内酶系统的应激反应及斑马鱼应对锑胁迫的响应机制。以期类比人体受锑胁迫时所产生的毒性效应及体内酶系统的响应机制,了解锑对人体的毒害作用。
1 材料与方法 1.1 材料 1.1.1 实验用鱼市售斑马鱼,体长3-4 cm,在实验室条件(24 h曝气,26℃,光暗周期为t(光):t(暗)=12 h:12 h),用曝气3 d的自来水驯养1个月。每日吸取粪便及残余饵料,并置换1/2的水(曝气3 d),每日喂食(水骚干)两次,直至死亡率小于1%方可用于毒理实验,实验前24 h停止喂食。
1.1.2 器材紫外分光光度计、冷冻离心机、冷冻匀浆机、水浴锅、分析天平、容量瓶等。
1.1.3 试剂过氧化氢酶测定试剂盒(可见光法)、总超氧化物歧化酶测试盒(羟胺法)、过氧化物酶测定试剂盒(比色法)、超微量Na+K+-ATP酶测定试剂盒、乙酰胆碱酯酶测试盒、乳酸脱氢酶试剂盒(比色法)、酸性磷酸酶测定试剂盒(分光光度法)、碱性磷酸酶测定试剂盒(可见光比色法)、总蛋白测定试剂盒(考马斯亮蓝法)(所有试剂盒均购于南京建成生物工程研究所),酒石酸锑钾、NaCl等。
1.2 方法 1.2.1 锑胁迫下斑马鱼酶活性的变化用曝气3 d的自来水和酒石酸锑钾配制锑溶液(0、10、20、30和40,0 mg/L为对照组),准备5个10 L鱼缸,分别加入不同浓度的锑溶液和20尾体长3-4 cm、禁食24 h的成年斑马鱼。定期(24、48、96和144 h)取出斑马鱼,用生理盐水洗净后置于-20℃保存备用。
将斑马鱼样品制备成组织匀浆,通过酶活试剂盒对斑马鱼匀浆液进行处理,再用紫外分光光度计测定其吸光度,CAT、POD、SOD、AchE、LDH、ATP、ACP和AKP活性的变化情况。
1.2.2 数据分析本实验所有数据均测了3组平行,全部取平均值,用Origin9.1进行图片绘制,用SPSS 20进行显著性分析等。
2 结果 2.1 Sb对斑马鱼抗氧化酶系统活性的影响 2.1.1 Sb对CAT活性的影响图 1展示了锑对斑马鱼CAT活性的影响,培养时间为24 h时,与对照组浓度相比,不同锑浓度都对CAT活性有显著的抑制作用,锑浓度为10 mg/L时,在48、96和144 h时CAT活性均大于对照组,锑浓度为20 mg/L时,CAT活性随时间的增加呈现先升高再降低的变化趋势。

|
| 图 1 锑对斑马鱼CAT活力的影响 |
图 2展示了锑对斑马鱼SOD活性的影响,从图中看出,随着锑胁迫时间增加,锑含量为20、30和40 mg/L时SOD活性呈现先增高后降低的趋势;在24、48和144 h时,各浓度组SOD活性基本都小于对照组,在96 h时,各浓度组酶活性都大于对照组。

|
| 图 2 锑对斑马鱼SOD活力的影响 |
锑对斑马鱼POD活性的影响由图 3可见,在24和144 h时,各浓度组POD活性均低于对照组,在48 h时,除40 mg/L时POD活性低于对照组,其余浓度组POD活性均高于对照组;在96 h时,10和40 mg/L浓度组POD活性低于对照组,20和30 mg/L浓度组POD活性高于对照组。

|
| 图 3 锑对斑马鱼POD活力的影响 |
锑对斑马鱼Na+K+-ATPase酶活性的影响见图 4,由图可知,在24 h时,不同浓度Sb胁迫下斑马鱼Na+K+-ATPase酶活性均低于对照组,随时间增加,10和20 mg/L浓度组酶活性也显著增加;30和40 mg/L浓度组在48和96 h酶活性都呈现降低趋势,而后随时间增加到144 h,酶活性升高。
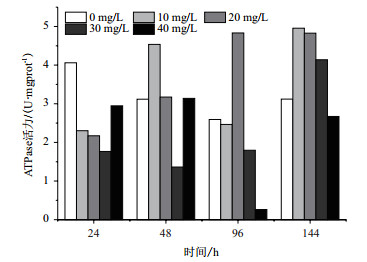
|
| 图 4 锑对斑马鱼Na+K+-ATPase活力的影响 |
锑对斑马鱼AchE活性的影响见图 5,由图可知,在24 h时,各个浓度组锑胁迫下的AchE活性均低于对照组,随着时间增加,低浓度组(10 mg/L)对AchE活性呈诱导效应,高浓度组(30和40 mg/L)对酶活仍呈抑制作用。

|
| 图 5 锑对斑马鱼AchE活力的影响 |
锑对斑马鱼LDH活性的影响见图 6,由图可知,在24 h时,各浓度组酶活性均低于对照组,在48和96 h时,低浓度组(10和20 mg/L)酶活性高于对照组,高浓度组(30和40 mg/L)酶活性低于对照组,LDH酶活性随锑胁迫浓度增加整体呈现“锯齿形”变化趋势。

|
| 图 6 锑对斑马鱼LDH活力的影响 |
Sb对斑马鱼ACP活性的影响见图 7,从图中可知,随着时间增加,其ACP活性呈“锯齿形”变化趋势,在24 h时,各浓度组ACP活性均低于对照组,低浓度时(10 mg/L),在48和96 h时的ACP活性均高于对照组,而144 h时ACP活性则低于对照组。
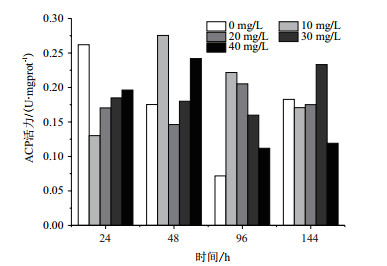
|
| 图 7 锑对斑马鱼ACP活力的影响 |
Sb对斑马鱼AKP活性的影响见图 8,从图中可见,在24 h时,低浓度组(10和20 mg/L)酶活性低于对照组,高浓度组(30和40 mg/L)酶活性则高于对照组。在48 h时,各浓度组AKP酶活性均高于对照组,在96 h时,10、20和30 mg/L酶活性高于对照组,而40 mg/L酶活性则低于对照组。
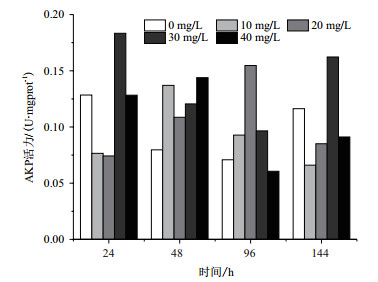
|
| 图 8 锑对斑马鱼AKP活力的影响 |
利用Univariat模型,分别对8种酶活性随时间增加和Sb浓度增加的变化情况进行显著性分析。
结果由表 1可知,除AKP活性随时间增长一般显著外,其他酶活性随时间和Sb浓度变化均呈极显著,表明酶活性对时间和Sb浓度变化敏感度较强,数据有一定的统计意义。
生物体内的活性氧自由基(Reactive oxygen species,ROS)是代谢过程中必不可少的产物,通常情况ROS的产生与清除处于动态平衡,而当生物处于重金属胁迫、有机物污染等逆境中时,就会产生大量ROS,主要包括超氧阴离子(O2-·)、过氧化氢(H2O2)和羟基自由基(·OH),少量的ROS能作为细胞信号因子[22],参与激活机体的抗氧化信号通路[23],但大量ROS堆积就会损伤蛋白质、脂质及DNA等大分子,损伤若不能及时修复就会导致机体发生氧化损伤[24],也就是氧化应激反应。CAT、SOD和POD广泛存在于真核生物的各类细胞中,是抗氧化酶系统中比较重要的3种酶[25]。
3.2.1 Sb对CAT活性的影响CAT可以将H2O2还原成H2O,阻止其与O2反应生成·OH[25]。低浓度(10 mg/L)的锑对CAT活性有一定的促进作用,可能是因为斑马鱼在锑胁迫下产生大量ROS,迫使机体产生大量CAT来调节ROS正常浓度范围,是斑马鱼对锑适应的一种表现,这与陈立伟[26]探究镉对黄颡鱼CAT的影响一致。随着锑的浓度逐渐升高、胁迫时间逐渐增加,斑马鱼机体内的平衡可能被打破,大量的ROS堆积导致CAT活性降低,这表明斑马鱼可能由适应锑变成了锑中毒,过量ROS可能会破坏蛋白质、DNA等大分子,造成机体损伤。
3.2.2 Sb对SOD活性的影响SOD可以促进O2-·与H+反应产生H2O2,从而抑制O2向·OH的转化,防止后者大量堆积对细胞造成损伤[27]。本实验结果表明,随着时间在增加,不同浓度组SOD活性均表现为Hormesis现象[28],表明斑马鱼在短时间接触锑时,机体产生大量的SOD可能是用来阻止过量的自由基对机体造成损伤,也是斑马鱼对锑胁迫产生的适应性,而当胁迫时间增加到一定范围时,平衡被打破,大量自由基堆积,通过引起细胞内脂质的过氧化、损伤DNA分子或调节相关基因而诱导细胞凋亡[29]。
3.2.3 Sb对POD活性的影响POD能将O2-·转化为H2O2,而当H2O2过剩时,又能将H2O2还原成H2O和O2-·,还能利用H2O2将醛、醇、酚等底物氧化。本实验结果表明,各浓度组POD活性随锑胁迫时间增加,呈现“锯齿形”变化趋势,表明斑马鱼刚接触锑时,机体无法迅速适应从而使POD活性降低,随胁迫时间增加,机体逐渐适应,可能为调节体内自由基浓度而产生大量POD,随着胁迫时间超过临界值,POD活性急剧降低,可能是因为斑马鱼产生应激反应,受到严重的氧化损伤[30]。该研究结果与宋志慧等[27]研究的铜对斑马鱼POD活性的影响一致。
3.3 Sb对斑马鱼Na+K+-ATPase酶活性的影响Na+K+-ATPase酶与膜上磷脂的结合状态能影响膜的功能,还参与物质运输、氧化磷酸化以及能量代谢等生理生化过程,对维持离子梯度具有重要的意义[31]。从本次研究结果来看,在短时间内各浓度组Na+K+-ATPase酶活性均低于对照组,表明锑可以在短时间内影响斑马鱼的Na+K+-ATPase酶活性,Na+K+-ATPase酶活性降低可能是因为锑离子进入斑马鱼体内与其膜上的ATP酶结合,从而改变ATP酶的空间结构,阻止其与底物的结合,最终抑制了酶活性[32]。进而影响斑马鱼物质运输、能量代谢等生理生化过程,随时间增加出现的Na+K+-ATPase酶活性增高的情况,可能是因为斑马鱼自身的调节功能,对锑胁迫产生了一定的适应。
3.4 Sb对斑马鱼乙酰胆碱酶活性的影响AchE广泛存在于各种动物组织中,在神经突触间隙中,通过催化水解神经递质乙酰胆碱来终止其对胆碱受体的兴奋作用,维持神经冲动的正常传递[19],其活性升高则会抑制兴奋地传递,活性降低则表现为过度兴奋,无论其活性升高或者降低都会影响斑马鱼正常的生理生化功能[33]。由图 5可知,短时间(24 h)内各浓度组的AchE活性均低于对照组,表现出短时间内的毒物兴奋作用[33],随胁迫时间的增加,低浓度组AchE活性有些许增加,锑对AchE活性的抑制作用转变为促进作用,抑制了其兴奋的传导,但高浓度组的AchE活性随时间增加一直保持在较低水平,表明斑马鱼机体一直处于过度兴奋的状态。孟昭宇等[34]通过实验发现,三价砷和五价砷胁迫下鲤鱼、草鱼等乙酰胆碱酶活性随砷浓度增加呈先降低后升高的趋势,砷与锑同为第ⅤA族,化学性质相似,对鱼的作用机制也可能相似。
3.5 Sb对斑马鱼乳酸脱氢酶活性的影响LDH是在细胞内催化乳酸氧化成丙酮酸的重要酶,当机体各个组织器官病变或受到损伤时,其内部的LDH就要发生变化[20, 35]。实验结果表明,短时间内各浓度组LDH酶活性均低于对照组,该研究结果与陈立伟研究的镉对黄颡鱼LDH的影响一致[26],随着时间增加,低浓度组LDH酶活性有所上升,斑马鱼机体在锑胁迫下具有更强的催化乳酸生成丙酮酸的能力,这是斑马鱼对污染刺激产生适应性的一种表现,以增强LDH活性的方式增加机体的能量代谢,但高浓度组的LDH酶活性仍很低。
3.6 Sb对斑马鱼磷酸酶活性的影响 3.6.1 Sb对ACP活性的影响ACP是溶酶体的标志酶之一,表明溶酶体和其他水解酶的存在,也表明细胞内消化的进行[36],而斑马鱼可以通过胞饮作用直接吸收蛋白质颗粒然后进行细胞内消化[37],ACP还参与免疫调节、信号传导等生命活动,在细胞损伤和修复过程中发挥重要作用[38]。本实验结果显示,短时间(24 h)内ACP活性浓度降低,通过胞饮作用吸收的蛋白质含量减少,吸收的营养物质减少,表明锑可以在短期内影响斑马鱼对营养物质的吸收。随后ACP活性又迅速升高,是斑马鱼对锑胁迫适应性的一种表现,可能是因为斑马鱼机体吸收大量营养物质来抵抗锑对组织器官的损伤,也有可能是因为锑胁迫导致斑马鱼机体大量细胞受损,细胞内存在大量的溶酶体和水解酶进行细胞内消化,后期ACP酶活性又降低,表明机体的调节机制存在极限。
3.6.2 Sb对AKP活性的影响AKP主要存在于细胞膜中,参与营养物质的吸收、转运和离子分泌等过程,与机体生长、免疫防御和消化吸收功能密切相关[36-38]。实验表明,短时间(24 h)高浓度(30、40 mg/L)锑胁迫能促进AKP活性,48 h时不同浓度对AKP活性也呈促进作用,表明其吸收营养物质较多,可能是因为斑马鱼为了抵抗锑的毒害作用的一种适应性表现,高浓度下AKP活性降低,可能是机体的调节机制存在极限。
4 结论随锑胁迫时间增加,斑马鱼ATP酶、CAT活性呈先降低后增高的现象,SOD、POD、AchE、LDH和ACP活性呈先降低后增高再降低的变化趋势,AKP酶活性呈现先增高后降低的趋势。
锑对斑马鱼的抗氧化酶系统的影响表现为先抑制后促进再抑制,对兴奋传导、能量代谢、物质运输、机体生长和免疫防御等生命过程的中间环节产生一定影响。斑马鱼可以通过一系列应激反应缓解锑对其的毒性机制,但其调节机制有一定范围,由于斑马鱼与人类基因的高度相似性,类比锑对人体上述生命过程也可能有明显的毒害作用。
| [1] |
Guo J, Su L, Zhao X, et al. Relationships between urinary antimony levels and both mortalities and prevalence of cancers and heart diseases in general US population, NHANES 1999-2010[J]. Science of The Total Environment, 2016, 571: 452-460. DOI:10.1016/j.scitotenv.2016.07.011 |
| [2] |
Herath I, Vithanage M, Bundschuh J. Antimony as a global dilemma:Geochemistry, mobility, fate and transport[J]. Environmental Pollution, 2017, 223: 545-559. DOI:10.1016/j.envpol.2017.01.057 |
| [3] |
Filella M, et al. Antimony in the environment:a review focused on natural waters[J]. Earth Sci Rev, 2003, 59(1): 265-285. |
| [4] |
Shotyk W, Kracher M, Chen B. Antimony:global environmental contaminant[J]. J Environ Monit, 2005, 7(12): 1135-1136. DOI:10.1039/b515468p |
| [5] |
万智勇. 我国锑环境污染问题现状[J]. 资源节约与环保, 2014(8): 150. |
| [6] |
Fu Z, Wu F, et al. Antimony, arsenic and mercury in the aquatic environment and fish in a large antimony mining area in Hunan, China[J]. Science Total Environ, 2010, 408(16): 3403-3410. DOI:10.1016/j.scitotenv.2010.04.031 |
| [7] |
Wang X, He M, Xi J, et al. Antimony distribution and mobility in rivers around the world's largest antimony mine of Xikuangshan, Hunan Province, China[J]. Microchemical J, 2011, 97(1): 4-11. DOI:10.1016/j.microc.2010.05.011 |
| [8] |
戈兆凤, 韦朝阳. 锑环境健康效应的研究进展[J]. 环境与健康杂志, 2011(7): 649-653. |
| [9] |
曲长菱, 齐大勇. 环境污染物分析中的有机试剂 二十五、锑[Sb][J]. 环境科学研究, 1979(10): 75-77. |
| [10] |
卢莎莎, 等. 都柳江水体-沉积物间锑的迁移转化规律[J]. 贵州大学学报:自然科学版, 2013, 30(3): 131-136. |
| [11] |
王安, 安飞云, 高泽宣, 等. 锑对小鼠肝线粒体抗氧化酶系统影响的实验研究[J]. 中华预防医学杂志, 1998(4): 38-39. |
| [12] |
王凯.蚯蚓金属硫蛋白的诱导、测定及硒对锑中毒的解毒机理[D].保定: 河北大学, 2013. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_D349779
|
| [13] |
Yang JL. Comparative acute toxicity of gallium(Ⅲ), antimony(Ⅲ), indium(Ⅲ), cadmium(Ⅱ), and copper(Ⅱ)on freshwater swamp shrimp (Macrobrachium nipponense)[J]. Biological Research, 2014, 47: 13. |
| [14] |
Howe K, et al. The zebrafish reference genome sequence and its relationship to the human genome[J]. Nature, 2013, 7446: 489-503. |
| [15] |
李洁斐, 李卫华, 金泰廙, 等. 斑马鱼及其在环境毒理学中的应用[J]. 环境与职业医学, 2005(5): 78-81. |
| [16] |
Lin C, et al. Characterization, molecularmodelling and developmental expression of zebrafish manganese superoxide dismutase[J]. Fish Shellfish Immunol, 2009, 27(2): 318-324. DOI:10.1016/j.fsi.2009.05.015 |
| [17] |
Wang L, et al. Molecular biomarkers in aquatic organisms in relation to the oxidative stress imposed by environmental pollutants[J]. Acta Ecologica Sinica, 2007, 27(1): 380-388. |
| [18] |
贾秀英, 陈志伟. 铜、镉对鲫鱼组织Na+-K+-ATPase酶活性的影响[J]. 科技通报, 2003, 19(1): 50-53. DOI:10.3969/j.issn.1001-7119.2003.01.012 |
| [19] |
叶东平, 陈斌, 何正波. 乙酰胆碱酯酶的分离纯化及生物学研究进展[J]. 安徽农业科学, 2011, 39(7): 3811-3814. DOI:10.3969/j.issn.0517-6611.2011.07.012 |
| [20] |
毛瑞鑫, 刘福军, 张晓峰, 等. 鲤鱼乳酸脱氢酶活性的QTL检测[J]. 遗传, 2009, 31(4): 407-411. |
| [21] |
He H, Sun F. Studies on the character-istics of acid and alkaline phos phatase in Chinese shrimp, Penaeus chinensis[J]. Oceanoi ogia et Limnoiogia Sinica, 1992, 23(5): 555-560. |
| [22] |
Bedard K, Krause KH. The NOX family of ROS— generating NADPH oxidases:physiology and pathophysiology[J]. Physiol Rev, 2007, 87(1): 245-313. DOI:10.1152/physrev.00044.2005 |
| [23] |
Mikhaĭlov VF, Mazurik VK, Burlakova EB. Signal function of the reactive oxygen species in regulatory networks of the cell reaction to damaging effects:contribution of radiosensitivity and genome instability[J]. Radiats Biol Radioecol, 2003, 43(1): 5-18. |
| [24] |
Trevisan M, et al. Correlates of markers of oxidative status in the general population[J]. Am J Epidemiol, 2001, 4: 348-356. |
| [25] |
于德玲, 王昌留. 过氧化氢酶的研究进展[J]. 中国组织化学与细胞化学杂志, 2016, 25(2): 189-194. |
| [26] |
陈立伟.镉积累对黄颡鱼酶活及金属硫蛋白表达的影响[D].保定: 河北大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10075-1011290910.htm
|
| [27] |
宋志慧, 王庆伟. Cu2+、Cd2+、Cr6+胁迫对斑马鱼抗氧化酶活性的影响[J]. 安徽农业科学, 2011, 39(8): 4739-4741. DOI:10.3969/j.issn.0517-6611.2011.08.128 |
| [28] |
Calabrese EJ, Baldwin LA. Defining hormesis[J]. Hum Exp Toxiocol, 2002, 21(2): 91-97. DOI:10.1191/0960327102ht217oa |
| [29] |
韩月, 黄友解, 王友明. 氧化应激对动物肠道的危害及其营养学缓解措施[J]. 上海畜牧兽医通讯, 2017(4): 44-49. |
| [30] |
李敏, 赵月, 曹志会, 等. 链霉素废水对斑马鱼POD活性和GSH含量的影响[J]. 安全与环境工程, 2015, 3: 1-5, 11. |
| [31] |
文玉杰, 李晓玫. 钠钾ATP酶的信号转导功能新进展[J]. 生理科学进展, 2005(2): 159-162. DOI:10.3321/j.issn:0559-7765.2005.02.015 |
| [32] |
曹剑辉.镉对草鱼(Ctenopharyngodon idellus)ATPase等分子生态毒理学指标的影响研究[D].广州: 华南师范大学, 2004. http://d.wanfangdata.com.cn/Thesis/Y594735
|
| [33] |
郭建波.重金属(铬、镍、砷)对大黄鱼幼鱼的毒性和毒理学研究[D].舟山: 浙江海洋大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10340-1017153774.htm
|
| [34] |
孟昭宇, 林洪, 王爱青. 三价砷和五价砷对鱼类乙酰胆碱脂酶的体外抑制比较[J]. 中国海洋大学学报:自然科学版, 2005(3): 471-474. |
| [35] |
闫永峰, 等. 短期低浓度混合重金属污染对鲫鱼乳酸脱氢酶活性的影响[J]. 商丘师范学院学报, 2012, 28(3): 78-80. DOI:10.3969/j.issn.1672-3600.2012.03.019 |
| [36] |
詹付凤, 赵欣平. 重金属镉对鲫鱼碱性磷酸酶和酸性磷酸酶活性的影响[J]. 四川动物, 2007(3): 641-643. DOI:10.3969/j.issn.1000-7083.2007.03.053 |
| [37] |
曹新芳, 黄卉卉, 任秋楠, 等. 泥鳅消化道过氧化物酶、三磷酸腺苷酶、琥珀酸脱氢酶、酸性磷酸酶、碱性磷酸酶及非特异性酯酶的分布与组织定位[J]. 中国组织化学与细胞化学杂志, 2018, 27(5): 453-458. |
| [38] |
王一泽, 孙敬锋, 刘军锋, 等. 养殖半滑舌鳎肝胰、中肾、鳃、头肾、脾和心中酸性磷酸酶、碱性磷酸酶和过氧化物酶的组织化学定位[J]. 中国组织化学与细胞化学杂志, 2017, 26(3): 229-234. |





