2. 南阳医学高等专科学校基础医学部,南阳 473061
2. College of Basic Medicine, Nanyang Medical University, Nanyang 473061
谷胱甘肽S -转移酶(Glutathione S-transferases,GSTs)属于机体Ⅱ相生物转化系统酶类,能够催化谷胱甘肽与各种不溶的外源性或内源性有毒化合物等亲电子物质发生共扼反应,并将其转化成可溶性的无毒物质从而排出体外[1-2]。GSTs在生命活动过程中具有解毒、抗氧化等保护细胞的作用,而且对污染物胁迫效应敏感[1-2]。研究表明,GSTs表达可以被重金属、杀虫剂、多环芳烃、多氯联苯、四丁基锡和雌激素和多溴联苯醚等外源性物质诱导,常作为潜在生物指标物和环境健康评估早期预警靶分子[1-2]。在哺乳动物中,根据GSTs底物特异性、免疫学性质和蛋白质序列的同源性,把GSTs划分为α、μ、π、θ、σ、ζ和ω等7个大类[3]。软体动物作为动物王国重要类群之一,目前已经从九孔鲍(Haliotis diversicolor)、菲律宾蛤仔(Ruditapes philippinarum)、紫贻贝(Mytilus edulis)、圆蛤(Mercinaria mercinaria)、凸顶珠蚌(Unio mmidus)、河蚬(Corbicula fluminea)、三角帆蚌(Hyriopsis cumingii)、褶纹冠蚌(Cristaria plicata)等软体动物中分离出GSTs序列[4]。环境污染物对贝类产生胁迫时,其机体内GSTs表达水平显著升高,并通过催化过氧化氢的氧化还原反应,清除体内由代谢反应产生的氧自由基和过氧化物,保护细胞免受外界胁迫环境损伤[5-6]。在氧化应激条件下,GSTs表达水平被视为是一种适应性反应,GSTs表达被认为是受氧化应激的动物的分子标志物。
五氯酚(Pentachlorophenol,PCP)广泛应用于农药、木材防腐剂和个人护肤品等工农业生产中,目前在地表水、地下水、污水和饮用水中都不同程度检测到[7-8]。PCP存在能够给水生生物和人类生存带来显著的健康威胁,已被美国、欧洲和中国定为一种具有严重危害的持久性污染物[9-13]。背角无齿蚌(Anodonta woodiana)作为淡水底栖生物的重要类群,在淡水环境监测中具有重要作用[14-15]。我们前期研究发现,PCP处理对背角无齿蚌具有显著的毒性效应,具体机制有待进一步探讨[16]。由此,本研究中从背角无齿蚌中克隆出σ型谷胱甘肽S-转移酶完整基因序列并命名为σ-GST,通过Real-time PCR分析σ-GST时空表达,为揭示PCP胁迫效应奠定理论基础。
1 材料与方法 1.1 材料背角无齿蚌购自南阳市水产市场,PCP和二甲亚砜(Dimethyl sulfoxide,DMSO)购自Sigma-Aldrich公司,TRIzol试剂、M-MLV反转录酶、菌株DH5α、克隆载体pMDl9-T、连接酶、PCR产物回收纯化试剂盒、RACE试剂盒均购自TaKaRa公司。其余常规药品均为进口或国产分析纯级。
背角无齿蚌(壳长6.5±0.5 cm)处理之前,动物置于实验室自动水循环系统中适应养殖2周。PCP溶解于DMSO中以制备储备液。动物处理实验在长方形塑料盒(40 cm×25 cm;10 cm高)进行,饲养采用人工模拟池塘水(每1 L去离子水中含48 mg NaHCO3、33 mg CaCl2·2H2O、60 mg MgSO4·7H2O和0.5 mg KCl)[16]。为了确定σ-GST组织分布,来自同一塑料盒5只动物进行解剖,取斧足、鳃、肝胰脏、闭壳肌、心脏、血淋巴和外套膜等组织。根据上述动物处理方法,将80只河蚌随机饲养于10个塑料盒中,8只/盒,分为对照组和PCP处理组,每组5个盒子。PCP处理组采用13.9 mg/L的PCP进行处理,对照组用同体积DMSO处理,水中DMSO浓度不超过3‰。第0、1、3、6、9、12和第15天从每组中取出5只河蚌,解剖肝胰脏、鳃和血淋巴,液氮速冻,于-80℃保存。
1.2 方法 1.2.1 总RNA提取和cDNA第一链的合成总RNA提取采用TRIzol试剂(宝生物生物有限公司,大连),1.2%琼脂糖凝胶电泳检测RNA质量,具有完整rRNA条带的RNA用于合成cDNA,M-MLV试剂盒合成第一链cDNA,用作PCR反应模板。
1.2.2 背角无齿蚌σ-GST核心片段的扩增简并引物σ-GST1和σ-GST2分离σ-GST cDNA保守区域片段,PCR产物连接至pMDT-19载体,双向测序。确定σ-GST部分cDNA序列后,根据部分cDNA序列设计的特异性引物(表 1),按照试剂盒要求,扩增σ-GST cDNA5' 和3' 区域序列,5' RACE和3' RACE的PCR产物进行测序和拼接。
为了确定σ-GST转录水平,采用SYBR Premix Ex TaqTM试剂盒并按照要求进行定量分析。β-actin作为内参基因,根据σ-GST-F和σ-GST-R引物常用PCR仪中分离靶基因(表 1),琼脂糖凝胶电泳仅在检测出一个条带,PCR产物测序,序列鉴别。使用ABI7500实时检测系统(Applied Biosystems,美国)进行real-time PCR,构建标准曲线,通过2-ΔΔCT分析σ-GST表达水平。
1.2.4 序列和系统发育分析分析σ-GST序列,通过GenBank数据库搜索(www.ncbi.nlm.nih.gov/blast)进行BLAST程序比对;根据http://www.cbs.dtu.dk/services/SignalP预测信号肽;采用Simple Modular Architecture Research Tool(http://smart.embl-heidelberg.de/)预测蛋白质结构域;使用DANMEN分析程序对σ-GST基因进行多序列比对;通过Swiss-model(http://swissmodel.expasy.org/)预测σ-GST的蛋白质三维结构;使用MEGA5.0软件构建系统进化树。
1.2.5 统计学处理σ-GST表达水平以±s表示表示,采用双向方差分析和两两比较分析(Least-significant difference,LSD),确定组间、时间、组间和时间交互作用来分析σ-GST表达显著性差异。PCP处理后σ-GST的表达水平的显著性差异采用单向方差分析(Analysis of variance,ANOVA),P < 0.05为差异有统计学意义。
2 结果 2.1 背角无齿蚌σ-GST分子结构背角无齿蚌σ-GST的cDNA全长为821 bp,由一个132 bp的5' 非编码区,一个80 bp的3' 非编码区和一个609 bp的开放阅读框(Open reading frame,ORF)。开放阅读框由203个氨基酸组成的多肽链,分子质量为23.28 kD,等电点为5.19。终止信号(AATAAA)位于3' 非编码区794-799位置(图 1)。σ-GST氨基酸序列有N端的G-位点(3-73)和C端的H-位点(81-187)两个保守区域(图 1)。

|
| 粗体:起始和终止密码;波浪线:终止信号“AATAAA”;下划线:GSH结合位点保守氨基酸;绿色阴影:GST的N-端保守区域;灰色阴影:GST的C-端保守区域 图 1 背角无齿蚌σ-GST基因的cDNA序列和推导的氨基酸序列 |
背角无齿蚌σ-GST和其他水生动物GST进行多重序列比对,所有比对物种GST的N端区域高度保守,而C端区域则相对多样化(图 2)。在σ-GST的N端G-位点为催化中心,由Tyr8、Arg14、Gln50、Pro52、Gln63和Ser64保守氨基酸残基组成;C端H-位点为底物结合部位,由Glu96、Arg99、Arg100、Leu103、Lys104、Leu160和Thr163保守氨基酸残基组成(图 2)。

|
| HcGST:三角帆蚌σ型谷胱甘肽S-转移酶(AGU68336.1),CgGST:长牡蛎σ型谷胱甘肽S-转移酶(CAE11863.1),AcGST:海兔σ型谷胱甘肽S-转移酶(AAM82563.1),LmGST:东亚飞蝗σ谷胱甘肽S-转移酶(AHC08045.1),XlGST:非洲爪蟾σ型谷胱甘肽S-转移酶(AF525020_1) 图 2 背角无齿蚌σ-GST与其他物种σ型GST序列多重比对 |
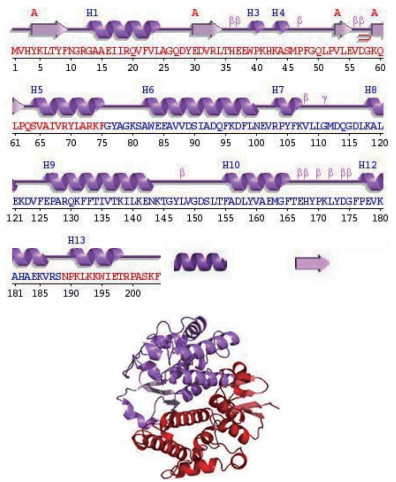
背角无齿蚌σ-GST蛋白质二级结构由11个α-螺旋和4个β-折叠组成(图 3)。在N端结合GSH的G-位点包含3个α -螺旋和4个β-折叠,C端区域H-位点包含8个α-螺旋。背角无齿蚌σ-GST三维结构与其他物种σ -GST高度相似。
|
| A:σ-GST二级结构;B:σ-GST的3D结构 图 3 背角无齿蚌σ-GST二级和3D结构预测 |
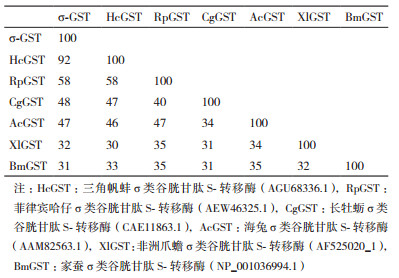
BLAST分析表明,背角无齿蚌σ-GST与σ-GST家族其他成员较高同源性。背角无齿蚌σ-GST氨基酸序列与双壳类三角帆蚌(H. cumingii)σ型GST有92%同源性,与腹足纲海兔(Aplysia californica)有47%同源性,与非洲爪蟾(Xenopus laevis)有32%同源性,与昆虫家蚕(Bombyx mori)有31%同源性(表 2)。
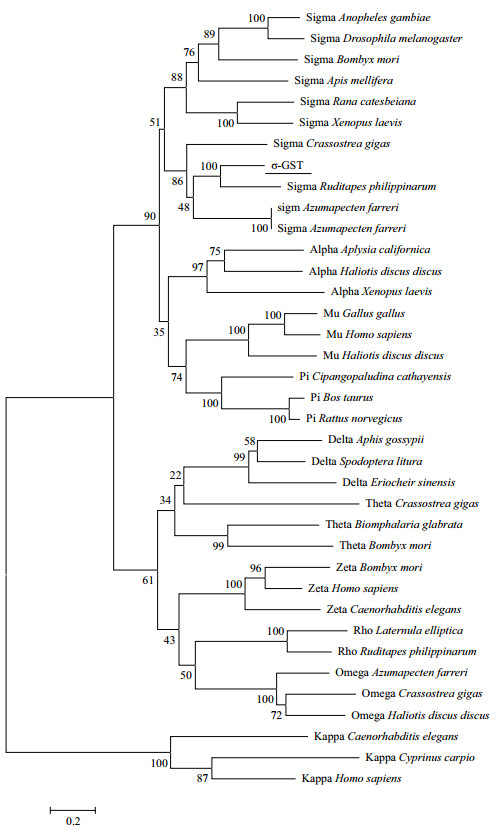
为研究背角无齿蚌σ-GST与不同类型GST成员之间进化关系,分别从脊椎动物和无脊椎动物中选取不同类型GST成员,利用MEGA 5.0邻位连接方法,构建系统进化树。不同群体中,背角无齿蚌σ-GST与无脊椎动物和脊椎动物σ型GST成员形成了σ家族谱系;背角无齿蚌σ-GST与软体动物σ型GST成员亲缘关系最近,其次脊椎动物,最后是昆虫;在软体动物的中,背角无齿蚌σ-GST进化关系与淡水蚌类亲缘关系最近(图 4)。
|
| 图 4 根据背角无齿蚌σ-GST氨基酸序列使用邻接法构建的系统进化树 |
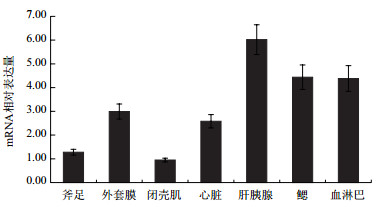
背角无齿蚌σ-GST广泛分布于斧足、外套膜、闭壳肌、心脏、肝胰腺、血淋巴和鳃(图 5);在肝胰脏、鳃和血淋巴呈现相对高表达,外套膜和心脏中等表达水平,斧足和闭壳肌表达水平较低。
|
| 每组数据来源于5只动物,重复3次 图 5 背角无齿蚌σ-GST基因的空间表达 |
在肝胰腺、鳃和血淋巴中,PCP处理后背角无齿蚌σ-GST在组别、时间、时间和组别交互作用中呈现表达水平显著性差异(表 3)。
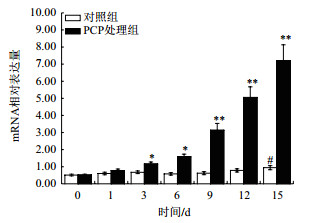
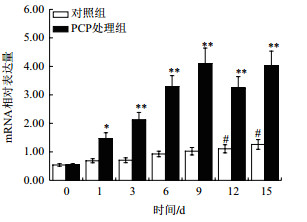
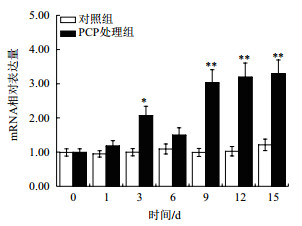
在肝胰腺中,PCP处理后,背角无齿蚌σ-GST增加mRNA水平上调呈时间依赖模式;与对照组相比,σ-GST表达水平在第1、3和15天分别增加了28.73%、70.37%(P < 0.05)和6.64倍(P < 0.01)(图 6)。与对照组相比,PCP处理组后鳃中σ-GST表达水平在第1天增加1.14倍(P < 0.05),第9天达到峰值(图 7)。与对照组相比,血淋巴中σ-GST表达水平明显提高,在第3、9、12和15达到显著水平(图 8)。
|
| n=5/组/时间点;“*”“**”表示与相应对照组相比有显著或极显著差异(P < 0.05,P < 0.01);“#”“##”表示与相应对照组相比有显著或极显著差异(P < 0.05,P < 0.01),下同 图 6 PCP对背角无齿蚌肝胰腺σ-GST基因表达的影响 |
|
| 图 7 PCP对背角无齿蚌鳃σ-GST基因表达的影响 |
|
| 图 8 PCP对背角无齿蚌血淋巴σ-GST基因表达的影响 |
背角无齿蚌σ-GST开放阅读框由203个氨基酸组成的多肽链,分子质量为23.28 kD,等电点为5.19,不含有信号肽;已有研究显示,三角帆蚌和褶纹冠蚌σ-GST没有发现信号肽切割位点以及糖基化位点,故认为背角无齿蚌σ-GST可能是细胞溶质蛋白[17-18]。背角无齿蚌σ-GST划分为N端区域和C端区域,这两个区域与σ类GST结构非常相似。多重序列比对表明,背角无齿蚌σ-GST的N端G-位点相对保守,C端多变,提示这些结构特征与GST生物学功能有关。前期研究表明,GST的N端保守氨基酸残基有助于结合GSH;一般来说,GSH结合G位点氨基酸组成具有高度特异性,常有11个高度保守氨基酸组成,分别为Tyr7、Arg13、Trp38、Lys46、Gln53、Leu54、Pro55、Gln66、Ser67、Glu98和Asp99,Tyr7在稳定与GSH结合方面发挥重要作用[17-18]。C端的H-位点组成相对活跃与适应广泛底物结合有关。H-位点是亲电底物的结合点,有8个保守的氨基酸残基:Tyr7、Phe8、Val10、Arg13、Val104、Tyr108、Asn204和Gly205[19]。GST中特定残基紧邻重要催化基团,表明GST家族具有底物催化多样性的机制[19-20]。GST活性位点需要特定氨基酸残基结合并在蛋白质结构中准确定位,从而产生更大功能和结构上约束。在σ类GST,Tyr残基影响GSH稳定性,GSH与G位点的稳定结合主要依赖于Tyr残基;这种稳定残基是σ家族中ball-and-socket类型细胞溶质GSTs的主要特征,这种稳定残基在胞浆GST结构形成中起重要作用[19-20]。背角无齿蚌σ-GST氨基酸序列与三角帆蚌σ型GST有92%同源性,与菲律宾哈仔(R. philippinarum)σ型GST有58%同源性,与长牡蛎σ型GST有48%同源性,本研究获取背角无齿蚌GST基因应属于GST基因家族中的σ家族。一般来说GSTs的相似性在40%以上可以认为是属于同一个家族的,如果相似性低于30%则可认为分属于不同的家族[21]。系统进化结果显示,背角无齿蚌σ-GST最接近于σ类GSTs,并将其归于这一类群;其次是α类GSTs,与其他类型GSTs亲缘关系较远,提示σ类型GSTs从不同类型GSTs早期分化中具有一个独立演化的过程。
背角无齿蚌σ-GST在多个组织广泛分布,其中在肝胰腺、鳃和血淋巴中为高表达,外套膜和心脏中等表达水平,斧足和闭壳肌表达水平较低,提示σ-GST这种表达模式与机体抗氧化作用和组织功能有关。一般来说,活性氧簇(Reactive oxygen species,ROS)在机体中保持相对较低水平,ROS产生后会被一系列抗氧化剂酶迅速清除,实现ROS水平和抗氧化酶活性之间的平衡。抗氧化酶广泛分布是维持机体内稳态的一个重要标志。GSTs在水生无脊椎动物中分布根据不同的结构、酶的特性以及生理功能而有所不同,在疣荔枝螺(Thais clavigera)中,μ-GSTs主要在鳃中表达,其次是肾脏和肌肉[22];菲律宾蛤仔ζ-GSTs在血细胞中的表达量最高,其次是鳃和外套膜[23]。水生生物中研究表明,σ类GSTs在肝胰腺、鳃、血淋巴和性腺中大量表达,这种组织分布模式与动物解毒功能和先天免疫应答有关[24]。本研究中背角无齿蚌σ-GST组织间广泛分布有助于清除机体活性氧,在细胞氧化和抗氧化之间维持平衡。双壳类动物肝胰腺是重要代谢器官,在外源性有毒物质降解和防止氧化应激方面起着重要作用,软体动物GST能降解多种植物化学物质和合成农药[25]。背角无齿蚌σ-GST在肝胰腺中的表达量高于其他组织,也表明了肝胰腺可能是外源物质的主要解毒器官。
PCP处理能够明显诱导背角无齿蚌肝胰腺、鳃和血淋巴中σ-GST表达,提示σ-GST表达上调对PCP毒性效应具有保护作用。对于有氧生物而言,ROS包括过氧化物阴离子、过氧化氢、烷基过氧化物、单线态氧和羟基自由基[26]。背角无齿蚌是滤食性淡水双壳类动物,PCP具有较高亲脂性,易沉积和过量积累在细胞内,催化细胞产生ROS[9-10]。GST广泛分布在所有活细胞中,主动或被动地结合各种外源性/内源性有毒分子,如致癌物、药物治疗制剂和氧化应激产物,促进细胞解毒功能[27-28]。GST高表达与细胞免受内源性氧化应激影响有关。高水平GST对抗农药的毒性有关,褐飞虱GST水平增高具有抗氧化损伤和保护组织作用[29]。铜和镉胁迫均能促使厚壳贻贝(Mytilus coruscus)GST基因表达水平显著升高,且呈现为时间依赖效应,提示GST参与动物的解毒过程,可以指示水环境重金属污染状况[30]。太平洋牡蛎(Crassostrea gigas)在碳氢化合物和农药污染环境中,动物体内各种亚型GST表达量都显著增加,且与毒素类型以及浓度有关[31]。由此可见,σ-GST表达水平上调对PCP毒性效应具有保护作用。肝胰腺和血淋巴中,PCP处理后背角无齿蚌σ-GST表达水平上调显示时间依赖效应,提示这种表达模式与ROS持续生成和机体应对氧化应激效应过程有关。在正常情况下,总ROS水平保持相对较低的水平,ROS被一系列抗氧化酶不断消除,维持ROS水平和抗氧化酶活性之间的平衡。随着PCP处理时间延长,ROS越来越多地在细胞中产生和积累。面对挑战,机体以不断增强抗氧化酶活性为对策消除活性氧,由此,背角无齿蚌σ-GST表达水平随时间不断上调。
有机污染物、工业废水和环境内分泌干扰物等进入细胞后,大量O22-和H2O2等活性氧分子立即在细胞中产生,活性氧分子不但直接对细胞造成损伤,还将大量脂质分子氧化成为过氧化脂质,细胞膜结构与功能会受到过氧化脂质影响,机体正常生命活动受到危害。GST分子具有细胞解毒和抗氧化双重功效,PCP对背角无齿蚌产生胁迫时,其机体内σ-GST表达水平显著升高,并通过催化过氧化氢氧化还原反应,清除体内由代谢反应产生的氧自由基和过氧化物,保护细胞免受外界胁迫环境损伤。
4 结论本研究结果表明,PCP处理后背角无齿蚌σ-GST在主要免疫器官肝胰腺、鳃和血淋巴表现出显著的上调趋势,推测背角无齿蚌σ-GST表达水平上调有助于对抗PCP处理所产生的胁迫效应,提高动物环境耐受能力。
| [1] |
Hayes JD, Flanagan JU, Jowsey IR. Glutathione transferases[J]. Annu Rev Pharmacol Toxicol, 2005, 45: 51-88. DOI:10.1146/annurev.pharmtox.45.120403.095857 |
| [2] |
Sheehan D, Meade G, Foley VM, et al. Structure, function and evolution of glutathione transferases:implications for classification of non-mammalian members of an ancient enzyme superfamily[J]. Biochem J, 2001, 360(1): 1-16. DOI:10.1042/bj3600001 |
| [3] |
Zhang L, Qiu L, Wu H, et al.Expression profiles of seven glutathione S-transferase (GST) genes from Venerupis philippinarum exposed to heavy metals and benzo[a]pyrene[J].Comp Biochem Physiol C, 2012, 155: (5): 17-27.
|
| [4] |
Li HH, Yang ZY, Huang Q, et al. Molecular cloning and characteri-zation of a sigma-class glutathione S-Transferase from the freshwater mussel Hyriopsis cumingii[J]. Microbiology and Immunology, 2015, 59(4): 219-230. DOI:10.1111/mim.v59.4 |
| [5] |
Yang Y, Cheng JZ, Singhal SS, et al. Role of glutathione S-transfer-ases in protection against lipid peroxidation.Overexpression of hGSTA2-2 in K562 cells protects against hydrogen peroxide-induced apoptosis and inhibits JNK and caspase 3 activation[J]. J Biol Chem, 2001, 276(22): 19220-19230. DOI:10.1074/jbc.M100551200 |
| [6] |
Park H, Ahn IY, Kim H, et al. Glutathione S-transferase as a biomarker in the Antarctic bivalve Laternula elliptica after exposure to the polychlorinated biphenyl mixture Aroclor 1254[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2009, 150(4): 528-536. DOI:10.1016/j.cbpc.2009.07.008 |
| [7] |
Zheng W, Yu H, Wang X, et al. Systematic review of pentachlorophenol occurrence in the environment and in humans in China:not an egligible health risk due to the re-emergence of schistosomiasis[J]. Environ Int, 2012, 42: 105-116. DOI:10.1016/j.envint.2011.04.014 |
| [8] |
Chen Y, Yu S, Tang S, et al. Site-specific water quality criteria for aquatic ecosystems:A case study of pentachlorophenol for Tai Lake, China[J]. Sci Total Environ, 2016, 541: 65-73. DOI:10.1016/j.scitotenv.2015.09.006 |
| [9] |
Law WM, Lau WN, Lo KL, et al. Removal of biocide pentachlorophenol in water system by the spent mushroom compost of Pleurotus pulmonarius[J]. Chemosphere, 2003, 52(9): 1531-1537. DOI:10.1016/S0045-6535(03)00492-2 |
| [10] |
Xing L, Sun J, Liu H, et al. Combined toxicity of three chlorophe-nols 2, 4-dichlorophenol, 2, 4, 6-trichlorophenol andpentachlorop-henol to Daphnia magna[J]. J Environ Monit, 2012, 14(6): 1677-1683. DOI:10.1039/c2em30185g |
| [11] |
Zhou WM, Fu DQ, Sun ZG. Blacklist:China preferred controlled pollutant in water[J]. Environ Monit China, 1990, 6: 1-3. |
| [12] |
Olaniran AO, Igbinosa EO. Chlorophenols and other related derivatives of environmental concern:properties, distribution and microbial degradation processes[J]. Chemosphere, 2011, 83(10): 1297-1306. DOI:10.1016/j.chemosphere.2011.04.009 |
| [13] |
Zheng W, Wang X, Yu H, et al. Global trends and diversity in pentachlorophenol levels in the environment and in humans:a meta-analysis[J]. Environ Sci Technol, 2011, 45: 4668-4675. DOI:10.1021/es1043563 |
| [14] |
Liu H, Yang J, Gan J. Trace element accumulation in bivalve mussels Anodonta woodiana from Taihu Lake, China[J]. Arch Environ Contam Toxicol, 2010, 59(4): 593-601. DOI:10.1007/s00244-010-9521-6 |
| [15] |
Zhang X, Liu Z, Jeppesen E, et al. Effects of deposit-feeding tubificid worms and filter-feeding bivalves on benthic-pelagic coupling:implications for the restoration of eutrophic shallow lakes[J]. Water Res, 2014, 50: 135-146. DOI:10.1016/j.watres.2013.12.003 |
| [16] |
Xia X, Hua C, Xue S, et al. Response of selenium-dependent glutathione peroxidase in the freshwater bivalve Anodonta woodiana exposed to 2, 4-dichlorophenol, 2, 4, 6-trichlorophenol and pentachlorophenol[J]. Fish Shellfish Immunol, 2016, 55: 499-509. DOI:10.1016/j.fsi.2016.06.012 |
| [17] |
Xia C, Meyer DJ, Chen H, et al. Chemical modification of GSH transferase P1-1 confirms the presence of Arg-13, Lys-44 and one carboxylate group in the GSH-binding domain of the active site[J]. Biochem J, 1993, 293(Pt 2): 357-362. |
| [18] |
Karshikoff A, Reinemer P, Huber R, et al. Electrostatic evidence for the activation of the glutathione thiol by Tyr7 in pi-class glutathione transferases[J]. Eur J Biochem, 1993, 215(3): 663-670. DOI:10.1111/ejb.1993.215.issue-3 |
| [19] |
Balchin D, Wallace L, Dirr HW. S-nitrosation of glutathione transferase p1-1 is controlled by the conformation of a dynamic active site helix[J]. J Biol Chem, 2013, 288(21): 14973-14984. DOI:10.1074/jbc.M113.462671 |
| [20] |
Balchin D, Fanucchi S, Achilonu I, et al. Stability of the domain interface contributes towards the catalytic function at the H-site of class alpha glutathione transferase A1-1[J]. Biochim Biophys Acta, 2010, 1804(12): 2228-2233. DOI:10.1016/j.bbapap.2010.09.003 |
| [21] |
Sheehan D, Meade G, Foley VM, et al. Structure, function and evolution of glutathione transferases:implications for classification of non-mammalian members of an ancient enzyme superfamily[J]. Biochemical Journal, 2001, 360: 1-16. DOI:10.1042/bj3600001 |
| [22] |
Rhee JS, Raisuddin S, Hwang DS, et al. A mu-class glutathione S-transferase (GSTM) from the rock shell Thais clavigera[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2008, 148(3): 195-203. |
| [23] |
Kasthuri, S R, Navaneethaiyer, U, Youngdeuk, L, et al. First molluscan theta-class glutathione S-transferase:Identification, cloning, characterization and transcriptional analysis post immune challenges[J]. Comparative Biochemistry and Physiology, 2012, 162: 10-23. DOI:10.1016/j.cbpb.2012.02.004 |
| [24] |
Ben Naceur C, Maxime V, Ben Mansour H, et al. Oyster's cells regulatory volume decrease:A new tool for evaluating the toxicity of low concentration hydrocarbons in marine waters[J]. Ecotoxicol Environ Saf, 2016, 133: 327-333. DOI:10.1016/j.ecoenv.2016.07.030 |
| [25] |
Chen J, Xiao S, Deng Y, et al. Cloning of a novel glutathione S-transferase 3(GST3) gene and expression analysis in pearl oyster, Pinctada martensii[J]. Fish Shellfish Immunol, 2011, 31(6): 823-830. |
| [26] |
Ognjanovic BI, Markovic SD, Pavlovic SZ, et al. Effect of chronic cadmium exposure on antioxidant defense system in some tissues of rats:protective effect of selenium[J]. Physiological Research, 2008, 57(3): 403-411. |
| [27] |
Monteiro DA, de Almeida JA, Rantin FT, et al. Oxidative stress biomarkers in the freshwater characid fish, Brycon cephalus, exposed to organophosphorus insecticide Folisuper 600(methyl parathion)[J]. Comparative Biochemistry and Physiology C-Toxicology & Pharmacology, 2006, 143(2): 141-149. |
| [28] |
Shallaja MS, D'Silva C. Evaluation of impact of PAH on a tropical fish, Oreochromis mossambicus using multiple biomarkers[J]. Chemosphere, 2003, 53(8): 835-841. DOI:10.1016/S0045-6535(03)00667-2 |
| [29] |
Vontas JG, Small GJ, Hemingway J. Glutathione S-transferases as antioxidant defence agents confer pyrethroid resistance in Nilaparvata lugens[J]. Biochem J, 2001, 357(Pt1): 65-72. |
| [30] |
刘慧慧, 何建瑜, 赵荣涛, 薛超波. 重金属胁迫下厚壳贻贝谷胱甘肽S-转移酶基因表达分析[J]. 海洋与湖沼, 2014, 45(2): 274-280. |
| [31] |
Boutet I, Tanguy A, Moraga D, 20 04. Characterisation and expression of four mRNA sequences encoding glutathione S-transferases pi, mu, omega and sigma classes in the Pacific oyster Crassostrea gigas exposed to hydrocarbons and pesticides[J]. Marine Biology, 2004, 146(1): 53-64. DOI:10.1007/s00227-004-1423-6 |