微藻是一类能进行光合自养且广泛分布于自然界的低等植物,因其生长速率快、生物量大和能高水平合成积累多种天然化合物而被人类广泛利用。微藻基生物产品目前已经应用于生物制药、化妆美容、医疗保健,生物染料、畜禽养殖和水产等行业中[1-3]。利用微藻生产优质生物柴油已成为当今国内外研究的热点之一[4-5],现已对优质富油藻种选育[6]、规模化培养体系及油脂富集调控技术和制油工艺[7]等进行了诸多研究,微藻生物柴油产业化呈现良好前景,尽管成本高和存在一些限制因素。
提高微藻生物质和油脂产量是规模化制备生物柴油或高值藻油产品的关键环节。然而,微藻规模化培养过程中常有伴生细菌污染,尤其是微藻藻际微环境中存在一些不易去除的细菌。现今对这些伴生或共生的细菌与微藻互作机制以及对微藻生长和目标产物积累的影响还知之甚少。一些研究指出[8-10],微藻和细菌密不可分,经过长期自然进化,真核微藻与原核细菌之间形成复杂的相互作用,包括营养依赖、代谢互补等多种方式。而且,藻菌互作是动态的,能对不同环境做出响应。
目前,已有研究证明[11],菌藻共生系统可以用于对工厂、市政和养殖等各种污水进行高效处理,具有良好的经济、环境和社会效益。有关在微藻规模化养殖中,应用有益藻菌共生体系以期获得高量微藻生物质和生产生物燃油等其他藻基产品还未见详尽报道。
本文以前期筛选获得的埃氏小球藻(Chlorella emersonii)藻株SXND-25为试材,分离鉴定藻际细菌菌群,筛选优势促生菌,人工构建藻菌共生体系,分析促生菌对小球藻作用,建立了能显著提高微藻生物量和产油量的藻菌共生体系。据此提出了在微藻规模化养殖中,通过建立调节藻际有益菌丰度的藻菌共生体系以期高效生产微藻生物质和其他高值藻基产品的技术策略。
1 材料与方法 1.1 材料 1.1.1 藻种与培养基实验所采用的藻种是本实验室从山西一煤化厂附近水体中分离纯化的藻株,经18S rDNA鉴定其为埃氏小球藻(Chlorella emersonii)的一个新株系,命名为SXND-25。埃氏小球藻用BG11培养基培养。
1.1.2 菌株与培养基实验所使用的菌株是在培养埃氏小球藻的过程中,从藻际微环境分离出来的6个细菌菌群/种,经过16SrRNA鉴定,分别属于鹑鸡肠球菌(Enterococcus gallinarum)、大肠杆菌(Escherichia coli)、假单胞菌(Pseudomonas)和菠萝泛菌(Pantoea)4个属。菌株用牛肉膏蛋白胨培养基培养。
1.2 方法 1.2.1 藻种的分离、纯化与鉴定将采集到的水样加入BG11培养基,置于光照培养箱培养。培养条件为:温度(25±1)℃,湿度45%,光照强度4 500 lx,光暗比16 h:8 h,每天定时摇动3次。用平板涂布法将藻液稀释分离,待长出单细胞藻落,用接种环挑单株落于液体培养基培养。纯化方法是重复平板涂布和挑单株培养,直至培养皿上没有杂菌和杂藻为止。
纯化的藻种在达到一定的生物量后离心获得湿藻液,冷冻干燥后获得干藻粉,参照程蔚兰等[12]用CTAB法提取藻DNA,用18S rDNA为引物进行PCR扩增,测序后在数据库中进行序列比对,用邻接法在MEGA7.0中构建系统发育树,鉴定藻种。
1.2.2 菌群/种的分离、培养与鉴定根据小球藻生长曲线,在生长初期、对数生长期、稳定期各取藻液1 mL,分别稀释105-108倍。每10倍为一个梯度,各浓度梯度重复3次。平板涂布于固体牛肉膏蛋白胨培养基中,做好标记。2-3 d后,观察并记录固体培养基中菌落形态特征,挑取固体培养基中形态特征不同的单菌落分装于牛肉膏蛋白胨液体培养基中,作好标号,扩繁培养。
菌液离心获得菌体,提取细菌DNA,用16S rRNA为引物进行PCR扩增,序列对比后用邻接法在MEGA7.0中构建系统发育树,从而鉴定出菌群的种属。
1.2.3 优势促生菌种/群的筛选在1 L BG11中接种初始小球藻0.2 g,实验组分别加入藻菌比(细胞数)为1:1的6个菌株/群进行混合培养。菌液经8 000 r/min离心5 min,弃上清。菌体沉淀用20 mL BG11培养基重悬后,接入小球藻的培养体系中。对照组为小球藻培养,在小球藻培养体系中加入20 mL BG11培养基,每组设置3次重复。检测培养一定时期的藻体生物量和藻细胞油脂积累等性状,以确定促进微藻生长的优势菌群/种。
1.2.4 菌藻共生体系的构建实验组选用优势菌种/群,将菌液接入到小球藻对数期培养体系(藻体干重为0.2 g/L,体积为1 L)中,分别设置藻菌比为10:1、5:1、1:1、1:5、1:10等组合进行共培养。每组设置3次重复,对照组为小球藻单独培养(藻干重为0.2 g/L,体积为1 L)。
1.2.5 小球藻尼罗红染色和油脂含量及成分测定将800 μL藻液与200 μL二甲基亚砜(DMSO),10 μL尼罗红丙酮溶液(0.1 mg/mL)均匀混合,42℃条件下避光水浴5 min。使用蓝光作为激发光,在正置荧光显微镜下观察并拍照。
本实验提取油脂的方法是直接转酯化法:将5 mg冻干藻粉、0.1-0.3 mL氯仿:甲醇(2:1,V/V)、0.1-0.5 mL HCl-甲醇(5%,V/V)依次加入特氟龙密封垫片的玻璃螺纹管中。85℃水浴30 min,冷却至室温后,加入900 μL正己烷。将其在设定条件为25℃,150 r/min的摇床上萃取1 h。静置过夜后,取上清正己烷萃取液,参照张飞等[13]描述的方法,使用气相色谱仪(GC)(Agilent 7890D)测定脂肪酸组成及含量。色谱柱为Agilent HP-88弱极性毛细管色谱柱(30 m×250 μm×0.25 μm),样品1 μL分流进样,分流比1:40进样口温度260℃。使用氮气作为载气,流速为1.0 mL/min。计算各组分的百分含量:峰面积归一化法。实验重复3次。
1.2.6 数据处理实验数据经Excel整理后进行统计和作图,采用SPSS软件t检验进行分析。实验数据表示为3次重复的平均值±标准差,P < 0.05表示差异显著。
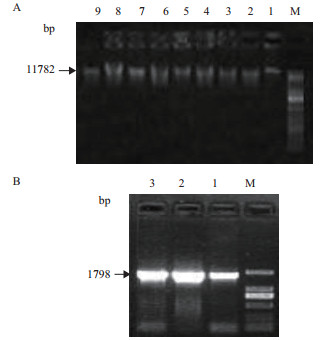
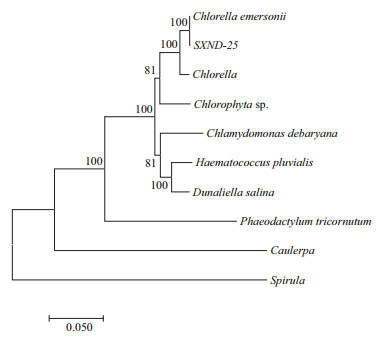
2 结果 2.1 藻株形态学及分子鉴定分离出的单株藻在光学显微镜下观察细胞形态为绿色,圆球形(图 1),初步鉴定为一株小绿藻。经18S rDNA扩增,PCR产物大小为1 798 bp(图 2),测序并与已有微藻18S rDNA序列比对构建系统进化树显示,此藻种与埃氏小球藻(KX395729.1)的距离最近(图 3),但其序列相似度为98%,并不是同一株系,最终鉴定此藻种为埃式小球藻的一个新株系,命名为SXND-25。

|
| 图 1 纯化的藻种在光学显微镜下的形态 |
|
| 图 2 藻株基因组DNA(A)和藻株18S rDNA PCR产物(B) |
|
| 图 3 几种微藻18S rDNA序列的系统进化树分析 |
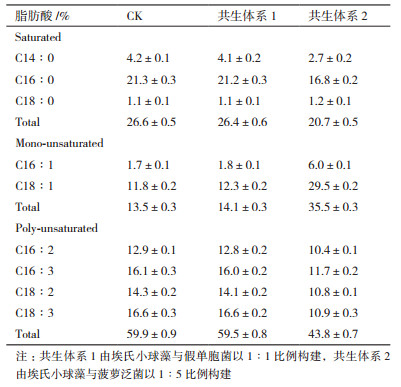
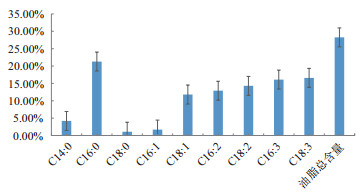
用尼罗红染料对小球藻细胞染色,在荧光显微镜下定性观察油脂储存情况(图 4),可以看到油体在细胞内均匀分布。提取油脂、GC测试结果显示,此种小球藻含油量为28.25%,油脂成分中单不饱和脂肪酸(16:1和18:1)含量占总油脂含量的13.50%(图 5)。

|
| 图 4 尼罗红染色后的埃氏小球藻在荧光显微镜下的油体分布 |
|
| 图 5 埃氏小球藻的总油脂含量(W/W)及各脂肪酸相对含量(%) |
将分离到的细菌涂布于细菌培养基,培养至菌落形成,观察菌落形态(图 6),包括菌落大小、表面黏稠程度、颜色、边缘特征,将菌落分成6个不同菌种(表 1)。挑去单个菌落,分别纯化培养后,提取基因组DNA,进行16S rRNA测序鉴定。序列比对(图 7)显示1号和4号菌种为肠杆菌科的菠萝泛菌属(Pantoea),5号菌种为肠杆菌科的大肠杆菌属(Escherichia coli),2号和6号菌种是假单胞杆菌科的假单胞菌属(Pseudomonas),3号菌种是肠球菌科的鹑鸡肠球菌属(Enterococcus gallinarum)。

|
| 图 6 菌落的形态 |

|
| 图 7 六个菌种及其他已知菌种18S rDNA序列的系统进化树分析 |
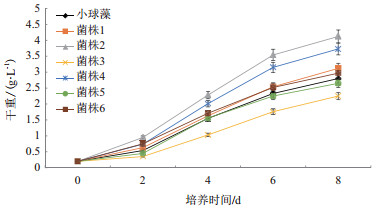
将埃氏小球藻与6株共栖菌分别以1:1比例组合,连续8 d共培养,检测微藻生物量(图 8)表明,6株共栖菌中,菌株3鹑鸡肠球菌和菌株5大肠杆菌抑制了微藻的生长,其中抑制作用最强的菌株为菌株3。其余4株共栖菌促进了微藻的生长,菌株2假单胞菌的促进作用最显著,微藻生物量达到4.12 g/L,比对照组增长1.32 g/L,增长量占对照组生物量的47.14%;其次是菌株4菠萝泛菌的促进作用明显微藻生物量达到3.73 g/L,比对照组增长0.93 g/L,增长量占对照组生物量的33.21%。据此,筛选出促进微藻生长的优势促生菌株/群为2号和4号菌种,即假单胞菌和菠萝泛菌,用于下一步埃氏小球藻藻菌共生体系的构建。
|
| 图 8 六株共栖菌对埃氏小球藻生物量的影响 |
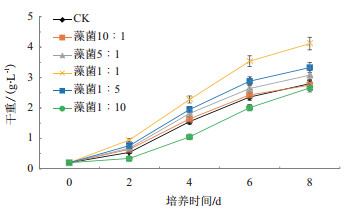
构建埃氏小球藻与假单胞菌不同配比(10:1、5:1、1:1、1:5、1:10)藻菌共生体系,分别共培养8 d,检测每天的生物量和第8天的藻细胞含油量。结果表明(图 9),藻菌比和生物量呈先增后减的趋势。在藻菌比例为1:1时,第8天生物量高达4.12 g/L,相比对照组增长了1.32 g/L,增长率为47.14%,此时油脂含量为29.50%,相比对照组增长了1.25%,增率为4.42%。埃氏小球藻和假单胞菌共生体系中,生物量和油脂含量在1:1以前呈正相关(图 10),其后随着藻菌比的降低,小球藻的生物量和含油率均减低。

|
| 图 9 埃氏小球藻与假单胞菌共生体系生物量变化情况 |
|
| 图 10 埃氏小球藻与假单胞菌共生培养第8天的微藻生物量和油脂含量 |
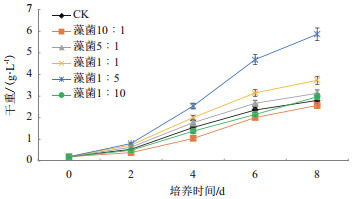
构建埃氏小球藻与菠萝泛菌不同配比(10:1、5:1、1:1、1:5、1:10)藻菌共生体系,分别共培养8 d,检测每天的生物量,结果表明(图 11)当藻菌比例为1:5时,埃氏小球藻生物量最大,第8天生物量为5.86 g/L,相比对照组增长了3.06 g/L,增长率为109.29%。
|
| 图 11 埃氏小球藻与菠萝泛菌共生体系微藻生物量变化 |
取微藻培养第8天藻样,检测藻细胞含油量。图 12显示,藻细胞油脂含量与生物量趋势相反,藻菌比例与油脂含量的趋势先减后增。当藻菌比例为1:5时,藻细胞油脂含量降低为26.88%,相比对照组降低了4.85%。

|
| 图 12 埃氏小球藻与菠萝泛菌共培养第8天的微藻生物量和油脂含量 |
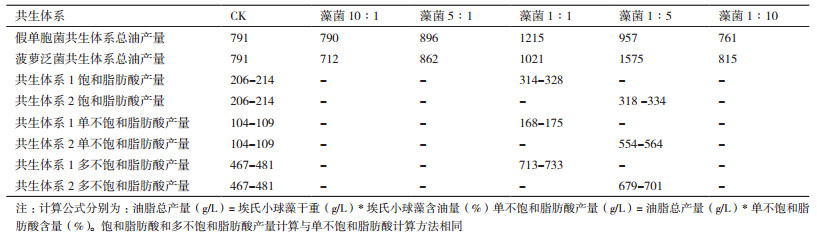
构建埃氏小球藻与假单胞菌比为1:1的共生体系1以及埃氏小球藻与菠萝泛菌比为1:5的共生体系2,分别培养8天后,检测藻细胞各脂肪酸成分含量,并计算饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)的含量。检测结果表明(表 2)共生体系1和共生体系2中MUFA含量比对照组均有提高。共生体系2中藻细胞MUFA含量提高更显著,比对照增加了162.96%,同时饱和脂肪酸和多不饱和脂肪酸相应地降低。在藻菌共生培养体系中,藻细胞油脂的总产量均比对照组高(表 3),且共生体系2总油脂产量高达1 575 mg/L,共生体系1次之。然而,共生体系2中的MUFA产量远高于共生体系1,达554-564 mg/L,其中油酸(C18:1)比对照组显著提高。单不饱和的油酸和棕榈油酸(16:1)是制取优质生物柴油的理想脂肪酸成分。因此,共生体系2更适合应用于生产生物柴油的规模化培养。
微藻生长自然水体以及微藻规模化培养过程中,其藻际微环境常存在一些不易彻底分离和去除的细菌菌群,包括抑藻菌、溶藻菌和促生菌以及依赖菌等。Amin[14]和张晶等[15]对自然水体中藻菌共生体系研究揭示,细菌为微藻的生长提供了CO2,同时可以分解有机物,固定无机氮;微藻则提供了O2促使菌的生长。在微藻纯化培养过程中,添加抗生素只杀死了部分外部菌,有益的共生菌则会因藻种的协助得以生存。将促生菌与目标微藻构建藻菌共生体系,已应用于各种废水处理,废水净化及资源化利用效果明显。
通过构建优势促生菌种与埃氏小球藻的共生体系,我们研究发现,埃氏小球藻与假单胞菌(Pseudomonas)1:1组合(共生体系1),以及埃氏小球藻与菠萝泛菌(Pantoea)1:5组合(共生体系2),不仅能显著提高微藻生物量,还促进藻细胞油脂合成积累。共生体系1在培养8 d时,微藻油脂含量由28.25%增长到29.50%,油脂总产量由791 mg/L增长到1 215 mg/L。虽然共生体系2的油脂含量有所降低,但是在生物量提高较大,最终微藻总油脂产量由791 mg/L增长到1 575 mg/L。其他一些人工构建藻菌共生体系研究亦显示有益共生菌可促进微藻生物量和油脂积累的增加[16-18]。例如,Suminto等[19]研究表明,黄杆菌属对小球藻的生长具有促进作用。史玉倩等[20]报道菠萝泛菌也可以促进小球藻生长和油脂积累,Mouget等[21]的结果显示,假单胞菌(Pseudomonas)对小球藻(Chlorella)和栅藻(Scenedesmusobliqnus)的生长都有促进作用。
需要指出的是,不同种属的细菌与不同微藻的互作效果差异较大。章登岚[22]研究表明假单胞菌(Pseudomonas sp.)会导致微囊球藻(Microcystis aeruginosa)的死亡,从而降低了微囊球藻的生物量。Abed等[23]的研究则显示,假单胞菌(Pseudomonas)能促进蓝藻(Cyanobacterial)—也称蓝细菌生物量提高8倍。本研究从埃氏小球藻藻际分离鉴定出6种不同菌种,其中2个菌种抑制微藻生长,4个菌种促进微藻生长,假单胞菌(Pseudomonas)和菠萝泛菌(Pantoea)促生效果极为显著。
尽管本研究未检测藻菌互作具体机制,可能是抑生菌为了竞争养分产生了抑制小球藻生长的物质,从而杀死部分埃氏小球藻,而促生菌有可能产生能促进微藻生长的物质,导致埃氏小球藻生物量增加。本文中假单胞菌(Pseudomonas)对小球藻的生物量和油脂含量均有显著提高,是最值得关注的问题。尚海[10]等做电镜显示细菌与藻细胞以胞外连体的形式共生。共生状态下的假单胞菌随着藻细胞的大量繁衍,逐渐处于一种胁迫状态,可能通过胞外连体错误地向藻细胞传递胁迫信号,藻细胞接受胁迫信号从而调节了自身的油脂代谢途径。可进一步分离测得共生菌的细胞数和油脂含量来验证。
另外,一些研究表明,假单胞菌(Pseudomonas)和菠萝泛菌(Pantoea)是一些高等植物的病原菌[24-25]。例如,顾沁等[26]报道菠萝泛菌是玉米叶脉产生黄色斑点的致病菌。菠萝泛菌也是多肉植物褐腐病的致病菌[27]。然而,这两个菌却能显著促进埃氏小球藻及其他一些微藻的生长。可见,藻菌共生及互作效果具有种属专一性。小球藻作为单细胞真核生物,经与共生菌协同进化,藻细胞可能释放一些抑制周围其他生物的活性成分,使得菠萝泛菌不会像危害高等植物那样抑制小球藻生长,反而小球藻能适当控制菠萝泛菌的生物量,存活的菠萝泛菌可不断地提供CO2和其他营养促进小球藻的快速生长,二者处于协作共生状态。进一步检测微藻产生何种物质或信号分子能有效控制这两种植物病原菌的生长,可为研发藻源功效成分及其在农作物生产上应用提供了理论依据。
微藻总油脂产量和脂肪酸构成(特别是单不饱和脂肪酸)是微藻用于制备优质生物柴油和高值微藻油脂产品的两个关键因素。本研究另一个重要发现是,所构建的两个藻菌共生体系均能显著提高藻细胞油脂中单不饱和脂肪酸(十六烯酸和十八烯酸)合成积累量,尤其是共生体系2效果更强。这可能是菌藻共生互作所调控的结果。随着藻菌共生体系培养时间延长,氮源供应量下降,造成体系进入氮胁迫状态。为应对氮胁迫,微藻积累更多油脂和具有高抗氧化活性的单不饱和脂肪酸[28],具体机制还有待进一步研究。从制备油脂生物燃油和高端藻油产品出发,可选用共生体系2进行埃氏小球藻规模化高效养殖。
4 结论本研究筛选到一株生长快、含油量高(> 28%,干重百分比)的优异埃氏小球藻藻株,并从其藻际微环境分离鉴定出6种不同的细菌菌种。成功构建了埃氏小球藻与2种优势促生菌(假单胞菌和菠萝泛菌)分别组合的有益藻菌共生体系。研究表明,通过构建藻菌共生体系,适当调控优势促生菌的丰度,可显著提高微藻生物量及总油脂和单不饱和脂肪酸的产量。这为探究藻菌互作和规模化养殖微藻以制备优质生物燃油或高值微藻油脂产品提供了一条新策略。
| [1] |
Abomohra EF, Jin W, Tu R, et al. Microalgal biomass production as a sustainable feedstock for biodiesel:Current status and perspectives[J]. Renewable and Sustainable Energy Reviews, 2016, 64(1): 596-606. |
| [2] |
黄英明, 王伟良, 李元广, 等. 微藻能源技术开发和产业化的发展思路与策略[J]. 生物工程学报, 2010, 26(7): 907-913. |
| [3] |
李润植, 季春丽, 崔红利. 微藻生物技术助力功能农业[J]. 山西农业大学学报:自然科学版, 2018, 38(3): 1-12. |
| [4] |
郑洪立, 张齐, 马小琛, 等. 产生物柴油微藻培养研究进展[J]. 中国生物工程杂志, 2009, 29(3): 110-116. |
| [5] |
Reddy MS, Md.YF, Sanjoy B, et al. Microalgae as Sustainable Renewable Energy Feedstock for Biofuel Production[J]. BioMed Research International, 2015, 2015(9): 1-13. |
| [6] |
王玉荣, 师文静, 佟明友, 等. 产油微藻的分离筛选与鉴定[J]. 食品与生物技术学报, 2016, 35(1): 77-81. DOI:10.3969/j.issn.1673-1689.2016.01.012 |
| [7] |
史飞飞, 陈通, 程蔚兰, 等. 酸驯化和紫外诱导提高微藻耐酸性[J]. 生物技术通报, 2017, 33(8): 146-151. |
| [8] |
刁梦洁, 柳杰, 王晚晴, 等. 菌藻共生对污水处理和微藻生物量积累的影响[J]. 环境工程, 2018, 36(3): 8-12. |
| [9] |
王荣昌, 程霞, 曾旭. 污水处理中菌藻共生系统去除污染物机理及其应用进展[J]. 环境科学学报, 2018, 38(1): 13-22. |
| [10] |
尚海, 薛林贵, 马萍, 等. 小球藻藻菌共生体系在产油方面的特性[J]. 微生物学通报, 2017, 44(10): 2280-2288. |
| [11] |
马浩天, 李润植, 张宏江, 等. 基于微藻培养处理畜禽养殖废水的研究进展[J]. 生物技术通报, 2017, 10(9): 1-8. |
| [12] |
程蔚兰, 邵雪梅, 宋程飞, 等. 氮胁迫对埃氏小球藻生长及油脂积累的影响[J]. 生物技术通报, 2017, 33(11): 160-165. |
| [13] |
张飞, 高秀清, 张靖洁, 等. 种子特异表达异源DGAT1基因提高大豆种子含油量和营养品质[J]. 生物工程学报, 2018, 34(9): 1478-1490. |
| [14] |
Amin SA, Green DH, Hart MC, et al. Photolysis of iron-siderophore chelates promotes bacterial-algal mutualism[J]. Proceedings of the National Academy of Sciences, 2009, 106(40): 17071-17076. DOI:10.1073/pnas.0905512106 |
| [15] |
张晶, 侯和胜, 佟少明. 微藻与细菌作用关系的研究进展[J]. 激光生物学报, 2016, 25(5): 385-390. DOI:10.3969/j.issn.1007-7146.2016.05.001 |
| [16] |
杨世平, 刘慧玲, 黄翔鹄, 等. 一株促藻生长细菌培养条件的优化[J]. 广东海洋大学学报, 2010, 30(6): 21-24. DOI:10.3969/j.issn.1673-9159.2010.06.004 |
| [17] |
Xi Yang, Ping Xie, Yunzhen Yu, et al. Microcystis aeruginosa/Pseudomonas pseudoalcaligenes interaction effects on off-flavors in algae/bacteria co-culture system under different temperatures[J]. Journal of Environmental Sciences, 2015, 31(5): 38-43. |
| [18] |
涂仁杰, 金文标, 韩松芳, 陈洪一. 细菌对城市污水中小球藻生长和油脂积累的影响[J]. 环境科学, 2017, 38(10): 4279-4285. |
| [19] |
Suminto, Kazutsugu Hirayama. Application of a growth-promoting bacteria for stable mass culture of three marine microalgae[J]. Hydrobiologia, 1997, 358(1/3): 223-230. DOI:10.1023/A:1003109503745 |
| [20] |
史玉倩, 赵艳. 水稻种子内生泛菌促进小球藻生长和油脂积累[J]. 中国农业科学, 2016, 49(8): 1429-1442. |
| [21] |
Mouget JL, Dakhama A, Lavoie MC, et al. Algal growth enhancement of bacteria:is consumption of photosynthetic oxygen involved?[J]. Fems Microbiology Ecology, 2010, 18(1): 3-5. |
| [22] |
章登岚, 赵以军, 吴刚, 等. 不同来源溶藻菌的分离、鉴定及溶藻效果比较[J]. 微生物学杂志, 2017, 37(3): 100-104. DOI:10.3969/j.issn.1005-7021.2017.03.016 |
| [23] |
Abed RM. Interaction between cyanobacteria and aerobic heterotrophic bacteria in the degradation of hydrocarbons[J]. International Biodeterioration & Biodegradation, 2010, 64(1): 58-64. |
| [24] |
冯洁. 植物病原细菌分类最新进展[J]. 中国农业科学, 2017, 50(12): 2305-2314. DOI:10.3864/j.issn.0578-1752.2017.12.011 |
| [25] |
曹慧英, 李洪杰, 朱振东, 等. 玉米细菌干茎腐病菌成团泛菌的种子传播[J]. 植物保护学报, 2011, 38(1): 31-36. |
| [26] |
顾沁, 张昊, 黄海, 等. 一种玉米新型细菌性褐腐病的病原鉴定[J]. 植物保护, 2016, 42(3): 87-90. DOI:10.3969/j.issn.0529-1542.2016.03.014 |
| [27] |
厉艳, 王英超, 宋涛, 等. 进境多肉植物细菌性褐腐病的病原分离与鉴定[J]. 食品安全质量检测学报, 2017, 8(11): 4143-4146. DOI:10.3969/j.issn.2095-0381.2017.11.011 |
| [28] |
涂泽敏, 吴芳燕, 罗剑飞, 等. 产油脂微藻的分离、鉴定及筛选[J]. 现代食品科技, 2018, 10(5): 1-6. |