2. 中国农业科学院农业资源与农业区划研究所 农业农村部农业微生物资源收集与保藏重点实验室,北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences/Key Laboratory of Microbial Resources, Ministry of Agriculture and Rural Affairs, Beijing 100081
桃红侧耳[Pleurotus djamor(Rumph. ex Fr.)Boedijn]色泽鲜艳,是兼具食用、观赏和药用价值的食用菌[1-4]。子实体颜色是食用菌的重要商品性状之一,已成为食用菌育种的重要方向。目前市场上的P. djamor一般为粉红色、颜色较浅,选育颜色更深的P. djamor新品种需求强烈。
食用菌的许多重要农艺性状,如产量、质量和抗病性,都是受多基因遗传控制的数量性状[5-7]。子实体颜色遗传规律也已在双孢蘑菇、金针菇和白黄侧耳等食用菌中开展诸多研究。廖建华等[8]研究发现双孢蘑菇(Agaricus bisporus)子实体颜色受一对基因控制,棕色为显性、白色为隐性;Callac等[9]证明了A. bisporus菌盖白色是由与乙醇脱氢酶(Alcohol dehydrogenase,ADH)基因座连接的单一位点上的隐性等位基因控制;谢宝贵等[10]认为金针菇(Flammulina velutipes)颜色黄色为显性、白色为隐性,受一对基因控制;盛春鸽等[11]研究表明白黄侧耳(Pleurotus cornucopiae)颜色性状为数量性状,深灰色对白色呈不完全显性,由不同位点上的两对主基因控制。目前对于P. djamor的研究,主要集中在人工栽培技术[12-14]、多糖提取工艺[15-16]、富硒红平菇的研究[17]以及漆酶基因的克隆[18]、异源表达[19]和对染料的脱色能力[20-21]等方面,鲜见子实体颜色的相关研究。在资源挖掘的基础上,本研究以粉红色和灰褐色P. djamor为材料,经杂交、测交,探索P. djamor子实体粉红色性状的遗传学特征和规律,为食用菌的色泽育种提供理论依据。
1 材料与方法 1.1 材料 1.1.1 培养基PDA培养基:土豆200.0 g、葡萄糖20.0 g、KH2PO4 2.0 g、MgSO4 0.5 g,琼脂15.0 g,蒸馏水定容至1.0 L,121℃灭菌30 min。
再生培养基:葡萄糖10.0 g,麦芽糖5.0 g,酵母粉5.0 g,甘露醇109.3 g,琼脂15.0 g,蒸馏水定容至1.0 L,121℃灭菌30 min。
出菇配方:棉籽壳94%(W/W),麸皮5%(W/W),石灰1%(W/W),含水量65%(W/W)左右,126℃灭菌2 h。
1.1.2 试剂2%溶壁酶(购自广东微生物研究所):0.4 g溶壁酶加入到20.0 mL的0.6 mol/L甘露醇溶液,摇匀,用0.22 μL膜过滤除菌,备用。
1.1.3 亲本菌株以P. djamor粉红色菌株CCMSSC00450和灰褐色菌株CCMSSC04445为材料(图 1),以上菌株均保藏于国家食用菌标准菌株库(China Center for Mushroom Spawn Standards and Control,CCMSSC)。

|
| 图 1 亲本子实体颜色 |
引用潘迎捷[22]的方法将亲本菌株进行原生质体单核化。
1.2.2 F1代杂交子原生质体单核化获得的单核菌株进行配对杂交,挑取接合部位菌丝,进行镜检。将存在锁状联合的菌株分离纯化,保存备用。
1.2.3 栽培条件出菇温度:24-28℃,光照强度:100-500 lx,相对湿度:80%-95%(W/W)。
1.2.4 颜色性状的测交群体构建根据黄毅[23]的方法收集单孢子单核体。选取F1代中目的菌株的单孢单核体分别与粉红色亲本中携带隐性基因的单核体进行杂交,镜检是否存在锁状联合,将存在锁状联合的菌株分离纯化,保存备用,用于构建子实体颜色的测交群体。
1.2.5 群体颜色测定选取成熟期的子实体,用分光测色仪(CM-700d,日本Konica Minolta)对菌盖和菌褶颜色进行测量。每个菌株取3个子实体,每个子实体取3个测量位点,每次测量重复3次取平均值。采用Weijn[24]的方法用公式WI=L-3b将测得的三色空间坐标L、a、b数值中的L、b转化为WI(Whitness Index)值进行统计分析。
1.2.6 数据处理使用IBM SPSS Statistics 21软件中LSD模型对分离群体子实体菌盖和菌褶的颜色性状进行统计分析。同时采用一般线性模型进行单因素方差分析,计算广义遗传力(Broad-sense heritability)。K-S检验分析菌盖和菌褶的颜色性状是否符合正态分布,Pearson相关性分析菌盖颜色和菌褶颜色是否有相关性。广义遗传力计算公式为:H2=σg2/(σg2+σe2/r)[25]。其中H2为广义遗传力,σg2是遗传因素引起的变异,σe2是误差变量,r是试验重复数(r=1)。
2 结果 2.1 原生质体单核菌株的获得通过原生质体单核化获得亲本菌株CCMSSC00450和CCMSSC04445的组成型单核菌株,分别编号为PDm52和PDm17,PDm99和PDm14。
2.2 F1代杂交子的获得粉红色亲本CCMSSC00450的两个组成型单核菌株PDm52和PDm17分别与灰褐色亲本CCMSSC04445的两个组成型单核菌株PDm99和PDm14配对杂交,得到4种杂交子:PDm52×PDm99、PDm52×PDm14、PDm17×PDm14和PDm17×PDm99,颜色分别表现为粉红色、粉灰色、灰褐色和白色(图 2)。根据杂合子的表型从而推断双亲颜色遗传基因的纯合度。其中F1代出现了与亲本不同的颜色,即粉灰色(PDm52×PDm14)和白色(PDm17×PDm99),证明亲本所携带的控制颜色的遗传基因是杂合的。粉红色和灰褐色相对于白色为显性,白色为隐性。
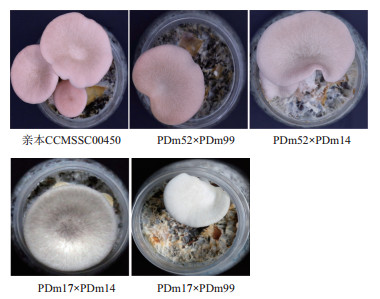
|
| 图 2 亲本和F1代子实体颜色 |
选取F1代中粉红色表型明显的菌株PDm52×PDm99,收集到207个单孢子单核体,作为分离群体。以PDm17为测交菌株,构建测交群体。
对测交群体中各菌株的菌盖和菌褶颜色性状进行统计分析见表 1。WI值越小,颜色越深;反之,颜色越浅。菌盖WI值有极显著性差异(P < 0.01),测交群体中有49个菌株(24%)菌盖颜色WI值小于粉红色亲本菌株(00450)WI值(41.11)(图 3-A);菌褶WI有极显著性差异(P < 0.01),测交群体中有51个菌株(25%)菌褶颜色WI值小于粉红色亲本菌株(00450)WI值(29.94)(图 3-B),两者数据表明测交群体中出现了较明显的超亲分离现象,存在多个比粉红色亲本(00450)子实体的颜色更深、更红的菌株。另外,群体中菌盖颜色和菌褶颜色都有较高的变异系数(CVcap=26.82%,CVgill=37.63%),表明子实体颜色有显著的性状分离现象。
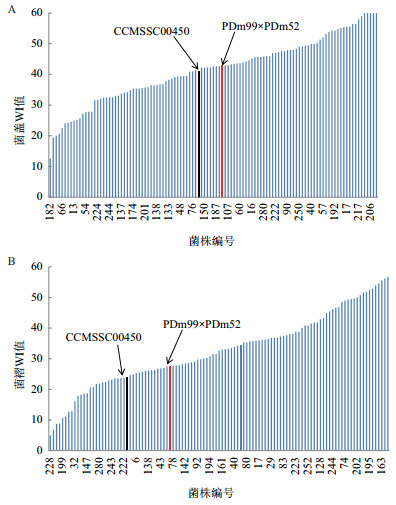
|
| 黑色:亲本菌株CCMSSC00450;红色:F1粉杂交菌株PDm52×PDm99 图 3 测交群体菌盖(A)和菌褶(B)WI值柱状图 |
子实体颜色出现明显的性状分离,从粉红色、淡粉色到白色,颜色由深到浅(图 4)呈连续型分布,说明粉红色对于白色为不完全显性;P. djamor子实体颜色是由多基因控制的数量性状,而这些基因在形成子代群体(207个菌株)过程中发生了分离。

|
| 挑选了有代表性的图片反应群体颜色变化,从粉红色、淡粉色到白色呈连续型分布 图 4 测交群体子实体颜色 |
对测交群体子实体菌盖和菌褶的颜色WI值进行K-S检验。菌盖颜色检验结果渐进显著性Asym Sig.(2-tailed)=0.805 > 0.05,菌褶颜色检验结果渐进显著性Asym Sig.(2-tailed)=0.447 > 0.05,说明菌盖和菌褶颜色性状的WI值均符合正态分布(图 5),表明该性状是由多基因控制的数量性状。
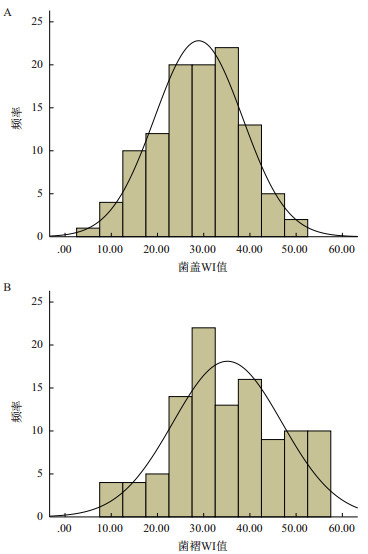
|
| 图 5 菌盖(A)和菌褶(B)颜色WI值的频率分布 |
测交群体菌盖和菌褶WI值ANOVA分析见表 2。结果表明,P. djamor子实体菌盖和菌褶颜色两个性状均是由遗传因素决定的(P < 0.01)。菌盖颜色性状的广义遗传力H2=0.88,菌褶颜色性状的广义遗传力H2=0.91,表明颜色性状为高度可遗传的性状,基因型是使颜色表型变异的主要因素。
根据测交群体子实体菌盖颜色和菌褶颜色的Pearson相关性分析,菌盖颜色和菌褶颜色之间存在极显著相关性(r=0.990,P < 0.01,n=109)。
3 讨论本研究利用传统的杂交和测交技术对P. djamor颜色的遗传规律进行了分析。根据亲本组成型单核体间杂交配对出菇结果,选择F1代粉红色杂交子(PDm52×PDm99)的担孢子单核子代菌株作为分离群体,分析粉红色和白色相对性状的遗传和分离规律。因为白色为隐性性状,故选择携带白色隐性性状的单核菌株PDm17为测交菌株。F1粉与PDm17构建的测交群体中出现了不同程度的粉色甚至比亲本更深。由于个体间微弱的颜色差别难以使用肉眼进行区分,采用CM-700d分光测色仪对其进行数据化统计达到了区分目的。与本研究结果相似,谢宝贵等[10]对F. velutipes颜色遗传规律的研究中发现,子实体颜色出现了浅黄、黄、深黄等,呈连续分布,认为是遗传因子“串联”在一起的生化反应结果。盛春鸽等[11]认为P. cornucopiae颜色遗传规律具多基因加性效应,每个微效基因的增加或减少都会导致子实体颜色深浅的不同。由于P. djamor和P. cornucopiae同属侧耳属(Pleurotus),从研究结果看,以数量性状分析更为合理。推测P. djamor颜色遗传规律可能与P. cornucopiae类似,不同程度颜色的出现是因为其他遗传因子参与了颜色的形成,具有基因加性效应,中间色泽的产生证明粉红色对白色是不完全显性遗传。
P. djamor的野生资源是研究食用菌颜色变异的重要来源之一。本研究中,测交群体部分菌株能形成原基但不能继续分化形成子实体,可能是由于子实体发育的相关基因下调或者丢失[26]。此外,部分菌株的出菇时间明显缩短,是研究出菇、发育等相关性状的理想材料。
然而目前关于食用菌的基因功能验证技术方法未获得突破,食用菌遗传规律研究进展缓慢。但是,随着基因敲除以及RNAi和CRISPR等技术[27-30]在真菌中的应用,深入挖掘与颜色形成或控制颜色形成相关的基因或通路、阐明食用菌子实体颜色形成规律已经成为可能。
4 结论P. djamor子实体颜色粉红色对白色为不完全显性,白色为隐性,是具有高遗传力的多基因控制的数量性状;菌褶颜色比菌盖颜色更深,两者之间有极强相关性,本研究为食用菌子实体颜色遗传研究提供了科学数据和理论支撑。
| [1] |
Dulay RMR, Miranda LA, Malasaga JS, et al. Antioxidant and antibacterial activities of acetonitrile and hexane extracts of Lentinus tigrinus and Pleurotus djamour[J]. Biocatalysis & Agricultural Biotechnology, 2017, 9: 141-144. |
| [2] |
Jiao F, Wang X, Song X, et al. Processing optimization and anti-oxidative activity of enzymatic extractable polysaccharides from Pleurotus djamor[J]. International Journal of Biological Macromolecules, 2017, 98: 469-478. DOI:10.1016/j.ijbiomac.2017.01.126 |
| [3] |
张其昌, 黄谚谚, 赖万年, 等. 红平菇RO-1营养成分分析[J]. 食用菌, 1995(4): 12. |
| [4] |
Rampinelli JR, Silveira MLL, Gern RMM, et al. Nutritional value of Pleurotus djamor cultivated in banana straw[J]. Alimentos E Nutri??o, 2010, 21(2): 197-202. |
| [5] |
Foulongne-Oriol M, Rodier A, Rousseau T, et al. Quantitative genetics to dissect the fungal-fungal interaction between Lecanicillium verticillium and the white button mushroom Agaricus bisporus[J]. Fungal Biology, 2011, 115(4-5): 421-431. DOI:10.1016/j.funbio.2011.02.017 |
| [6] |
Ramírez L, Larraya LM, Pisabarro AG. Molecular tools for breeding basidiomycetes[J]. International Microbiology:the Official Journal of the Spanish Society for Microbiology, 2000, 3(3): 147. |
| [7] |
Salzberg AM. Breeding edible mushrooms:State of the art[J]. Journal of Pediatric Surgery, 2005, 6(6): 793-793. |
| [8] |
廖剑华, 陈美元, 卢政辉, 等. 双孢蘑菇子实体颜色的遗传规律研究[J]. 菌物学报, 2007, 26(增刊): 138-140. |
| [9] |
Callac P, Moquet F, Imbernon M, et al. Evidence for PPC1, a determinant of the pilei-pellis color of Agaricus bisporus fruitbodies[J]. Fungal Genetics & Biology, 1998, 23(2): 181. |
| [10] |
谢宝贵, 江玉姬, 吴文礼. 金针菇子实体颜色的遗传规律研究[J]. 菌物学报, 2004, 23(1): 79-84. |
| [11] |
盛春鸽, 黄晨阳, 陈强. 白黄侧耳子实体颜色遗传规律[J]. 中国农业科学, 2012, 45(15): 3124-3129. |
| [12] |
周伟峰. 红平菇的人工栽培[J]. 中国食用菌, 1994(6): 24-25. |
| [13] |
熊芳, 朱坚, 邓优锦, 等. 红平菇(Pleurotus diamor)培育条件和栽培技术研究[J]. 江西农业大学学报, 2011, 33(5): 1006-1011. DOI:10.3969/j.issn.1000-2286.2011.05.032 |
| [14] |
池玉杰, 伊洪伟, 刘智会. 红平菇菌株H1的培养特性与营养成分分析[J]. 东北林业大学学报, 2007, 35(1): 53-57. DOI:10.3969/j.issn.1000-5382.2007.01.018 |
| [15] |
张建军.红平菇菌丝体多糖的提取、结构分析和抗糖尿病作用研究[D].泰安: 山东农业大学, 2016.
|
| [16] |
Zhang J, Liu M, Yang Y, et al. Purification, characterization and hepatoprotective activities of mycelia zinc polysaccharides by Pleurotus djamor[J]. Carbohydrate Polymers, 2016, 136(6): 588-597. |
| [17] |
Oliveira, A PD, Naozuka J. Preliminary results on the feasibility of producing selenium-enriched pink (Pleurotus djamor) and white (Pleurotus ostreatus) oyster mushrooms:bioaccumulation, bioaccessibility, and Se-proteins distribution[J]. Microchemical Journal, 2019, 145: 1143-1150. DOI:10.1016/j.microc.2018.12.046 |
| [18] |
郑苗苗, 邵淑丽, 张令昂, 等. 红平菇HP1漆酶基因及启动子克隆和序列分析[J]. 江苏农业科学, 2014, 42(8): 21-26. DOI:10.3969/j.issn.1002-1302.2014.08.007 |
| [19] |
郑苗苗, 邵淑丽, 张东向, 等. 红平菇漆酶基因异源表达及对染料脱色的研究[J]. 纺织学报, 2014, 35(12): 84-90. |
| [20] |
Wesenberg D, Kyriakides I, Agathos SN. White-rot fungi and their enzymes for the treatment of industrial dye effluents[J]. Biotechnology Advances, 2003, 22(1-2): 161-187. DOI:10.1016/j.biotechadv.2003.08.011 |
| [21] |
Yildirim N, Tanyol M, Dere T, et al. The investigation on physico-chemical parameters of the textile effluents after treatment by white rot fungus Pleurotus djamor[J]. New Biotechnology, 2012, 29: S184-S184. |
| [22] |
潘迎捷, 陈明杰, 汪昭月, 等. 香菇菌丝原生质体的分离与培养[J]. 上海农业学报, 1989, 5(1): 25-30. |
| [23] |
黄毅. 食用菌栽培[M]. 北京: 高等教育出版社, 2008.
|
| [24] |
Weijn A, Tomassen MMM, Bastiaannet S, et al. A new method to apply and quantify bruising sensitivity of button mushrooms[J]. LWT-Food Science and Technology, 2012, 47(2): 308-314. DOI:10.1016/j.lwt.2012.01.024 |
| [25] |
Gao W, Weijn A, Baars JJP, et al. Quantitative trait locus mapping for bruising sensitivity and cap color of Agaricus bisporus(button mushrooms)[J]. Fungal Genetics & Biology, 2015, 77: 69-81. |
| [26] |
Muraguchi H, Umezawa K, Niikura M, et al. Strand-Specific RNA-Seq analyses of fruiting body development in Coprinopsis cinerea[J]. PLoS One, 2015, 10(10): e0141586. DOI:10.1371/journal.pone.0141586 |
| [27] |
Nakazawa T, Ando Y, Kitaaki K, et al. Efficient gene targeting in ΔCc.ku70 or ΔCc.lig4 mutants of the agaricomycete Coprinopsis cinerea[J]. Fungal Genetics & Biology, 2011, 48(10): 939-946. |
| [28] |
Nakazawa T, Ando Y, Kitaaki K, et al. A mutation in the Cc.ubc2 gene affects clamp cell morphogenesis as well as nuclear migration for dikaryosis in Coprinopsis cinerea[J]. Fungal Genetics & Biology, 2011, 48(5): 519-525. |
| [29] |
Ohm RA, Jong JFD, Berends E, et al. An efficient gene deletion procedure for the mushroom-forming basidiomycete Schizophyllum commune[J]. World Journal of Microbiology and Biotechnology, 2010, 26(10): 1919-1923. DOI:10.1007/s11274-010-0356-0 |
| [30] |
Jong JFD, Ohm RA, Bekker CD, et al. Inactivation of ku80 in the mushroom-forming fungus Schizophyllum commune increases the relative incidence of homologous recombination[J]. FEMS Microbiol Lett, 2010, 310(1): 91-95. DOI:10.1111/fml.2010.310.issue-1 |






