开花植物的有性繁殖需要雄性配子体营养细胞特定区域的极性生长,从而逐渐形成花粉管。通过花粉管顶端的极性扩展,花粉管向胚珠输送精子并完成双受精[1]。由于花粉管具备典型极性生长的特性,且体外方便培养,目前已被广泛作为研究植物细胞极性发育的理想模式系统[2]。发掘极性生长相关的关键调控因子,阐述细胞极性建成与极性生长的调控机理,是植物有性生殖方面的热点领域,同时也为提高授粉效率这一增收策略提供一定的理论依据。
花粉管的生长过程是被严格调控的,并且依赖大量的信号组件,而钙离子在其中起到极其重要的作用[3-5]。钙离子在花粉管的伸长过程中形成一定的浓度梯度,花粉管的顶端钙离子浓度最高,而从顶端到底部浓度逐步递减[6]。已有研究成果发现打破顶端钙离子梯度会严重影响花粉管的正常生长,而钙离子梯度偏转会引起生长轴的重新调整[7-8]。在许多物种中,顶端富集的钙离子梯度可以表现出周期振荡的特征,这种振荡与花粉管增长率的周期变化相关[5]。钙离子泵(ACA9)、环核苷酸门控通道(CNGC18)及类谷氨酸受体(GLR1.2和GLR 3.7)的功能研究显示它们在调控花粉管增长率、花粉管形态和与雌配子体的互作等方面都具有重要作用[9-11]。这些发现强调了钙信号的形成及维持对花粉管极性生长的重要性。另一个重要的调控因子就是小G蛋白ROP1,其下游存在2个作用相反的效应蛋白RIC3和RIC4,前者引起微丝的解聚,而后者促进微丝的聚合。微丝动态(解聚与聚合)的正常维持才能造就花粉管的顶端生长,这一过程受到ROP1活性的严格调控[12]。
植物中钙离子信号的传递是由一系列的钙传感器所介导的,钙传感器在与钙离子结合后,发生构象变化并将信息传递给下游目标,类钙调神经磷酸酶B亚基(Calcineurin B-like protein,CBL)就是一类典型的钙离子传感器家族,拟南芥基因组编码10个CBL成员,其下游效应子是一组丝氨酸/苏氨酸激酶,被命名为CBL互作蛋白激酶(CBL interacting protein kinase,CIPK)[13]。不同的CBL-CIPK复合体建立了复杂的钙信号网络,可以从胞内和胞外钙库的不同部位感知钙信号[14-15]。CBL参与调节包括离子平衡和胁迫应对等过程在内的多种细胞过程。CBL1或CBL9协同CIPK23激活K+通道AKT1,从而使植物在低K+条件下正常生长[16]。此外,钙传感器CBL4/SOS3与CIPK24/SOS2的复合体调节Na+/H+反向转运蛋白SOS1的活性,从而显著提高植物的耐盐性[17]。
以往的CBL相关研究主要集中于植物对环境胁迫的响应机制领域,较少涉及花粉管的极性生长领域。本研究利用基因枪瞬时表达体系,分析了CBL9及其N末端保守位点的点突变体CBL9G2A的亚细胞定位与过量表达表型情况,旨在揭示CBL9在花粉管极性生长中的功能及其调控机制,为提高授粉效率这一增收策略提供理论依据。
1 材料与方法 1.1 材料烟草(Nicotiana tabacum)培养于温室内,28℃恒温,光周期为12 h/12 h。基因枪转化前,收集新鲜的烟草花粉(每次转化需8朵花的花粉)。拟南芥(Arabidopsis thaliana L.,col-0)生长条件为22℃、光周期16 h/8 h。基因枪专用金粉、铜网、微载体、易裂膜等购自Bio-Rad公司(Bio-Rad,U.S.A.)。限制性内切酶、Pyrobest DNA Polymerase、dNTP及T4 DNA ligase购自六合通经贸有限公司(代理Takara的产品)。凝胶回收试剂盒以及Taq DNA Polymerase购自天根生化科技公司。Plasmid Mini Kits试剂盒的品牌为QIAGEN。T4 DNA ligase及AMV Reverse Transcriptase购自Promega公司。
1.2 方法 1.2.1 基因克隆及表达载体的构建选取6周龄的拟南芥花朵提取总RNA,通过反转录及PCR扩增获得CBL9全长序列。基于overlap-PCR技术,将CBL9的N末端中第二位甘氨酸(Gly)定点突变为丙氨酸(Ala),获得CBL9G2A点突变体,序列检测正确的目的片段分别构建到瞬时表达载体pBLAT:YFP(目的片段连接到黄色荧光蛋白YFP的N末端)。
1.2.2 基因枪转化试验采用Plasmid Mini Kits(QIAGEN,Germany)提取用于基因枪瞬时转化的质粒DNA,0.8 µg质粒包裹在0.5 mg金粉上,通过基因枪瞬时转化体系将目的质粒转化到烟草花粉中。各项射击参数为:易裂膜与微弹载体之间距离为2 cm;微弹载体飞行距离为10 mm;微弹飞行距离为7 cm;易裂膜破裂压力为1 100 psi;真空度为27 mm Hg。转化完成的花粉在28℃,避光培养3-4 h后,分别通过荧光显微镜及共焦扫描显微镜对各自过表达表型及亚细胞定位进行观察与测量。
1.2.3 荧光显微镜分析花粉管表型将转化获得的花粉管放在OLYMPUS荧光倒置显微镜(MODE BX51)下观察,显微镜配备的CCD摄像机(MODE DP70,OLYMPUS)用于拍摄转化成功的花粉管。3次独立的转化试验所获得的照片通过Zeiss LSM图像浏览器(3.2版)进行测量分析(80根左右花粉管的长度及顶端最宽处的直径)。
1.2.4 共焦激光扫描显微镜观察亚细胞定位通过共焦激光扫描显微镜(Model LSM 510 META,Zeiss)进行花粉管中CBL9-YFP或CBL9G2A-YFP的亚细胞定位分析,显微镜激发光波段为488 nm,接受光波段为505-530 nm,通过Zeiss LSM图像浏览器(3.2版)进行相应的图像分析。
2 结果 2.1 CBL9在成熟花粉中高量表达分析目前,拟南芥钙传感器主要有4个基因家族:钙调素(CaM)、类钙调素(CML)、类钙调神经磷酸酶B亚基(CBL)以及钙离子依赖蛋白激酶(CPK)。CBL家族包含10个成员。基于网上公布的基因芯片数据(https://www.genevestigator.ethz.ch/),生成CBL全家族成员的表达热图(Expression heat-map),通过颜色的深浅反映不同的CBL在各组织细胞中的表达情况(图 1)。CBL1主要在叶(保卫细胞及叶肉细胞)与根(根冠及中柱)组织中表达,CBL2、CBL3、CBL8及CBL9在成熟花粉中相对表达较高,而在其他组织中表达较少,或者不表达。CBL4与CBL10分别主要在花柄离区和茎尖中表达。CBL5-CBL7依次主要在下胚轴、柱头及根冠中表达。CBL9作为花粉高量表达的典型代表,被选为进一步研究的对象。

|
| 图 1 CBL家族成员在各组织中的表达热图 |
利用基因枪技术将CBL9在烟草花粉中进行瞬时表达,经过3-4 h的花粉培养,在共焦扫描显微镜下,单独表达YFP的花粉管荧光呈弥散分布。而YFP标记的CBL9则在花粉管质膜上有清晰的表达(图 2-A)。CBL9-YFP定位于胞内随着胞质环流运动的颗粒状细胞器上(图 2-A)。通过生物学统计分析,大约80根花粉管的长度以及花粉管顶端的最宽处直径被测量统计(图 2-B),与对照相比,过表达CBL9的花粉管长度显著缩短,且宽度显著增加。
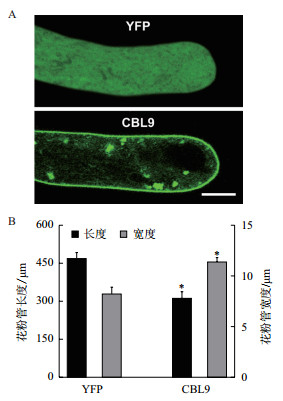
|
| A:CBL9的亚细胞定位情况分析,标尺为5 μm;B:CBL9过表达表型的统计学分析,*代表与YFP对照存在显著性差异(P < 0.01,t检验) 图 2 CBL9在花粉管中的定位(A)与过表达表型统计(B) |
CBL9的N末端存在一个保守的氨基酸位点(图 3-A),即第二位的甘氨酸位点,此位点对于CBL1的花粉管质膜定位至关重要[18]。CBL9与CBL1的序列相似度超过89%,为了验证该位点的作用同样适用于CBL9,将CBL9的第二位甘氨酸(G)定点突变为丙氨酸(A),从而构建CBL9的点突变体(CBL9G2A)。
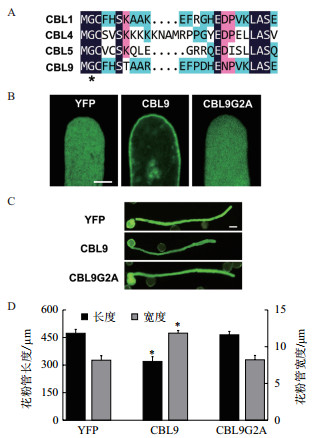
|
| A:部分CBL家族成员的N端保守序列比较分析;B:CBL9G2A-YFP亚细胞定位,标尺为5 μm;C-D:CBL9G2A过表达表型分析。*代表与YFP单独表达的对照组存在显著性差异(P < 0.01,t检验) 图 3 CBL9点突变体在花粉管中的定位与表型分析 |
花粉管亚细胞定位的观察结果(图 3-B)显示,CBL9-YFP有明显的质膜定位,然而CBL9G2A-YFP呈现出与YFP对照相一致的胞质弥散分布。
表型量化结果(图 3-C-D)显示,过量表达CBL9G2A并没有显著影响花粉管的极性生长,即花粉管的长度及宽度与对照没有显著差异。表明CBL9在花粉管中的功能发挥与其质膜定位密切相关。
3 讨论钙离子是花粉管极性生长中至关重要的调节因子[4, 19]。然而,对于花粉管中钙离子信号如何被感知和传递并触发下游反应的认识却十分有限,迄今为止,只有少数信号组分已确定影响花粉管的萌发或生长。本研究通过基因枪技术,在烟草花粉中瞬时过量表达CBL9会使花粉管的顶端生长形态发生改变,即花粉管长度缩短,顶端肿胀。这一结果与Mahs等[18]所得出的结论相一致,进一步印证了CBL9在花粉管顶端生长中发挥重要的作用。另外,亚细胞定位结果显示CBL9主要定位于花粉管的质膜及颗粒状细胞器,相似的定位同样体现在CBL9的同源基因CBL1(氨基酸相似度为89%)上。在前人的研究中[18],CBL1可以和标记囊泡的染料FM4-64共定位,由此推测CBL9所定位的颗粒状细胞器也可能为胞内囊泡系统。花粉管的质膜是介导细胞内外信号传导与物质交换的屏障,胞外的钙离子通过位于质膜上的离子通道,内流到花粉管中,从而参与形成花粉管顶端的钙离子梯度。维持正常的顶端钙离子梯度对于花粉管生长的速率与导向至关重要[1]。目前,多个离子通道参与该调控过程,其中包括环核苷酸门控通道(Cyclic nucleotide gated channel,CNGC)及类谷氨酸受体(Glutamate receptor-like,GLR)等。质膜定位的CNGC18过量表达导致花粉管的异常生长,并伴随着胞内钙离子在顶端的过量聚集[10, 20]。另外,GLR1.2和GLR3.7是一类配体门控的离子通道,促进钙离子通过质膜流入胞内,在生成钙信号和浓度梯度等方面发挥关键功能[9]。由此可以推测质膜定位的CBL9可能通过作用于某一或某些离子通道,参与调控胞内的钙离子梯度的正常建立与维持。
研究显示CBL1的N末端存在肉豆蔻酰化和棕榈酰化修饰位点,这两类脂质修饰一方面可以影响CBL1蛋白到内质网的途径,另一方面也可以妨碍内质网经由囊泡体系到顶端质膜的过程[21]。对CBL1的N末端保守位点进行修改,能够有效阻断这两种脂质修饰,以此获得CBL1的点突变体(CBL1G2A,第二位的甘氨酸定点突变为丙氨酸)。CBL1G2A无法正常定位到质膜上,呈现弥散分布[18]。CBL9与CBL1的序列相似度超过89%,本研究采取了CBL9相似研究策略,并取得了相同的结果,即CBL9的N端保守位点的改变直接影响其正常的花粉管质膜定位和功能发挥。CBL9定位异常的原因可能是由于其N-末端无法有效肉豆蔻酰化和棕榈酰化,从而影响了CBL9借助囊泡体系定位到花粉管质膜的过程。
除了花粉管极性生长方面,序列高度相似的CBL1与CBL9的相关进展主要体现在植物胁迫条件下的应激反应。例如低钾条件下,CBL1与CBL9共同激活下游互作靶蛋白CIPK23,具备蛋白激酶活性的CIPK23再进一步激活质膜定位的钾离子通道AKT1,从而提高了植株根系吸收钾离子的能力。另外CBL1/9-CIPK23体系还可以通过磷酸化作用,激活硝酸盐转运载体CHL1以应对低氮胁迫[13]。尽管CBL1与CBL9在很多方面都体现出相似的生物学功能,但两者的组织定位表现出明显的差异。CBL1主要在叶及根中表达,而CBL9则相对集中于花粉中(图 1)。由此推测CBL1可能主要在胁迫应答方面发挥作用,而CBL9可能主要调控花粉管的极性发育。
本研究中CBL9作为钙离子感受器的一种类型,在花粉管的质膜上呈现均匀分布状态,说明CBL9功能并不局限于一个特定的质膜区域,而是可以在整个花粉管发挥它的功能。处于生长状态的花粉管中存在一个从顶端向下延展的钙离子浓度梯度(2-10 μmol/L),钙离子感受器CBL9作为分子开关的活性高低,可能取决于钙离子在花粉管中不同质膜区域的浓度。CBL下游存在一类蛋白激酶(CIPK),逆境胁迫研究揭示了一个错综复杂的CBL-CIPK互作的网络系统:不同胁迫条件(盐害、低温等)诱导的钙信号被不同的CBLs所感知,然后作用于不同的CIPKs,最终将逆境诱导产生的钙信号按照不同方式传递下去,以完成植物不同的生理活动需要。另外,一个CBL蛋白与不同CIPKs相互作用时可以显示不同钙离子浓度的依赖性[3, 13, 22]。花粉管极性生长过程中可能存在类似的调控体系:花粉管不同区域内的不同钙离子浓度被CBL9感应,进而分别作用于下游不同的CIPKs,最终实现对花粉管顶端生长的多方面调控功能。花粉管顶端生长中的CBL-CIPK调控体系的建立,还有待CBL下游互作因子的进一步发掘。
4 结论CBL9主要定位于花粉管的质膜,其过量表达造成花粉管的去极化生长,而N末端点突变体CBL9G2A无法定位到质膜,并呈现正常的花粉管顶端生长表型。CBL9的N末端在其亚细胞定位及功能发挥方面发挥一定的作用。
| [1] |
Rounds CM, Bezanilla M. Growth mechanisms in tip-growing plant cells[J]. Annu Rev Plant Biol, 2013, 64(2): 43-65. |
| [2] |
Qin Y, Yang Z. Rapid tip growth:insights from pollen tubes[J]. Semin Cell Dev Biol, 2011, 22(8): 816-824. DOI:10.1016/j.semcdb.2011.06.004 |
| [3] |
Steinhorst L, Kudla J. Calcium-a central regulator of pollen germination and tube growth[J]. BBA-Mol Cell Res, 2013, 1833(7): 1573-1581. |
| [4] |
Konrad KR, Wudick MM, Feijo JA. Calcium regulation of tip growth:new genes for old mechanisms[J]. Curr Opin Plant Biol, 2011, 14(6): 721-730. DOI:10.1016/j.pbi.2011.09.005 |
| [5] |
Hepler PK, Kunkel JG, Rounds CM, et al. Calcium entry into pollen tubes[J]. Trends Plant Sci, 2011, 17(1): 32-38. |
| [6] |
Kroeger J, Geitmann A. The pollen tube paradigm revisited[J]. Curr Opin Plant Biol, 2012, 15(6): 618-624. DOI:10.1016/j.pbi.2012.09.007 |
| [7] |
Pierson E, Miller D, Callaham D, et al. Pollen tube growth is coupled to the extracellular calcium ion flux and the intracellular calcium gradient:effect of BAPTA-type buffers and hypertonic media[J]. The Plant Cell, 1994, 6(12): 1815-1828. DOI:10.1105/tpc.6.12.1815 |
| [8] |
Rathore K, Cork R, Robinson K. A cytoplasmic gradient of Ca2+ is correlated with the growth of lily pollen tubes[J]. Dev Biol, 1991, 148(2): 612-619. DOI:10.1016/0012-1606(91)90278-B |
| [9] |
Michard E, Lima PT, Borges F, et al. Glutamate receptor-like genes form Ca2+ channels in pollen tubes and are regulated by pistil D-serine[J]. Science, 2011, 332(6028): 434-437. DOI:10.1126/science.1201101 |
| [10] |
Frietsch S, Wang YF, Sladek C, et al. A cyclic nucleotide-gated channel is essential for polarized tip growth of pollen[J]. PNAS, 2007, 104(36): 14531-14536. DOI:10.1073/pnas.0701781104 |
| [11] |
Schiott M, Romanowsky SM, Baekgaard L, et al. A plant plasma membrane Ca2+ pump is required for normal pollen tube growth and fertilization[J]. PNAS, 2004, 101(25): 9502-9507. DOI:10.1073/pnas.0401542101 |
| [12] |
Gu Y, Fu Y, Dowd P, et al. A Rho family GTPase controls actin dynamics and tip growth via two counteracting downstream pathways in pollen tubes[J]. J Cell Biol, 2005, 169(1): 127-138. DOI:10.1083/jcb.200409140 |
| [13] |
Luan S. The CBL-CIPK network in plant calcium signaling[J]. Trends Plant Sci, 2009, 14(1): 37-42. DOI:10.1016/j.tplants.2008.10.005 |
| [14] |
Hashimoto K, Kudla J. Calcium decoding mechanisms in plants[J]. Biochimie, 2011, 93(12): 2054-2059. DOI:10.1016/j.biochi.2011.05.019 |
| [15] |
Kudla J, Batistic O, Hashimoto K. Calcium signals:The lead currency of plant information processing[J]. The Plant Cell, 2010, 22(3): 541-563. DOI:10.1105/tpc.109.072686 |
| [16] |
Xu J, Li HD, Chen LQ, et al. A protein kinase, interacting with two calcineurin B-like proteins, regulates K+ transporter AKT1 in Arabidopsis[J]. Cell, 2006, 125(7): 1347-1360. DOI:10.1016/j.cell.2006.06.011 |
| [17] |
Liu J, Zhu JK. A calcium sensor homolog required for plant salt tolerance[J]. Science, 1998, 280(5371): 1943-1945. DOI:10.1126/science.280.5371.1943 |
| [18] |
Mahs A, Steinhorst L, Han JP, et al. The calcineurin B-like Ca2+ sensors CBL1 and CBL9 function in pollen germination and pollen tube growth in Arabidopsis[J]. Mol Plant, 2013, 6(4): 1149-1162. DOI:10.1093/mp/sst095 |
| [19] |
Bloch D, Yalovsky S. Cell polarity signaling[J]. Curr Opin Plant Biol, 2013, 16(6): 734-742. DOI:10.1016/j.pbi.2013.10.009 |
| [20] |
Chang F, Yan A, Zhao LN, et al. A putative calcium-permeable cyclic nucleotide-gated channel, CNGC18, regulates polarized pollen tube growth[J]. J Integr Plant Biol, 2007, 49(8): 1261-1270. DOI:10.1111/jipb.2007.49.issue-8 |
| [21] |
Batistic O. Plant calcineurin B-like proteins and their interacting protein kinases[J]. BBA-Mol Cell Res, 2009, 1793(6): 985-992. |
| [22] |
Defalco TA, Bender KW, Snedden WA. Breaking the code:Ca2+ sensors in plant signalling[J]. Biochem J, 2010, 425(1): 27-40. DOI:10.1042/BJ20091147 |




