温度对植物的生长发育和地理分布起着重要的作用,是极其重要的环境因子之一。低温会降低作物的产量和品质,影响作物的产量和品质[1]。
在低温条件下,植物体内的亲水蛋白、可溶性糖等渗透调节物质大量增加,膜组成改变[2]。低温胁迫首先伤害的是植物细胞的细胞膜,低温胁迫下,细胞膜由液晶相逐渐转变为凝胶相,膜流动性降低、离子渗漏和膜蛋白失活等现象[3]。生物膜是细胞与外界环境联系的界面,生物膜的基本组成成分之一是多不饱和脂肪酸(PUFAs),PUFAs通常是指含有两个或两个以上双键的长链脂肪酸,具有重要的生理功能[4]。植物体内膜脂的PUFAs约占总脂肪酸的60%,为适应低温胁迫,植物往往会通过改变自身不饱和脂肪酸含量进而来调整膜的流动性,从而维持适宜于蛋白发挥活性的环境[5]。而脂肪酸不饱和水平的变化主要通过调节脂肪酸去饱和酶的活性来实现[6-7]。
在植物中,脂肪酸去饱和酶可分为ω-3型(FA-D2、FAD6)和ω-6型(FAD3、FAD7、FAD8)两大类,催化在脂肪酸链的特定位置形成双键,从而产生特定的不饱和脂肪酸。ω-3脂肪酸去饱和酶是不饱和脂肪酸合成途径中催化16:2(7,10)或18:2(9,12)转化为16:3(7,1 0,13)或18:3(6,9,12)的关键酶,使脂肪酸形成第三个双键。
近年来,已经有许多植物的ω-3脂肪酸去饱和酶基因被克隆,如马铃薯[8]、黄瓜[9]、菊花[10]、紫苏[11]和播娘蒿[12]等。研究也发现这些脂肪酸去饱和酶基因在改变植物膜脂脂肪酸的组成、叶绿体的发育以及叶片成熟过程中三烯脂肪酸含量的增加、抗冷性的增强、低温光抑制后光合能力的恢复等方面具有重要作用。转AtFAD8基因烟草的MDA含量明显低于野生型植株,而抗氧化酶活性明显高于野生型植株,表明AtFAD8基因通过增加转基因烟草的抗氧化能力而提高烟草幼苗的耐冷性[13]。将烟草中ω-3脂肪酸去饱和酶的编码基因沉默会导致突变植株的三烯脂肪酸比野生型植株明显减少[14]。于超[15]发现过量表达番茄内质网ω-3脂肪酸去饱和酶基因FAD3能够增强番茄植株的耐冷性,而抑制该基因表达可提高番茄植株的耐热性。陈玮国等[16]发现油葵FAD2-5可能参与了油葵对低温胁迫应答的调节,并且其表达具有昼夜节律性。曹英萍等[17]发现OsFAD7和OsFAD8的mRNA在低温下上升,并且mRNA的表达具有昼夜节律性。
甜高粱是单子叶禾本科高粱属C4植物,其茎秆含糖量极高,具“二代甘蔗”的美名[18]。甜高粱不仅生物量极高,还耐盐碱、耐旱、耐涝、耐高温、耐严寒[19]。甜高粱对土壤的适应能力很强,pH值为5.0-8.5,均能很好生长。适应栽培的区域广泛,10℃以上积温2 600-4 500℃的地区(从海南岛至黑龙江),均可栽培。高粱籽粒可食用、饲用、酿酒;茎秆可做饲料、制糖等,秆渣还可饲用、制纸等[20]。因此,甜高粱具有较大的生物学优势以及经济学优势。而对甜高粱这些优良的特性进行研究有利于我们对其他作物进行基因改造,获得耐胁迫性的作物。
本研究将从甜高粱分离并克隆得到的ω-3脂肪酸去饱和酶基因FAD7在野生型拟南芥中过量表达,测定了在低温处理条件下野生型和过表达植株的Fo、Fv/Fm、电导率、MDA、超氧阴离子自由基和过氧化氢含量等指标,阐明SbFAD7在植物抗冷中的作用,旨为探索植物抗冷的机理奠定基础。
1 材料与方法 1.1 材料甜高粱自交系M-81E种子,拟南芥野生型种子,大肠杆菌菌株(DH5α),农杆菌菌株(GV3101)。反转录试剂盒购自华越洋,植物总RNA提取试剂盒、质粒小提试剂盒胶回收试剂盒等均购自天根生化科技有限公司。
1.2 方法 1.2.1 SbFAD7基因的克隆及生物信息学分析将沙培的长至三叶一心期的甜高粱取材,提取其RNA进行PCR扩增,然后将得到的PCR反应产物进行琼脂糖凝胶电泳检测目的条带以获取基因的全长。所用引物为FAD-F、FAD-R,序列见表 1。利用NCBI数据库和生物信息学软件对SbFAD7的蛋白结构、同源性和进化进行分析。
将长至三叶一心时期的甜高粱一部分用0、50、100、150和200 mmol/L NaCl溶液处理48 h,一部分用100 mmol/L NaCl溶液处理0、12、24、36、48 h,一部分用4℃处理0、4、8、12、24 h后取材提RNA,用Beacon Designer 7软件设计RT-PCR引物,引物为FAD-S和FAD-A。选用甜高粱的β-actin基因作为内参,引物为Sbactin-S和Sbactin-A。引物序列如表 1。
1.2.3 拟南芥过表达植株中SbFAD7基因的表达量分析以野生型,过表达植株的RNA为模板,用设计的qPCR特异性引物进行基因的定量分析。利用拟南芥Actin2基因的引物作为内参,引物分别为AtActin2-S和AtActin2-A,序列如表 1。
1.2.4 转基因拟南芥中脂肪酸含量的测定采用毛细管气相色谱法测定野生型和过表达植株中脂肪酸的含量。将叶片在研钵中研磨后放入105℃的恒温干燥箱烘至恒重。在10 mL比色管中加入样品0.5 g,再加入2 mL提取液(苯:石油醚=1:1),静置30 min以上。然后加入1 mL 0.4 N的KOH/CH3OH溶液,静置10 min以上。加入超纯水定容,待上层液澄清后,将0.25 mL的上清液移入安培瓶中,在N2下吹干,再加入50 µL正己烷,最后取0.5 µL进样分析。每个处理均做3个重复。
1.2.5 Fo和Fv/Fm的测定叶片暗适应20-30min后,以英国Hansatech公司生产的FMS2便携调制式荧光仪测定Fo、Fm等荧光参数。暗适应下可变荧光可根据公式计算:
Fv=Fm-Fo
式中,Fo:初始荧光,即PSII反应中心处于完全开放时的荧光产量;Fm:最大荧光产量,即PSII反应中心处于完全关闭时的荧光产量;Fv:暗适应下的可变荧光,反应QA的氧化还原状态;Fv/Fm:暗适应下PSII的最大光化学效率。
1.2.6 电导率的测定将长势差不多的叶片放入具塞试管中,先用去离子水洗3次,然后加15 mL去离子水置于真空泵中抽气30 min,振荡器上振荡2 h,静置摇匀,测定初电导。然后沸水煮30 min,冷却至室温10 min,测定终电导。根据公式计算:
相对电导率(%)=(初电导-空白)×100/(终电导-空白)。
1.2.7 MDA的测定取拟南芥的叶片,称重,剪碎,放入研钵中,加入少量石英砂和2 mL 0.1%的三氯乙酸(TCA),充分研磨,将匀浆移入试管中,用1.5 mL 0.1%的三氯乙酸分别冲洗研钵两次,将冲洗液都倒入试管中,再加入2.5 mL 0.5%的硫代巴比妥酸,摇匀,沸水浴10 min后,立即取出放入冷水中,冷却后,3 000 r/min离心10 min,取上清液量其体积,以0.5%的硫代巴比妥酸溶液为空白对照,用分光光度计分别测量532 nm和600 nm的吸光度。根据公式计算MDA的含量:
MDA含量(mmol/g FW)=ΔA×N/(155×W)
式中:ΔA:A532和A600之差,N:上清液总体积,155为1 mmol反应产物在532 nm处的吸收系数,W:称取植物材料的鲜重(g)。
1.2.8 超氧阴离子自由基含量的测定称取植物材料0.3 g,加5 mL预冷的50 mmol/L PBS(pH 7.8)在冰上研磨。匀浆液转入10 mL离心管中,12 000 r/min离心20 min,冰上保存,此时上清液为O2-.的待测液。反应体系:1 mL待测液+0.8 mL 50 mmol/L PBS(pH 7.8)+0.2 mL 10 mmol/L盐酸羟胺,振荡混匀,25℃温浴1 h,再分别向各管中加1 mL 17 mmol/L对氨基苯磺酸,1 mL 7 mmol/L α-萘胺,振荡混匀,25℃温浴20 min,以标曲中的1号管作对照,测定530 nm处的吸光度值。以标准曲线计算O2-.的产生速率。
1.2.9 过氧化氢含量的测定称取植物材料0.2 g,加5 mL 4℃预冷的丙酮研磨提取。匀浆液转入5 mL离心管中,3 000 r/min离心10 min,上清液即为H2O2待测液。反应体系为:1 mL待测液+0.1 mL 20% TiCl4+0.2 mL浓氨水,待沉淀形成后3 000 r/min离心10 min,弃上清,用适量丙酮(5 mL)洗涤3到5次,最后用5 mL 2 mol/L H2SO4溶解沉淀后转移至10 mL容量瓶中,用蒸馏水定容,以标曲中的1号管作对照,测定415 nm处的吸光度值。以标准曲线计算H2O2的含量。
2 结果 2.1 基因的克隆及生物信息学分析SbFAD7基因的编码区序列长度为1 356 bp,编码452个氨基酸。从图 1可以看出,玉米的ω-3脂肪酸去饱和酶基因与甜高粱SbFAD7基因亲缘关系最近。

|
| Ac:菠萝(Ananas comosus);At:拟南芥(Arabidopsis thaliana);Bd:二穗短柄草(Brachypodium distachyon);Dc:铁皮石斛(Dendrobium catenatum);Os:水稻(Oryza sativa);Pm:黍(Panicum miliaceum);Si:小米(Setaria italica);Zm:玉米(Zea mays) 图 1 甜高粱FAD7基因的生物信息学分析 |
如图 2所示,SbFAD7基因的表达受到盐和低温的诱导,随着盐浓度的增加,SbFAD7基因的表达量逐渐升高,在200 mmol/L NaCl处理下,SbFAD7基因的表达量最高(图 2-A);随着盐和低温处理时间的增加,SbFAD7基因的表达量也随之增加,分别在盐溶液处理48 h、低温处理24 h时,SbFAD7基因的表达量达到最高(图 2-B和2-C)。
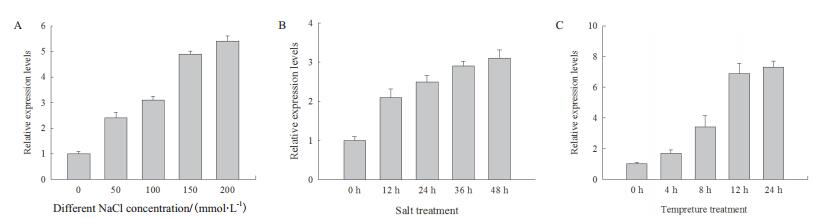
|
| 图 2 甜高粱FAD7基因在非生物胁迫下的表达量分析 |
拟南芥过表达植株的不同株系中,SbFAD7的转录水平和野生型相比都显著提高,表明SbFAD7基因已成功转入到拟南芥植株中(图 3)。其次,过表达植株OE1、OE13和OE17中SbFAD7的转录水平相对于其他株系来说比较高,因此我们选择OE1、OE13和OE17进行后期生理指标的验证。
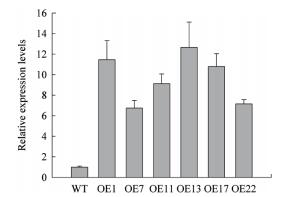
|
| 图 3 过表达拟南芥植株中SbFAD7的表达量分析 |
如表 2所示,相对于野生型植株,过表达植株的18:2含量明显降低,18:1含量稍微降低,而18:3含量明显升高。从图 4也可看出,低温处理后过表达植株的抗冷性明显比野生型植株的抗冷性强。说明SbFAD7基因过量表达后,促进了18:2向18:3的转化,提高了拟南芥植株的抗冷性。

|
| 图 4 冷处理后野生型植株和过表达植株的生长情况 |
从图 5可看出,低温胁迫下,野生型和过表达拟南芥的Fo均有所升高,而最大光化学效率降低,但相对于野生型来说,过表达植株OE1,OE13,OE17的Fo增加的少,而Fv/Fm的下降幅度较野生型要低,表明SbFAD7在拟南芥中的过量表达,能够提高拟南芥的光化学效率,减轻低温光抑制,提高拟南芥抵抗低温的能力。

|
| 每列代表 5次测量的x±s,不同字母识别的平均值在P < 0.05时有显著差异,下同 图 5 冷处理后对拟南芥叶绿素荧光的影响 |
如图 6所示,低温处理24 h条件下,野生型和过表达拟南芥的电导率和MDA含量都增加,但过表达植株的增加幅度明显比对照低,这说明SbFAD7的过量表达能够减轻低温胁迫下膜脂过氧化水平,从而降低植物细胞遭受逆境伤害的程度。

|
| 图 6 冷处理后拟南芥叶片中电导率和丙二醛含量的变化 |
由图 7中可以看出,在低温处理24 h条件下,野生型和过表达拟南芥叶片的H2O2含量和O2-.产生速率均有所增加,而且过表达植株增加的量都比野生型增加的少,说明SbFAD7的过量表达能够降低细胞中活性氧的产生。

|
| 图 7 冷处理对拟南芥中H2O2和O2-.的影响 |
低温胁迫是对植物尤其是农作物的生长发育威胁较大的一类非生物胁迫因子[21],因此研究农作物的耐冷基因一方面可以揭示农作物的耐冷机理,另一方面还可以提高农作物的耐冷性。
本研究发现SbFAD7基因的表达量与盐浓度、盐处理时间以及低温处理时间成正相关,随着盐浓度的增大,基因的表达量也随之增大,并在200 mmol/L下达到最大。分别随着盐和低温处理时间的增加,SbFAD7基因的表达量也随之增加。表明SbFAD7基因是组成型表达,其表达受高盐和低温诱导。
ω-3脂肪酸去饱和酶是催化18:2转化为18:3的关键酶,研究表明,低温处理下膜脂的三烯脂肪酸含量增加是对低温胁迫的适应[22]。本试验发现SbFAD7基因过表达之后促进了18:2向18:3的转化。
在叶绿素荧光参数中,Fv/Fm是暗适应下PSII最大光化学效率,代表PSII原初光能转化效率,是光抑制的重要指标[23]。本研究发现低温处理24 h条件下,SbFAD7基因过表达植株的Fv/Fm较野生型要高,表明在低温胁迫条件下,SbFAD7基因过表达能够增强膜的稳定性,减轻PSII的光抑制。
膜脂脂肪酸含量的不饱和程度会影响膜的流动性[24],通过测定电导率来研究低温处理对膜的伤害程度。低温处理下,SbFAD7基因过表达植株的电导率比野生型的电导率低。由此说明,相对于野生型,转基因植株的膜系统的伤害程度比较轻。
植物的防御系统在低温等逆境条件下遭到破坏后,活性氧(H2O2和O2-.)会大量积累,引发膜脂过氧化作用,进而引发一系列的生理代谢紊乱[25]。MDA作为膜脂过氧化的产物,其含量代表膜脂过氧化的水平,反映植物细胞遭受逆境伤害的程度[26]。本研究发现在低温处理24 h下,转基因植株的MDA、H2O2含量以及O2-.产生速率均比野生型的低,这就说明SbFAD7基因能够通过减少植物体内的活性氧的积累,降低膜脂过氧化的程度,进而保护膜结构,提高植物细胞的抗低温能力。
本研究通过对甜高粱SbFAD7基因的研究发现该基因受低温胁迫诱导,将该基因过表达拟南芥之后会促进亚油酸向亚麻酸的转化,提高不饱和脂肪的含量,减轻低温光抑制,减少了活性氧的积累,从而减轻膜脂过氧化程度,保持低温胁迫下细胞膜的完整性,提高转基因植株的抗低温能力。
4 结论本研究发现甜高粱ω-3脂肪酸去饱和酶FAD7基因能够通过促进18:2向18:3的转化,减轻PSII的光抑制,减少植物体内活性氧的积累,降低膜脂过氧化的程度,增强膜的稳定性来提高植物的抗冷性。
| [1] |
于超, 王华森. 番茄内质网ω-3脂肪酸去饱和酶基因表达载体的构建与转化[J]. 西北农业学报, 2012, 21(9): 90-94. |
| [2] |
刘华, 张建涛, 陈海燕, 等. 脂肪酸去饱和酶参与植物对胁迫的响应[J]. 东北农业大学学报, 2013(1): 154-160. DOI:10.3969/j.issn.1005-9369.2013.01.034 |
| [3] |
刘奕清, 朱建勇, 陈泽雄. 低温胁迫对尾巨桉幼苗细胞膜透性的影响[J]. 林业科技, 2007, 32(4): 3-5. |
| [4] |
李金金, 张晶晶, 年洪娟. Δ12-脂肪酸去饱和酶FAD2的基本特性及其在胁迫中的功能[J]. 生命科学研究, 2013, 17(2): 174-178. DOI:10.3969/j.issn.1007-7847.2013.02.015 |
| [5] |
刘训言.番茄叶绿体ω-3脂肪酸去饱和酶基因(LeFAD7)的克隆及其在温度逆境下的功能分析[D].泰安: 山东农业大学, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y903604
|
| [6] |
曹福亮, 王欢利, 郁万文, 等. 高等植物脂肪酸去饱和酶及编码基因研究进展[J]. 南京林业大学学报:自然科学版, 2012, 36(2): 125-132. |
| [7] |
戴晓峰, 肖玲, 武玉花, 等. 植物脂肪酸去饱和酶及其编码基因研究进展[J]. 植物学报, 2007, 24(1): 105-113. |
| [8] |
李飞, 徐建飞, 刘杰, 等. 三个耐冻性不同的马铃薯野生种中FAD2基因的克隆及表达分析[J]. 作物学报, 2014, 40(1): 45-53. |
| [9] |
刘春香, 何启伟, 赵光强, 等. 黄瓜ω-3脂肪酸去饱和酶基因cDNA的克隆及表达[J]. 园艺学报, 2008, 35(9): 1357-1362. DOI:10.3321/j.issn:0513-353X.2008.09.017 |
| [10] |
李永华, 王翠丽, 李永, 等. 菊花脂肪酸脱饱和酶基因CmFAD7的克隆与表达分析[J]. 园艺学报, 2015, 42(1): 65-74. |
| [11] |
梁倩, 李璐, 安茜, 等. 紫苏脂肪酸去饱和酶基因PfFAD2的生物信息学及表达特性分析[J]. 山西农业科学, 2018, 46(3): 316-319. DOI:10.3969/j.issn.1002-2481.2018.03.02 |
| [12] |
唐三元, 黄骥, 张红生, 等. 播娘蒿油酸脱氢酶基因(DsFAD6)的克隆和表达分析[J]. 分子植物育种, 2007, 5(1): 15-20. |
| [13] |
Kodama H, Horiguchi G, Nishiuchi T, et al. Fatty acid desaturation during chilling acclimation is one of the factors involved in conferring low-temperature tolerance to young tobacco leaves[J]. Plant Physiol, 1995, 107: 1177-1185. DOI:10.1104/pp.107.4.1177 |
| [14] |
Murakami Y, Tsuyama M, Kobayashi Y, et al. Trienoic fatty acids and plant tolerance of high temperature[J]. Science, 2000, 41(5452): 476-479. |
| [15] |
于超.温度胁迫下番茄内质网ω-3脂肪酸去饱和酶基因的表达和功能研究[D].泰安: 山东农业大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10434-2009234719.htm
|
| [16] |
陈玮国, 周至铭, 周茜萍, 等. 油葵HaFAD2-5基因的克隆及其对低温和光照的响应[J]. 分子植物育种, 2018, 16(2): 452-459. |
| [17] |
曹英萍, 石金磊, 李钟, 等. 水稻OsFAD2、OsFAD6的克隆及其家族成员对非生物胁迫的响应[J]. 遗传, 2010, 32(8): 839-847. |
| [18] |
魏福年, 马龙彪. 非生物胁迫对甜高粱种子萌发的影响国内研究进展[J]. 中国糖料, 2018, 40(2): 55-57. |
| [19] |
李欣欣, 黄萍, 庄义庆, 等. 能源作物甜高粱抗逆性的研究进展[J]. 江苏农业学报, 2016, 32(6): 1429-1433. DOI:10.3969/j.issn.1000-4440.2016.06.036 |
| [20] |
王栋, 孙峰, 陈吉宝. 甜高粱抗逆性研究进展[J]. 河南农业, 2017(14): 28-30. |
| [21] |
马刘峰, 陈芸, 任羽, 等. 棉花CBF2基因克隆和超表达CBF2棉花增强抗冷性[J]. 植物生理学报, 2018, 54(2): 255-264. |
| [22] |
高岩, 郭东林, 郭长虹. 三烯脂肪酸在高等植物逆境胁迫应答中的作用[J]. 分子植物育种, 2010, 8(2): 365-369. |
| [23] |
刘明丽.干旱胁迫下氮素对玉米生理特性的影响[D].济南: 山东师范大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10445-1016075683.htm
|
| [24] |
陈善娜, 黎继岚, 李聪. 云南高原水稻品种干胚膜脂脂肪酸的不饱和度与抗冷性关系[J]. 云南大学学报:自然科学版, 1995(3): 264-268. |
| [25] |
李晶, 阎秀峰, 祖元刚. 低温胁迫下红松幼苗活性氧的产生及保护酶的变化[J]. 植物学报, 2000, 42(2): 148-152. DOI:10.3321/j.issn:1672-9072.2000.02.007 |
| [26] |
王瑞, 马凤鸣, 李彩凤, 等. 低温胁迫对玉米幼苗脯氨酸、丙二醛含量及电导率的影响[J]. 东北农业大学学报, 2008, 39(5): 20-23. DOI:10.3969/j.issn.1005-9369.2008.05.005 |






