核酸除了作为遗传物质的载体之外,还可以与一些天然存在或人工合成的小分子或离子结合,并发生构象的改变; 或是在这些靶分子的存在下,具有类似蛋白酶的催化活性,可以催化底物发生切割或连接反应,这一类核酸称为功能核酸(Functional nucleic acids,FNAs)[1-2]。FNAs主要有两类[3],一类是与靶物质结合时可发生构象改变的适配体(Aptamer); 另一类是有酶催化活性的脱氧核酶(DNAzyme)和G-四链体(富含腺嘌呤的DNA所形成的四链体结构)与氯化血红素的复合物(Hemin/G4)。
近些年来,许多学者将FNAs用于构建各种生物传感器,包括光学生物传感器[4-5]、压电生物传感器[6-7]和电化学生物传感器[8-9]。其中,电化学功能核酸生物传感器(Functional Nucleic Acids Elechemical Biosensors,FNAs-EB)由于其操作简单,便携性,灵敏度高,特异型强等优点,并且在快速检测和现场检测方面具有广阔的发展前景,近年来备受青睐。
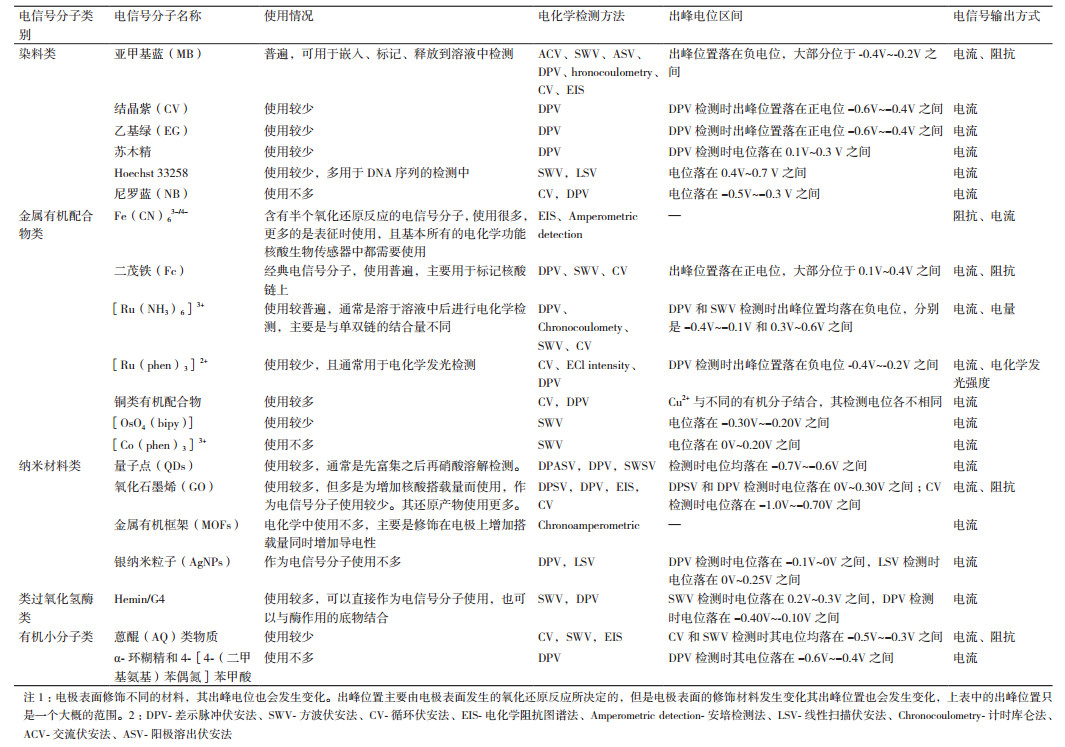
FNAs-EB的构建包括3个过程:信号识别、信号转换和信号输出[10]。信号识别主要是通过具有特异性识别能力的FNAs来实现; 信号转换主要是通过具有电活性的电信号分子实现的; 信号输出主要是通过电化学工作站和相关的分析设备来完成。具有氧化还原活性的电信号分子是FNAs-EB中必不可少的信号转换元件。核酸在电极表面的状态、是否与靶物质结合、单链还是双链都可以通过这些电信号分子的转换变成电化学信号(电流、阻抗、电位、电势)显示出来(图 1)。因此,电信号分子的选择对于每一个FNAs-EB的构建都至关重要。常用的电化学检测方法包括差示脉冲伏安法(Differential pulse voltammograms,DPV)、方波伏安法(Square wave voltammetry,SWV)、循环伏安法(Cyclic voltammograms,CV)、电化学阻抗图谱法(Electrochemical impedance spectroscopy,EIS)、安培检测法(Amperometric detection)、线性扫描伏安法(Linear sweep voltammetry,LSV)、计时库仑法(Chronocoulometry)、交流伏安法(Alternating current voltammetry,ACV)、阳极溶出伏安法(Anodic stripping voltammetry,ASV)等。
|
| 图 1 电信号的输出形式 |
目前尚未发现有研究人员对于FNAs-EB中所使用的电信号分子进行总结或是分类,因此,本文将电信号分子按照其化学本质和结构特征进行分类,共分为5大类,分别介绍了每种电信号分子的产生电信号的方式和电信号分子的具体应用,并对每种电信号分子的优缺点进行了说明,最后对电信号分子的发展进行了展望。
FNAs-EB中的电信号分子主要包括染料类、金属有机配合物类、纳米材料类、类过氧化氢酶类和有机小分子类。每一大类下都有具体的分类,具体见表 1。该表主要从电信号分子的使用情况、电化学检测方法、出峰电位区间以及电信号输出信号的方式对电信号分子进行汇总。
|
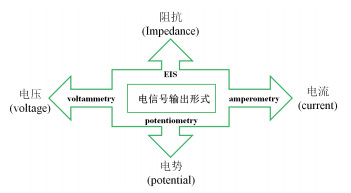
| 图 2 染料类电信号分子 |
染料类的电信号分子通常是一些具有多个苯环或者杂环的有机小分子,它们与DNA的相互作用主要是沟槽作用和嵌插作用。有平面结构的多环芳烃(如吖啶类、吩噻嗪类、卟啉类等)可以以嵌插方式作用于DNA分子碱基对,还可以通过自身所带的电荷与DNA发生静电吸附作用[11]。但是,苏木精与DNA间不是嵌插作用模式或沟槽作用模式、而是静电作用模式[12]。
1.1 亚甲基蓝亚甲基蓝(Methylene blue,MB),也称次甲基蓝,是一种芳香杂环化合物,属吩噻嗪类染料,被用作化学指示剂、染料、生物染色剂和药物使用。MB用作氧化还原指示剂通常用于电化学生物传感器检测中,其产生电信号的方式主要有3种。
把电信号分子标记在核酸链上,通过核酸构象的改变来调节亚甲基蓝和电极表面距离,从而通过峰电流或者阻抗的变化来表示靶物质的存在与否及靶物质的多少。Mao等[13]将MB标记在三核酸链上,靶物质的存在将适配体分离,从而导致三核酸的形成,MB与电极表面的距离拉近而实现电流的增加,其检测限(Limit of detection,LOD)是0.86 nmol/L。这种方式是MB最常见的使用方式,标记方式简单且通用,但是容易受到溶液环境的干扰且合成价格较贵。
研究表明,亚甲基蓝与单双链DNA(ssDNA/dsDNA)的结合能力不同,与dsDNA结合较多而与ssDNA作用较少[14]。因此在利用FNAs进行检测的过程中,可以通过从ssDNA到dsDNA的转换或是dsDNA到ssDNA的转换而引起的电信号的变化来进行电化学检测。Yun等[15]利用铀酰离子(UO22+)的切割核酶和杂交链式反应(Hybridization chain reaction,HCR),当靶物质UO22+存在时,发生切割,裸露的ssDNA触发HCR反应,形成长双链,在溶液中加入MB,MB与dsDNA结合,电化学检测有明显电流增加。这种方法虽然使用简单,但是背景信号容易过高。
有研究人员将标记在核酸链上的MB的通过酶切等作用释放到溶液中,然后进行电化学方法检测[16]。如Liu等[17]通过形成G4把MB封闭到纳米介孔二氧化硅中,在碱性环境中G4结构中打开,释放MB到溶液中,然后进行电化学检测,实现对甲基转移酶活性的检测。该方法使用较少。
1.2 结晶紫结晶紫(Crystal violet,CV)是三苯甲烷染料家族的成员,已被广泛用于纺织品,纸张,食品和药物的染色,同时也是生化调查中重要的生物染色剂和探针。有研究发现CV具有与带负电荷的磷酸骨架和G4环的氢键和阳离子-偶极相互作用的能力。Kong等[18]则进一步证明CV对G4的选择性比dsDNA或ssDNA显著。Li等[19]设计了一个利用Pb2+诱导富含G的序列形成G4结构,当CV嵌入到G4结构中时,发生CV的还原,导致电流增强,从而实现对Pb2+的检测,其检测限为0.4 nmol/L。CV在功能核酸介导的电化学生物传感器中使用较少,可能由于其使用范围太窄。
1.3 乙基绿乙基绿(Ethyl Green,EG)也属三苯甲烷家族,是一种染料,金黄色闪光结晶,可溶于水和乙醇,由CV加入乙基制成。有研究的光谱和电化学结果表明,DNA和EG的主要相互作用模式是选择性条件下的静电结合[20]。Maryam等[21]利用EG作为电信号物质基于C-Ag+-C错配检测Ag+。当Ag+存在的时候,富含C的核酸序列与之结合,使得原本与核酸链结合的EG部分脱去而导致峰电流的降低,从而实现对Ag+的检测,检测限是26 pmol/L。该方法是一个阳性组信号减小的模型,这对于其线性检测范围的上限是一个很大的限制。
1.4 苏木精苏木精(Hematoxylin)是一种天然染料,可以和核酸链结合用于电化学生物传感器中。苏木精与单双链DNA的结合能力不同,但都是与DNA链的大沟穴结合且更倾向于和dsDNA结合,其结合的差异性可以通过电信号的差异显示。Aghili等[22]利用苏木精作为电信号分子设计了一个检转基因的电化学生物传感器,该方法实现了较高的灵敏度,其检测限是13.0×10-15 mol/L。
1.5 Hoechst 33258Hoechst 33258,是一种荧光染料,常用于细胞中的DNA染色,可与DNA链中富含腺嘌呤-胸腺嘧啶(A-T)的区域,与DNA中的小沟穴结合。有研究人员把Hoechst 33258用于电化学生物传感器中作为电信号分子[23],Ahmed等[24]基于环介导的等温扩增反应构建了检测转基因玉米的电化学传感器,利用Hoechst 33258的氧化产生的电子转移来实现电信号的产生。Hoechst 33258在电化学生物传感器中应用较少,且多用于转基因的检测。
1.6 尼罗蓝尼罗蓝(Nile blue,NB),又称耐尔蓝,尼罗蓝硫酸盐。绿色结晶性粉末,具有金属光泽。溶于热水呈蓝色,微溶于冷水和乙醇,常用于配制酸碱混合指示剂,也用作生物染色剂。NB是具有杂环平面和刚性结构的阳离子吩恶嗪染料,其平面疏水性吩恶嗪部分会促进NB嵌入到DNA螺旋的相对非平面内部,其结合常数约10-3。NB与ssDNA的结合是通过静电相互作用,而与dsDNA的结合是嵌入和静电相互作用的双重作用,根据这种结合的差异性,可以把NB用于FNAs-EB中[25]。Alipour等[26]利用NB作为电信号分子用于检丙型肝炎病毒,NB与靶分子和探针所形成的dsDNA结合,导致NB在dsDNA上积累而实现电信号的增加。由于NB与单双链均可结合,这种方法的背景信号会比较高。
2 金属有机配合物类电信号分子金属有机配合物是指由金属原子或离子作为中心原子或中心离子与有机配体完全或部分由配位键结合形成的化合物[27]。过渡金属配合物具有低毒性,易制备,化学稳定性好,氧化还原信号强,结构灵活性高等优点,因此,金属基配合物经常被设计用作电化学DNA杂交指示剂。对于带负电的金属有机配合物,它与DNA的相互作用主要是与DNA的带负电的磷酸骨架之间的静电排斥作用力[28-29],如[Fe(CN)6]3-/4-。而带正电的金属有机配合物与DNA的相互作用方式主要是外层的静电作用。常用于FNAs-EB的过渡金属有机配合物主要包括:铁类有机配合物、钌类有机配合物、铜类有机配合物、锇类有机配合物、钴类有机配合物等。
|
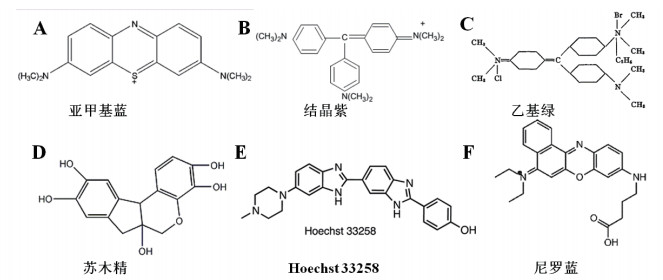
| 图 3 金属有机配合物类电信号分子 |
铁氰化钾{K3[Fe(CN)6]},别名赤血盐,深红色或红色单斜晶系柱状结晶或粉末。亚铁氰化钾K4[Fe(CN)6俗称黄血盐,是化学式为K4[Fe(CN)6·3H2O的配位化合物。室温下为柠檬黄色单斜晶体,于沸点分解。两者均可溶于水。K3[Fe(CN)6和K4[Fe(CN)6的酸根离子两者本身就是一组可以发生半个氧化还原反应的离子对,其在FNAs-EB中的应用主要是用于EIS检测中,通过检测带负电的[Fe(CN)6]3-/4-离子和带负电的核酸的磷酸骨架的静电排斥作用的阻抗值,然后根据EIS图谱判断电极表面的核酸修饰情况。Huang等[30]构建了一个基于腺嘌呤纳米线的Hg2+电化学生物传感器,并用含[Fe(CN)6]3-/4-的溶液对核酸修饰的电极进行表征,而Cai等[31]构建了一个基于DNA水凝胶和切割核酶介导的靶循环及HCR检Hg2+的传感器,并用EIS直接进行定性和定量检测,并获得线性检测范围和检测限。
2.1.2 二茂铁及其衍生物二茂铁(Ferrocene,Fc)也称双环茂二烯合铁,是一种具有芳香族性质的过渡金属有机化合物。常温下为橙黄色粉末,有樟脑气味。Fc由于具有2个可以自由旋转的环戊二烯环,能与DNA碱基产生疏水、堆积作用而发生沟面结合[32]。Fc作为电信号分子其产生电信号的方式主要是被标记在核酸链的末端或者茎环核酸的一端,通过切割核酶的切割作用或是核酸链之间的相互作用改变Fc与电极表面之间的距离,从而实现电信号的改变,达到检测的目的。Wei等[33]基于三核酸结构和抗原抗体杂交构建了一个检地高辛抗体的生物传感器,抗原抗体结合之后,三核酸结构打开,形成茎环,Fc与电极之间距离减小,电流增加。Zhang等[34]基于Pb2+的切割核酶和发卡的结构设计了一个检Pb2+的生物传感器,当靶物质Pb2+存在时,发卡的一部分被切割,Fc远离电极,电流减小,从而实现对Pb2+的检测,检测限是0.25 nmol/L。Fc作为电信号分子在FNAs-EB中使用较多,和MB一样都是经典的电信号分子,且会跟MB结合用在比率电化学传感器中[35-37],双电信号分子的结合使用相当于引进了内参,排除了背景信号的干扰。
2.2 钌类有机配合物 2.2.1 氯化六胺合钌氯化六胺合钌([Ru(NH3)6]Cl3)作为电信号分子主要是[Ru(NH3)6]3+起作用,其与DNA作用的主要方式是嵌入作用[38]。[Ru(NH3)6]3+只与dsDNA结合而不与ssDNA结合,它与DNA序列中带负电的磷酸骨架静电结合之后通过电化学方法(DPV、CV等)检测电信号。Cui等[39]基于金纳米粒子和发卡DNA构建了检DNA的电化学生物传感器,当靶序列存在的时候,将连有发卡的金纳米粒子连接在电极表面,基于[Ru(NH3)6]3+进行DPV检测,检测限为1×10-15 mol/L。值得一提的是DNA磷酸骨架的结合会受到检测溶液中电介质的影响,尤其是其中的阳离子浓度,[Ru(NH3)6]3+本身的浓度也会影响最终检测的电信号,所以实验过程中需要优化[40]。
2.2.2 1,10-菲咯啉二氯化钌1,10-菲咯啉二氯化钌{[Ru(phen)3]Cl2}在电化学检测中的应用主要是基于带正电的钌配合物{[Ru(phen)3]2+}与带负电的磷酸骨架之间的静电吸引作用,由于DNA的单双链的阴离子密度不同,可以结合的钌配合物分子的数量也不同,从而通过检测结合在核酸链上的钌配合物分子的电子传递情况,结合的钌配合物分子越多,峰电流越大。Huang等[41]利用石墨烯,金纳米棒及聚硫堇的复合物和超级三明治的放大方法设计了一个检人乳头瘤病毒DNA的电化学生物传感器,当靶物质存在的时候引发超级三明治的发生,产生长双链,[Ru(phen)3]2+与长双链结合,有明显的电流增加。Liu等[42]基于劈裂适配体设计了一个检ATP的电化学生物传感器,当靶物质ATP存在的时候形成双链,[Ru(phen)3]2+与长双链结合引起电流的增加。这种与单双链均可结合的电信号分子存在一个共性的问题,即背景信号过高。
2.3 铜类有机配合物铜(Cu)是价格相对低廉,化学稳定性好和低毒性的过渡金属,并且在电化学方面,Cu2+表现出合适的氧化还原电位,高的电子转移可逆性(Cu2+/ Cu+)和强的响应信号。因此,它常常被选作电化学信号源,与某些功能性配体结合,然后作为生物传感应用的电化学探针。
2.3.1 4’-氨基苯并-18-冠醚-6-Cu2+冠醚具有与金属离子选择性络合的优异能力,因此经常用作选择性测定各种金属离子的功能材料。18-冠醚-6是重要的主体冠醚,其空腔尺寸与一系列金属离子的大小相当,在溶液和固态中形成稳定的“金属空腔”型络合物。Zhan等[43]设计了一个以4’-氨基苯并-18-冠醚-6铜(Ⅱ)配合物(AbC-Cu2+)作为电信号分子的电化学生物传感器检测花椰菜花叶病毒启动子(CaMV 35s),冠醚环通过羧基与氨基之间形成共价键连接至茎环核酸末端,而Cu2+与环之间通过配位键结合,此时有一个较高的电流信号产生,当茎环被靶物质打开后,电流信号降低,两者之间的电子转移是通过Cu2+/ Cu+产生的。该方法实现了一个较低的灵敏度,检测限是0.060 pmol/L。这种电信号分子对于检核酸的电化学生物传感器具有通用性。
2.3.2 三聚氰胺-Cu2+作为具有1,3,5-三嗪骨架的氰胺三聚物,三聚氰胺(Mel)具有非常好的稳定性和较差的电活性。即使在强碱性条件下,由于氨基的电氧化带来的电化学响应也非常弱,因此不适用于Mel的电化学分析。而Cu2+的加入可以改善其电活性,由于Mel的pKa约为6,所以中性或弱碱性条件适合于通过将亚铜离子与中性Mel配位而形成Cu-Mel络合物。Zhu等[44]利用Cu2+与三聚氰胺的结合设计了一种可以快速检测污染的奶制品中三聚氰胺含量的浓度。当Mel的浓度大于Cu2+时,会形成CuCl2(Mel)2H2O配合物; 当Cu2+浓度小于Mel的浓度时,会形成CuCl2Mel(H2O)2配合物。该检测体系实现了检测限为7.92 nmol/L。Wang等[45]基于茎环结构和Mel-Cu2+作为电信号物质以及金纳米粒子设计了检测核酸序列的电化学生物传感器,检测限低至1.2×10-19 mol/L。但是这种针对某种特殊非法添加物设计的检测方法不具有通用性。
2.3.3 L-天门冬氨酸-Cu2+Cu2+与很多氨基酸具有很强的结合能力,Wang等[46]基于Cu2+与L-天门冬氨酸(L-Asp)结合和分子信标设计了一个检测DNA的电化学生物传感器,电信号的产生主要来自Cu2+/Cu+之间的氧化还原反应,其检测限最低可达到0.17 f mol/L。这种电信号产生的方式也可用于其他类似的电化学生物传感器中。
2.4 锇类有机配合物四氧化锇联吡啶[OsO4(bipy)]不与完全互补的双链结合,且当四氧化锇联吡啶[OsO4(bipy)]与ssDNA结合时,该ssDNA无法和其互补链结合,因此可用于检测单碱基错配。Mix等[47]利用[OsO4(bipy)]作为电信号分子检测实际转基因玉米样品,可以检测到混合样品中0.6%的转基因样品。[OsO4(bipy)]作为电信号分子使用较少,且多用于转基因的检测。这种与单链结合而不与完全互补的双链结合的电信号分子比较少见,适合用于关闭型的生物传感器的构建。
2.5 钴类有机配合物1,10-邻菲咯啉合钴[Co(phen)3]3+被用作电化学传感器的电信号分子,原理与[Ru(phen)3]2+类似。Wang等[48]利用[Co(phen)3]3+作为电信号分子构建了检测转基因大豆的电化学传感器,并实现了1.0×10-9 mol/L的检测限。同样,以[Co(phen)3]3+作为电信号分子设计的功能核酸电化学生物传感器的背景信号会比较高。
3 纳米材料类电信号分子纳米材料是指在三维空间中至少有一维处于纳米尺寸(0.1-100 nm)或由它们作为基本单元构成的材料。纳米材料类的电信号分子的一个主要结构特征就是具有纳米级的尺度,因此具有量子尺寸效应和表面效应。纳米材料类的电信号分子的电子转移效率相对于其他电信号分子会高很多,因此基于纳米材料类的电信号分子的电化学生物传感器具有很高的灵敏度。
|
| 图 4 纳米材料类电信号分子 |
量子点(Quantum dots,QDs)是一种纳米材料,电化学生物传感器中最常用的是硒化镉(CdSe)QD。QDs作为电信号分子主要用来标记核酸链,当识别和杂交过程结束之后,用硝酸将标记在核酸链上的量子点溶解出Cd2+,再采用电化学方法检测Cd2+的峰电流,根据Cd2+的浓度与靶物质的关系得出靶物质的浓度[49]。Tang等[50]在磁珠表面修饰了Pb2+的切割核酶序列,并利用滚环扩增反应和标记有CdS QDs的信号探针设计了检Pb2+的电化学生物传感器,当Pb2+存在时发生切割从而引发滚环扩增反应,扩增出来的重复序列与CdS QDs信号探针互补,再利用磁珠分离,硝酸溶解之后进行电化学检测,其检测限可达7.8 pmol/L。Yang等[51]基于Ni2+的切割核酶和CdSe QDs检测Ni2+,检测限是6.67 nmol/L。QDs作为电信号分子具有通用性,且背景信号不高,具有很大的应用前景。
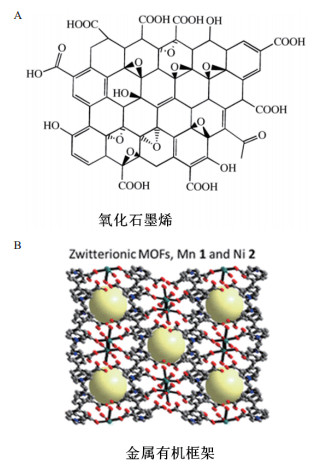
3.2 氧化石墨烯及其复合物氧化石墨烯(Graphene oxide,GO)是石墨烯的氧化物,氧化后其表面含氧官能团增多而使其性质较石墨烯更加活泼。GO的亲水性很强,而且在水中有良好的分散性。GO和还原性氧化石墨烯(Reduced graphene oxide,rGO)具有高导电性,生物兼容性和表面修饰功能。GO可与ssDNA通过π-π作用结合,而对于双链DNA没有该作用。GO中具有一些可还原的基团,Park等[52]把GO作为电信号物质,通过测量电化学还原GO的过程中产生的电流来检测Hg2+浓度。但是GO和rGO更多的是与金纳米粒子(AuNPs)等纳米材料结合使用,用于电极的修饰,通过增加核酸探针的搭载量来实现信号放大的作用[53-55]。使用较多,但是修饰的过程复杂且价格较高,不利于普及。
3.3 金属有机框架金属有机框架(Metal-organic frameworks,MOFs),即金属-有机配位聚合物,它是通过配位键、共价键和分子间弱键(π-π堆积、范德华力、氢键及其他静电作用等)将金属离子与有机配体自组装形成的具有无限规整并无限扩展的周期性网络结构的晶体材料[56]。该类配合物有着丰富的拓扑结构,较高的比表面积,金属离子与配体间既有较强的成键作用又包含分子间弱相互作用,既整合了金属中心的导电、荧光、氧化还原和催化等特性,又有着有机分子材料优良的溶解性能、柔性及成型性能。MOFs是一种具有良好的稳定性,巨大的孔隙率和比表面积的纳米材料,在气体储存,药物输送和传感器方面受到极大的关注。由于MOFs具有内在的过氧化物酶催化活性,因此在电化学生物传感器中也有应用。Xu等[57]基于以Fe制备的MOFs,即MIL-101(Fe)和Pb2+适配体构建了一个Pb2+电化学生物传感器,MIL-101(Fe)作为电信号分子,将双金属银铂纳米粒子(AgPtNPs)与之联用,增加了其电导率和电催化活性,灵敏度达到0.032 pmol/L。MOFs虽具有酶的活性有利于提高灵敏度,但是其合成过程较为复杂,且修饰的过程的表征也很复杂,因此不适于常规使用。
3.4 银纳米粒子基于银纳米粒子(AgNPs)的功能核酸电化学生物传感器其电信号的产生主要是源于Ag/AgCl之间的反应。Tang等[58]利用在羟胺存在下T-Hg2+-T的结合将氯金酸还原,并生成金汞齐,而金汞齐可以将Ag+还原并形成AgNPs,增强其电化学信号,基于此设计的Hg2+电化学生物传感器的检测限达到0.002 nmol/L并且具有很高的特异性。Miao等[59]基于正四面体DNA和茎环结构构建了一个检miRNA的电化学传感器,并用AgNPs标记在信号探针上,当靶物质存在时,打开的茎环结构导致体系的电化学阻抗显著增加,但是由于AgNPs的存在,与AgCl电极之间的氧化还原反应使得阻抗大幅度降低,从而实现高灵敏度检测miRNA,其检测限可达0.4 fmol/L。AgNPs作为电信号分子其背景信号低,且修饰过程相对于其他的纳米材料较为简单。
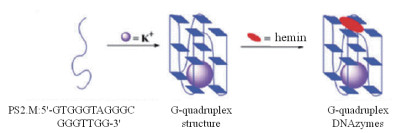
4 类过氧化氢酶类电信号分子类过氧化氢酶类的电信号分子的一个主要特征就是具有氯化血红素(Hemin)和富含腺嘌呤的核酸链形成的四联体结构(G4)组成的复合物。当Hemin嵌入G4结构中,该复合物(hemin /G4)会具有辣根过氧化物酶的催化活性[60]。把hemin /G4与一些底物结合会触发一些氧化还原反应发生,并发生电子的转移。
|
| 图 5 hemin/G4的形成过程 |
苯胺(An)在hemin /G4的催化活性下在H2O2溶液中即使在温和条件下也会形成聚苯胺(PAn)。PAn是一种有用的导电聚合物,其优良的导电性和氧化还原性在电催化和电化学传感器领域得到了广泛的研究。Zhu等[61]通过An到PAn的反应将PAn沉积到电极表面形成纳米膜,吸附核酸至电极表面,之后进行电催化反应以此来检测靶DNA。Zhang等[62]基于HCR和苯胺和hemin /G4形成的长纳米线构建了一个检Pb2+的电化学生物传感器,其检测限可达32 pmol/L。
4.2 Hemin /G4+H2O2 +硫堇硫堇(Thionine,TH)是一种芳香族氧化还原染料,由于其独特的优势,如高水溶性,可逆的电化学响应和合适的氧化还原电位,已被广泛用作电分析化学领域的电活性探针。Gao等[63]利用硫堇和Pb2+适配体构建了Pb2+电化学传感器,并利用硫堇与石墨烯的结合放大了电信号,因实现了较高的灵敏度,其检测限可达3.2×10-14 mol/L,且具有良好的重建性和选择性。Zhou等[64]基于Pb2+的脱氧核酶和hemin/G4及硫堇构建了一个检Pb2+的电化学传感器。Hemin/G4复合物具有过氧化物酶活性,可以催化硫堇的氧化态与还原态之间的转换从而产生电子的转移,他们还通过金钯双金属纳米粒子进行信号放大,而实现灵敏度的提高。
4.3 Hemin /G4除了上述的一些与G4/hemin联用的电信号分子之外,由于hemin本身也存在电子转移,因此有研究人员仅用G4/hemin复合物所产生检测一些靶生物分子(凝血酶,miRNA等)[65-66]。
这些基于Hemin /G4所构建的电化学生物传感器,首先有个问题就是hemin本身的非特异性吸附会导致背景信号过高; 其次,若结合了其他底物的氧化还原反应,底物本身的特异性吸附也会影响实验结果。
5 有机小分子类电信号分子有机小分子类的电信号分子是基于上述4种电信号分子分类之后,将不属于上述4类的电信号分子归为一类,因此它们之间没有一个共同的特征。
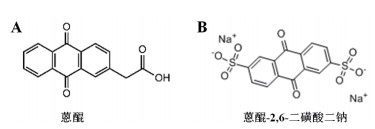
5.1 蒽醌类物质蒽醌(Anthraquinone,AQ)是经常用于生物分子电化学标记的氧化还原活性分子。通过直接连接或通过乙炔或更长的柔性连接物连接的多种AQ衍生物被多次用于嘌呤或嘧啶核苷的标记,甚至通过亚磷酰胺合成化学掺入到DNA中以研究通过DNA的电荷转移[67]。
Zhang等[68]用AQ的衍生物,蒽醌-2,6-二磺酸二钠(Anthraquinone-2,6-disulfonate,AQDS)作为电活性物质,结合金纳米簇设计了检测痕量汞的电化学生物传感器。AQDS具有独特的蒽环结构,可以嵌入dsDNA中,电化学检测中有醌/氢醌氧化还原电对的可逆双电子转移过程。Zhou等[69]也利用AQDS和多孔纳米金设计了检测Ag+的电化学生物传感器。
蒽醌-2-磺酸钠盐(AQMS)作为AQ的衍生物,也作为电活性物质被用在电化学生物传感器中。Bala等[70]把MB和AQMS作为电信号分子分别标记在核酸上用于检Pb2+,发现阴离子嵌入剂的检测效果要比阳离子嵌入剂MB的检测效果好,这是因为dsDNA和ssDNA都带有负电荷,与阳离子嵌入剂会因为静电吸引作用结合。而阳离子嵌入剂和dsDNA之间的相互作用是静电吸引,嵌入和可能的物理吸附的协同作用的结果。因此,会有很高的背景信号。特别是当静电引力成为相互作用中的主导力时,很难区分dsDNA和ssDNA。
值得一提的是AQDS属于阴离子嵌入剂,其产生的背景信号要比阳离子嵌入剂低。由于AQ与DNA都是带负电的分子,因此AQ的嵌入过程很慢,但是高盐浓度的缓冲液可以暂时屏蔽其静电排斥而加快其嵌入。
|
| 图 6 蒽醌类电信号分子 |
环糊精(Cyclodextrin,CD),又称为环状直链淀粉,它是由6-8个D-葡萄糖以α-1,4-糖苷键连接成环状的低聚糖,分别称为α、β或γ-环糊精。环糊精分子呈环形圆筒状。由于具有“内疏水,外亲水”的特殊分子结构,能作为“宿主”包络众多不同种类的“客体”化合物,形成包络物。目前已经发展成为超分子化学最重要的主体。dabcyl是最常用的深色淬灭剂之一,用于标记寡核苷酸和多肽。它所形成的偶联物广泛地用于制备诊断探针,例如分子标记和蛋白酶底物。Fan等[71]利用α-CD与dabcyl的分子识别作用和PbS纳米粒子构建了电化学生物传感器来检测DNA,并具有良好的选择性,可识别单碱基错配。这种基于主客体识别应用于FNAs-EB中的研究较少,而CD可与很多分子实现主客体识别,因此具有很广阔的应用前景。
6 总结与展望本文从电信号分子的化学性质和结构的角度把电信号分子分为5大类,包括染料类、金属有机配合物类、纳米材料类、类过氧化氢酶类和有机小分子类,并对每一大类下的不同电信号分子的电信号的产生方式和应用以及优缺点进行了阐述。对于染料类的电信号分子而言,不仅具有电活性,而且具有荧光特性,这对于发展同时具有电信号和荧光信号这两种输出信号的生物传感器方面具有应用前景,但是目前染料类电信号分子使用较多的只有MB。对于金属有机配合物类的电信号分子,根据其化学组成而言仍有很多过渡金属可被发展为电信号分子,目前使用较多的是[Fe(CN)6]3-/4-和[Ru(NH3)6]3+,金属有机配合物类的电信号分子有个明显的优点是无需标记,只需要溶于溶液即可。纳米材料的电信号分子由于具有良好的电子传递效率颇受关注,但是其合成复杂且成本较高。类过氧化氢酶类的电信号分子在使用过程中容易出现电极对于hemin的非特异性吸附,但是酶底物的存在可以放大电信号,因此使用也较多。有机小分子类的电信号分子还有很多,基于环糊精和dabcyl的电化学传感器的成功构建也说明超分子化学在新的电信号分子发现具有很大的发展前景。
电信号分子的选择直接关系到FNAs-EB的检测限的高低、线性检测范围的大小、成本及应用领域。因此,电信号分子的发展对于FNAs-EB发展具有很重要的推动和促进作用。目前文献中所提到的电信号分子都存在各种各样的问题而导致其不能应用在实际生活中的现场检测、实时检测以及快速检测。对于那些与单双链均可结合的电信号分子将其用于构建FNAs-EB,均存在背景信号过高的问题; 对于基于hemin/G4的电信号分子,hemin本身的非特异性吸附问题所带来的电信号对于阳性组本身的电信号干扰太大也是目前一个亟待解决的问题; 对于一些小众的电信号分子(三聚氰胺-Cu2+、CV等),它们使用的局限性导致其通用性有限。这些问题目前是构建FNAs-EB亟待解决的问题,解决这些问题对于功能核酸介导的电化学生物传感器的发展将是一个很大的突破。
目前,基于功能核酸的电化学生物传感器存在着一个很大的问题就是核酸在界面修饰的不稳定性问题,这种不稳定性主要来源于非均相界面的特异性吸附导致无法确保核酸链在电极表面处于直立状态; 再者,ssDNA是非刚性的结构,在电极表面的形态也具有不确定性。这些不确定性导致产生的电信号的不稳定性,同时也导致所构建的电化学生物传感器不具有可重复性。解决电化学的稳定性问题对于电化学生物传感器的发展将是一个质的飞跃。很多学者通过改变在电极表面固定的核酸的结构来提高电极的稳定性,如Li等[72]把具有刚性结构的DNA纳米结构(正四面体DNA)固定在电极表面以降低电极表面的非特异性吸附和提高电极的稳定性,实验结果表明电极表面固定正四面体DNA可以降低背景信号。电信号分子同样是FNAs-EB的重要组成部分,能否通过对于电信号分子进行化学修饰来改善电极的稳定性也是我们需要探究的地方。
目前文献中所提到的电信号分子既有无机分子,又有有机分子; 既有普通材料又有纳米材料。电信号分子的多样性为电化学生物传感器的多重检测提供了可能,可以利用不同电信号分子的出峰电位不同开发用于多重检测的电化学生物传感器,也可以利用电信号分子产生电信号的方式的差异性来进行多重传感设计。
微型电极是近些年来比较热门的一个话题,微型电极的发展对于发展用于快速检测、现场检测的电化学生物传感器至关重要。而微型电极由于其“微”的特性,其表面可以修饰的核酸的量便受到了限制,因此电极材料就必须选择比表面积大且能够更多地搭载核酸的材料,因此多孔的纳米材料(石墨烯或氧化石墨烯等)就成为一个优先选择。除了电极材料之外,选择适用于微型电极的电信号分子也是增强其电信号提高灵敏度的一种方法。微型电极的发展是将电化学生物传感器用于高通量检测、细胞检测或体内检测前提。因此,寻找更适合微型电极的电信号分子至关重要。
目前,关于电信号分子的专门研究仍较少,而且很多具有氧化还原电活性的信号分子尚未被应用在电化学中。很多过渡金属离子具有多种价态,将其与环状分子(如环糊精)结合构建新的电信号分子是有可能的; 对于一些有颜色变化的氧化还原反应,如果可以将其用作电信号分子,可实现可视化与电信号的两种输出方式; 许多金属有机配合物离子尚未被应用于电化学领域中,筛选出具有电化学活性的其他金属有机配合物离子作为电信号分子也有可能。电信号的产生主要是发生了氧化还原反应,因此,那些可发生氧化还原反应且可以与核酸作用的化学小分子都有可能应用在FNAs-EB中,这在发展低成本的电化学生物传感器方面具有广阔前景。
| [1] |
Tjong V, Tang L, Zauscher S, et al. "Smart" DNA interfaces[J]. Chemical Society Reviews, 2014, 43(5): 1612-1626. DOI:10.1039/C3CS60331H |
| [2] |
Pinheiro AV, Han D, et al. Challenges and opportunities for structural DNA nanotechnology[J]. Nat Nanotechnol, 2011, 6(12): 763. DOI:10.1038/nnano.2011.187 |
| [3] |
Gong L, Zhao Z, Lv YF, et al. DNAzyme-based biosensors and nanodevices[J]. Chem Commun, 2015, 51(6): 979-995. DOI:10.1039/C4CC06855F |
| [4] |
Mariani S, Scarano S, Spadavecchia J, et al. A reusable optical biosensor for the ultrasensitive and selective detection of unamplified human genomic DNA with gold nanostars[J]. Biosensors and Bioelectronics, 2015, 74: 981-988. DOI:10.1016/j.bios.2015.07.071 |
| [5] |
Huang Y, Tian Z, Sun LP, et al. High-sensitivity DNA biosensor based on optical fiber taper interferometer coated with conjugated polymer tentacle[J]. Opt Express, 2015, 21: 26962-26968. |
| [6] |
Li S, Qiu W, Zhang X, et al. A high-performance DNA biosensor based on the assembly of gold nanoparticles on the terminal of hairpin-structured probe DNA[J]. Sensors and Actuators B:Chemical, 2016, 223: 861-867. DOI:10.1016/j.snb.2015.09.121 |
| [7] |
Kim S, Choi SJ. A lipid-based method for the preparation of a piezoelectric DNA biosensor[J]. Anal Biochem, 2014, 458: 1-3. DOI:10.1016/j.ab.2014.04.028 |
| [8] |
Xuan F, Luo X, Hsing IM. Conformation-dependent exonuclease Ⅲ activity mediated by metal ions reshuffling on thymine-rich DNA duplexes for an ultrasensitive electrochemical method for Hg2+ detection[J]. Anal Chem, 2013, 85(9): 4586-4593. DOI:10.1021/ac400228q |
| [9] |
Hu W, Min X, Li X, et al. DNAzyme catalytic beacons-based a label-free biosensor for copper using electrochemical impedance spectroscopy[J]. RSC Advances, 2016, 6(8): 6679-6685. DOI:10.1039/C5RA20641C |
| [10] |
Liu A, et al. Development of electrochemical DNA biosensors[J]. TrAC Trends Anal Chem, 2012, 37: 101-111. DOI:10.1016/j.trac.2012.03.008 |
| [11] |
尤加宇.有机染料分子和DNA相互作用的电化学研究及分析应用[D].青岛: 青岛科技大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10426-2006125712.htm
|
| [12] |
姜吉刚. 苏木精与DNA作用机理的荧光光谱[J]. 光谱实验室, 2012, 29(5): 2814-2817. DOI:10.3969/j.issn.1004-8138.2012.05.044 |
| [13] |
Mao Y, Liu J, He D, et al. Aptamer/target binding-induced triple helix forming for signal-on electrochemical biosensing[J]. Talanta, 2015, 143: 381-387. DOI:10.1016/j.talanta.2015.05.009 |
| [14] |
Kerman K, et al. Voltammetric determination of DNA hybridization using methylene blue and self-assembled alkanethiol monolayer on gold electrodes[J]. Anal Chim Acta, 2002, 462(1): 39-47. DOI:10.1016/S0003-2670(02)00308-2 |
| [15] |
Yun W, Jiang J, Cai D, et al. Ultrasensitive electrochemical detection of UO22+ based on DNAzyme and isothermal enzyme-free amplification[J]. RSC Advances, 2016, 6(5): 3960-3966. DOI:10.1039/C5RA22773A |
| [16] |
Zhu Y, Zeng G, Zhang Y, et al. Highly sensitive electrochemical sensor using a MWCNTs/GNPs-modified electrode for lead (Ⅱ) detection based on Pb2+-induced G-rich DNA conformation[J]. Analyst, 2014, 139(19): 5014-5020. DOI:10.1039/C4AN00874J |
| [17] |
Liu P, Pang J, Yin H, et al. G-quadruplex functionalized nano mesoporous silica for assay of the DNA methyltransferase activity[J]. Analytica Chimica Acta, 2015, 879: 34-40. DOI:10.1016/j.aca.2015.04.023 |
| [18] |
Kong DM, Ma YE, Wu J, et al. Discrimination of G-quadruplexes from duplex and single-stranded DNAs with fluorescence and energy-transfer fluorescence spectra of crystal violet[J]. Chemistry-A European Journal, 2009, 15(4): 901-909. DOI:10.1002/chem.200801441 |
| [19] |
Li F, Feng Y, Zhao C, et al. Crystal violet as a G-quadruplex-selective probe for sensitive amperometric sensing of lead[J]. Chem Commun, 2011, 47(43): 11909-11911. DOI:10.1039/c1cc15023e |
| [20] |
Raoof JB, Ojani R, Ebrahimi M, et al. Developing a nano-biosensor for DNA hybridization using a new electroactive Label[J]. Chinese Journal of Chemistry, 2011, 29(11): 2541-2551. DOI:10.1002/cjoc.v29.11 |
| [21] |
Ebrahimi M, Raoof JB, Ojani R. Novel electrochemical DNA hybridization biosensors for selective determination of silver ions[J]. Talanta, 2015, 144: 619-626. DOI:10.1016/j.talanta.2015.07.020 |
| [22] |
Aghili Z, Nasirizadeh N, et al. A nanobiosensor composed of exfoliated graphene oxide and gold nano-urchins, for detection of GMO products[J]. Biosens Bioelectron, 2017, 95: 72-80. DOI:10.1016/j.bios.2017.02.054 |
| [23] |
Ligaj M, Tichoniuk M, Gwiazdowska D, et al. Electrochemical DNA biosensor for the detection of pathogenic bacteria Aeromonas hydrophila[J]. Electrochimica Acta, 2014, 128: 67-74. DOI:10.1016/j.electacta.2013.10.061 |
| [24] |
Ahmed MU, Saito M, Hossain MM, et al. Electrochemical genosensor for the rapid detection of GMO using loop-mediated isothermal amplification[J]. Analyst, 2009, 134(5): 966-972. DOI:10.1039/b812569d |
| [25] |
Ju H, Ye Y, Zhu Y. Interaction between nile blue and immobilized single-or double-stranded DNA and its application in electrochemical recognition[J]. Electrochimica Acta, 2005, 50(6): 1361-1367. DOI:10.1016/j.electacta.2004.08.024 |
| [26] |
Alipour E, Allaf FN, Mahmoudi-Badiki T. Investigation of specific interactions between Nile blue and single type oligonucleotides and its application in electrochemical detection of hepatitis C 3a virus[J]. J Solid State Electrochem, 2016, 20(1): 183-192. DOI:10.1007/s10008-015-2957-x |
| [27] |
徐佳.过渡金属有机配合物的合成、表征及催化应用[D].合肥: 合肥工业大学, 2017.
|
| [28] |
Zhou J, Xu M, Tang D, et al. Nanogold-based bio-bar codes for label-free immunosensing of proteins coupling with an in situ DNA-based hybridization chain reaction[J]. Chem Commun, 2012, 48(100): 12207-12209. DOI:10.1039/c2cc36820j |
| [29] |
Dai S, Xue Q, Zhu J, et al. An ultrasensitive fluorescence assay for protein detection by hybridization chain reaction-based DNA nanotags[J]. Biosens Bioelectron, 2014, 51(2): 421-425. |
| [30] |
Huang YL, Gao ZF, Jia J, et al. A label-free electrochemical sensor for detection of mercury (Ⅱ) ions based on the direct growth of guanine nanowire[J]. J Hazard Mater, 2016, 308: 173-178. DOI:10.1016/j.jhazmat.2016.01.048 |
| [31] |
Cai W, Xie S, Zhang J, et al. An electrochemical impedance biosensor for Hg2+ detection based on DNA hydrogel by coupling with DNAzyme-assisted target recycling and hybridization chain reaction[J]. Biosensors and Bioelectronics, 2017, 98: 466-472. DOI:10.1016/j.bios.2017.07.025 |
| [32] |
陈灿辉, 李红, 朱伟, 张全新. 二茂铁及其与DNA复合物的电化学行为[J]. 物理化学学报, 2005(10): 1067-1072. DOI:10.3866/PKU.WHXB20051001 |
| [33] |
Wei W, Zhang L, Ni Q, et al. Fabricating a reversible and regenerable electrochemical biosensor for quantitative detection of antibody by using "triplex-stem" DNA molecular switch[J]. Analytica Chimica Acta, 2014, 845: 38-44. |
| [34] |
Zhang Y, Xiao S, Li H, et al. A Pb2+-ion electrochemical biosensor based on single-stranded DNAzyme catalytic beacon[J]. Sensors and Actuators B:Chemical, 2016, 222: 1083-1089. DOI:10.1016/j.snb.2015.08.046 |
| [35] |
Xiong E, Wu L, Zhou J, et al. A ratiometric electrochemical biosensor for sensitive detection of Hg2+ based on thymine-Hg2+-thymine structure[J]. Anal Chim Acta, 2015, 853: 242-248. DOI:10.1016/j.aca.2014.10.015 |
| [36] |
Jia J, et al. A regenerative ratiometric electrochemical biosensor for selective detecting Hg2+ based on Y-shaped/hairpin DNA transformation[J]. Anal Chim Acta, 2016, 908: 95-101. DOI:10.1016/j.aca.2015.12.028 |
| [37] |
Miao P, et al. DNA modified Fe3O4@ Au magnetic nanoparticles as selective probes for simultaneous detection of heavy metal ions[J]. ACS Appl Mater Interfaces, 2017, 9(4): 3940-3947. DOI:10.1021/acsami.6b14247 |
| [38] |
黄敏.萘啶衍生物的合成及其在电化学检测DNA中的应用研究[D].武汉: 湖北大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10512-1016169587.htm
|
| [39] |
Cui HF, Xu TB, Sun YL, et al. Hairpin DNA as a biobarcode modified on gold nanoparticles for electrochemical DNA detection[J]. Anal Chem, 2015, 87(2): 1358-1365. DOI:10.1021/ac504206n |
| [40] |
Shen L, Chen Z, Li Y, et al. Electrochemical DNAzyme sensor for lead based on amplification of DNA- Au Bio-Bar codes[J]. Anal Chem, 2008, 80(16): 6323-6328. DOI:10.1021/ac800601y |
| [41] |
Huang H, et al. An ultrasensitive electrochemical DNA biosensor based on graphene/Au nanorod/polythionine for human papilloma-virus DNA detection[J]. Biosens Bioelectron, 2015, 68: 442-446. DOI:10.1016/j.bios.2015.01.039 |
| [42] |
Liu Z, et al. Label-free and signal-on electrochem-iluminescence aptasensor for ATP based on target-induced linkage of split aptamer fragments by using[J]. Chem A European J, 2010, 16(45): 13356-13359. DOI:10.1002/chem.v16.45 |
| [43] |
Zhan F, Liao X, Gao F, et al. Electroactive crown ester-Cu2+ complex with in-situ modification at molecular beacon probe serving as a facile electrochemical DNA biosensor for the detection of CaMV 35s[J]. Biosens Bioelectron, 2017, 92: 589-595. DOI:10.1016/j.bios.2016.10.055 |
| [44] |
Zhu H, et al. Electrochemical sensor for melamine based on its copper complex[J]. Chem Commun, 2010, 13: 2259-2261. |
| [45] |
Wang Q, Gao F, Ni J, et al. Facile construction of a highly sensitive DNA biosensor by in-situ assembly of electro-active tags on hairpin-structured probe fragment[J]. Sci Rep, 2016, 6: 22441. DOI:10.1038/srep22441 |
| [46] |
Wang X, et al. A Novel DNA electrochemical sensor based on grafting of L-aspartic acid and Cu2+ ions on the terminal of molecule beacons[J]. Int J Electrochem Sci, 2013, 8: 7529-7541. |
| [47] |
Mix M, Rüger J, Krüger S, et al. Electrochemical detection of 0. 6% genetically modified maize MON810 in real flour samples[J]. Electrochemistry Communications, 2012, 22: 137-140. DOI:10.1016/j.elecom.2012.06.019 |
| [48] |
Wang MQ, Du XY, Liu LY, et al. DNA biosensor prepared by electrodeposited Pt-nanoparticles for the detection of specific deoxyribonucleic acid sequence in genetically modified soybean[J]. Chinese J Anal Chem, 2008, 36(7): 890-894. DOI:10.1016/S1872-2040(08)60048-1 |
| [49] |
Fan H, Chang Z, Xing R, et al. An Electrochemical aptasensor for detection of thrombin based on target protein-induced strand displacement[J]. Electroanalysis, 2008, 20(19): 2113-2117. DOI:10.1002/elan.v20:19 |
| [50] |
Tang S, Lu W, Gu F, et al. A novel electrochemical sensor for lead ion based on cascade DNA and quantum dots amplification[J]. Electrochimica Acta, 2014, 134: 1-7. DOI:10.1016/j.electacta.2014.04.021 |
| [51] |
Yang Y, Yuan Z, Liu XP, et al. Electrochemical biosensor for Ni2+ detection based on a DNAzyme-CdSe nanocomposite[J]. Biosensors and Bioelectronics, 2016, 77: 13-18. DOI:10.1016/j.bios.2015.09.014 |
| [52] |
Park H, Hwang SJ, Kim K. An electrochemical detection of Hg2+ ion using graphene oxide as an electrochemically active indicator[J]. Electrochemistry Communications, 2012, 24: 100-103. DOI:10.1016/j.elecom.2012.08.027 |
| [53] |
Zhang Z, et al. One-step fabrication of electrochemical biosensor based on DNA-modified three-dimensional reduced graphene oxide and chitosan nanocomposite for highly sensitive detection of Hg(Ⅱ)[J]. Sensor Actuat Chem, 2016, 225: 453-462. DOI:10.1016/j.snb.2015.11.091 |
| [54] |
Wang H, et al. Electrochemical DNA probe for Hg2+ detection based on a triple-helix DNA and Multistage Signal Amplification Strategy[J]. Biosensor Bioelectron, 2016, 86: 907-912. DOI:10.1016/j.bios.2016.07.098 |
| [55] |
Wang N, Lin M, Dai H, et al. Functionalized gold nanoparticles/reduced graphene oxide nanocomposites for ultrasensitive electrochemical sensing of mercury ions based on thymine-mercury-thymine structure[J]. Biosens Bioelectron, 2016, 79: 320-326. DOI:10.1016/j.bios.2015.12.056 |
| [56] |
Xu W, Zhou X, et al. label-free and enzyme-free strategy for sensi-tive electrochemical lead aptasensor by using metal-organic frame-works Loaded with AgPt nanoparticles as signal probes and electro-catalytic enhancers[J]. Electrochim Acta, 2017, 251: 25-31. DOI:10.1016/j.electacta.2017.08.046 |
| [57] |
Rogez G, et al. Layered hydroxide hybrid nanostructures:a route to multifunctionality[J]. Chem Soc Rev, 2011, 40(2): 1031. DOI:10.1039/c0cs00159g |
| [58] |
Tang J, Huang Y, Zhang C, et al. DNA-based electrochemical determination of mercury (Ⅱ) by exploiting the catalytic formation of gold amalgam and of silver nanoparticles[J]. Microchim Acta, 2016, 183(6): 1805-1812. DOI:10.1007/s00604-016-1813-8 |
| [59] |
Miao P, et al. Tetrahedral DNA nanostructureba-sed microRNA biosensor coupled with catalytic recycling of the analyte[J]. ACS Appli Mater Interfaces, 2015, 7(11): 6238-6243. DOI:10.1021/acsami.5b01508 |
| [60] |
Yuan Y, et al. An ultrasensitive electrochemical aptasensor with autonomous assembly of hemin-G-quadruplex DNAzyme nanowires for pseudo triple-enzyme cascade electrocatalytic amplification[J]. Chem Commun, 2013, 49(66): 7328-7330. DOI:10.1039/c3cc42874e |
| [61] |
Zhu Q, et al. Electrochemical preparation of polyaniline capped Bi2S3 nanocomposite and its application in impedimetric DNA biosensor[J]. Sensor Actuat B Chem, 2015, 207: 819-826. DOI:10.1016/j.snb.2014.10.120 |
| [62] |
Zhang B, Chen J, Liu B, et al. Amplified electrochemical sensing of lead ion based on DNA-mediated self-assembly-catalyzed polymerization[J]. Biosens Bioelectron, 2015, 69: 230-234. DOI:10.1016/j.bios.2015.02.041 |
| [63] |
Gao F, et al. label-free electrochemical lead (Ⅱ) aptasensor using thionine as the signaling molecule and graphene as signal-enhancing platform[J]. Biosens Bioelectron, 2016, 81: 15-22. DOI:10.1016/j.bios.2016.01.096 |
| [64] |
Zhou Q, Lin Y, Lin Y, et al. Highly sensitive electrochemical sensing platform for lead ion based on synergetic catalysis of DNAzyme and Au-Pd porous bimetallic nanostructures[J]. Biosensors and Bioelectronics, 2016, 78: 236-243. DOI:10.1016/j.bios.2015.11.055 |
| [65] |
Jiang B, et al. label-free and amplified aptasensor for thrombin detection based on background reduction and direct electron trans-fer of hemin[J]. Biosensor Bioelectron, 2013, 43: 289-292. DOI:10.1016/j.bios.2012.12.038 |
| [66] |
Yu Y, et al. Ultrasensitive electrochemical detection of microRNA based on an arched probe mediated isothermal exponential amplification[J]. Anal Chem, 2014, 86(16): 8200-8205. DOI:10.1021/ac501505a |
| [67] |
Balintová J, et al. Anthraquinone as a redox label for DNA:Synthesis, enzymatic incorporation, and electrochemistry of anthraquinone-modified nucleosides, nucleotides, and DNA[J]. Chem A European J, 2011, 17(50): 14063-14073. DOI:10.1002/chem.v17.50 |
| [68] |
Zhang Y, Zeng GM, Tang L, et al. Quantitative detection of trace mercury in environmental media using a three-dimensional electrochemical sensor with an anionic intercalator[J]. RSC Advances, 2014, 4(36): 18485-18492. DOI:10.1039/c3ra47871h |
| [69] |
Zhou Y, et al. A novel biosensor for silver (Ⅰ) ion detection based on nanoporous gold and duplex-like DNA scaffolds with anionic intercalator[J]. RSC Adv, 2015, 5(85): 69738-69744. DOI:10.1039/C5RA10686A |
| [70] |
Bala A, Pietrzak M, Górski Ł, et al. Electrochemical determination of lead ion with DNA oligonucleotide-based biosensor using anionic redox marker[J]. Electrochimica Acta, 2015, 180: 763-769. DOI:10.1016/j.electacta.2015.08.162 |
| [71] |
Fan H, Zhao K, Lin Y, et al. A new electrochemical biosensor for DNA detection based on molecular recognition and lead sulfide nanoparticles[J]. Anal Biochem, 2011, 419(2): 168-172. DOI:10.1016/j.ab.2011.08.005 |
| [72] |
Li C, Hu X, Lu J, et al. Design of DNA nanostructure-based interfacial probes for the electrochemical detection of nucleic acids directly in whole blood[J]. Chem Sci, 2017, 9(4): 979-984. |