近年来,基于动物细胞培养技术的流感疫苗生产已经成为主流。与传统的鸡胚生产工艺相比,细胞培养生产工艺在流感爆发时操作更灵活,并且可快速大规模培养以应对SPF(无特定病原体)鸡蛋供应不足的问题[1-3]。然而,随着流感的频发,流感疫苗的需求量越来越大,同时现有细胞培养生产工艺产能相对低下,导致市场供不应求。因此,当下提高流感病毒在细胞中的扩增效率的研究工作尤为迫切。在动物细胞培养过程中,培养基的开发和优化是促进细胞生长、维持和目的产品生产等的核心技术和研究热点[4-6]。
在基于细胞培养的流感疫苗生产工艺中,培养基是细胞生长和维持活性的基础,而流感病毒是利用宿主细胞的蛋白质及其他物质原料进行复制扩增,因此培养基也是流感疫苗生产的关键因素。病毒感染前一般需要用新鲜的培养基交换或稀释细胞悬液,然而在实验室研究或工业生产中,在病毒生产阶段更换的病毒维持培养基大多与用于细胞生长阶段的细胞生长培养基是同一种[7-8]。由于病毒生产的特性不同于细胞生长,所需的生物合成原料与途径也不同于细胞,采用细胞生长培养基进行病毒生产引起的营养物质需求和浓度配比的不平衡最终必将影响病毒的扩增效率[9-10]。因此,针对特定的病毒生产阶段筛选适于流感病毒生产的维持培养基十分重要。同时,了解维持培养基中病毒感染后的细胞代谢特性,有利于进一步设计和优化基于细胞培养的流感病毒生产工艺。
本研究基于MDCK细胞悬浮培养扩增流感病毒的生产工艺,执行实验次数为33次的Simplex Lattice实验,并运用统计学方法确定维持培养基的基础配方,使最高病毒产量高达214.062 HAU/100 μL,且目前文献报道的H9N2流感病毒生产工艺均未能达到此病毒滴度,说明该维持培养基具有支持MDCK细胞高效生产流感病毒的能力。此外,为研究高产过程的代谢特性,在2 L生物反应器中进行该维持培养基的产毒验证的同时,以细胞生长培养基为对照,比较在两种培养基中病毒感染后的细胞代谢动力学,为其他细胞系的病毒疫苗用培养基开发提供指导和借鉴。
1 材料与方法 1.1 材料 1.1.1 细胞株与病毒株本实验所用贴壁MDCK细胞购自ATCC; MDCK悬浮细胞为实验室前期从贴壁MDCK细胞驯化所得; 甲型流感病毒株A/chicken/Guangdong/SS/94(H9N2)为肇庆大华农生物药品有限公司惠赠,并在MDCK悬浮细胞中适应传代,其TCID50值108 virions/mL。
1.1.2 培养基XenoTM-S001S MDCK培养基,由上海倍谙基生物科技有限公司提供,在下文重命名为XP培养基; DMEM培养基购自美国Gibco公司; 6种基础无血清培养基为实验室无血清配方库中挑选所得,分别命名为A、B、C、D、E和F培养基。其中A、B、C、E和F培养基为实验室自主研发的5种无血清培养基,专利号分别为CN 103045533 A、CN 1778902 A、CN 104328158 A、CN 101603026 A和CN 101760442 A,而D培养基是在国外培养基的基础上研制而成,专利号为US 8,846,032 B2。
1.2 方法 1.2.1 细胞培养种子细胞培养:MDCK悬浮细胞以1×106 cells/mL的细胞密度稀释接种于125 mL摇瓶(Corning,USA)中,工作体积为30 mL,2 d传1代,维持细胞活性在95%以上,所用传代培养基为XP培养基。摇瓶置于130 r/min的摇床上,在37℃、5% CO2培养箱中培养。生物反应器培养:取对数生长期的种子细胞,以1.0×106 cells/mL的细胞密度接种至2 L生物反应器中,工作体积为1 L,细胞生长培养基为XP培养基。细胞生长阶段反应器参数设置为:pH为7.0±0.2,温度为37℃,DO为40%空气饱和度,搅拌转速为130 r/min。
1.2.2 病毒感染摇瓶中的病毒感染:当MDCK悬浮细胞生长到10-12×106 cells/mL时,在125 mL摇瓶中采用1:1稀释的方法(15 mL细胞液+15 mL培养基)进行病毒感染实验,TPCK-胰酶(Sigma,USA)添加浓度为5 μg/mL,病毒种子液按MOI为0.001添加,并且置于37℃,5% CO2的培养箱中培养3 d。
生物反应器中的病毒感染:当细胞密度达到10-12×106 cells/mL时,弃掉一半的细胞液并补加同等体积的维持培养基(1:1稀释)至反应器中进行病毒感染,病毒种子液按MOI=0.001接入,TPCK-胰酶按5 μg/mL添加,且置于37℃,5% CO2的培养箱中培养3 d。病毒感染阶段反应器参数设置中仅pH值不同于细胞生长阶段,pH为7.2±0.2。
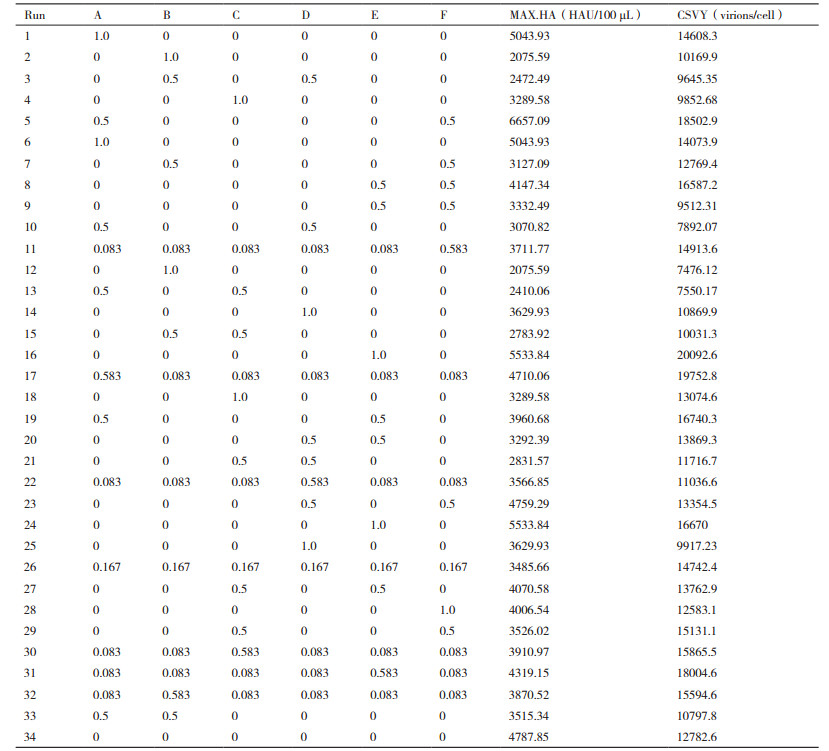
1.2.3 Simplex Lattice实验设计运用Design Expert(Version 8.0.6)软件,以A-F等6种基础培养基为变量,进行Simplex Lattice实验设计,设计矩阵如表 1所示。按表 1将A-F等6种基础培养基按比例混合,共设计34组实验; 其中第34组为XP培养基,作为对照组。将处于指数生长期的种子细胞以1.0×106 cells/mL的细胞密度接种至1 L的摇瓶中,工作体积为300 mL,在37℃,5% CO2的培养箱中进行培养。当细胞密度达到10-12×106 cells/mL时,按1.2.2中的方法在125 mL摇瓶中进行病毒感染实验。
培养过程中,每隔24 h进行取样计数,细胞悬液经1 500 rpm离心5 min后上清液于-80℃储存,用于进一步的病毒滴度或代谢物浓度检测。
1.2.5 细胞计数通过台盼蓝染色法采用IC1000自动细胞计数仪(Countstar,China)测量培养过程中的细胞密度和活性。
1.2.6 流感病毒滴度检测总流感病毒滴度由Kalbfuss[11]所描述的病毒HA滴度检测方法所确定,HA滴度的单位为HAU/100μL。单细胞产毒率(CSVY)的计算方法见文献[12],单位为virions/cell。
1.2.7 代谢物浓度检测葡萄糖、乳酸和氨的浓度由BioProfile 100 Plus analyzer(Nova Biomedical,USA)检测,氨基酸浓度由高效液相色谱HPLC(Agilent,USA)测定,操作按使用说明书进行。
1.2.8 代谢物比消耗或比生成速率及转化率计算代谢物消耗或生成速率计算:
 (1)
(1)
式中,Qi为物质i在t1到t2时间段内的比消耗或比生成速率(mmol/(109 cells·day)); ΔCi为物质i在t1到t2时间段内的浓度差(mmol/L); IVCD为t1到t2时间段内活细胞密度对时间的积分(109 cells·day/L)。
代谢物得率计算:
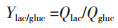 (2)
(2)
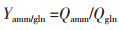 (3)
(3)
式中,Ylac/gluc和Yamm/gln分别为乳酸对葡萄糖的转化得率(mmol/mmol)和氨对谷氨酰胺的转化得率(mmol/mmol),Qlac和Qamm分别为乳酸和氨的比生成速率(mmol/(109 cells·day)),Qgluc和Qgln分别为葡萄糖和谷氨酰胺的比消耗速率(mmol/(109 cells·day))。
1.2.9 统计学分析实验结果采用t检验进行统计学分析,P < 0.05表示实验结果存在显著性差异。
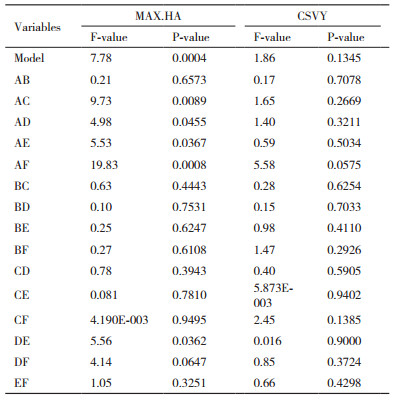
2 结果 2.1 高产流感病毒维持培养基的筛选Simplex Lattice实验中,以病毒感染过程中的最大HA滴度(MAX.HA)及最大单细胞产毒率(CSVY)为响应值,实验结果如表 1所示。运用Design-Expert软件,对表 1中实验组响应值进行方差分析,如表 2所示。MAX.HA的二次多项式模型P值为0.0004,故模型显著,满足如下方程:
 (4)
(4)
由表 2可知,CSVY的二次多项式模型P值为0.134 5,故模型不显著。根据单纯形算法,以MAX.HA最大且CSVY符合要求为优化指标,通过软件分析确定A-F等6个影响因素的最佳取值,可得:当A和F培养基以0.568:0.432比例混合时得到无血清培养基为最适合流感病毒生产的维持培养基,命名为X-MM培养基。
2.2 生物反应器验证在2 L生物反应器中验证X-MM培养基所支持流感病毒在MDCK细胞中的扩增能力,并以XP培养基作为对照组比较产毒差异,结果如图 1所示。由图 1-A可知,在X-MM培养基中24、48、72 hpi时流感病毒的HA滴度分别为212.697、214.016、214.062 HAU/100 μL,较XP培养基组分别提高了71%、64%和58%左右。进一步计算CSVY,如图 1-B所示,X-MM培养基组的CSVY为3.62×104 virions/cell,较对照组2.30×104 virions/cell提高了57%左右。
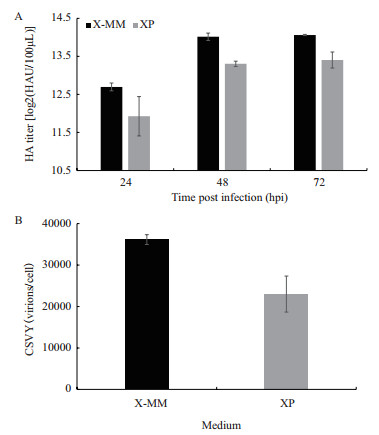
|
| 图 1 两种培养基下流感病毒滴度随时间变化(A)和单细胞产毒率(B) |
为研究病毒感染后细胞在两种培养基中产毒差异的原因,以XP培养基作为对照考察X-MM培养基中MDCK细胞感染流感病毒后的代谢特征,结果如图 2-4所示。图 2为MDCK细胞在两种培养基下进行接毒实验的葡萄糖(Gluc)、谷氨酰胺(Gln)、乳酸(Lac)及氨(Amm)的浓度变化。由图可知,病毒感染时,两培养基组中的初始代谢物浓度一致,但随着病毒感染的复制,两培养基组的代谢物浓度出现差异。由于病毒感染过程中的代谢物消耗或生成主要发生在0-24 hpi(早期),因此重点考察了Gluc、Lac、Amm及氨基酸(AA)在0-24 hpi比代谢速率情况(图 3)。由图 3-A可知,X-MM培养基组的QGluc和QLac分别为2.314和2.108 mmol/(109 cells·day),均显著高于XP培养基组,其QGluc和QLac分别为1.695和1.234 mmol/(109 cells·day)。进一步计算乳酸对葡萄糖的转化率,可知X-MM培养基组和XP培养基组的Ylac分别为1.07和0.73,说明分别有约53.5%和36.5%的葡萄糖直接转化为丙酮酸,再生成乳酸。通过分析胞内氨基酸的代谢情况(图 3-B),可知在病毒感染0-24 hpi两培养基组中的生成类氨基酸有Glu、Asp、Ala和Gly,其中Gly仅在X-MM培养基组中生成,其他氨基酸均为消耗类氨基酸。进一步比较各类氨基酸的在两种培养基组中的代谢差异,相较对照组,在X-MM培养基组中Ser、Gln、Thr、Arg、Val、Met、Phe、Ile、Leu和Lys均是消耗增多的氨基酸,Asp和Ala是生成减少的氨基酸。而Ser、Arg和Ile的比消耗速率分别较对照组提高了58.59%、25.09%和16.26%,且均存在显著性差异; Ala的比生成速率较对照组下降幅度最大,为69.43%。此外,由图可知,病毒感染时0 hpi的培养液中的初始氨基酸浓度,较对照组,X-MM培养基组中的Glu、Gly和Ala浓度显著下降,下降幅度分别为26.29%、14.29%和25.84%,而Asn、Ser、Thr、Arg、Tyr、Cys、Met和Ile浓度显著增加,增加幅度分别为21.66%、13.71%、13.61%、21.51%、24.95%、11.54%、6.95%和8.17%,其他氨基酸浓度无显著性差异。
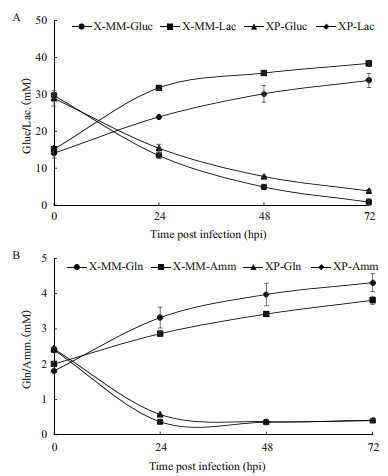
|
| 图 2 两种培养基下流感病毒感染过程中MDCK细胞中葡萄糖和乳酸(A)、谷氨酰胺和氨(B)的浓度变化 |

|
| 图 3 两种培养基下流感病毒感染过程中MDCK细胞在0-24 hpi的比代谢速率 |
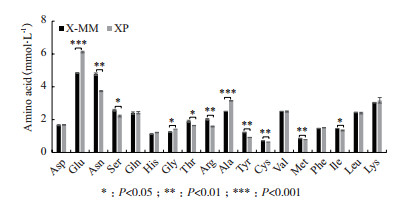
|
| 图 4 两种培养基下流感病毒感染0 hpi时培养液中氨基酸的初始浓度 |
本研究采用Simplex Lattice实验设计,通过统计学方法获得适于流感病毒在MDCK细胞中高效扩增的维持培养基。在该培养基下,流感病毒在MDCK细胞中的最大HA滴度、单细胞产毒率及TCID50分别可达214.062 HAU/100 μL,3.62×104 virions/cell和107.585 TCID50/mL,且均明显高于细胞生长培养基组。因此,在病毒感染时以维持培养基替代细胞生长培养基,在病毒疫苗生产工艺中十分重要。此外,Wang等[13]在悬浮MDCK细胞体系中所生产的H9N2流感病毒滴度为210; 李春艳等[14]报道H9N2流感病毒在基于MDCK细胞大规模微载体培养体系中的HA滴度为29,而本研究通过维持培养基优化后的H9N2流感病毒滴度可达文献报道最高滴度的16倍。在获得高产维持培养基的基础上,本研究首次揭示了MDCK细胞在高产条件下细胞的代谢特性。在X-MM组和XP组中,病毒感染后0 hpi的Gluc、Gln、Lac和Amm的初始浓度一致,但前者细胞在0-24 hpi对Gluc的消耗速率显著高于后者,表明X-MM培养基组中营养物组分的差异很可能促使细胞的代谢通路发生了改变,因此细胞能够快速摄取培养基中的葡萄糖以提供病毒高效生产过程中的物质能量需求。同时,在0-24 hpi时,X-MM培养基组下Ylac显著高于在XP培养基组,表明前者进入糖酵解途径的葡萄糖增多。Fontaine等[15]已报道糖酵解途径是病毒自我复制所必需的代谢途径,抑制糖酵解途径会抑制胞外感染性病毒的生成及病毒基因合成。此外,病毒扩增会诱发宿主细胞凋亡,导致细胞线粒体膜受损及ATP合成量不足,而糖酵解途径的增强可以改善因凋亡引起的能量ATP供给不足的问题[16]。因此,X-MM培养基组病毒产量更高的原因可能与细胞对葡萄糖利用率提高和糖酵解途径的增强有关。
另外,分析高产维持培养基中的氨基酸代谢可以发现,在病毒感染早期,与对照组相比,X-MM培养基组中Ser、Gln、Thr、Arg、Val、Met、Phe、Ile、Leu和Lys的比消耗速率均得到提高,同时有文献报道细胞在产毒期会更多地消耗上述氨基酸用于病毒扩增[17-18],这可能是X-MM培养基组病毒产量和感染性更高的原因之一。其中,Ser、Ile和Arg的消耗速率存在显著性提高,且在采用X-MM培养基进行稀释后,较高的Ser、Arg和Ile初始浓度暗示在病毒生产用维持培养基中此3种氨基酸的供给至关重要。在病毒生产过程中,Ser参与病毒基因表达中必不可少的磷脂酰丝氨酸的合成[19],且有报道称Ser在HIV病毒感染早期会促进病毒复制[20],而另外两种氨基酸的作用还有待深入研究。此外,X-MM培养基组中的Ala比生成速率较XP培养基组有大幅度下降。据报道,Ala会损害细胞生长和生产力[21-22]。而采用X-MM稀释后0 hpi时的培养基的Ala浓度明显低于采用XP培养基进行稀释后的初始培养基中的浓度,说明在维持培养基中,合理的Ala浓度也是促进病毒产量提高的重要因素。因此,加强病毒感染过程中细胞内的糖酵解途径及提高培养基中的丝氨酸、精氨酸和异亮氨酸的浓度、降低丙氨酸浓度,可以有效促进流感病毒在细胞内的扩增。同时,关注病毒感染早期的糖酵解途径及上述关键氨基酸代谢将有利于实现更合理的病毒产量优化过程。
4 结论本研究通过Simplex Lattice实验设计高效、快速地获得一款适于流感病毒在MDCK细胞中高效扩增的维持培养基,其病毒滴度可达214.062 HAU/100 μL,是现有文献报道的16倍。在该高产维持培养基下探索细胞代谢差异发现,糖酵解途径的增强,丝氨酸、精氨酸及异亮氨酸等氨基酸消耗速率的增强和丙氨酸生成速率的下降很可能是该培养基支持细胞高产的关键代谢特征。
| [1] |
Youil R, Su Q, Toner TJ, et al. Comparative study of influenza virus replication in Vero and MDCK cell lines[J]. Journal of Virological Methods, 2004, 120(1): 23-31. DOI:10.1016/j.jviromet.2004.03.011 |
| [2] |
Audsley JM, Tannock GA. Cell-based influenza vaccines:Progress to date[J]. Drugs, 2008, 68(11): 1483-1491. DOI:10.2165/00003495-200868110-00002 |
| [3] |
Mabrouk T, Ellis RW. Influenza vaccine technologies and the use of the cell-culture process(cell-culture influenza vaccine)[J]. Dev in Biol, 2002, 110(1): 125-134. |
| [4] |
Keen MJ, Rapson NT. Development of a serum-free culture medium for the large scale production of recombinant protein from a Chinese hamster ovary cell line[J]. Cytotechnol, 1995, 17(3): 153-163. DOI:10.1007/BF00749653 |
| [5] |
Rourou S, van der Ark A, van der Velden T, et al. Development of an animal-component free medium for vero cells culture[J]. Biotechnology Progress, 2010, 25(6): 1752-1761. |
| [6] |
Merten OW. Development of serum-free media for cell growth and production of viruses/viral vaccines--safety issues of animal products used in serum-free media[J]. Dev in Biol, 2002, 111: 233-257. |
| [7] |
Tapia F, et al. Production of high-titer human influenza A virus with adherent and suspension MDCK cells cultured in a single-use hollow fiber bioreactor[J]. Vaccine, 2014, 32(8): 1003-1011. DOI:10.1016/j.vaccine.2013.11.044 |
| [8] |
Ru AL, Jacob D, Transfiguracion J, et al. Scalable production of influenza virus in HEK-293 cells for efficient vaccine manufacturing[J]. Vaccine, 2010, 28(21): 3661-3671. DOI:10.1016/j.vaccine.2010.03.029 |
| [9] |
Lorizate M, Kräusslich HG. Role of lipids in virus replic-ation[J]. Cold Spring Harb Perspec Biol, 2011, 3(10): 1-20. |
| [10] |
Lohr V, Rath A, Genzel Y, et al. New avian suspension cell lines provide production of influenza virus and MVA in serum-free media:Studies on growth, metabolism and virus propagation[J]. Vaccine, 2009, 27(36): 4975-4982. DOI:10.1016/j.vaccine.2009.05.083 |
| [11] |
Kalbfuss B, Knöchlein A, Kröber T, et al. Monitoring influenza virus content in vaccine production:Precise assays for the quantitation of hemagglutination and neuraminidase activity[J]. Biologicals, 2008, 36(3): 145-161. DOI:10.1016/j.biologicals.2007.10.002 |
| [12] |
Bock A, Schulze-Horsel J, Schwarzer J, et al. High-density microcarrier cell cultures for influenza virus production[J]. Biotechnology Progress, 2011, 27(1): 241-250. DOI:10.1002/btpr.v27.1 |
| [13] |
Wang H, Guo S, Li Z, et al. Suspension culture process for H9N2 avian influenza virus(strain Re-2)[J]. Archives of Virology, 2017, 162(10): 3051-3059. DOI:10.1007/s00705-017-3460-8 |
| [14] |
李春艳, 肖晶, 李曦, 等. 微载体规模比培养MDCK细胞增殖H9N2亚型禽流感病毒的研究[J]. 中国人兽共患病学报, 2009(12): 1149-1153. DOI:10.3969/j.issn.1002-2694.2009.12.005 |
| [15] |
Fontaine KA, et al. Dengue virus induces and requires glycolysis for optimal replication[J]. J Virol, 2015, 89(4): 2358-2366. DOI:10.1128/JVI.02309-14 |
| [16] |
Ritter JB, Wahl AS, Freund S, et al. Metabolic effects of influenza virus infection in cultured animal cells:Intra- and extracellular metabolite profiling[J]. BMC Syst Biol, 2010, 4(1): 61-83. |
| [17] |
Huang D, Xia-Hou K, Liu XP, et al. Rational design of medium supplementation strategy for improved influenza viruses production based on analyzing nutritional requirements of MDCK Cells[J]. Vaccine, 2014, 32(52): 7091-7097. DOI:10.1016/j.vaccine.2014.10.067 |
| [18] |
Genzel Y, Behrendt I, et al. Metabolism of MDCK cells during cell growth and influenza virus production in large-scale microcarrier culture[J]. Vaccine, 2004, 22(17-18): 2202-2208. DOI:10.1016/j.vaccine.2003.11.041 |
| [19] |
Saito K, Nishijima M, Kuge O. Phosphatidylserine is involved in gene expression from Sindbis virus subgenomic promoter[J]. Biochem Biophys Res Commun, 2006, 345(2): 878-885. DOI:10.1016/j.bbrc.2006.04.138 |
| [20] |
Kaushik R, Ratner L. Role of human immunodeficiency virus type 1 matrix phosphorylation in an early postentry step of virus replication[J]. Journal of Virology, 2004, 78(5): 2319-2326. DOI:10.1128/JVI.78.5.2319-2326.2004 |
| [21] |
Lohr V, Genzel Y, Behrendt I, et al. A new MDCK suspension line cultivated in a fully defined medium in stirred-tank and wave bioreactor[J]. Vaccine, 2010, 28(38): 6256-6264. DOI:10.1016/j.vaccine.2010.07.004 |
| [22] |
Chen P, Harcum SW. Effects of amino acid additions on ammon-ium stressed CHO cells[J]. J Biotechnol, 2005, 3: 277-286. |