甘露醇作为一种功能性糖醇,因其甜度和生理热量值均较低,且生理代谢不需要胰岛素等优点,可作为甜味剂供糖尿病人使用,也可防止牙齿龋变、可用作矫味剂和用于烘烤食品等[1-2]。在国际上,食品添加剂联合专家委员会(JECFA)和美国FDA食品添加剂法规均规定在食品工业上可以使用甘露醇[3]。目前,工业生产甘露醇的方法主要仍采用海藻提取法和化学氢化法,而利用微生物发酵法生产甘露醇研究较多的是乳酸菌,但因乳酸菌培养要求较高和难以实现高密度培养,导致生产成本较高,仍未实现工业化生产。
目前已通过基因工程手段对产甘露醇的相关酶进行过量表达或敲除菌株中副产物的生成途径,构建了许多以大肠杆菌、谷氨酸棒杆菌等作为宿主的生产甘露醇的重组菌株[4]。Gaspar等[5]构建了一株可以高效将葡萄糖转化为甘露醇的甘露醇转运突变菌。2005年,Kaup等[6-8]在大肠杆菌中异源表达胞外葡萄糖异构酶使葡萄糖转化为甘露醇。在此基础上,共表达了来源于大肠杆菌的xylA基因和葡萄糖异构酶,其能利用葡萄糖生成甘露醇。同时,在大肠杆菌中构建重组氧化/还原循环,使其能够从果糖生成甘露醇。结果表明,重组大肠杆菌可作为D-甘露醇合成的有效生物催化宿主。目前,关于D-甘露醇生成的研究大多集中于不同底物的转化和辅因子循环体系的构建,关于其他因素对甘露醇合成的影响研究目前较少。
为了进一步研究影响甘露醇合成的因素,结合KEGG中列出的大肠杆菌K-12的代谢途径可知,甘露醇可作为一种次级碳源被大肠杆菌所利用,导致生成的甘露醇会被菌体自身所分解利用,所以欲阻断甘露醇的分解途径,以实现甘露醇的积累。旨在选取来源于布氏乳杆菌(Lactobacillus brevis)的甘露醇脱氢酶基因,构建了合成甘露醇的重组菌株,在此基础上,主要针对大肠杆菌中甘露醇的分解途径进行研究,对该途径的关键基因进行敲除,探究基因敲除后菌株的生长以及菌株利用甘露醇能力的变化,旨在为研究大肠杆菌合成甘露醇的代谢调控提供依据。
1 材料与方法 1.1 材料 1.1.1 菌株L. brevis(用于甘露醇脱氢酶基因mdh的获得)、E. coli DH5α(用于重组质粒的构建)、E. coli K-12(用于重组质粒的表达)、克隆表达载体pTrc99a、克隆载体pMD19-T simple均为本实验室保存。用于基因敲除的质粒pGRB和pRedCas9均由天津大学陈涛老师课题组提供。
1.1.2 培养基及培养条件MRS液体培养基(g/L):牛肉膏10.0,蛋白胨10.0,酵母提取物5.0,K2HPO4 2.0,柠檬酸三铵2.0,CH3COONa 5.0,葡萄糖20.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.19,吐温-80 1 mL,用于L. brevis于37℃培养,在MRS液体培养基中添加2%琼脂粉后为MRS固体培养基。
LB液体培养基,用于大肠杆菌于37℃下培养,在液体培养基中添加2%琼脂粉后为固体培养基。当在固体或液体培养基中培养菌体需要添加氨苄青霉素时,其终浓度为100 mg/L; 需要添加奇霉素时,其终浓度为25 mg/L。
1.1.3 试剂异丙基硫代半乳糖苷(IPTG)、氨苄青霉素、奇霉素、还原型辅酶Ⅱ二钠盐(NADH)等均购于Sigma公司; Taq DNA聚合酶、solution Ⅰ连接酶、限制性内切酶EcoRI和HindⅢ、同源重组酶ClonExpress均购于TaKaRa公司; DNA分子量标准、DNA纯化回收试剂盒、质粒快速提取试剂盒和蛋白质分子量标准等均购于上海生物工程有限公司; PCR引物均由北京华大基因技术有限公司合成; 克隆载体pMD19-T simple购于宝生物工程(大连)有限公司。
1.2 方法 1.2.1 重组质粒的构建按参考文献[9]所述方法提取L. brevis总基因组DNA。根据GenBank报道的L. brevis ATCC 367中甘露醇脱氢酶基因(mdh)全序列进行引物设计,见表 1。用限制酶分别对扩增后的甘露醇脱氢酶基因片段和载体pTrc99a进行双酶切,构建重组质粒pTrc99a-mdh,通过氨苄青霉素抗性平板筛选转化子,然后分别使用双酶切法和PCR验证法对转化子质粒进行鉴定。
分别按2%接种量转接含有R1和R0的种子液至200 mL LB液体培养基中培养至OD600达到0.8-1.0时,用SDS-PAGE分析重组蛋白的表达结果。
1.2.3 酶活的测定参见文献[10]所述方法测定甘露醇脱氢酶的酶活。酶活计算公式为:
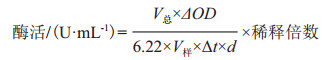
分别挑取单菌落接种于5 mL液体LB培养基中,37℃条件下、220 r/min振荡培养过夜。再按2%的接种量,将过夜培养物接种于50 mL的液体LB培养基中。对相应发酵液进行诱导表达,后进行菌体离心,收集上清液进行高效液相色谱检测。
用高效液相色谱分析底物与产物的含量变化。色谱条件:Prevail Carbohydrate ES色谱柱(4.6 mm×250 mm); 流动相乙腈:水=75:25;柱温30℃; 流量1.0 mL/min; 进样量20 μL; 检测器为蒸发光散射检测器。以溶液浓度为横坐标,峰面积的对数值为纵坐标,绘制标准曲线,并得到回归方程。
1.2.5 利用CRISPR/Cas9基因组编辑技术对大肠杆菌进行基因敲除以菌株K-12为出发菌株,敲除甘露醇磷酸转移酶编码基因中的ⅡA、ⅡB和ⅡC元件cmtA、cmtB和甘露醇磷酸转移酶编码基因mtlA。构建用于基因敲除的质粒pGRB-sgRNA:将由华大公司合成的sgRNA片段(表 2)与经反向PCR获得的pGRB质粒进行连接,利用热激法将重组质粒pGRB-sgRNA转入大肠杆菌DH5α,通过氨苄青霉素抗性平板筛选转化子。
构建用于基因敲除的打靶片段:以野生型大肠杆菌K-12基因组为模板,分别用两对引物cmtAcmtB-up-1/2、cmtAcmtB- down-1/2(表 1)扩增靶基因cmtA和cmtB的上下游同源臂,将两个片段进行重叠PCR得到线性目的片段。利用CRISPR/Cas9基因组编辑技术[11]对大肠杆菌进行基因敲除,对筛选得到的转化子进行菌落PCR鉴定。
1.2.6 菌株生长曲线的测定分别挑取单菌落到5 mL LB液体培养基中,过夜培养,按2%接种到50 mL LB液体培养基中,37℃培养,每隔30 min测定吸光值OD600,重复3次,绘制菌株的生长曲线。
1.2.7 测定基因敲除重组菌对甘露醇的利用能力分别以葡萄糖和甘露醇作为唯一碳源,以及以葡萄糖和甘露醇按1:1的比例作为混合碳源,通过测定OD600的吸光值测定出发菌株和突变菌株对甘露醇的利用情况。
2 结果 2.1 甘露醇脱氢酶重组质粒的构建及鉴定将重组质粒经EcoRI和HindⅢ双酶切鉴定转化子,大小约为1 000 bp左右的小条带为目的基因,大小约为4 000 bp左右的大片段为pTrc99a载体,结果如图 1-A所示,再次进行PCR验证,片段为1 000 bp,与预计大小相符,结果如图 1-B所示,表明目的基因已插入到pTrc99a载体中,得到重组质粒pTrc99a-mdh。

|
| M :DNA marker ;1 :重组质粒的双酶切验证 ;2 :重组质粒的 PCR 验证 图 1 重组质粒pTrc99a-mdh双酶切及PCR验证电泳图 |
将目的蛋白进行SDS-PAGE电泳分析后得到的结果如图 2所示,大小约为36.8 kD,目的蛋白得以表达,与预测相同。同时对重组酶进行酶活的测定,酶活达到173 U/mL。

|
| M :Protein molecular weight marker ;1 :目的蛋白 图 2 SDS-PAGE分析蛋白纯化情况 |
由于果糖进入大肠杆菌细胞时会发生磷酸化,成为果糖-6-磷酸,不能被甘露醇脱氢酶催化合成甘露醇,因此我们采用细胞破碎液进行转化,添加果糖作为底物进行转化,收集转化后的上清液,通过HPLC法对其进行分析,同时也对胞外的发酵液进行检测,在发酵体系中均不能检测到果糖和甘露醇的存在,说明重组菌株R1不能积累甘露醇。
2.4 甘露醇分解途径的阻断及相关酶的功能分析 2.4.1 重组菌株R2的构建以菌株K-12为出发菌株,敲除基因cmtA、cmtB,首先扩增靶基因的上下游同源臂,所得PCR产物大小分别均为600 bp,结果如图 3-A所示。将两个片段进行重叠PCR得到线性目的片段,大小为1 200 bp,结果如图 3-B所示。经菌落PCR鉴定重组质粒pGRB-sgRNA转化子,所得片段大小为600 bp,与预期一致,结果如图 3-C所示,表明sgRNA已插入到pGRB载体中。而后将核酸酶Cas9表达质粒、打靶片段和sgRNA重组质粒pGRB-sgRNA电转化入感受态细胞中,对筛选得到的转化子进行菌落PCR鉴定,出发菌株K-12验证引物间的大小应为3 033 bp,而发生基因敲除和同源重组后的菌株,其验证引物间的大小应为1 200 bp,条带大小均与预期大小相符,结果如图 3-D和图 3-E所示,说明靶基因被成功敲除,最终可获得菌株R2。

|
| M :DNA marker ;1 :打靶片段的上下游同源臂 ;2 :打靶片段 ;3 :重组质粒 pGRB 的菌落 PCR 验证 ;4 :出发菌株 K-12 的 PCR 产物 ;5 :菌株 R2 的PCR 产物 图 3 cmtA、cmtB基因敲除元件的构建及结果验证 |
再次利用CRISPR/Cas9系统对大肠杆菌R2进行基因敲除,对筛选得到的转化子进行菌落PCR鉴定,出发菌株R2验证引物间的大小应为3 114 bp,而发生基因敲除和同源重组后的菌株,其验证引物间的大小应为1 200 bp,条带大小均与预期大小相符,结果如图 4所示,说明靶基因被成功敲除,最终可获得菌株R4(所有重组菌株如表 3所示)。

|
| M :DNA marker ;1 :菌株 R2 的 PCR 产物 ;2 :菌株 R4 的 PCR 产物 . 图 4 mtlA基因敲除元件的构建及结果验证 |
对重组菌株进行酶活的测定,结果如表 4所示。
分别测定重组菌株R3、重组菌株R5与出发菌株R1在LB培养基中的生长曲线。结果如图 5-A所示,与出发菌株R1相比,菌株R3的生长情况基本不受影响,二者的生长曲线基本重合; 而菌株R5比出发菌株R1的生长速率低,长势弱,说明将3个基因全部敲除后,生长受到了微弱影响。

|
| A :生长曲线 ;B :以葡萄糖为唯一碳源 ;C :以葡萄糖和甘露醇为混合碳源 ;D :以甘露醇为唯一碳源 图 5 菌株R1、R3、R5生长曲线及利用甘露醇的能力比较 |
甘露醇能够作为碳源被菌体利用,将大肠杆菌PTS系统中的cmtA、cmtB和mtlA敲除后,菌株不能对甘露醇进行磷酸化,则菌株无法再利用其进行生长。因此我们测定了菌株R3、R5和出发菌株R1对葡萄糖及甘露醇的利用情况,以葡萄糖作为唯一碳源测定生长曲线,结果如图 5-B所示,3株菌株对葡萄糖的利用情况基本一致,基因敲除对菌株利用葡萄糖的能力没有影响; 以葡萄糖和甘露醇作为混合碳源测定生长曲线,结果如图 5-C所示,3株菌株的生长趋势出现差距,R1最快,R5最慢,先进入稳定期,原因可能是由于葡萄糖被利用后,敲除菌株无法利用甘露醇而进入稳定期; 以甘露醇作为唯一碳源时,结果如图 5-D所示,R5基本没有生长,说明敲除菌株已无法利用甘露醇作为碳源进行生长。实验表明,cmtA、cmtB、mtlA基因全部敲除后,菌株利用甘露醇的途径已被阻断。
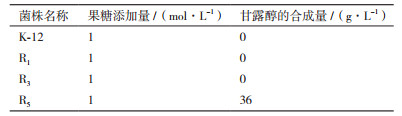
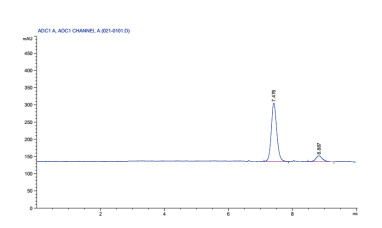
2.7 甘露醇的转化检测按照1.2.4的方法对菌株R1、R3、R5的转化后上清液进行产物分析,结果如表 5和图 6所示,在发酵体系中能够检测到果糖和甘露醇的存在; 说明重组菌株R5能够转化果糖生成甘露醇,并使甘露醇得以积累。
|
| 图 6 底物和产物的液相色谱分析 |
目前,运用基因工程的方法构建产甘露醇的菌株时,对其辅酶再生体系进行优化。但甘露醇的生产是一种较为复杂的过程,仍有其他的因素会对其产生影响。之前,已有蔡友华等[12]构建了一株敲除嘌呤核苷磷酸化酶基因的大肠杆菌,成功沉默了肌苷水解为次黄嘌呤的途径,提高了酶催化的转化率和5' -磷酸化肌苷的纯度,降低了肌苷的损耗和生产成本。邱磊[13]敲除了球孢白僵菌的磷酸化酶基因Cdc25,使其在细胞周期、菌丝分隔方式及形态以及影响隔膜形成的若干效应基因的转录水平方面都发生了不同方向的改变。而大肠杆菌自身含有可使甘露醇发生磷酸化的基因。所以,我们考虑甘露醇的磷酸化是使大肠杆菌不能积累甘露醇的一部分原因。
对异源表达的酶进行优化是目前的研究热点之一。之前也已有程雅韵等[14]、Liu等[15]和Wang等[16]利用大肠杆菌异源表达甘露醇脱氢酶,可利用表达后的酶实现将果糖转化为甘露醇的实验,但表达的酶活力较低,转化率也较低。王芳[17]和陈艳等[9]利用大肠杆菌表达L. brevis来源的甘露醇脱氢酶,实现了D-甘露醇的合成。而后,封志媚等[18]利用大肠杆菌表达来源于G. oxydans的甘露醇脱氢酶基因,酶活力达到270 U/mL,转化率达到97.4%。所以,我们考虑对该异源表达的酶进行优化,使重组菌株生产甘露醇的产量得以进一步提高。
而本研究中选用了以NADH为辅酶型的甘露醇脱氢酶基因,以使D-果糖转化为D-甘露醇,此过程需要一定的辅酶使其完成。目前已有文献报道,在大肠杆菌中,异源表达甘露醇脱氢酶、甲酸脱氢酶基因,构建一个NADH循环再生体系,实现D-果糖到D-甘露醇的细胞转化[8, 19]。例如,将来源于Leuconostoc pseudomesenteroides ATCC 12291的甘露醇脱氢酶基因(mdh)和来源于Mycobacterium VCtCCaP N10的甲酸脱氢酶在大肠杆菌中进行共表达,而甲酸在甲酸脱氢酶和NAD+的作用下脱氢变成二氧化碳,NAD+还原形成NADH,最终重组大肠杆菌细胞能够生成D-甘露醇[19-20]。结合目前的研究热点,我们将在本研究的基础上,对该重组菌株进行进一步的构建与优化,为进一步探究甘露醇的大肠杆菌合成菌株奠定基础。
4 结论本研究以目前研究透彻、遗传背景清晰、非病原性的大肠杆菌作为研究模型,敲除了大肠杆菌PTS系统中分解利用甘露醇途径的三个基因cmtA、cmtB、mtlA,获得突变菌株R4,发现其生长速率明显下降且菌株已无法利用甘露醇进行生长,说明大肠杆菌对甘露醇的分解途径已被完全阻断。构建了重组菌株R5,表达后测得酶活力为258 U/mL,在发酵体系中能够检测到果糖和甘露醇的存在,说明重组菌株能够转化果糖生成甘露醇,并使甘露醇得以积累。
| [1] |
Dai Y, Meng Q, Mu W, et al. Recent advances in the applications and biotechnological production of mannitol[J]. Journal of Functional Foods, 2017, 36: 404-409. DOI:10.1016/j.jff.2017.07.022 |
| [2] |
Park YC, Oh EJ, Jo JH, et al. Recent advances in biological production of sugar alcohols[J]. Current Opinion in Biotechnology, 2016, 37: 105. DOI:10.1016/j.copbio.2015.11.006 |
| [3] |
杨海军, 袁卫涛. 甘露醇的工业化生产及市场应用[J]. 山东食品发酵, 2008, 36(1): 27-29. |
| [4] |
Reshamwala SM, Pagar SK, Velhal VS, et al. Construction of an efficient Escherichia coli whole-cell biocatalyst for d-mannitol production[J]. Journal of Bioscience & Bioengineering, 2014, 118(6): 628-631. |
| [5] |
Gaspar P, Neves AR, Ramos A, et al. Engineering Lactococcus lactis for production of mannitol:high yields from food-grade strains deficient in lactate dehydrogenase and the mannitol transport system[J]. Applied & Environmental Microbiology, 2004, 70(3): 1466. |
| [6] |
Kaup B, Bringer-Meyer S, Sahm H. D-Mannitol formation from d -glucose in a whole-cell biotransformation with recombinant Escherichia coli[J]. Applied Microbiology and Biotechnology, 2005, 69(4): 397. DOI:10.1007/s00253-005-1996-0 |
| [7] |
Kaup B, Bringer-Meyer S, Sahm H. Metabolic engineering of Escherichia coli:construction of an efficient biocatalyst for D-mannitol formation in a whole-cell biotransformation[J]. Applied Microbiology and Biotechnology, 2016, 68(2): 235-240. |
| [8] |
Kaup B, Bringer-Meyer S, Sahm H. Metabolic engineering of Escherichia coli:construction of an efficient biocatalyst for D-mannitol formation in a whole-cell biotransformation[J]. Communications in Agricultural & Applied Biological Sciences, 2004, 64(3): 333-339. |
| [9] |
陈艳, 田康明, 李玉, 等. 以蔗糖为底物利用重组大肠杆菌合成甘露醇[J]. 微生物学通报, 2014, 41(11): 2182-2190. |
| [10] |
Ortiz ME, Fornaguera MJ, Raya RR, et al. Lactobacillus reuteri CRL1101 highly produces mannitol from sugarcane molasses as carbon source[J]. Applied Microbiology and Biotechnology, 2012, 95(1): 991-999. |
| [11] |
Li Y, Lin Z, Huang C, et al. Metabolic engineering of Escherichia coli using CRISPR-Cas9 meditated genome editing[J]. Metabolic Engineering, 2015, 31: 13-21. DOI:10.1016/j.ymben.2015.06.006 |
| [12] |
蔡友华, 郑明英, 严杰能, 等.一种嘌呤核苷磷酸化酶基因敲除的大肠杆菌Ecoli-SL26的构建方法: 中国102994537A[P], 2013.
|
| [13] |
邱磊.球孢白僵菌组氨酸激酶家族、核激酶Weel和磷酸化酶Cdc25的功能解析[D].杭州: 浙江大学, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2666037
|
| [14] |
程雅韵, 王新, 郑琳, 等. 假肠膜明串珠菌甘露醇脱氢酶基因的克隆及表达[J]. 食品科学, 2016, 37(13): 153-156. DOI:10.7506/spkx1002-6630-201613027 |
| [15] |
Liu S, Saha B, Cotta M. Cloning, expression, purification, and analysis of mannitol dehydrogenase gene mtlK from Lactobacillus brevis[J]. Applied Biochemistry & Biotechnology Part A Enzyme Engineering & Biotechnology, 2005, 121-124(1-3): 391. |
| [16] |
Wang ZL, Ying SH, Feng MG. Gene cloning and catalysis features of a new mannitol-1-phosphate dehydrogenase (BbMPD) from Beauveria bassiana[J]. Carbohydrate Research, 2010, 345(1): 50. DOI:10.1016/j.carres.2009.09.020 |
| [17] |
王芳.甘露醇发酵及甘露醇脱氢酶的克隆表达[D].石家庄: 河北科技大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1473561
|
| [18] |
封志媚, 赵雅童, 刘业学, 等. NADPH依赖的甘露醇脱氢酶的重组表达及甘露醇的转化条件[J]. 生物技术通报, 2017, 33(8): 186-191. |
| [19] |
Kaup B, Bringer-Meyer S, Sahm H. D-Mannitol formation from d -glucose in a whole-cell biotransformation with recombinant Escherichia coli[J]. Applied Microbiology and Biotechnology, 2005, 69(4): 397. DOI:10.1007/s00253-005-1996-0 |
| [20] |
Song SH, Vieille C. Recent advances in the biological production of mannitol[J]. Applied Microbiology & Biotechnology, 2009, 84(1): 55. |